犬急性胰腺炎病程與血液指標變化相關性研究
王明月++田欣欣++周東海


摘要:探究犬急性胰腺炎病程中相關血液指標的變化和病程發展的關系,以利于更好的評估急性胰腺炎患犬病程發展。對12只本地雜種犬構建急性胰腺炎模型,對照組A組4只,水腫組B組4只,出血壞死組C組4只。術后第1、2、3、4、5天各采血,進行血常規、血液生化檢查,同時收集臨床急性胰腺炎病犬血液指標及臨床資料,進行分析。結果表明,水腫型和出血壞死型急性胰腺炎犬的白細胞在術后12 h開始上升,在15~40 h之間水平較高,在36~40 h開始下降;淀粉酶在術后12 h開始高于正常范圍,水腫型急性胰腺炎患犬比出血壞死型急性胰腺炎患犬淀粉酶維持在高于正常范圍的時間更久;淋巴細胞于急性胰腺炎初期明顯降低,術后第3天回復正常范圍。三個血液指標聯合診斷,更能有效的評估犬急性胰腺炎的病程發展階段。
關鍵詞:犬;急性胰腺炎;白細胞;淀粉酶;淋巴細胞
中圖分類號:S858.292 文獻標識碼:A 文章編號:1007-273X(2017)01-0005-03
犬急性胰腺炎(Acute pancreatitis)是由高濃度游離脂肪酸、毒素、病原等誘發胰腺內一系列的酶被激活,造成胰腺本身及周圍組織損傷的疾病[1]。該病發病迅速,臨床上分為水腫型胰腺炎和壞死型胰腺炎,后者預后不良[2]。現階段臨床獸醫工作者對犬急性胰腺炎的診斷僅能做到確診,未能對犬病情發展進行準確評估。因此,尋找能輔助評估犬急性胰腺炎病程發展的指標對臨床犬急性胰腺炎的治療具有重要的指導意義。
本研究對臨床急性胰腺炎病例和12例犬急性胰腺炎模型的白細胞、淋巴細胞和血清淀粉酶指標進行檢測,比較分析其階段性診斷的意義。
1 材料與方法
1.1 試驗藥物和材料
5%牛磺膽酸鈉;2 500 U/mg胰蛋白酶;鹽酸塞拉嗪注射液;丙泊酚注射液;硫酸阿托品注射液;酚磺乙胺注射液;生理鹽水;淀粉酶生化試劑板;3 mL 肝素鈉抗凝管,2 mL EDTAK2抗凝管;留置針;20 G平口點膠槍頭;PGA可吸收縫合線。
1.2 主要儀器
SYSMEX pocH-100iV Diff全自動動物血液分析儀;FUJI DRI-CHEM4000ie全自動干式生化分析儀;i-STAT1 300便攜式血氣分析儀;愛德仕公司生產的SN急性胰腺炎CPL犬胰腺特異性脂肪酶試劑板;恒諾2-16R臺式冷凍高速離心機。
1.3 試驗動物
選取體重在5~15 kg的本地健康雜種犬12只,雌雄不限,對照組4只,編號A1、A1、A3、A4;水腫型急性胰腺炎組4只,編號B1、B2、B3、B4;出血壞死性急性胰腺炎組4只,編號C1、C2、C3、C4。2015年9月至2016年12月于華中農業大學動物醫院門診收集26例犬急性胰腺炎臨床病例。
1.4 造模方法
1.4.1 構建犬急性胰腺炎模型 ①術前禁食24 h,禁水12 h;術前阿托品0.015 mg/kg、酚磺乙胺25 mg/kg皮下注射,鹽酸賽拉嗪1.2 mg/kg肌肉注射,丙泊酚靜脈維持麻醉。②將試驗犬仰臥保定于手術臺上,劍狀軟骨后10~15 cm范圍內剃毛、消毒,于臍孔上腹正中切口,切口長5~8 cm,逐層切入打開腹腔。于右側最后一肋弓處找尋十二指腸,看到犬胰腺組織為粉紅色,質軟,呈扁平長帶狀,右葉游離。找到胰體處,切開一長度為2~3 cm的切口。③可于腸腔內壁黏膜面看到一白色臍孔樣凹陷,即為十二指腸小乳頭,為犬主胰管開口處。④將20 G平口點膠槍頭插入主胰管內2 cm(小乳頭直徑與犬體格差異不大),用手固定。⑤點膠槍頭連接1個1 mL注射器,向主胰管內以0.5 mL/min的速度推注5%牛磺膽酸鈉0.5 mL/kg,制成水腫型急性胰腺炎模型;將5%牛磺膽酸鈉和2 500 U胰蛋白酶混合,前者用量0.5 mL/kg,后者用量3 000 U/kg,以1 mL/min的速度向主胰管內推注,制成出血壞死型急性胰腺炎模型[3]。⑥依次縫合腸壁、腹膜、肌肉、皮膚。切口處碘伏消毒。一切操作均在無菌條件下進行。⑦術后每天禁食禁水,靜脈注射200~400 mL的生理鹽水,碘伏處理傷口。⑧空白對照組除手術外,作同樣處理。
1.4.2 血液指標檢測及癥狀變化資料收集 術前1 h,記錄試驗犬體溫、體重,采血檢測血常規數值,檢測淀粉酶含量。于術后第1天,收集試驗犬靜脈血清,用愛德仕公司生產的SN急性胰腺炎CPL犬胰腺特異性脂肪酶試劑板檢測;并于術后第1、2、3、4、5天,記錄試驗犬體溫、體重、精神狀態變化,采血檢測血常規數值和淀粉酶數值變化情況。
1.5 臨床病例來源
2015年9月至2016年7月在華中農業大學附屬動物醫院門診確診的26例急性胰腺炎患犬作為自然發病組。
2 結果與分析
2.1 臨床病例調查結果
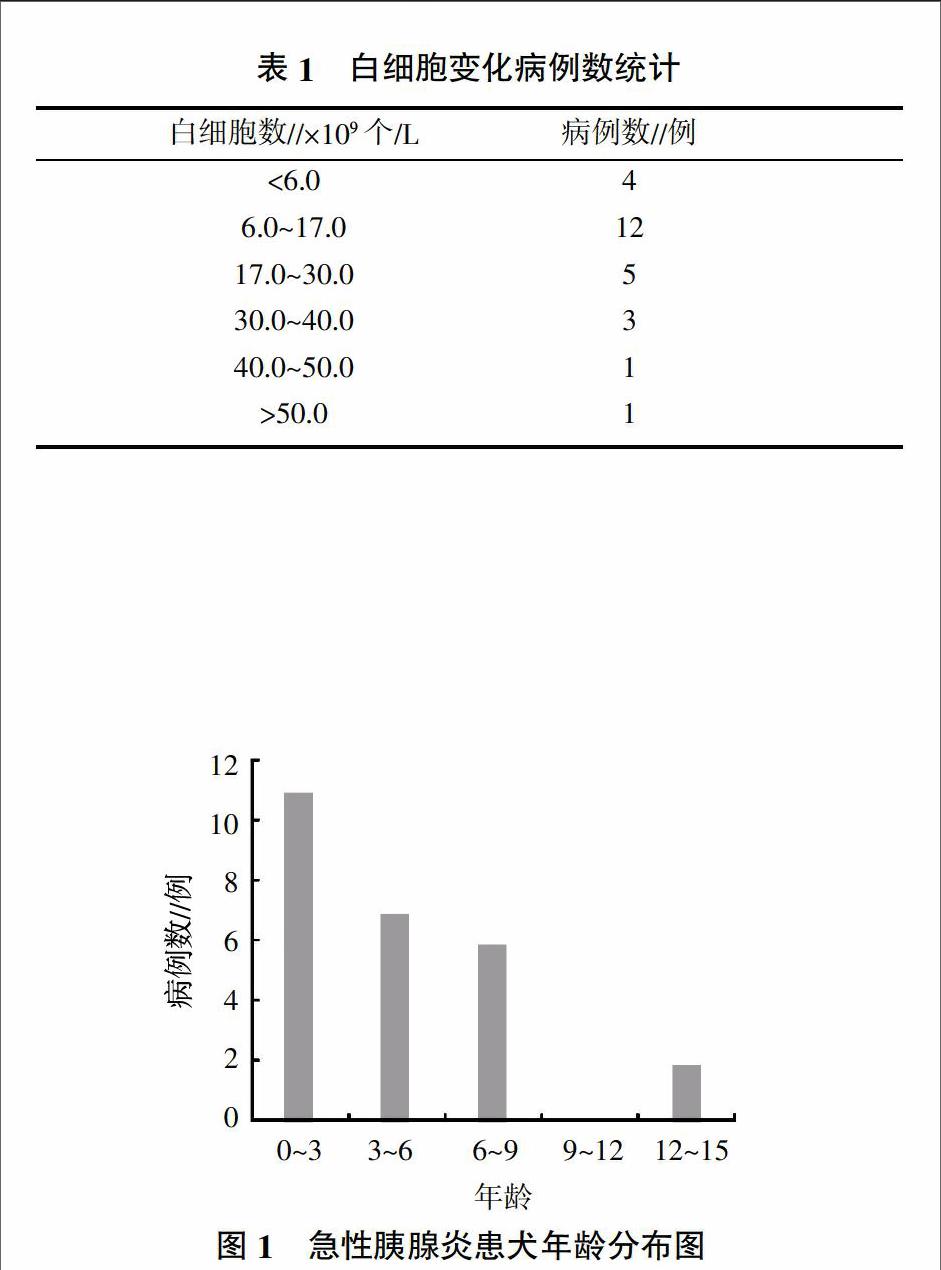
由表1可見,白細胞數處于正常范圍內[(6.0~17.0)×109個/L]的犬有12例,低于正常值的有4例,高于正常值的有10例。
由圖1可見,急性胰腺炎患犬0~3歲的有11例,3~6歲的有7例,6~9歲的有6例,12~15歲的有2例。由圖2可見,急性胰腺炎患犬雌性占34.6%,雄性占65.4%。
2.2 造模結果
向主胰管注入5%牛磺膽酸鈉5~10 min,胰腺組織出現葉間隙明顯增寬,組織水腫體積增大現象。且術后第1~2天內,犬右腹部明顯增大。于術后第1天采取靜脈血檢測CPL,結果呈陽性。表明成功制備水腫胰腺炎模型。
向主胰管注入5%牛磺膽酸鈉和2 500 U胰蛋白酶混合物5~10 min,胰腺組織出現明顯水腫、充血、出血現象。于術后第1天采取靜脈血檢測CPL,結果呈陽性。表明成功制備出血壞死型胰腺炎模型。
2.3 癥狀變化及血液檢測結果
由圖3可見,B組和C組在術后第一天白細胞都有不同程度的升高,在術后第二天、第三天均有不同程度的降低。通過采血檢測白細胞值,發現水腫型和出血壞死型胰腺炎犬白細胞在術后12 h開始上升[正常范圍(6~17)×109個/L],在15~40 h之間水平較高[(20~50)×109個/L],在36~40 h開始下降。這表明白細胞往往在急性胰腺炎發生后12 h才表現明顯的升高,持續30 h左右高于正常值。
從圖4中可見,兩個試驗組中,犬的淋巴細胞于術后第1天均明顯降低,術后第3天回復正常范圍(術前范圍)。
由圖5可見,試驗組犬的淀粉酶水平在術后均有不同程度的升高。
2.4 肉眼觀察病理變化
于造模后第7天,分別處死對照組、水腫組、出血壞死組犬各一只,取胰腺組織。健康犬胰腺組織質地粉紅色,體積大小無變化,無壞死結節,無肉眼可見病理變化;水腫型胰腺炎犬胰腺組織體積大小無變化,無壞死結節,但有30%胰腺組織葉間隙輕微增寬,胰腺小葉界限明顯;出血壞死型胰腺炎犬胰腺組織體積整體縮小,有60%肉眼可見壞死灶,為白色鈣化灶,胰腺小葉萎縮。
3 討論
3.1 臨床病例
調查結果顯示,急性胰腺炎患犬中雄性占65.4%,雌性占34.6%,這和相關報道相一致[4]。從圖1中可以看出,雖然中老年犬仍是急性胰腺炎的高發犬,但是和以往相關統計[4、5]相比,犬急性胰腺炎發生的年齡有明顯的提前趨勢。
表1顯示,26例臨床病例中,有12例白細胞處于正常范圍內。且這12例病例經過治療均預后良好。4例白細胞小于正常范圍的犬中,有3例死亡。2例白細胞大于40×109個/L的病犬均死亡。而白細胞介于(17~40)×109個/L范圍之間的病犬,治療時間較長,最后均以痊愈為轉歸。這說明病程發展過程中,白細胞高于40×109個/L的病犬和低于6×109個/L的病犬,均處于病程的危險期。若病犬白細胞一直處于高于40×109個/L或低于6×109個/L的水平,則預后不良。
3.2 造模動物
犬急性胰腺炎是一種臨床上較為復雜的疾病,且當前研究還未發現特異性的指標能動態指示病程變化,獸醫工作者僅能通過對炎癥細胞變化、淀粉酶變化和病犬的整體精神狀態來粗略評估犬急性胰腺炎的病程發展[6]。本次試驗結果能給評估犬急性胰腺炎病程發展提供一些參考。
在犬急性胰腺炎發生時,白細胞會明顯升高,但尚未精確到具體時間。由圖3可見,水腫型和出血壞死型胰腺炎犬白細胞在術后12 h開始上升[正常范圍(6~17)×109個/L],在15~40 h之間水平較高[(20~50)×109個/L],在36~40 h開始下降。這表明白細胞往往在急性胰腺炎發生后12 h才表現明顯的數值升高,持續30 h左右高于正常值。且當白細胞恢復至正常值,并不代表病犬已經自愈,可能胰腺組織已造成不可逆的損壞。
在臨床診斷中,獸醫工作者往往未把淋巴細胞作為評估犬急性胰腺炎病情發展的參考指標。筆者通過試驗發現,淋巴細胞數值變化也能從一定程度上反映犬急性胰腺炎的病程發展。由圖4中可以看出,兩個試驗組犬的淋巴細胞于術后第1天均明顯降低,術后第3天回復正常范圍(術前范圍)。這表明,淋巴細胞參與了急性胰腺炎的炎癥反應,這與楊斌[7]報道的情況相一致。但是對于淋巴細胞的免疫調節在急性胰腺炎中的具體作用還需進一步研究。
由圖5可見,試驗組犬的淀粉酶水平在術后均有不同程度的升高。筆者通過采血檢測淀粉酶值,發現淀粉酶在術后12 h開始高于1 500 U/L[正常范圍(500~1 500)U/L],水腫型急性胰腺炎病犬于術后18~50 h達到一個高峰,術后70~90 h開始降至接近1 500 U/L,術后第4天回到正常范圍;壞死型急性胰腺炎病犬于術后18~98 h達到一個高峰,術后120 h開始接近1 500 U/L,術后一周部分回到正常值。這表明,水腫型胰腺炎病犬的淀粉酶水平比出血壞死型急性胰腺炎病犬的淀粉酶水平更早恢復至正常范圍。但由于正常情況下檢測到的血清淀粉酶只有少部分是胰淀粉酶,淀粉酶濃度與急性胰腺炎嚴重程度不成正相關,所以淀粉酶濃度降至正常范圍并不能表明患犬痊愈[8]。
4 小結
通過結合臨床病例和造模試驗可以得出結論:當急性胰腺炎病犬的白細胞處于一個高水平,且維持時間超過40 h時,病程處于危險期,且消化系統造成了一定程度上的不可逆的損傷,且有預后不良的可能;淋巴細胞在急性胰腺炎初期會明顯降低;當淀粉酶高于1 500 U/L時,據發病時間已有12 h,當CPL檢驗結果呈陽性,且淀粉酶在正常范圍內時,據發病已有90 h。
總結以上三個指標對評估急性胰腺炎病程發展的意義可以發現,各個指標有各自的作用,但又有一定的限制。血清淀粉酶對于診斷急性胰腺炎具有一定意義,但由于該指標在病程發展過程中先升高后降低,所以單獨依據此指標并不能判斷急性胰腺炎病程發展,應結合CPL陽性結果來判斷病程發展。白細胞在急性胰腺炎前期會一直處于高于正常范圍的水平,而淋巴細胞僅在發病24 h內明顯降低,兩者相結合,能評估急性胰腺炎的病程是否在初期。三者聯合應用于臨床診斷治療中,能幫助獸醫工作者對急性胰腺炎病程發展做出更準確有效的判斷。
參考文獻:
[1] 谷武陽,譚 敏,彭廣能,等.犬急性胰腺炎的模型構建及清開靈治療試驗[J].中國獸醫雜志,2015,51(2):68-70.
[2] 張衛憲,馬立新,楊 麗,等.犬胰腺炎的診斷和防治研究進展[J].河南畜牧獸醫,2011,32(12):9-10.
[3] 譚 敏.犬急性胰腺炎病理模型的構建及臨床治療研究[D].四川雅安:四川農業大學,2008.
[4] 李澤盛,郭亞楠,陳柏良,等.犬急性胰腺炎并發急性腎衰竭臨床病例分析[J].動物醫學進展,2015,36(12):182-184.
[5] 朱 國,師福山,張海彬.犬急性胰腺炎流行病學調查[J].浙江畜牧獸醫,2016,41(3):35-38.
[6] 陳宇馳.cPL雙抗體夾心ELISA檢測犬急性胰腺炎方法的建立與應用[D].南京:南京農業大學,2011.
[7] 楊 斌.T、B淋巴細胞對急性胰腺炎的作用及其免疫治療[D]. 西安:第四軍醫大學,2013.
[8] 田學昌,劉吉盛,曲 暢,等.聯合檢驗血清淀粉酶、脂肪酶與C反應蛋白在急性胰腺炎早期診斷中價值[J].現代儀器與醫療,2015,21(2):76-78.

