右美托咪定對(duì)乳大鼠心肌細(xì)胞線粒體活性氧和細(xì)胞凋亡的影響*
曹露 周丹 李濤 陳琳琳 譚曉秋 劉力 劉雪茹△
(1.西南醫(yī)科大學(xué)附屬醫(yī)院麻醉科; 2.醫(yī)學(xué)電生理學(xué)教育部重點(diǎn)實(shí)驗(yàn)室·西南醫(yī)科大學(xué)心血管醫(yī)學(xué)研究所,四川 瀘州 646000)
論 著
右美托咪定對(duì)乳大鼠心肌細(xì)胞線粒體活性氧和細(xì)胞凋亡的影響*
曹露1周丹1李濤2陳琳琳2譚曉秋2劉力1劉雪茹1△
(1.西南醫(yī)科大學(xué)附屬醫(yī)院麻醉科; 2.醫(yī)學(xué)電生理學(xué)教育部重點(diǎn)實(shí)驗(yàn)室·西南醫(yī)科大學(xué)心血管醫(yī)學(xué)研究所,四川 瀘州 646000)
目的:探討右美托咪定(Dexmedetomidine,DEX)對(duì)線粒體介導(dǎo)的乳大鼠心肌細(xì)胞氧化應(yīng)激通路的作用。方法:取新生乳大鼠(3~4天)的心肌進(jìn)行原代培養(yǎng),培養(yǎng)24 h后分為對(duì)照組(C組)、H2O2組(終濃度500 μM,H組)、右美托咪定組(5 μM DEX,D組)、聯(lián)合用藥組(500 μM H2O2+5 μM DEX,DH組)。各組細(xì)胞分別給予相應(yīng)藥物刺激6 h,采用流式細(xì)胞儀測(cè)定活性氧自由基(Reactive oxygen species,ROS)水平及心肌細(xì)胞凋亡變化;并通過(guò)ELISA法測(cè)定各組乳大鼠心肌細(xì)胞線粒體介導(dǎo)的凋亡因子Caspase-3,Caspase-9表達(dá)的變化。結(jié)果:與H2O2組相比,DEX明顯抑制H2O2介導(dǎo)的乳大鼠心肌細(xì)胞的ROS水平增加(P<0.05);下調(diào)線粒體介導(dǎo)的下游凋亡因子Caspase-3, Caspase-9的表達(dá)(P<0.05),從而減少H2O2誘導(dǎo)的凋亡(P<0.05)。結(jié)論:右美托咪定通過(guò)抑制心肌細(xì)胞活性氧水平以及下調(diào)線粒體介導(dǎo)的Caspase-3和Caspase-9的表達(dá)發(fā)揮抑制凋亡作用,對(duì)心肌細(xì)胞有一定的保護(hù)作用。
右美托咪定;心肌細(xì)胞;活性氧;氧化應(yīng)激;細(xì)胞凋亡
右美托咪定(Dexmedetomidine,DEX)是一種新型的高選擇性的α2腎上腺素受體激動(dòng)劑,目前廣泛應(yīng)用于ICU和手術(shù)過(guò)程中[1,2]。可通過(guò)抑制交感神經(jīng)興奮性和增強(qiáng)迷走神經(jīng)興奮性,產(chǎn)生鎮(zhèn)靜、鎮(zhèn)痛、抗焦慮、抗驚厥、抗寒顫、催眠遺忘、穩(wěn)定血流動(dòng)力學(xué)、減少插管時(shí)應(yīng)激反應(yīng)、減少麻醉劑與阿片類(lèi)藥物的用量和改善麻醉恢復(fù)等一系列作用[3]。右美托咪定對(duì)機(jī)體許多重要臟器如心臟、大腦、腎臟、肝、肺、胃腸道等具有保護(hù)作用[4,5]。有研究報(bào)道提示,DEX減少心肌I/R損傷可能與調(diào)控心肌線粒體滲透性轉(zhuǎn)換孔(Mitochondrial permeability transition pore, mPTP)開(kāi)放及其上游線粒體ATP敏感性鉀通道(Mitochondrial ATP sensitive potassium channels, mitoKATP)活性有關(guān)[6]。由于線粒體氧化應(yīng)激在心肌損傷與保護(hù)中發(fā)揮重要作用,而活性氧(Rreactive oxygen species,ROS)在一定程度上能夠反應(yīng)細(xì)胞氧化應(yīng)激程度。本文擬探討右美托咪定對(duì)線粒體介導(dǎo)的乳大鼠心肌細(xì)胞氧化應(yīng)激通路的作用。
1 材料與方法
1.1 主要材料及試劑
新生SD大鼠3~4天(由西南醫(yī)科大學(xué)動(dòng)物實(shí)驗(yàn)中心提供);右美托咪定(江蘇恩華);H2O2(Sigma,美國(guó));DMEM培養(yǎng)液和胎牛血清(Gibco,美國(guó));0.25%胰蛋白酶(Sigma,美國(guó));羅丹明標(biāo)記鬼筆環(huán)肽(Rhodamine Phalloidin)(Cytoskeleton,美國(guó));DAPI(4,6-二脒基-2-苯基吲哚)、活性氧檢測(cè)試劑盒、Caspase-3和Caspase-9試劑盒(碧云天,中國(guó))。
1.2 乳鼠心肌細(xì)胞培養(yǎng)
首先將新生乳鼠心臟在無(wú)菌條件下取出,經(jīng)PBS液反復(fù)沖洗后,剪去心房和結(jié)締組織,然后再用PBS液沖洗,剪成1 mm3碎塊,再加入0.25%胰蛋白酶置于4℃冰箱過(guò)夜,Ⅱ型膠原酶洗滌2次,直到心臟組織基本消化完畢,1500 g·min-1離心5min后去除上清液,再用含10%FBS的DMEM培養(yǎng)基將沉淀充分吹打混勻,在37℃、5%CO2培養(yǎng)箱中通過(guò)差速貼壁,以去除心臟的成纖維細(xì)胞和內(nèi)皮細(xì)胞,再次的心肌細(xì)胞懸液取8 ml接種到4個(gè)3.5 cm的培養(yǎng)皿中并置于37℃、5%CO2的培養(yǎng)箱中,培養(yǎng)48 h后分組處理。
1.3 實(shí)驗(yàn)分組
實(shí)驗(yàn)分為四組:對(duì)照組(C組)、H2O2組(H組)、右美托咪定組(D組)、右美托咪定+H2O2組(DH組)。首先對(duì)D組和DH組加入終濃度為0.5 μM的右美托咪定,隨后置于37℃細(xì)胞培養(yǎng)箱12 h孵育。待孵育結(jié)束后,在H組和DH組中加入500 μM的H2O2進(jìn)行孵育。
1.4 流式細(xì)胞術(shù)檢測(cè)活性氧自由基(ROS)水平變化
由于乳鼠心肌細(xì)胞是貼壁細(xì)胞,采用原位裝載探針檢測(cè)ROS的方法。使用1:1000無(wú)血清培養(yǎng)液稀釋DCFH-DA,終濃度為10 μM。去除細(xì)胞培養(yǎng)液,加入適當(dāng)體積稀釋好的DCFH-DA。各組心肌細(xì)胞于37℃下避光孵育0.5 h,再用PBS洗兩次,然后用流式細(xì)胞儀檢測(cè)。同時(shí)設(shè)置陽(yáng)性對(duì)照(Rosup),通常活性氧陽(yáng)性對(duì)照在刺激細(xì)胞20~30 min后可以顯著提高活性氧水平。
1.5 ELISA法檢測(cè)Caspase-3和Caspase-9蛋白的表達(dá)
Caspase-3,Caspase-9檢測(cè)方法按照試劑盒(江蘇碧云天公司)說(shuō)明書(shū)進(jìn)行,主要包括測(cè)定pNA標(biāo)準(zhǔn)曲線、樣品收集、酶活性的檢測(cè)等實(shí)驗(yàn)步驟。以對(duì)照組(未經(jīng)DEX和H2O2處理)的pNA的量為1,對(duì)其他三組的pNA的量進(jìn)行標(biāo)準(zhǔn)化,從而比較各組Caspase-3,Caspase-9的活性。
1.6 細(xì)胞免疫熒光實(shí)驗(yàn)
采用FITC標(biāo)記α-肌動(dòng)蛋白觀察培養(yǎng)的心肌細(xì)胞的形態(tài)。將培養(yǎng)的心肌細(xì)胞鋪在玻片上生長(zhǎng),48 h后取出,PBS清洗三遍后分別用4%的多聚甲醛室溫固定20 min,0.1%的Triton X-100處理20 min,5%的BSA室溫封閉1 h,之后使用小鼠抗α-肌動(dòng)蛋白一抗4℃孵育過(guò)夜,F(xiàn)ITC標(biāo)記的抗小鼠二抗孵育1 h,最后使用DAPI室溫孵育10 min后進(jìn)行封片,在熒光顯微鏡下進(jìn)行觀察。
1.7 流式細(xì)胞術(shù)檢測(cè)細(xì)胞凋亡
采用流式細(xì)胞術(shù)測(cè)定細(xì)胞凋亡。培養(yǎng)的心肌細(xì)胞經(jīng)過(guò)上述處理之后,使用胰酶消化為單個(gè)的心肌細(xì)胞,按照試劑盒說(shuō)明書(shū)進(jìn)行染色后使用流式細(xì)胞儀(BD公司)進(jìn)行檢測(cè)細(xì)胞凋亡情況。
1.8 統(tǒng)計(jì)學(xué)處理
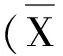
2 結(jié)果
2.1 心肌細(xì)胞形態(tài)學(xué)
使用FITC標(biāo)記α-肌動(dòng)蛋白觀察心肌細(xì)胞形態(tài),結(jié)果如圖1所示。培養(yǎng)的心肌細(xì)胞呈梭形,橫紋和肌動(dòng)蛋白清晰。

圖1 乳鼠心肌細(xì)胞形態(tài)(600X)藍(lán)色:DAPI染的細(xì)胞核;綠色:FITC標(biāo)記的α-actin。
2.2 DEX對(duì)H2O2誘導(dǎo)的心肌細(xì)胞ROS的影響
與對(duì)照組相比,陽(yáng)性處理組(Rosup)的ROS水平明顯增加(P<0.01)。500 μM H2O2處理6 h后,ROS水平也明顯增加(P<0.05)。聯(lián)合使用500 μM H2O2和5 μM DEX,與單純使用H2O2組相比,ROS水平明顯下降(P<0.05)。而單獨(dú)使用5 μM DEX,ROS水平的下降并無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見(jiàn)圖2。
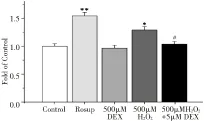
圖2 DEX對(duì)H2O2誘導(dǎo)的心肌細(xì)胞ROS的影響(n=5)注:與Control相比,*P<0.05;與500 μM H2O2組相比,#P<0.05。
2.3 DEX對(duì)H2O2誘導(dǎo)的心肌細(xì)胞Caspase-3、Caspase-9表達(dá)的影響
與對(duì)照組相比,500 μM H2O2處理6 h后,Caspase-3和Caspase-9表達(dá)明顯增加(P<0.01)。聯(lián)合使用500 μM H2O2和5 μM DEX,與單純使用H2O2組相比,Caspase-3和Caspase-9表達(dá)明顯增加(P<0.05)。與對(duì)照組相比,聯(lián)合使用的H2O2和DEX的Caspase-3和Caspase-9表達(dá)依然有所增加(P<0.05)。而單獨(dú)使用5 μM DEX,Caspase-3和Caspase-9表達(dá)水平有所降低,但并沒(méi)有統(tǒng)計(jì)學(xué)意義(P>0.05)。
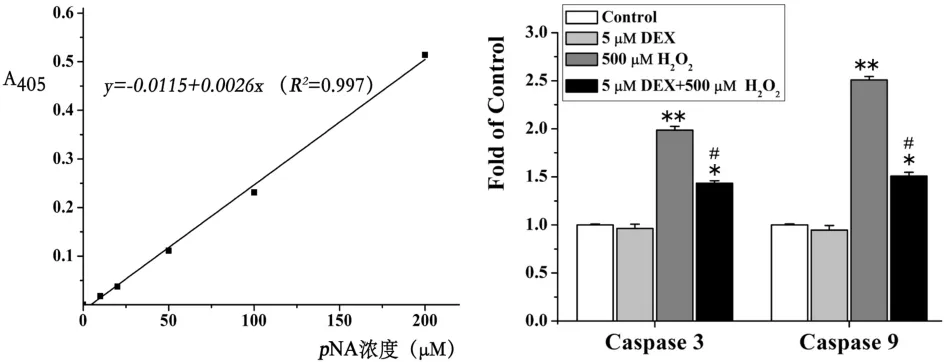
圖3 DEX對(duì)H2O2誘導(dǎo)的心肌細(xì)胞Caspase-3、-9活性的影響(n=4)注:與Control相比,*P<0.05,**P<0.05;與500 μM H2O2組相比,#P<0.05。
2.4 DEX對(duì)H2O2誘導(dǎo)的心肌細(xì)胞凋亡的影響
從圖4中可以看出,對(duì)照組細(xì)胞僅有19.9%的細(xì)胞凋亡率(第一象限和第四象限之和),而使用H2O2處理之后,細(xì)胞凋亡率明顯增加,由19.9%增加到65.7%(其中早期凋亡占46.2%,晚期凋亡占19.5%)。在使用H2O2的同時(shí)加入右美托咪定,可以明顯降低細(xì)胞凋亡率,細(xì)胞凋亡率為38.0%(其中早期凋亡占24.9%,晚期凋亡占13.1%)。
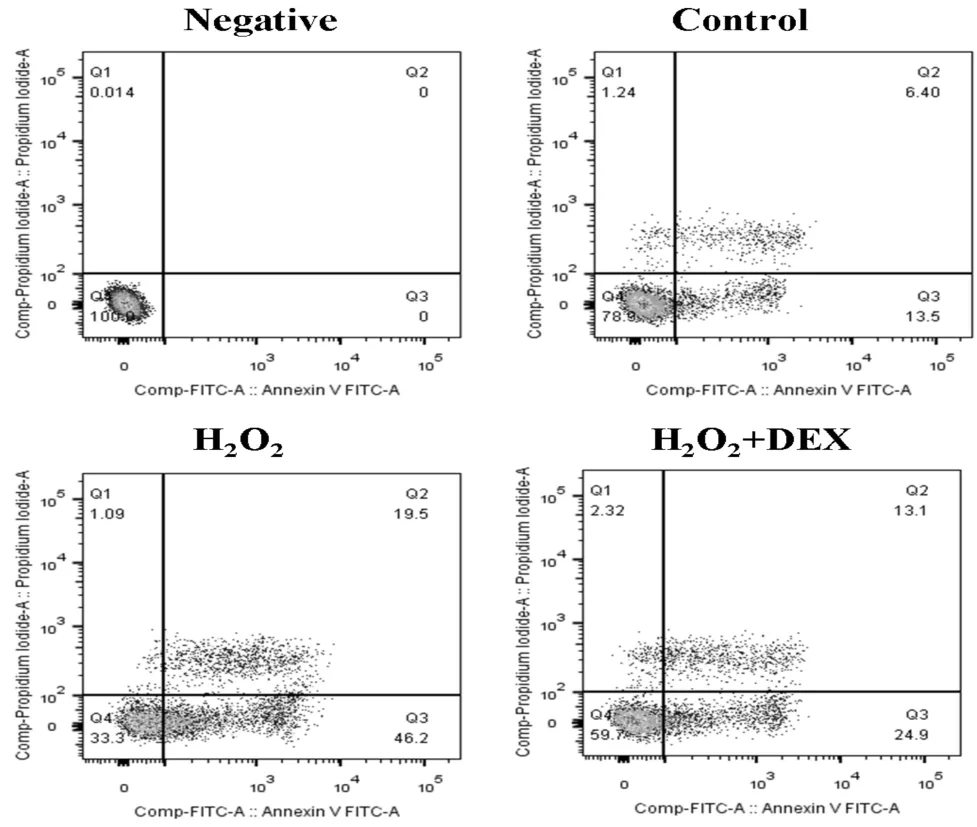
圖4 流式細(xì)胞術(shù)檢測(cè)DEX對(duì)H2O2誘導(dǎo)的心肌細(xì)胞凋亡的影響注:Negative為沒(méi)有使用凋亡檢測(cè)試劑的陰性對(duì)照,用于細(xì)胞形態(tài)和熒光校正與調(diào)零。
3 討論
右美托咪定(DEX)因具有鎮(zhèn)靜,鎮(zhèn)痛,抗交感而無(wú)呼吸抑制的臨床特點(diǎn)而在臨床上廣泛使用。有研究表明DEX還具有心肌保護(hù)作用,包括能夠降低心輸出量、前后負(fù)荷,減慢心率,降低心肌耗氧量,增加心內(nèi)膜的血液供應(yīng),使心肌氧供需趨于平衡[7]。但是也有研究提示右美托咪定不但對(duì)血流動(dòng)力學(xué)和冠狀動(dòng)脈血流量沒(méi)有影響,反而增加心肌梗塞面積[8]。表明右美托咪定對(duì)心肌保護(hù)的作用機(jī)制還需進(jìn)一步研究。
線粒體是真核動(dòng)物細(xì)胞進(jìn)行生物氧化和能量轉(zhuǎn)換的主要場(chǎng)所,被稱(chēng)為細(xì)胞的“動(dòng)力工廠”。線粒體生物氧化和能量轉(zhuǎn)換的過(guò)程中伴隨著活性氧(Reactive oxygen species,ROS)的產(chǎn)生[9]。ROS是參與維持細(xì)胞正常生理功能[10],以及組織修復(fù)等活動(dòng),而當(dāng)ROS將過(guò)度生成,超過(guò)了抗氧化的能力,增加了心肌氧化的應(yīng)激反應(yīng),進(jìn)而對(duì)線粒體的功能和能量的產(chǎn)生造成了不可逆的損傷,最終導(dǎo)致心肌細(xì)胞凋亡[11]。因此可知線粒體氧化應(yīng)激將導(dǎo)致線粒體能量代謝失調(diào),從而進(jìn)一步損傷了線粒體[12]。心肌細(xì)胞的凋亡是心肌損傷的重要機(jī)制,而線粒體凋亡途徑在心肌細(xì)胞的凋亡起著非常重要的作用[13]。Caspase-3、Caspase-9活性和表達(dá)增加被認(rèn)為是線粒體凋亡途徑發(fā)生的標(biāo)志[14]。有關(guān)通路在DEX心肌細(xì)胞保護(hù)中的作用的研究未見(jiàn)系統(tǒng)的報(bào)道。
過(guò)氧化氫(H2O2)誘導(dǎo)的氧化應(yīng)激模型是常用于研究心肌細(xì)胞氧化應(yīng)激損傷的手段之一,本實(shí)驗(yàn)研究了DEX對(duì)H2O2誘導(dǎo)的氧化應(yīng)激損傷后ROS和細(xì)胞凋亡的影響。實(shí)驗(yàn)結(jié)果表明,H2O2明顯增加心肌細(xì)胞ROS水平,使線粒體介導(dǎo)的細(xì)胞凋亡分子Caspase-3、Caspase-9表達(dá)增加,導(dǎo)致心肌細(xì)胞凋亡。而DEX能夠一定程度逆轉(zhuǎn)了H2O2導(dǎo)致的氧化應(yīng)激損傷。結(jié)果表明DEX能夠作用于心肌細(xì)胞的線粒體凋亡通路,抑制H2O2對(duì)心肌細(xì)胞的損傷,降低了心肌細(xì)胞凋亡。實(shí)驗(yàn)結(jié)果表明,單給DEX組的ROS產(chǎn)生與正常組相比不存在差異,這說(shuō)DEX并未對(duì)基礎(chǔ)水平的ROS產(chǎn)生影響。而H2O2則會(huì)引起心肌細(xì)胞ROS產(chǎn)量增加,造成過(guò)量的ROS得不到有效的清除。因此過(guò)量的ROS能夠造成線粒體氧化還原狀態(tài)失衡,引起線粒體凋亡通路活化,并導(dǎo)致細(xì)胞凋亡。而DEX能夠緩解治療組心肌細(xì)胞的氧化應(yīng)激負(fù)荷,抑制細(xì)胞內(nèi)ROS產(chǎn)生,減少Caspase-3、Caspase-9的表達(dá)活性。
綜上所述,DEX能夠抑制心肌細(xì)胞的線粒體凋亡途徑,達(dá)到保護(hù)心肌細(xì)胞的作用,但是其具體的信號(hào)轉(zhuǎn)導(dǎo)機(jī)制還需進(jìn)一步的深入研究。
1 Arcangeli A, D'Alò C, Gaspari R. Dexmedetomidine use in general anaesthesia[J]. Curr Drug Targets, 2009, 10(8): 687-695.
2 王藝萍,張敏,湯雪梅,等. 右美托咪定在心功能不全的老年患者纖支鏡檢查中的應(yīng)用[J]. 四川生理科學(xué)雜志, 2015, 37(1): 16-19.
3 Mahmoud M, Mason KP. Dexmedetomidine: review, update, and future considerations of paediatric perioperative and periprocedural applications and limitations[J]. Br J Anaesth, 2015, 115(2): 171-182.
4 Okada H, Kurita T, Mochizuku T, et al. The cardioprotective effect of dexmedetomidine on global ischemia in isolated rat hearts[J]. Resuscitation, 2007, 74(3): 538-545.
5 Guo H, Takahashi S, Cho S, et al. The effects of dexmedetomidine on left ventricular function during hypoxia and reoxygenation in isolated rat hearts[J]. Anesth Analg, 2005, 100(3): 629-635.
6 Wong ES, Man RY, Vanhoutte PM, et al. Dexmedetomidine induces both relaxations and contractions, via different {alpha}2-adrenoceptor subtypes, in the isolated mesenteric artery and aorta of the rat[J]. J Pharmacol Exp Ther, 2010, 335(3): 659-664.
7 Carollo DS, Nosssaman BD, Ramadhyani U, et al. Dexmedetomidine: a review of clinical applications[J]. Curr Opin Anaesthesiol, 2008, 21(4): 457-461.
8 Mimuro S, Katoh T, Suzuki A, et al. Deterioration of myocardial injury due to dexmedetomidine administration after myocardial ischaemia[J]. Resuscitation, 2010, 81(12): 1714-1717.
9 Walters JW, Amos D, Ray K, et al. Mitochondrial redox status as a target for cardiovascular disease[J]. Curr Opin Pharmacol, 2016, 27: 50-55.
10Urao N, Ushio-Fukai M. Redox regulation of stem/progenitor cells and bone marrow niche[J]. Free Radic Biol Med, 2013, 54: 26-39.
11Rodrigo R, Prieto JC, Castillo R. Cardioprotection against ischaemia / reperfusion by vitamins C and E plus n-3 fatty acids: molecular mechanisms and potential clinical applications [J]. Clin Sci(London), 2013, 124(1): 1-15.
12Burgoyne JR, Din HM, Eaton P, et al. Redox signaling in cardiac physiology and pathology[J]. Circ Res, 2012, 111(8): 1091-1106.
13馮睿章,黨萬(wàn)太. 心肌缺血/再灌注損傷與細(xì)胞內(nèi)多信號(hào)轉(zhuǎn)導(dǎo)通路的研究進(jìn)展[J]. 四川生理科學(xué)雜志, 2012, 34(1): 32-34.
14Rajendran P, Nandakumar N, Rengarajan T, et al. Antioxidants and human diseases[J]. Clinica Chimica Acta, 2014, 436: 332-347.
Effects of dexmedetomidine on ROS and apoptosis in neonatal rat cardiac muscle cells*
Cao Lu1, Zhou Dan1, Li Tao2, Chen Lin-lin1, Tan Xiao-qiu1, Liu Li1, Liu Xue-ru1△
(1.Department of Anesthesiology, Affiliated Hospital of Southwest Medical University; 2. Key Lab of Medical Electrophysiology, Ministry of Education; Institute of Cardiovascular Medicine, Southwest Medical University, Sichuan Luzhou 646000)
Objective:To investigate the effects of dexmedetomidine (DEX) on ROS and apoptosis in neonatal rat cardiac muscle cells. Methods: Neonatal rats (3-4 days) cardiomyocytes (NRCMs) were cultured for 24 h and divided into four groups: control group (Group C), H2O2group (final concentration of 500 μM, Group H), dexmedetomidine group (5 μM DEX, group D), and H2O2+DEX group (500 μM H2O2+ 5 μM DEX, group DH). Flow cytometry (FCM) was used to measure the effect of DEX on the ROS level and apoptosis of myocardial cells in rats. The level of Caspase-3 and Caspase-9 were detected by ELISA. Results: DEX significantly inhibited the increase of ROS levels in NRCMs induced by H2O2(P<0.05). The increased level of Caspase-3, Caspase-9 induced by H2O2was significantly inhibited by DEX (P<0.01 or P<0.05). DEX significantly attenuated cells ratio of apoptosis induced by H2O2(P<0.05). Conclusion: Dexmedetomidine inhibited the ROS levels and the activity of mitochondria mediated Caspase-3 and Caspase-9 expression and attenuated H2O2-induced apoptosis in myocardial cells, which may involved in the myocardial protective effect of DEX.
Dexmedetomidine; Myocardial cells; ROS; Oxidative stress; Apoptosis
國(guó)家自然科學(xué)基金資助項(xiàng)目(編號(hào):81401632);西南醫(yī)科大學(xué)青年基金項(xiàng)目(編號(hào):2014QN-003)
曹露,女,碩士研究生在讀,主要從事臨床麻醉學(xué)研究,Email:85933718@qq.com。
△通訊作者:劉雪茹,女,講師,主要從事臨床麻醉學(xué)研究,Email:liuxueru1981@163.com。
2016-11-28)

