利用hAPOA1原核蛋白生產兔多克隆抗體
徐志偉 趙杰++劉偉忠 劉照亭 王期
摘要:將hAPOA1的閱讀框連接到原核表達載體pGEX-4T-1中,構建成正確的pGEX-4T-1-hAPOA1原核表達質粒,然后將其轉入宿主菌BL21,經異丙基硫代半乳糖苷(IPTG)誘導后,宿主菌表達出與預期分子量大小相符的55.4 ku的融合蛋白;將純化后的包涵體融合蛋白免疫新西蘭大白兔,制備抗hAPOA1血清并檢測抗體效價。結果表明,經間接酶聯免疫吸附測定(ID-ELISA)及蛋白質免疫印跡(Western Blot)方法證實,獲得的融合蛋白免疫新西蘭大白兔得到了特異性的多克隆抗體,抗體效價為1 ∶[KG-*3]40 000,經濟效益可觀。
關鍵詞:hAPOA1;原核表達;新西蘭大白兔;融合表達;多克隆抗體
中圖分類號: S852.5文獻標志碼: A
文章編號:1002-1302(2016)12-0085-03
收稿日期:2016-08-11
基金項目:江蘇省農業科技自主創新資金[編號:CX(16)1326]。
作者簡介:徐志偉(1965—),男,江蘇常州人,碩士,助理研究員,主要從事畜禽養殖研究。E-mail:xzw1729@sina.com。
通信作者:王期,博士,主要從事生物技術研究。E-mail:swwq0401@163.com。
載脂蛋白A1(ApoA1)是apoA族最多的一種組分,apoA1為單一多肽鏈,由243個氨基酸殘基組成,是高密度脂蛋白(HDL)的主要載脂蛋白,不僅是生物試劑的重要原料,也是抗動脈粥樣硬化的指標[1]。目前,apoA1的檢測多采用免疫比濁法[2],現有的抗載脂蛋白A1抗體的生產采用傳統的免疫方式(免疫原從高密度脂蛋白純化得到,免疫動物受限等),產量、效價及特異性較差,已無法滿足日益增長的使用需求。本研究構建了hAPOA1的原核表達載體,通過大腸桿菌原核表達系統進行hAPOA1的蛋白表達與純化,并通過免疫新西蘭大白兔獲得了抗血清,為自主大規模生產抗hAPOA1抗體及后續的免疫檢測試劑盒研發奠定了基礎。
1材料與方法
1.1試驗材料
1.1.1菌種和質粒E.coli DH5α、表達載體pGEX-4T-1、E.coli BL21(DE3)均由筆者所在實驗室保存。
1.1.2試劑限制性內切酶NotⅠ、EcoRⅠ為TaKaRa公司產品;T4 DNA連接酶、TaqDNA聚合酶、核酸標準相對分子質量購自TaKaRa公司;蛋白質分子量標準購自MBI公司;蛋白胨和酵母粉購自英國OXOID公司;氨芐青霉素購自Ameresco公司;IPTG購自Merck公司;丙烯酰胺(Acr)及甲叉雙丙烯酰胺(Bis)購自Promega公司;四甲基乙二胺(TEMED)購自 BioRad 公司;考馬斯亮藍R-250購自Sanland公司;膠回收試劑盒及質粒提取試劑盒購自Axygen公司;弗氏完全佐劑和不完全佐劑為Sigma公司產品;Goat-Rabbit IgG-HRP購自 Bioworld;其余試劑均為國產分析純。
1.1.3試驗動物本研究所用動物為健康的新西蘭大白兔。
1.2試驗方法
1.2.1pGEX-4T-1-hAPOA1原核表達質粒的構建根據人源的hAPOA1基因序列(Gene ID:335)設計引物,5′和3′端分別加入EcoRⅠ和NotⅠ酶切位點。上游引物:5′-CCGGAATTCATGAAAGCTGCGGTGCTGACCTT -3′;下游引物:5′-AAAGCGGCCGCTCACTGGGTGTTGAGCTTCTTAGT-3′。以hAPOA1的全長cDNA序列為模板進行PCR擴增,反應程序:95 ℃ 5 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min,30個循環;72 ℃ 10 min。PCR產物和pGEX-4T-1載體分別經EcoRⅠ和NotⅠ雙酶切,并用T4 DNA連接酶連接,轉化E.coli DH5α感受態細胞。重組質粒經PCR和雙酶切篩選陽性克隆,并進行DNA測序,該重組質粒命名為pGEX-4T-1-hAPOA1(具體操作參考Novagen公司pET System Manual)。
1.2.2谷胱甘肽轉移酶(GST)-hAPOA1融合蛋白的小試誘導表達及鑒定將測序正確的重組質粒pGEX-4T-1-hAPOA1轉化宿主菌E.coli BL21(DE3),在平板上挑取3個克隆,各接種于4 mL含氨芐青霉素100 mg/L的LB液體培養基(含胰蛋白胨0.04 g,酵母提取物0.02 g,NaCl 0.04 g),37 ℃ 振蕩培養4 h,使D600 nm達到0.8~1.0,加異丙基硫代半乳糖苷(IPTG)至終濃度為1 mmol/L,繼續振蕩培養6 h,12 500 g 離心10 min后收集菌體并留樣進行聚丙烯酰氨凝膠電泳(SDS-PAGE),結合考馬斯亮藍G-250染色,脫色后分析融合蛋白表達與否。
1.2.3GST-hAPOA1融合蛋白的大量表達及表達產物分布將上述鑒定正確表達的pGEX-4T-1-hAPOA1-BL21(DE3)凍存菌株接種于4 mL含氨芐青霉素100 mg/L的LB液體培養基(含胰蛋白胨0.04 g,酵母提取物0.02 g,NaCl 0.04 g)中,37 ℃振蕩培養16 h,然后取4 mL接種到400 mL LB液體培養基中,37 ℃振搖培養2~4 h,D600 nm達到0.8~10時,加IPTG至終濃度0.5 mmol/L,20 ℃繼續振蕩培養 12 h,12 500 g 離心10 min收集菌體并留樣,按1 g菌體沉淀加 5 mL 磷酸緩沖鹽溶液(PBS)重懸誘導表達后的菌體沉淀,經超聲破碎(設置為工作5 s,間歇6 s,功率300 W,全程時間20 min)后,12 500 g、4 ℃離心15 min后取上清和沉淀留樣,進行SDS-PAGE,結合考馬斯亮藍G-250染色,脫色后分析GST-hAPOA1融合蛋白表達產物的表達量及存在形式。
1.2.4GST-hAPOA1融合蛋白的純化對于上述大量誘導的包涵體蛋白,分別用2、3、4、6、8 mol/L尿素溶液對沉淀進行梯度重懸、洗滌處理,每次洗滌完后于4 ℃、12 500 g離心 20 min 重新收集沉淀,接著將洗脫下的目的蛋白裝入透析袋,放入PBS中透析過夜。SDS-PAGE結合Western-Blot檢驗洗脫后的蛋白;采用二喹啉甲酸(BCA)法微量蛋白濃度測量試劑盒測定純化后蛋白濃度,分裝后于-80 ℃保存。
1.2.5hAPOA1多克隆抗體的制備將純化并透析過的包涵體融合蛋白按常規方法免疫新西蘭大白兔(注射總量為500 μg/只),首次免疫加等體積弗氏完全佐劑乳化后,大腿肌肉多位點注射;3周后以同樣的抗原劑量與弗氏不完全佐劑乳化后增強免疫;此后每隔7 d以同樣的抗原劑量加強免疫1次,共3次。第2次、第3次加強免疫前均耳緣靜脈采血,分離血清,以hAPOA1純化融合蛋白(2 μg/mL)為抗原進行間接酶聯免疫吸附測定(ID-ELISA)測定[3],以免疫前家兔血清作為陰性對照,PBS作為空白對照,效價檢測合格后在第3次加強免疫后7 d進行頸動脈采全血作為陽性血,同樣用 ID-ELISA方法測定免疫兔血清抗體效價。血液處理方法:37 ℃靜置1 h,4 ℃靜置過夜,5 000 r/min離心15 min,吸取上清于50 mL離心管,再次 5 000 r/min 離心 15 min,吸取上清,留取近期使用量于2~8 ℃存放,其余分裝后置于-80 ℃。
1.2.6hAPOA1血清抗體特異性檢測取純化后的融合蛋白GST-hAPOA1及空載體pGEX-4T-1表達蛋白樣品進行SDS-PAGE后,采用電轉膜法(100 V,60 min)轉移至硝酸纖維素(NC)膜上,5%脫脂奶粉封閉后,以本試驗制備的兔抗血清(1 ∶[KG-*3]500稀釋)為一抗,辣根過氧化物酶標記羊抗兔[JP2]IgG(1 ∶[KG-*3]12 000稀釋)為二抗進行反應。二氨基聯苯胺(DAB)避光顯色15 min左右,條帶清晰后用雙蒸水洗以終止反應。
2結果與分析
2.1pGEX-4T-1-hAPOA1原核表達質粒的構建
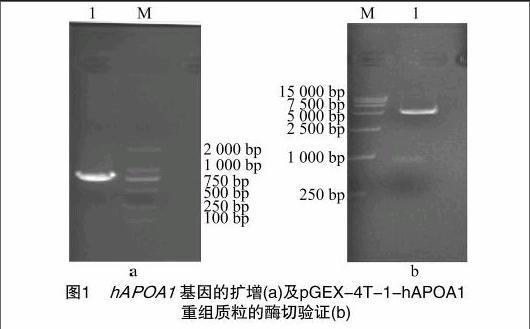
利用上述設計的引物對hAPOA1進行PCR擴增,PCR產物在1%瓊脂糖凝膠電泳結果(圖1-a)顯示,擴增出1個特異性的DNA條帶,分子量大小介于750 bp與1 000 bp之間,與理論值804 bp相符。對重組質粒用EcoRⅠ、NotⅠ雙酶切,獲得大小約為5 000、800 bp的2個條帶(圖1-b),與理論值4 969、804 bp一致,初步說明重組成功。重組質粒經上海英駿生物技術有限公司測序,結果正確,可以確定 pGEX-4T-1-hAPOA1 原核表達質粒構建成功。
2.2GST-hAPOA1融合蛋白的誘導表達及表達產物SDS-PAGE分析
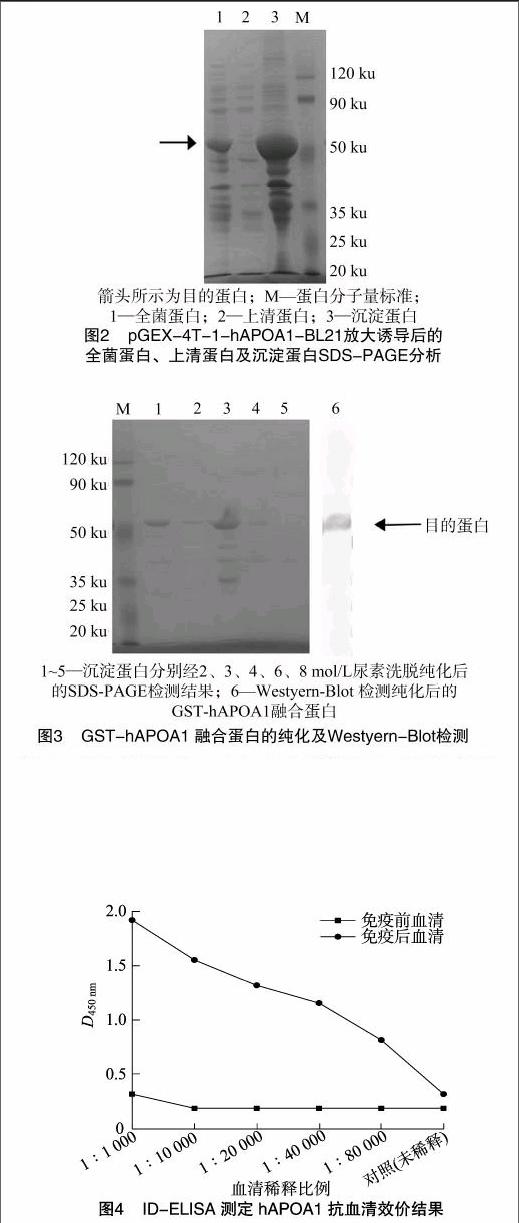
hAPOA1基因編碼267個氨基酸,由于克隆的hAPOA1基因插入位置在pGEX-4T-1載體的GST-tag下游,使用hAPOA1基因自帶的終止密碼子,谷胱甘肽轉移酶(GST)標簽蛋白分子量約為26 ku,所以重組菌表達的hAPOA1分子量約為55.4 ku。將重組原核表達質粒pGEX-4T-1-hAPOA1轉化大腸桿菌感受態BL21,隨機挑取3個克隆,37 ℃經IPTG誘導小試,收集菌體進行SDS-PAGE分析,結果顯示,在 55 ku 位置有較濃的特征蛋白條帶出現,與預期分子量一致,而對照組均無此條帶,說明重組菌能表達出hAPOA1蛋白(圖未顯示)。將上述鑒定正確的pGEX-4T-1-hAPOA1-BL21凍存菌于20 ℃放大誘導培養,收集菌體進行超聲破碎,取上清和沉淀分別進行SDS-PAGE,上清中幾乎無融合蛋白GST-hAPOA1表達(圖2),證明融合蛋白GST-hAPOA1以包涵體形式在宿主菌內高效表達。
2.3GST-hAPOA1融合蛋白的純化
對包涵體純化后,收集的蛋白經SDS-PAGE分析、Western Blot檢測并經BCA法計算可得,其濃度為1.10 mg/mL,純度約為90%,6 mol/L尿素溶液洗脫后獲得的融合蛋白的純度及產量最佳(圖3)。
2.4hAPOA1抗血清效價測定
將純化后并經過透析的融合蛋白作為免疫原,采用肌肉多[CM(25]點注射免疫新西蘭大白兔,4次注射后進行抗血清的效價[CM)]
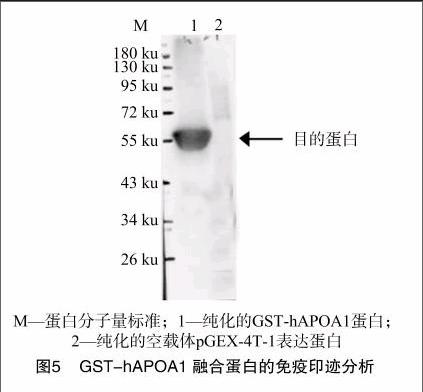
為抗原進行ID-ELISA測定,以表達的hAPOA1融合蛋白作抗原,抗血清稀釋 40 000 倍以上仍明顯地呈陽性反應(圖4)。效價判斷標準為大于最大D450 nm的50%的最小D450 nm所對應的稀釋度,本抗血清效價為 1 ∶[KG-*3]40 000。
2.5抗體免疫原性鑒定
[JP2]對純化的融合蛋白GST-hAPOA1及空載體pGEX-4T-1表達蛋白樣品進行SDS-PAGE電泳,將凝膠上的目的蛋白轉移到NC膜中,并對NC膜進行封閉、一抗、二抗孵育,然后用DAB顯色,結果在55 ku處出現明顯的特異性雜交條帶(圖5),表明本試驗制備的多克隆抗體具有免疫反應性和蛋白特異性,同時也表明融合蛋白在大腸桿菌中的表達獲得了成功。
[FK(W15][TPXZW5.tif;S+3mm]
3討論
高密度脂蛋白(HDL)具有促進膽固醇的逆向轉運及抗動脈硬化作用,Apoa1是HDL的結構蛋白,幾乎有所HDL都含有Apoa1,其水平可直接反映HDL在體內情況,Apoa1在HDL功能如抗氧化、抗炎方面至關重要,與冠心病呈負相關性[4]。另外,有研究表明,聯合檢測載脂蛋白A與載脂蛋白B(ApoB)對血脂的判斷具有重要的臨床價值[5-6],測定載脂蛋白及脂蛋白HDL、低密度脂蛋白(LDL)對分析病理發生狀態很有幫助。由此可見Apoa1對于醫學診斷及疾病治療的重要性。目前生產大量Apoa1抗血清,主要采用高密度脂蛋白純化的Apoa1作為抗原免疫得來。由于大量血清中分離純化Apoa1的過程中不可避免會有一些血清蛋白等雜蛋白的污染,去掉這些影響抗體交叉反應的雜蛋白成分,勢必會提高抗體生產成本。如果用含雜蛋白污染的Apoa1作為抗原免疫動物后,必然會導致非特異性抗體的產生,而Apoa1的臨床精確檢測需要高質量的抗體。本研究詳細報道了抗Apoa1抗體的制備過程,利用自主表達的Apoa1的重組蛋白抗原,不存在大量血清蛋白殘留的問題,且生產成本低,抗體特異性及效價均很好,是一種非常經濟可取的抗體制備方法。
[HS2][HT8.5H]參考文獻:[HT8.SS]
[1]徐寶華. 動脈粥樣硬化不穩定斑塊的研究進展[J].心血管病學進展,2005,26(5):498-501.
[2]李培英,王抒. 載脂蛋白免疫比濁法有關問題解答[J].臨床檢驗雜志,1995,13(3):158-159.
[3]薩姆布魯克J,拉塞爾D W. 分子克隆實驗指南[M].黃培堂,譯.3版.北京:科學出版社,2002:1256-1259.
[4]劉姍姍,王璐,邱建平. 血清載脂蛋白A1、載脂蛋白B及其比值與冠脈病變程度相關性分析[J].中國實驗診斷學,2013,17(7):1216-1218.
[5]Hirata T,Fujioka M,Takahashi K A,et al.ApoB C7623T polymorphism predicts risk for steroid-induced osteonecrosis of the femoral head after renal transplantation[J].Jounal of Orthopaedic Science,2007,12(3):199-206.
[6]陳保生. 載脂蛋白的結構和功能與病毒病的預防和治療[J].中國醫學科學院學報,2007,29(3):448-451.

