香菇胞外多糖的化學結構與抗氧化活性
摘要:利用高效液相色譜(HPLC)、氣相色譜(GC)和紅外光譜(IR)分析法等對香菇(Lentinus edodes)發酵液中香菇胞外多糖(exopolysaccharides,EPS)2種組分EPS-1、EPS-2的化學結構進行特征分析,測定其抗氧化活性。結果表明,EPS-1的單糖組成主要為鼠李糖、阿拉伯糖和甘露糖,其摩爾比為1.7 ∶[KG-*3]1.0 ∶[KG-*3]3.0;EPS-2的單糖組成主要為鼠李糖、阿拉伯糖、甘露糖和葡萄糖,其摩爾比為7.2 ∶[KG-*3]2.3 ∶[KG-*3]1.0 ∶[KG-*3]8.4;EPS-1、EPS-2均有較強的抗氧化活性,EPS-2 體外抗氧化活性相對更強。
關鍵詞:香菇;胞外多糖;化學結構;抗氧化
中圖分類號: R284.1文獻標志碼: A
文章編號:1002-1302(2016)12-0313-03
收稿日期:2015-12-30
作者簡介:元向東(1970—),男,河南安陽人,碩士,講師,主要從事生物技術及分析研究。E-mail:18865489890@163.com。
香菇(Lentinus edodes)別稱花菇,世界第二大真菌門側耳科香菇屬(Lentinus)食用菌,口味鮮美,營養豐富,富含多糖、維生素、蛋白質、多元酚、樸菇素、膳食纖維等多種生物活性物質,其中,香菇多糖具有抗氧化、抗衰老、抗腫瘤、抗炎、保肝護肝和降血糖等作用[1-2]。液體發酵是目前真菌發酵中應用較為廣泛的一項技術,具有可以工業化連續生產、規模大、產量高、發酵周期短、生產效益高等優點,除在液體發酵過程中產生大量菌絲或孢子外,還會在發酵液中分泌多糖、多肽等具有生理活性的物質。本研究采用DEAE-52纖維素柱和G-100葡聚糖,對香菇發酵液中的胞外多糖(exopolysaccharides,EPS)進行分離純化,得到EPS-1、EPS-2等2種組分。在此基礎上,采用高效液相色譜(HPLC)、氣相色譜(GC)和紅外光譜(IR)分析法等分別分析這2種組分的分子量、單糖組成、鍵型和抗氧化活性,以期為香菇液體的深層發酵及香菇胞外多糖的開發利用提供參考。
1材料與方法
1.1材料、試劑與儀器
1.1.1菌株與培養基供試菌種香菇由內蒙古農業科學院真菌研究所保存并提供。深層液體種子培養基:馬鈴薯 200 g、葡萄糖20 g、KH2PO4 1 g、MgSO4·7H2O 1 g、維生素B1 0.1 g、水1 L,自然pH值,于搖床25 ℃、160 r/min振蕩培養 10 d。深層液體發酵培養基:馬鈴薯200 g、葡萄糖20 g、KH2PO4 1 g、MgSO4·7H2O 1 g、維生素B1 0.1 g、蛋白胨3 g、酵母粉3 g、水1 L,自然pH值,100 L氣升式液體深層發酵罐中培養14 d,發酵溫度為25 ℃,連續通入無菌空氣。
1.1.2試劑30% H2O2,由天津市凱通化學試劑有限公司生產;95%乙醇,由天津市百世化工有限公司生產;DPPH、DEAE-52纖維素、葡聚糖G-100,由Sigma公司生產;苯酚,由天津市天大化學試劑廠生產;濃硫酸、濃鹽酸,由淄博化學試劑廠有限公司生產;三氯乙酸,由天津大茂化學試劑廠生產。
1.1.3儀器752-N紫外可見分光光度計、DK-S24型恒溫水浴鍋、DZF-6021型真空干燥箱,均由上海精宏實驗設備有限公司生產;GC2010氣相色譜儀,由日本島津公司生產;Nicolet380傅立葉變換紅外光譜儀,由美國熱電集團生產;TDL-5-A型臺式離心機,由上海安亭科學儀器廠生產;LXJ-68-02型離心機,由北京醫療儀器修理廠生產;1260型高效液相色譜儀,由美國安捷倫科技有限公司生產。
1.2多糖的提取
將香菇的發酵液離心,除去胞外產物;用旋轉蒸發儀濃縮,加入3倍體積的95%無水乙醇;4 ℃醇沉24 h,3 500 r/min 離心20 min;棄去上清液,將獲得的沉淀真空冷凍干燥即得胞外多糖。
1.3多糖組分的測定
采用DEAE-纖維素離子交換柱對EPS組分進行分析:用濃度梯度為0.2、0.5、1.0 mol/L的NaCl溶液進行洗脫,洗脫速度控制在1 mL/min;每個洗脫梯度收集25支試管,每支試管收集2 mL,采用苯酚-硫酸法[3]測定收集溶液的多糖濃度,繪制洗脫曲線。采用葡聚糖G-100凝膠柱對多糖組分進行純度鑒定[4]:用0.1 mol/L NaCl溶液充分平衡層析柱,用蒸餾水作為洗脫劑進行洗脫,洗脫速度控制在0.1 mL/min;每支試管收集 2 mL,采用硫酸-苯酚法測定收集溶液的多糖濃度,繪制洗脫曲線。
1.4EPS 2種組分分子量的測定
用0.2 mol/L NaCl水溶液將葡聚糖(標準品)及EPS樣品均配成質量濃度為2 mg/mL的溶液,采用高效凝膠滲透色譜法[5]測定多糖分子量,高效液相色譜儀測定條件為:Shodex SB-806 HQ 8.0 mm×300 mm色譜柱,柱溫為5 ℃,0.2 mol/L NaCl溶液為流動相,進樣量為100 μL,流速為 0.5 mL/min;以1 g分子質量對數(Mw)為縱坐標、保留時間(ET)為橫坐標繪制標準曲線,得線性回歸方程為:Mw=1-0.342 9ET+11.975(r2= 0.999 1);根據樣品上柱測定保留時間,計算樣品的分子量。
1.5EPS 2種組分的單糖構成
糖樣品經過0.25 mol/L H2SO4 100 ℃加熱16 h完全水解,或者不經過水解處理,按照Blakeney等的方法[6]將各單糖制備成全乙酰化糖醇衍生物;采用氣相色譜分析糖的構成,分離柱為島津公司生產的0.25 mm×30 m毛細管柱DB-1,柱溫為210 ℃,N2流速為30 mL/min。
1.6EPS 2種組分化學結構分析
試驗樣品采用KBr壓片,采用Perkin Elmer公司的Spectrun GXFT-IR紅外光譜分析系統對EPS 2種組分進行化學成分結構分析。
1.7EPS 2種組分體外抗氧化活性測定
EPS 2種組分清除DPPH自由基的測定方法為:2 mL 95%乙醇或0.1 μmol/L DPPH與2 mL濃度在100~1 000 mg/L 之間的EPS溶液進行混合,25 ℃水浴15 min,517 nm 處測定吸光度[7]。EPS清除羥基自由基的測定采用Smironff等的方法[8],多糖還原力的測定采用Oyaizu的方法[9]。
2結果與分析
2.1香菇胞外多糖的組成
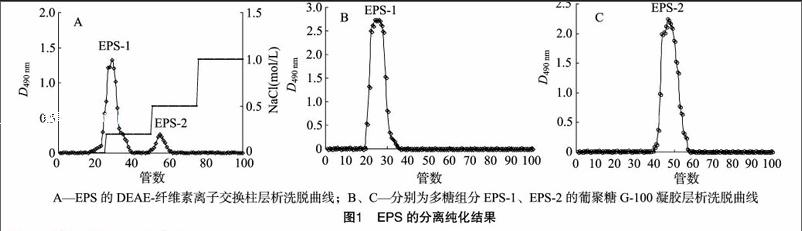
采用DEAE-纖維素柱分析EPS發現,EPS含有EPS-1、EPS-2這2個組分(圖1-A)。對EPS的2個組分采用葡聚糖G-100凝膠進行分離,結果表明,EPS-1、EPS-2均分離得到1個單一的洗脫峰(圖1-B、C),這表明EPS-1、EPS-2 均為純的多糖。
[TPYXD1.tif]
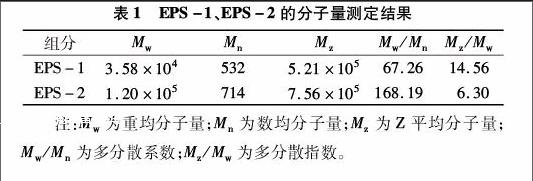
2.2EPS 2種組分的分子量
由表1、圖2可知,EPS-1、EPS-2的數均分子量分別為532、714,重均分子量分別為3.58×104、1.20×105,多分散系數分別為67.26、168.19。
[FK(W7][HT6H][JZ][WTHZ]表1EPS-1、EPS-2的分子量測定結果[HTSS]
[HJ*5][BG(!][BHDFG1*2,WK4*2,WK5*2。3,WK4。2W]組分MwMnMzMw/MnMz/Mw
[BHDG1*2,WK4*2,WK5*2。3,WK4。2DWW]EPS-13.58×1045325.21×10567.2614.56
[BHDW]EPS-21.20×1057147.56×105168.196.30[BG)F]
注:Mw為重均分子量;Mn為數均分子量;Mz為Z平均分子量;Mw/Mn為多分散系數;Mz/Mw為多分散指數。
2.3EPS 2種組分的單糖構成
由表2可知,EPS-1單糖組成有鼠李糖、阿拉伯糖、甘露糖,占比分別為28.8%、15.5%、55.7%,其摩爾比為 1.7 ∶[KG-*3]1.0 ∶[KG-*3]3.0;EPS-2單糖組成有鼠李糖、阿拉伯糖、甘露糖、葡萄糖,占比分別為36.7%、10.7%、5.6%、47.0%,其摩爾比為7.2 ∶[KG-*3]2.3 ∶[KG-*3]1.0 ∶[KG-*3]8.4。
2.4EPS 2種組分化學結構分析
由圖3可見,EPS-1在3 431.24 cm-1附近有明顯的由 —OH 伸縮振動引起的吸收峰,在2 935.87 cm-1附近有C—H伸縮振動引起的吸收峰[10];1 643.86 cm-1處有酰胺羰基存在的吸收峰;1 433.41 cm-1處為C—H變角振動;1 060.88 cm-1處有糖環上C—O伸縮振動引起的吸收峰,這表明多糖中存在D—吡喃環[11];812.01 cm-1處有α糖苷鍵存在的吸收峰,568.58 cm-1 處有吡喃環伸縮振動引起的吸收峰。
由圖4可見,EPS-2在3 415.82 cm-1附近有較強的由—OH伸縮振動引起的吸收峰,2 925.17 cm-1附近有C—H
[FK(W23][TPYXD2.tif;S+3mm]
伸縮振動引起的吸收峰[10];1 638.03 cm-1處有酰胺羰基存在的吸收峰;1 416.65、1 618.54 cm-1處為C—H變角振動;1 153.83、1 079.34、1 023.96 cm-1處的吸收峰由C—O、O—H伸縮振動引起,這表明多糖中存在D-吡喃環[11-12]。
2.5EPS 2種組分的體外抗氧化活性
由圖5可見,隨EPS-1、EPS-2濃度的升高,EPS-1、EPS-2的抗氧化活性上升;EPS-1、EPS-2濃度為 1 200 mg/L 時,對DPPH的清除率分別為(57.85±0.69)%、(78.96±1.65)%,對羥基自由基的清除率分別為(11.50±0.43)%、(47.20±2.06)%,還原力分別為0.61±0.01、1.26±0.03,EPS-2的抗氧化能力明顯優于EPS-1。
3結論與討論
香菇發酵液經DEAE-纖維素離子交換柱和葡聚糖G-100凝膠柱分離,可得到多糖組分EPS-1、EPS-2。氣相色譜[CM(25]法測定EPS-1、EPS-2單糖組成發現,EPS-1中主要含[CM)]
[FK(W12][TPYXD5.tif]
[JP3]有鼠李糖、甘露糖,而EPS-2中主要含有鼠李糖、葡萄糖,對[JP2]EPS-1、EPS-2化學結構分析發現,2種多糖均為D-吡喃型。
有研究表明,當多糖濃度為1 000 mg/L時,蟲草對DPPH的清除率為20%[13],樺褐孔菌對DPPH的清除率為10%[14];多糖濃度為1 200 mg/L時,桑黃的還原力為0.10[15],樹舌靈芝的還原力為0.40[16]。本研究結果表明,EPS-1、EPS-2濃度為1 200 mg/L時,EPS-1、EPS-2對DPPH的清除率分別為57.85%±0.69%、78.96%±1.65%,對羥基自由基的清除率分別為11.50%±0.43%、47.20%±2.06%,還原力分別為0.61±0.01、1.26±0.03,與蟲草等相比,EPS-1、EPS-2 對DPPH、羥基自由基有較強的清除能力及較強的還原力,且EPS-2的抗氧化活性相對更強。
[HS2][HT8.5H]參考文獻:[HT8.SS]
[1]呂國英,范雷法,張作法,等. 香菇多糖研究進展[J]. 浙江農業學報,2009,21(2):183-188.
[2]張昕,張強,梁彥龍. 香菇多糖的抗腫瘤和降糖作用機制的研究進展[J]. 中國藥事,2008,22(2):149-154.
[3]Gilles D M,Hamilton K A,Rebers J K,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,2002,28(3):350-356.
[4]王博,徐莎,黃琳娟,等. 白芨多糖BSPI-A的分離純化及結構研究[J]. 食品科學,2010,31(17):120-123.
[5]Lin H J,Qin X M,Aizawa K,et al. Chemical properties of water-soluble pectins in hot-and cold-break tomato pastes[J]. Food Chemistry,2005,93(3):409-415.
[6]Blakeney A B,Harris P J,Henry R J,et al. A simple and rapid preparation of alditol acetates for monosaccharide analysis[J]. Carbohydrate Research,1983,113(2):291-299.
[7]Liu X H,Feng P Y,Shi Y L. Study of isolation and purification of polysaccharides from fresh mycelia of Agaricus blazei Mussill and its anti-fatigue effect[J]. Journal of Southwest Agricultural University,2006,28(2):190-194.
[HT8.]
[8]Smirnoff N,Cumbes Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry,1989,28(4):1057-1060.
[9]Oyaizu M. Antioxidative activity of browning products of glucosamine fractionated by organic solvent and thin layer chromatography[J]. J Soc Food Sci,1986,35(11):771-775.
[10]Zou X. Quick isolation and purification of extracellular polysaccharides from Agaricus blazei Murill and elementary property analysis[J]. Food Science,2005,17(4):14.
[11]Liu X,Zhao M. Antioxidant activities and functional composition content of selected Phyllanthus emblica fruits juice[J]. Food and Fermentation Industries,2006,32(5):151-154.
[12]Melo M S,Feitosa J A,Freitas A P,et al. Isolation and characterization of soluble sulfated polysaccharide from the red seaweed [JP3]Gracilaria cornea[J]. Carbohydrate Polymers,2002,49(4):491-498.
[13]李曉磊,趙珺,李丹,等. 冬蟲夏草深層發酵胞外和蛹蟲草子實體抗氧化活性的對比研究[J]. 食品科技,2009,34(9):75-79.
[14]Shen J W,Yu H Y,Huo Y F,et al. Purification of polysaccharide of Phaeoporus obliquus and the bioactivity of purified fractions[J]. Mycosystema,2009,28(3):564-570.
[15]Xie L Y,Zhang Y,Peng W H. Immune function and antioxidant activity of intracellular polysaccharides from Phellinus baumii[J]. Food Science,2011,32(9):276-281.
[16]Li Z P,Wu P,Wu S Q. Study on antioxidant activity of Ganoderma applanatum intracellular polysaccharides[J]. Science and Technology of Food Industry,2010,31(6):108-110.

