龐泉溝自然保護區常見禾本科植物內生真菌分布及其影響因素
賈 彤,曹苗文,周永娜,喬沙沙,柴寶峰
山西大學黃土高原研究所, 太原 030006
龐泉溝自然保護區常見禾本科植物內生真菌分布及其影響因素
賈 彤*,曹苗文,周永娜,喬沙沙,柴寶峰
山西大學黃土高原研究所, 太原 030006
以龐泉溝自然保護區4種不同群落類型林地和灌叢下的優勢禾草為研究對象,調查不同禾草內生真菌感染率,研究內生真菌感染的禾草種群與原生生境的土壤理化性質、土壤酶活性及土壤微生物群落結構的相互關系。結果發現,影響紫羊茅、中亞薹草和野燕麥染菌率的主要因子是土壤水分含量和碳氮比,且土壤C、N、S以及土壤水分含量與紫羊茅的內生真菌染菌率成正相關,土壤蔗糖酶、脲酶和酸性磷酸酶與紫羊茅的感染率顯著正相關,但中亞薹草與紫羊茅的結果相反。絲蓋傘科是華北落葉松林和油松林土壤微生物群落的優勢真菌,但不同染菌植被群落類型下的優勢細菌微生物群落組成不同。總體看來,4種森林群落類型下禾草內生真菌染菌率與土壤理化性質相關性不同,且受到的生態因子影響大小也有差異,內生真菌感染導致各植被群落類型的土壤微生物群落結構具有差異,其優勢土壤真菌和土壤細菌組成不同,這有助于進一步認識原生生境下不同感染率的禾草種群對土壤微生物群落結構的影響及其在生態系統中的各異生態學功能。
內生真菌;染菌率;酶活性;土壤微生物群落
內生真菌(fungal endophyte)是指存在于健康的活植物體內,并不使宿主形成明顯病害癥狀的一類真菌[1]。感染內生真菌的宿主分布非常廣泛,涉及草本、灌木、針葉樹和藻類等多個類群,特別以禾本科植物最為常見。從世界范圍來看,目前已發現有內生真菌至少存在于在80個屬290多種禾本科植物中[2]。禾草內生真菌菌絲大多數存在于植物的頂部莖稈分生組織中,也分布在植物的葉片、葉鞘、種子和穗中,內生真菌的宿主植物主要集中在兩個單子葉植物科:禾本科(Poaceae)和莎草科(Cyperaceae)中[3]。在植物營養器官中,莖基部分生組織中內生真菌菌絲密度高于葉鞘和葉片[2]。有研究發現不同生長階段的宿主植物體內的內生真菌豐度和分布也有明顯不同[4]。
對于全球自然生態系統中禾草內生真菌感染率的調查結果顯示,芬蘭高羊茅的感染率在96%—100%之間[5];丹麥黑麥草感染率變化范圍4%—82%[6];北非的摩洛哥、突尼斯和地中海的撒丁島地區高羊茅感染率分別為89.3%,57.5%和68.6%[7]。Vinton等發現北美草原披堿草屬禾草Elymuscanadensis的種群感染率均為100%[8]。南志標等對中國21個地區的披堿草(Elymusdahuricus)進行了染菌率調查,并在其中6個地區的披堿草種子中發現內生真菌感染率在4.4%—100%[9]。內生真菌在內蒙古草原天然禾草中有廣泛分布,常見禾草中有約63%的禾草感染內生真菌[10]。Ahlholm等在研究環境和宿主基因型對白樺內生真菌感染率的影響時發現,環境與基因型的交互作用共同決定特定基因型內生真菌在環境條件改變時的感染率[11]。
大量研究表明,內生真菌與人工禾草的關系是互利共生關系[12- 13],而與天然禾草的共生關系是從拮抗到互利共生都存在[14- 15]。內生真菌的影響不只限于宿主植物,還可能涉及植物所在生境的土壤微生物。土壤微生物參與推動生態系統的物質循環和能量流動,有機物的分解,養分轉化等生化過程,是土壤養分的儲存庫和植物生長可利用養分的來源之一,可作為衡量土壤肥力水平和土壤養分資源生物有效性的重要指標[16]。禾草內生真菌對土壤微生物群落結構和功能的影響逐漸受到學者的重視[17]。有研究報道,內生真菌顯著增加了盆栽羊草土壤中細菌、革蘭氏陰性細菌、真菌磷脂脂肪酸含量和磷脂脂肪酸總量,增加了羊草樣地土壤中革蘭氏陽性細菌和放線菌的磷脂脂肪酸含量[18]。Casas等發現存在于黑麥草中較高的內生真菌Neotyphodiumoccultans能夠增加土壤真菌活性,影響土壤微生物群落的代謝多樣性[19]。
目前關于天然禾草內生真菌的生態學效應的研究多集中于栽培禾草或天然禾草的盆栽實驗,然而對原生生境中天然禾草內生真菌的分布及其對土壤微生物的影響鮮有報道。本文以龐泉溝自然保護區4個不同群落類型下的染菌禾草種群為研究對象,通過調查原生生境下內生真菌染菌率以及土壤理化性質和土壤酶活性,分別比較研究土壤理化性質和土壤酶活性對自然界染菌植株分布的影響,探究內生真菌對土壤微生物群落結構的影響,以期了解原生生境下不同感染率的禾草種群在生態系統中的各異生態學功能。
1 材料與方法
1.1 研究材料
2015年7月在山西省龐泉溝自然保護區選取4個不同群落類型的樣地(鬼箭錦雞兒灌叢,山楊林,華北落葉松林,油松林)進行樣品采集。龐泉溝自然保護區地處呂梁山脈中段,位于山西省交城縣西北部和方山縣東北部。地理位置110°22′—37°55′ N。海拔1600—2831 m。年平均氣溫在3—4℃,相對濕度為60%,雨量充沛,年平均降水800 mm。本研究中,每個樣地選取作為優勢種的禾本科植物(紫羊茅,野燕麥,中亞薹草,早熟禾)進行染菌率檢測。其中,每個樣地內單株(叢)間隔5—10 m,共采集30單株(叢)。每個樣地取3個土壤樣品,保存于冰盒中帶回實驗室,一部分土壤曬干后用于土壤理化性質的測定,另一部分將3個土壤樣品混合后保存于- 20℃冰箱中用于高通量測序。同時對各個采集樣點進行編號,記錄采集時間、地點、地理位置、海拔、土壤類型和草地群落類型等信息(表1)。
1.2 研究方法
1.2.1 內生真菌的檢測
采用苯胺藍染色法進行葉鞘內生真菌的檢測,具體方法為:剪取成熟的葉片(帶葉鞘),用解剖刀切開葉鞘部分上表皮層并用鑷子撕下一塊上表皮,撕裂面朝下將其置于滴有苯胺藍染液的載玻片上,在酒精燈上加熱幾秒鐘,染色10—20 min后,蓋上蓋玻片,壓片并用吸水紙吸去多余的染液,于光學顯微鏡下觀察。葉鞘中若出現大量深藍色的菌絲則記錄為該禾草為染菌植株。不同樣地內,禾草內生真菌染菌率按某種禾草帶菌植株占該禾草供試植株百分比計算。

表1 龐泉溝自然保護區不同采樣地點的具體位置及土壤類型
CjMC:鬼箭錦雞兒灌叢微生物群落Caraganajubatasoil microbial community;PdMC:山楊林微生物群落Populusdavidianasoil microbial community;LpMC:華北落葉松林微生物群落Larixprincipis-rupprechtiisoil microbial community;PtMC:油松林微生物群落Pinustabuliformissoil microbial community
1.2.2 土壤理化性質的測定
土壤比重的測定采用比重瓶法,土壤含水量(SWC)的測定采用環刀法。土壤孔隙度和土壤粒度使用Mastersizer 3000 激光衍射粒度分析儀(Malvern Co.Ltd, Malvern, UK)進行測定。土壤總碳(C)、總氮(N)、總硫(S)含量使用元素分析儀(vario EL/MACRO cube, Elementar, Hanau, Germany)進行測定。采用苯酚鈉—次氯酸鈉比色法對土壤脲酶活性進行測定,過氧化氫酶的測定采用高錳酸鉀滴定法,蔗糖酶的測定采用3,5-二硝基水楊酸比色法,酸性磷酸酶的測定采用磷酸苯二鈉比色法。
1.2.3 土壤微生物群落結構的測定
用OMEGA土壤提取試劑盒進行基因組提取,利用Qubit2.0 DNA檢測試劑盒對基因組DNA精確定量,以確定PCR反應加入的DNA量。PCR所用的引物已經融合了Miseq測序平臺的V3-V4通用引物。引物組成如下:341F引物:CCCTACACGACGCTCTTCCGATCTG (barcode) CCTACGGGNGGCWGCAG,805R引物GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC。真菌擴增區域為ITS1,引物組成如下:ITS1F引物:CCCTACACGACGCTCTTCCGATCTN (barcode) CTTGGTCATTTAGAGGAAGTAA,ITS2-Rev引物GTGACTGGAGTTCCTTGGCACCCGAGAATTCCAGCTGCGTTCTTCATCGATGC。土壤樣品送到生工生物工程(上海)股份有限公司(Sangon Biotech(Shanghai)Co., Ltd)進行高通量測序。
1.3 數據處理
采用Microsoft Excel進行數據處理和作圖,數據采用SPSS 19.0進行單因素和多因素方差分析處理。使用CANOCO 4.5進行RDA分析。
2 結果與分析
2.1 不同群落下優勢禾草的內生真菌染菌率
由圖1可知,鬼箭錦雞兒灌叢樣地(樣地1)的紫羊茅和油松林樣地(樣地4)的野燕麥內生真菌染菌率最高(100%),而且顯著高于油松林樣地的中亞薹草內生真菌染菌率(30.9%)。這說明在油松林樣地中,不同植物基因型會顯著影響禾草的染菌率。山楊林樣地(樣地2)以及華北落葉松林樣地(樣地 3)的野燕麥、早熟禾和中亞薹草內生真菌感染率不同,其中,早熟禾的內生真菌感染率達90%,但這兩個樣地中的禾草染菌率無顯著差異。中亞薹草在3個不同樣地之間的內生真菌染菌率也無顯著差異,其染菌率為30.9%—54.9%。野燕麥在兩個樣地之間的內生真菌感染率也無顯著差異,這表明不同地理種群對中亞薹草和野燕麥的內生真菌感染率影響不大,但不同植物種之間染菌率差異較大。
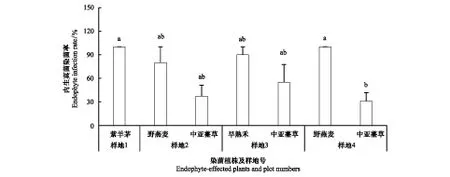
圖1 各個樣地的不同種禾草內生真菌感染率Fig.1 Endophyte infection rate of different grasses in each plot不同小寫字母表示差異顯著(P< 0.05)
2.2 土壤理化性質對禾草內生真菌感染率的影響
不同群落類型樣地中,幾種常見感染內生真菌的禾草分布受到土壤理化性質和土壤酶活性的影響(表2,圖2),為研究這些生態因子對禾草染菌率的影響大小以及影響每種禾草的重要因素,使用軟件CANOCO 5.0對實驗數據進行了RDA約束排序分析,得到4種感染內生真菌的禾草與8種土壤理化性質及4種土壤酶活性之間的關系(圖2)。結果表明土壤理化性質能夠解釋93.7%的4種常見禾草內生真菌染菌率的變異,其中,第一排序軸解釋了52%的變異信息,主要影響紫羊茅、中亞薹草和野燕麥的染菌率的理化性質是土壤水分含量和碳氮比(C/N)。第二排序軸解釋了39.3%的變異信息,主要與pH和總碳有關。不同土壤理化性質以及土壤酶活性與禾草內生真菌染菌率的相關性也不盡相同,土壤C、N、S以及土壤水分含量與紫羊茅的內生真菌染菌率成正相關,土壤蔗糖酶、脲酶和酸性磷酸酶與紫羊茅的感染率顯著正相關,但是,中亞薹草則與紫羊茅具有相反的結果。野燕麥染菌率與C/N及過氧化氫酶成顯著正相關關系,與S含量成顯著負相關關系(表2)。早熟禾受土壤理化性質和酶活性的影響較小,只與土壤碳含量顯著負相關。這表明不同的禾草內生真菌染菌率與土壤理化性質相關性不同,且受到的生態因子影響大小也各有差異。
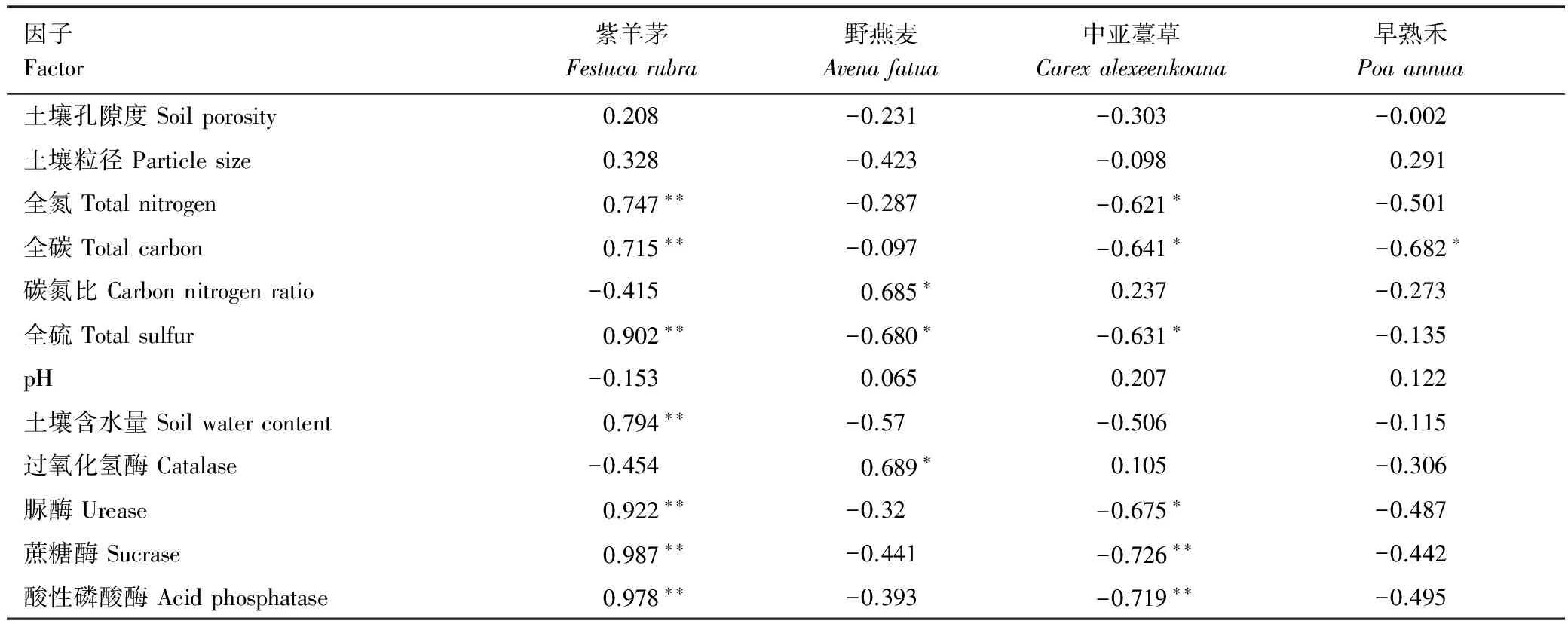
表2 內生真菌染菌率及其影響因子之間的相關性r
*表示在0.05水平上相關性顯著;**表示在0.01水平上相關性極顯著

圖2 不同禾草內生真菌染菌率與土壤理化性質及酶活性的RDA分析Fig.2 Redundancy analysis (RDA) bi-plot of endophyte infection rate, soil properties and enzyme activity
2.3 不同染菌率的植被對土壤微生物群落結構的影響
兩樣地中排在前21個細菌科的高通量數據結果表明,在細菌科的水平上,華北落葉松林土壤細菌群落主要是Chitinophagaceae,其相對豐度分別占整體細菌微生物群落的5.79%,其次是鞘脂單胞菌科(Sphingomonadaceae)、芽單胞菌科(Gemmatimonadaceae)和腸桿菌科(Entero-bacteriaceae),其相對豐度分別為5.15%、3.68%和3.39%(圖3)。油松林土壤細菌中最主要的為浮霉菌科(Planctomycetaceae,相對豐度9.27%),其次是芽單胞菌科、紅環菌科(Rhodocyclaceae)和鞘脂單胞菌科,分別占油松林土壤細菌微生物群落的4.32%、4.12%和3.59%。這說明不同染菌植被群落類型下的細菌微生物群落組成不同,其相對豐度變異性較大。
在真菌科的水平上,油松林土壤真菌的優勢群落是絲蓋傘科(Inocybaceae),相對豐度達37.67%,其次是革菌科(Thelephoraceae)、蠟傘科(Hygrophoraceae)和絲膜菌科(Cortinariaceae),相對豐度分別為19.87%、18.59%和10.52%(圖4)。相似地,絲蓋傘科也是華北落葉松林土壤真菌群落的優勢微生物,其相對豐度分別占整體真菌微生物群落的51.25%,其次是革菌科和被孢霉科(Mortierellaceae),其相對豐度分別為9.84%和4.01%。這表明兩個群落類型下的優勢真菌組成相同,但其相對豐度具有差異。
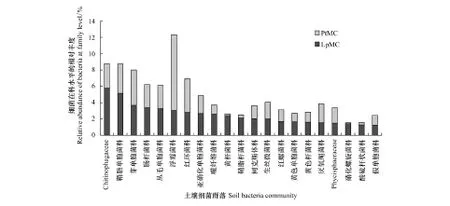
圖3 在科水平上不同樣地土壤細菌的相對豐度Fig.3 Relative abundance of bacteria at family level in different plotsLpMC:華北落葉松林土壤微生物群落Larix principis-rupprechtii soil microbial community;PtMC:油松林土壤微生物群落Pinus tabuliformis soil microbial community

圖4 在科水平上不同樣地的土壤真菌相對豐度 Fig.4 Relative abundance of fungi at family level in different plots LpMC:華北落葉松林土壤微生物群落Larix principis-rupprechtii soil microbial community;PtMC:油松林土壤微生物群落Pinus tabuliformis soil microbial community
3 討論
3.1 不同群落類型對優勢禾草內生真菌染菌率的影響
地中海草原區紫羊茅(F.rubra)內生真菌Epichlo?festuca的6個種群感染率在44%—92%之間[20]。本研究中鬼箭錦雞兒灌叢樣地的紫羊茅內生真菌染菌率高達100%。魏宇昆等發現不同樣地羽茅種群的內生真菌侵染率差別較大,侵染率最高的西烏旗種群和羊草樣地種群都為90%,定位站種群為80%,而霍林郭勒種群的侵染率只有40%[10]。與此結果不同,本研究發現中亞薹草在3個不同樣地之間的內生真菌染菌率也無顯著差異,其染菌率為30.9%—54.9%。野燕麥在兩個樣地之間的內生真菌感染率也無顯著差異,其原因可能是自然種群的內生真菌感染率對宿主而言,其“成本”和“收益”會隨著空間和時間以及環境選擇壓力的變化而改變,感染率也會相應地發生變化[21- 23]。Clay和Schardl認為,中等感染水平的內生真菌種群是不穩定的,感染率有增加或降低的可能,這取決于所在環境條件的選擇方向[24]。另外,分布區季節更替、環境空氣濕度、植物高度、其他植物類群都可能影響內生真菌的分布[25]。從整個生態系統層面考慮,不同感染率的禾草種群可能具有各異的生態學功能,是整個系統得以維持的條件之一,也是生態系統進化到某一階段的結果。
3.2 土壤理化性質及土壤酶活性對植被內生真菌感染率的影響
Lewis等研究發現,黑麥草屬野生種群的內生真菌感染水平和5種氣候因子有顯著的相關性,其中最顯著的是蒸散量和水分供給不足,回歸分析表明5個因素占到總變異的56%,僅水分供給不足就占到43%,感染率的空間分布表現為高感染率種群絕大多數分布在夏季干旱脅迫頻繁發生的地中海沿岸[26]。本研究得到類似的結論,實驗結果表明紫羊茅、中亞薹草和野燕麥染菌率的主要影響因素是土壤水分含量和碳氮比(C/N),其原因可能是內生真菌的正效應在關鍵時刻才表現出來,例如在極度、長期的干旱脅迫或種群數量快速下降時,共生體表現出較強的競爭力。本研究還發現土壤C、N、S以及土壤水分含量與紫羊茅的內生真菌染菌率成正相關,其部分原因可能是內生真菌感染提高了紫羊茅所在樣地的土壤C、N含量,促進土壤中C、N的積累[27]。
3.3 不同染菌率的植被對土壤微生物群落結構的影響
關于內生真菌感染對宿主所在土壤的微生物群落結構的影響,大多以高羊茅和黑麥草為研究對象,而且結果并不一致。Rudgers和Clay指出,禾草內生真菌對群落水平的影響大于對某個種群的影響[28]。Rudgers和Orr通過研究感染Neotyphodiumcoenophialum內生真菌的高羊茅對當地不同樹種生長的副作用,發現禾草內生真菌改變土壤的微生物群落[29]。Jenkins等發現, 感染內生真菌的高羊茅降低土壤中多種細菌的含量[30];而Iqbal等研究發現,感染內生真菌的高羊茅顯著提高了土壤微生物生物量[27]。本文以原生生境不同群落類型下不同優勢禾草為材料的研究結果表明,兩個樣地的土壤真菌群落優勢真菌都是絲蓋傘科,但不同染菌植被群落類型下的優勢細菌微生物群落組成不同,其原因可能在于內生真菌感染對土壤細菌群落結構組成的影響大于對土壤真菌的影響。紫羊茅的感染率與土壤蔗糖酶、脲酶和酸性磷酸酶顯著正相關,但中亞薹草與紫羊茅的結果相反,而染菌早熟禾與土壤理化性質和酶活性的關系不大,其原因可能在于內生真菌可以改變植物衰老葉片的化學組成,對不同植物的枯落物的分解速率不同[31- 32],進而對土壤微生物群落的結構和活性的影響結果具有一定差異。關于內生真菌感染如何改變宿主土壤微生物群落結構的原因目前還不明確,也可能是內生真菌能通過改變宿主禾草根系分泌物的含量,來改變土壤的理化性質, 進而改變土壤微生物群落結構[33]。
[1] Arnold A E, Maynard Z, Gilbert G S, Coley P D, Kursar T A. Are tropical fungal endophytes hyperdiverse? Ecology letters, 2000, 3(4): 267- 274.
[2] Clay K. Fungal endophytes of grasses. Annual Review of Ecology and Systematics, 1990, 21(1): 275- 297.
[3] Schardl C L.Epichlo?festucaeand related mutualistic symbionts of grasses. Fungal Genetics and Biology, 2001, 33(2): 69- 82.
[4] Bony S, Pichon N, Ravel C, Durix A, Balfourier F, Guillaumin J. The relationship between mycotoxin synthesis and isolate morphology in fungal endophytes ofLoliumperenne. New Phytologist, 2001, 152(1): 125- 137.
[5] Saikkonen K, Ion D, Gyllenberg M. The persistence of vertically transmitted fungi in grass metapopulations. Proceedings of the Royal Society B: Biological Sciences, 2002, 269(1498): 1397- 1403.
[6] Jensen A M D, Roulund N. Occurrence ofNeotyphodiumendophytes in permanent grassland with perennial ryegrass (Loliumperenne) in Denmark. Agriculture, Ecosystems and Environment, 2004, 104(3): 419- 427.
[7] Clement S L, Elberson L R, Youssef N N, Davitt C M, Doss R P. Incidence and diversity ofNeotyphodiumfungal endophytes in tall fescue from Morocco, Tunisia, and Sardinia. Crop Science, 2001, 41(2): 570- 576.
[8] Vinton M A, Kathol E S, Vogel K P, Hopkins A A. Endophytic fungi in Canada wild rye in natural grasslands. Journal of Range Management, 2001, 54(4): 390- 395.
[9] Zhang Y P, Nan Z B. Distribution of epichlo? endophytes in Chinese populations ofElymusdahuricusand variation in peramine levels. Symbiosis, 2007, 43(1): 13- 19.
[10] 魏宇昆. 中國北方草原禾草內生真菌資源調查及芨芨草屬植物內生真菌的遺傳多樣性研究[D]. 天津: 南開大學, 2006.
[11] Ahlholm J U, Helander M, Lehtim?ki S, W?li P, Saikkonen K. Vertically transmitted fungal endophytes: different responses of host-parasite systems to environmental conditions. Oikos, 2002, 99(1): 173- 183.
[12] Rasmussen S, Liu Q H, Parsons A J, Xue H, Sinclair B, Newman J A. Grass-endophyte interactions: a note on the role of monosaccharide transport in theNeotyphodiumlolii-Loliumperennesymbiosis. New Phytologist, 2012, 196(1): 7- 12.
[13] Ren A Z, Gao Y B, Zhou F. Response ofNeotyphodiumlolii-infected perennial ryegrass to phosphorus deficiency. Plant Soil and Environment, 2007, 53(3): 113- 119.
[14] Jia T, Shymanovich T, Gao Y B, Faeth S H. Plant population and genotype effects override the effects ofEpichlo? endophyte species on growth and drought stress response ofAchnatherumrobustumplants in two natural grass populations. Journal of Plant Ecology, 2015, 8(6): 633- 641.
[15] Jia T, Oberhofer M, Shymanovich T, Faeth S H. Effects of hybrid and non-hybridEpichlo? endophytes and their associated host genotypes on the response of a native grass to varying environments. Microbial Ecology, 2016, 72(1): 185- 196.
[16] 李秀璋, 方愛國, 李春杰, 南志標. 禾草內生真菌對其它微生物的影響研究進展. 生態學報, 2015, 35(6): 1660- 1671.
[17] Buyer J S, Zuberer D A, Nichols K A, Franzluebbers A J. Soil microbial community function, structure, and glomalin in response to tall fescue endophyte infection. Plant and Soil, 2011, 339(1- 2): 401- 412.
[18] 周勇, 鄭璐雨, 朱敏杰, 李夏, 任安芝, 高玉葆. 內生真菌感染對禾草宿主生境土壤特性和微生物群落的影響. 植物生態學報, 2014, 38(1): 54- 61.
[19] Casas C, Omacini M, Montecchia M S, Correa O S. Soil microbial community responses to the fungal endophyteNeotyphodiumin Italian ryegrass. Plant and Soil, 2011, 340(1- 2): 347- 355.
[20] Zabalgogeazcoa I, de Aldana B R V, Criado B G, Ciudad A G. The infection ofFestucarubraby the fungal endophyteEpichlo?festucaein Mediterranean permanent grasslands. Grass and Forage Science, 1999, 54(1): 91- 95.
[21] Brem D, Leuchtmann A.Epichlo? grass endophytes increase herbivore resistance in the woodland grassBrachypodiumsylvaticum. Oecologia, 2001, 126(4): 522- 530.
[22] Cheplick G P, Perera A, Koulouris K. Effect of drought on the growth ofLoliumperennegenotypes with and without fungal endophytes. Functional Ecology, 2000, 14(6): 657- 667.
[23] Morse L J, Day T A, Faeth S H. Effect ofNeotyphodiumendophyte infection on growth and leaf gas exchange of Arizona fescue under contrasting water availability regimes. Environmental and Experimental Botany, 2002, 48(3): 257- 268.
[24] Clay K, Schardl C. Evolutionary origins and ecological consequences of endophyte symbiosis with grasses. The American Naturalist, 2002, 160(S4): S99-S127.
[25] Petrini O. Fungal endophytes of tree leaves//Andrews J H, Hirano S S, eds. Microbial Ecology of Leaves. New York, NY: Springer, 1991: 179- 197.
[26] Lewis G C, Ravel C, Naffaa W, Astier C, Charmet G. Occurrence ofAcremoniumendophytes in wild populations ofLoliumspp. in European countries and a relationship between level of infection and climate in France. Annals of Applied Biology, 1997, 130(2): 227- 238.
[27] Iqbal J, Siegrist J A, Nelson J A, McCulley R L. Fungal endophyte infection increases carbon sequestration potential of southeastern USA tall fescue stands. Soil Biology and Biochemistry, 2012, 44(1): 81- 92.
[28] Rudgers J A, Clay K. Endophyte symbiosis with tall fescue: how strong are the impacts on communities and ecosystems? Fungal Biology Reviews, 2007, 21(2- 3): 107- 124.
[29] Rudgers J A, Orr S. Non-native grass alters growth of native tree species via leaf and soil microbes. Journal of Ecology, 2009, 97(2): 247- 255.
[30] Jenkins M B, Franzluebbers A J, Humayoun S B. Assessing short-term responses of prokaryotic communities in bulk and rhizosphere soils to tall fescue endophyte infection. Plant and Soil, 2006, 289(1- 2): 309- 320.
[31] Lemons A, Clay K, Rudgers J A. Connecting plant-microbial interactions above and belowground: a fungal endophyte affects decomposition. Oecologia, 2005, 145(4): 595- 604.
[32] Siegrist J A, McCulley R L, Bush L P, Phillips T D. Alkaloids may not be responsible for endophyte-associated reductions in tall fescue decomposition rates. Functional Ecology, 2010, 24(2): 460- 468.
[33] Van Hecke M M, Treonis A M, Kaufman J R. How does the fungal endophyteNeotyphodiumcoenophialumaffect tall fescue (Festucaarundinacea) rhizodeposition and soil microorganisms? Plant and Soil, 2005, 275(1- 2): 101- 109.
Distribution of endophyte fungi associated with common plants and preliminary assessment of impact factors in Pangquangou Nature Reserve
JIA Tong*, CAO Miaowen, ZHOU Yongna, QIAO Shasha, CHAI Baofeng
InstituteofLoessPlateau,ShanxiUniversity,Taiyuan030006,China
Fungal endophytes are fungi that live for a significant part of their life cycle internally and asymptomatically (without causing any apparent tissue damage) in plants. For grasses, these endophytes are often specialized, systemic, and vertically transmitted. Pangquangou Nature Reserve is located in the middle of the of Luliang Mountain range. It was established for the conservation of the first-grade State protection animal,Crossoptilonmantchuricum, and the cold-temperate coniferous forest. It plays a significant role in water conservation, eco-tourism, biodiversity maintenance, and other functions in Pangquangou Nature Reserve. Many studies have been conducted; however few of them have examined the distribution and mechanism of fungal endophytes associated with common plants in Pangquangou Nature Reserve. In the present study, we assessed the endophyte infection rate of dominant plants in four different forest communities. Our objective was to investigate the effects of endophyte fungi association on soil properties, soil enzyme activity, and soil microbial communities in native habitats. We surveyed endophyte infection rates of four common plants (Festucarubra,Avenafatua,Carexalexeenkoana, andPoaannua). We also analyzed the soil total carbon (C), total nitrogen (N), and total sulfur (S) with an Elemental Analyzer, and soil microbial community composition were assayed by using the high-throughput sequencing technique. Our results showed that soil water content and ratio of carbon and nitrogen were the main factors affecting the endophyte infection rates ofFestucarubraandCarexalexeenkoana, and the soil C, N, S and soil water content were positively correlated with the endophyte infection rate ofFestucarubra. There were strong positive correlations between soil invertase and endophyte infection rates ofFestucarubra, as well as urease and acid phosphatase. However,Carexalexeenkoanaexhibited opposite results to those ofFestucarubra. Inocybaceae is the dominant fungi of soil microbial community in Larix principis-rupprechtii community, but had different bacterial compositions in soil microbial community under four forest communities. Overall, there were different correlations between fungal endophyte infection rate and soil properties under different communities, and the effects of ecological factors were also different. Endophyte fungal contributed to change soil microbial community structure, and led to varying soil fungi and bacteria compositions in different forest communities. Our findings can help with further understanding the distribution of fungal endophytes associated with common plants in native habitats and the influence of endophyte infected plants on soil microbial community structure and ecological functions in ecosystems.
fungal endophyte; endophyte infection rate; enzymatic activity; soil microbial community
山西省應用基礎研究面上青年基金項目(201601D021101); 山西省回國留學人員科研資助項目(2016-006); 山西省科技攻關項目(20150313001- 3); 國家自然科學基金資助項目(31600308)
2016- 05- 31;
2016- 10- 09
10.5846/stxb201605311040
*通訊作者Corresponding author.E-mail: jiatong@sxu.edu.cn
賈彤,曹苗文,周永娜,喬沙沙,柴寶峰.龐泉溝自然保護區常見禾本科植物內生真菌分布及其影響因素.生態學報,2017,37(4):1103- 1110.
Jia T, Cao M W, Zhou Y N, Qiao S S, Chai B F.Distribution of endophyte fungi associated with common plants and preliminary assessment of impact factors in Pangquangou Nature Reserve.Acta Ecologica Sinica,2017,37(4):1103- 1110.

