餐廚垃圾厭氧消化起泡現象研究
何 琴,李 蕾,彭 爽,趙小飛,瞿 莉,王小銘,彭緒亞(重慶大學三峽庫區生態環境教育部重點實驗室,重慶 400045)
餐廚垃圾厭氧消化起泡現象研究
何 琴,李 蕾,彭 爽,趙小飛,瞿 莉,王小銘,彭緒亞*(重慶大學三峽庫區生態環境教育部重點實驗室,重慶 400045)
以餐廚垃圾中溫厭氧消化反應器為研究對象,考察泡沫事件對反應器性能如比沼氣產率(SBP)、比甲烷產率(SMP)和揮發性固體(VS)去除率等的影響;并通過分析泡沫前、后系統穩定性參數如揮發性脂肪酸(VFAs)濃度、VFA/總堿度(TA)值和氨氮(TAN)濃度等的變化情況,以及泡沫前、后(包括泡沫層與液體層)的細菌群落結構變化,解析泡沫事件產生的可能原因.結果表明,穩定期的SBP、SMP和VS去除率分別為(0.950 ± 0.104) m3/kg VS、(0.574 ± 0.072) m3CH4/kg VS和(87.14 ± 2.76)%,而泡沫事件顯著影響了反應器效率(t檢驗,95%的置信區間),SBP、SMP和VS去除率分別降為(0.717 ± 0.100) m3/kg VS、(0.432 ± 0.070) m3CH4/kg VS和(84.24 ± 4.44)%.泡沫發生前,系統內出現了VFAs快速積累現象,且易被產甲烷菌消耗的乙酸比例下降,而對泡沫趨勢具有增強作用的丙酸比例上升.并且泡沫出現后絲狀菌Longilinea arvoryzae和Levilinea,以及黏細菌Cytophaga fermentans的條帶強度明顯增大,而絲狀菌的絲狀結構以及粘細菌產生的粘性物質對起泡有一定程度的貢獻. 綜上,泡沫的產生可能是由系統內大量VFAs積累以及特定微生物大量繁殖的聯合作用引起的.
餐廚垃圾;厭氧消化;起泡現象;微生物
餐廚垃圾具有高有機質含量、高含水率及低熱值的特性,相比于常規的固體廢物處理方法如焚燒和填埋,常選擇厭氧消化技術處理餐廚垃圾并回收能源——沼氣[1].然而,泡沫問題是困擾厭氧消化系統穩定運行的一大難題[2-3].過去大量的研究者指出不適當的運行條件如超負荷、攪拌不當等會引起泡沫[2];也有不少研究者表明表面活性物質如蛋白質、脂質、VFAs等的積累,會減小表面張力,從而強化泡沫潛能[4].近年來也有研究者轉向分析關鍵微生物的影響,以期尋找泡沫產生的根本原因.如研究者[5-7]發現污泥厭氧消化反應器起泡后大量的 Gordonia或 Microthrix出現,并指出這兩種絲狀菌是誘導泡沫形成的主要原因.Kougias等[8]研究了經受泡沫事件的糞便消化反應器中微生物群落結構變化,卻發現除了常見的泡沫特征細菌 Nocardia 和Desulfotomaculum以外,可產生生物表面活性劑的Lactobacillus和Bacillus以及可減小溶液表面張力的Micrococcus和Streptococcus等的相對豐度在泡沫后顯著升高.然而,現有研究大多都專注于活性污泥系統,或污水污泥、糞便厭氧消化系統的泡沫研究.餐廚垃圾厭氧消化系統也極易出現起泡現象[9].但目前,研究者大多只報導了起泡現象的存在,起泡原因及對反應器性能及微生物群落的影響還鮮有進一步的研究.
本研究針對餐廚垃圾厭氧消化反應器的泡沫事件,根據所監測的理化指標,評估泡沫事件對反應器性能的影響;結合穩定性參數的分析,同時采用PCR-DGGE技術對比分析泡沫前、泡沫期(包括泡沫層與液體層)的細菌群落,以期尋找餐廚垃圾厭氧消化反應器中可能的起泡因子.
1 材料與方法
1.1 消化底物和接種污泥
消化底物為取自重慶大學某學生食堂的餐廚垃圾.在取樣前,估算運行30d所需的餐廚垃圾量,按照估算量分3份連續3d同一時間同一地點進行取樣,將取得的3份餐廚垃圾在大容器中混合均勻.人工去除骨頭、塑料袋和紙巾等雜質,用粉碎機制漿并混合均勻,過 10目篩,保證其粒徑≤2mm.采用四分法取樣測定理化性質,剩余餐廚垃圾用2L的容器分裝并密封,于-18℃條件冷凍保存,使用前1d于4℃解凍.反應器運行期間共取餐廚垃圾4次,每次取回后均測定餐廚垃圾理化性質,4次測定結果相差不大,情況如下:pH值為(6.31 ± 0.21),總固體含量(TS)為(28.20 ± 3.41)%,揮發性固體含量(VS)為(26.61 ± 3.25)%,VS/TS為(93.61 ± 1.54)%,碳氮比(C/N)為(14.73 ± 0.34).
接種污泥取自重慶市白市驛某戶農家沼氣池的室溫消化污泥.該消化污泥在接種前過10目篩,去除其中的大顆粒混雜物;并在(37 ± 1)℃預孵化2周,以去除其中殘留的原有機消化底物.接種污泥 pH 值為(7.35 ± 0.13),TS為(8.28 ± 0.63)%,VS為(5.54 ± 0.38)%,VS/TS為(67.05 ± 2.62)%,C/N為(10.06 ± 0.43).
1.2 反應器及運行
試驗在全自動的完全攪拌釜式反應器(CSTR)中進行,反應器總容積50L,工作容積30L.攪拌轉速 90r/min,采用間歇攪拌方式,攪拌時間3h,間歇時間 3h.通過與循環加熱水箱相連的容器夾套維持消化污泥溫度為(37 ± 1)℃.
一次性向反應器內投加 30L經預孵化后的接種污泥,采用每天進、出料一次的半連續方式運行.反應器運行階段劃分為:馴化期(1~14d)、穩定期(15~70d)、擾動期(71~86d)、泡沫期(87~129d)和恢復期(130~138d).
馴化期和穩定期的運行有機負荷(OLR)均為3.0kg VS/(m3·d).擾動期內,實驗樓分別在反應器運行的第71d、72d和75d發生了事故停電事件,時長分別為7h、10h和10h,造成反應器溫度波動(污泥溫度從設定的(37±1)℃降至(30±1)℃)和攪拌中斷.該事件發生后反應器內液面出現了少量的泡沫.為了觀察泡沫對系統性能及穩定性的影響,在第83d將OLR提升為4.0kg VS/(m3·d)以強化起泡現象.運行第87d反應器內出現了密集而穩定的泡沫,并持續了 43d.泡沫期間每日記錄反應器內所形成泡沫的體積,然后通過加強攪拌和多次從進料口手動回流消化液消除當天形成的泡沫.泡沫中后期和恢復期為了消泡并恢復系統正常運行,采用了降低進料負荷為 2.0kg VS/m3且進料間隔延長為2d的策略.
1.3 物化參數分析
pH值、產氣量和氣體成分(CH4和CO2)通過在線監測.在每日進料前取 80mL污泥用于其他物化參數的測定.TS、VS采用烘干法測定;總堿度(TA)和總揮發性脂肪酸(TVFA)濃度采用滴定法測定;總氨氮(TAN)采用標準方法[10]測定;C/N采用元素分析儀測定(Elementar VarioELⅢ元素分析儀,德國).VFAs(如乙酸、丙酸、丁酸、異丁酸、戊酸和異戊酸)采用氣相色譜法測定:氣相色譜儀(Agilent 7890A GC,Agilent,美國),FID檢測器,載氣為N2,DB-FFAP毛細管柱(30m×0.25mm I.D.,膜厚 0.5μm),進樣器和檢測器溫度分別為250和275℃,毛細管柱升溫程序:80℃維持2min,然后以 10℃/min的速率升溫至 200℃,并在200℃維持2min.每個指標測定設3個平行樣,結果取平均值.
1.4 DNA提取和PCR-DGGE
為了考察泡沫前后微生物群落變化情況,尋找反應系統中的泡沫特征微生物,分別對穩定期、泡沫初期(上層泡沫和下層污泥)、泡沫中期和末期及恢復期的反應器取樣進行微生物分析(對應編號1#~6#),取樣后立即于-80℃凍存,直至DNA提取處理.采用試劑盒E.Z.N.A.?Soil DNA Kit(OMEGA,美國)提取總DNA,并根據試劑盒說明書進行操作.
根據文獻資料,泡沫特征微生物均為細菌[5-8],故只對細菌進行擴增和序列分析.細菌引物采用341F(5′-CCTACGGGAGGCAGCAG-3′)和907R(5′-CCGTCAATTCCTTTGAGTTT-3′)用于細菌16S rDNA的PCR擴增,其中341F的5’端帶有40-bp的GC-clamp[11].反應體系50μL,包含各 1.0μL的上游和下游引物(10μmol/L),0.3μL Takara Ex 8Taq HS(5U/μL;Takara Bio,Shiga,日本), 5.0μL 10× Ex Taq Buffer,4.0μL dNTP 9Mixture (2.5mmol/L),20ng純化后的DNA模板,最后用無菌超純水補充體積至50μL.擴增反應在PCR儀(Veriti? 96-WellThermal Cycler,Applied Biosystems? Inc.,美國)中進行:94℃預變性 4min; 94℃變性 1min, 59℃退火 1min,72℃延伸 1.5min,循環 30次;在72℃延伸7min;最后于4℃結束反應.
利用DcodeTM基因突變檢測系統(Bio-Rad,美國)對 PCR擴增產物進行電泳分離.以去離子甲酰胺和尿素為變性劑,聚丙烯酰胺凝膠濃度為6%(質量濃度),變性梯度35%~70%.將30μL PCR產物與15μL 5×Loading Buffer混合均勻后加樣,電泳條件為60℃,120V預電泳20min,80V電泳14h.使用含有 SYBR Green I 染料的 1×TAE buffer(Molecular Probe,美國)染色 30min,然后在GelDoc凝膠成像系統(Bio-Rad,美國)中進行成像分析.
切取代表性條帶和優勢條帶,搗碎后置于30μL滅菌超純水中,于 4℃隔夜保存.以溶出的DNA為模板,以不含 GC-clamp的引物 341F/ 907R(細菌)進行第2次PCR擴增,反應體系及條件不變.PCR產物經純化試劑盒(E.Z.N.A.?Gel Extraction Kit,OMEGA,美國)純化后,克隆到pUM19-T Vector(Vazyme,美國)中,根據產品說明書進行操作.克隆后的基因片段送到北京鼎國昌盛生物科技有限公司測序.測序結果提交到GenBank,通過 NCBI基因序列數據庫(http: //www.ncbi.nlm.nih.gov/BLAST/)進行序列相似度搜索.
1.5 數據處理與分析
沼氣產量換算成標準狀態(0oC,101.325kPa)下的氣體體積.VS去除率和游離氨(FAN)濃度計算方法參考文獻[12].比沼氣產率(SBP)表示系統添加單位有機質(以1kg VS計)所產生的沼氣量(m3/kg VS);比甲烷產率(SMP)表示系統添加單位有機質(以1kg VS計)所產生的甲烷量(m3CH4/kg VS).使用SPSS軟件(version 18.0)分析各個理化指標的均值和標準偏差.
使用 Quantity One軟件(version 4.6.2)對DGGE圖譜中條帶的位置及亮度進行數字化,通過非加權配對算術平均法對圖譜進行聚類分析;使用SPSS軟件對圖譜進行主成分分析(PCA);根據公式計算Shannon-Wiener指數和Simpson指數
[13],用以表征樣品中微生物的豐富度和均勻度.
2 結果
2.1 厭氧消化反應器效能
從圖1可看出,反應器以3.0kg VS/(m3·d)的OLR啟動,經歷了前期效能參數波動較大的馴化期(1~14d)后,系統在 3.0kg VS/(m3·d)穩定運行56d(穩定期,15~70d).與馴化期相比,穩定期的SBP和SMP顯著提高,而VS去除率則變化不明顯(t檢驗,95%置信區間)(表1).
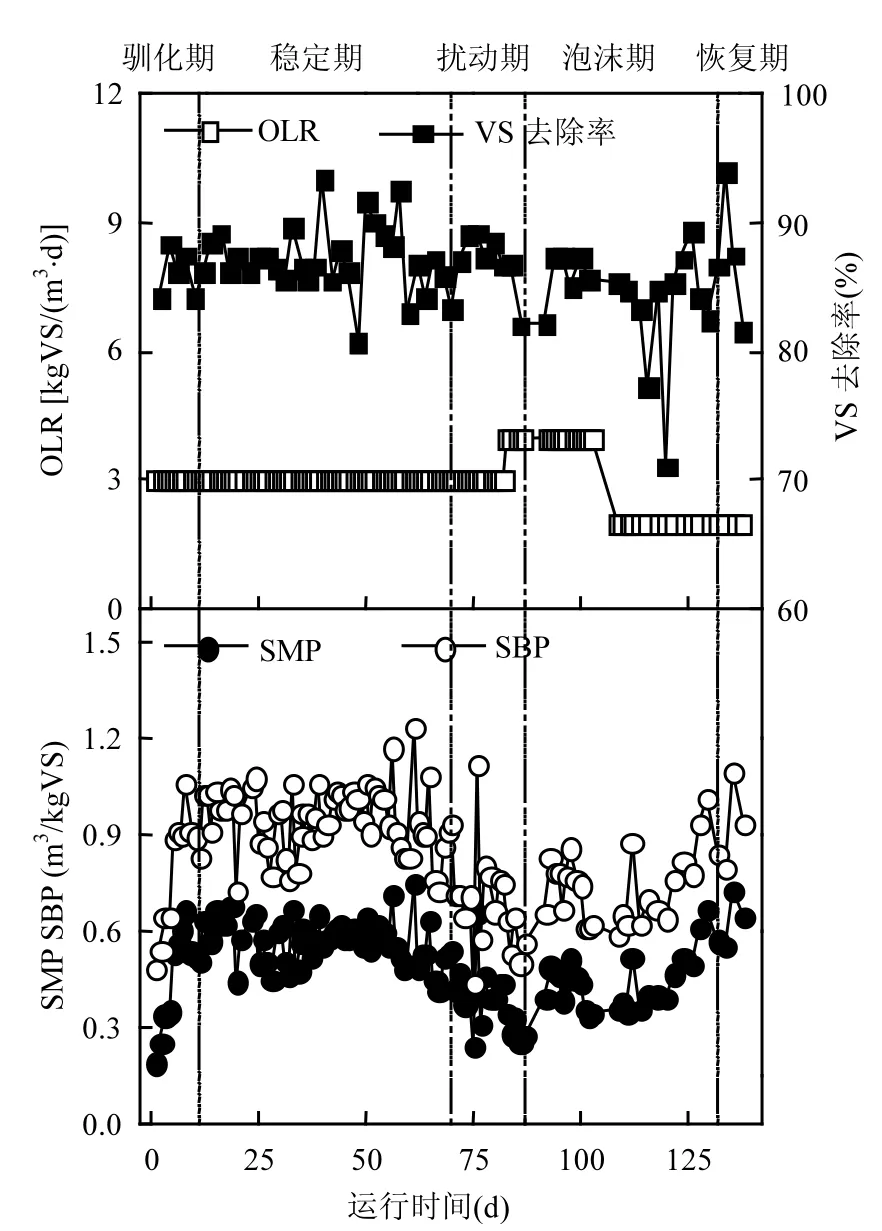
圖1 厭氧消化反應器效能參數Fig.1 Performance parameters of the studied anaerobic digester“┆”表示運行階段的劃分界線
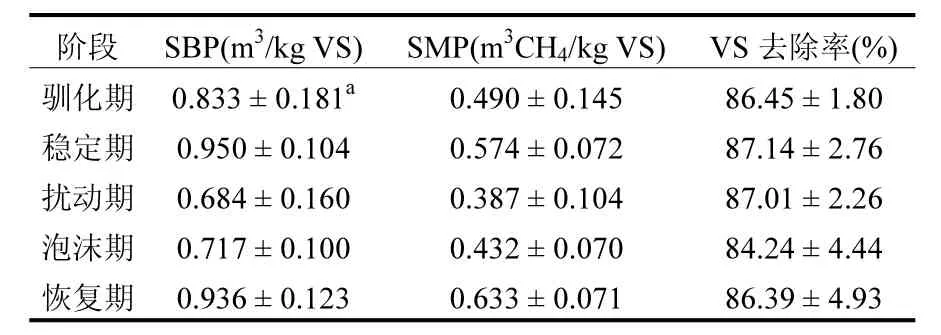
表1 各階段厭氧消化反應器效能參數Table 1 Performance parameters in different stages of the studied anaerobic digester
在經歷擾動前期的溫度波動和攪拌中斷過程中(71~75d),系統SBP和SMP迅速降低,分別從70d的0.923m3/kg VS和0.544m3CH4/kg VS降至0.444m3/kg VS和0.247m3CH4/kg VS(75d),降幅分別達到51.9%和54.6%.而VS去除率仍然沒有明顯變化.在第76d,SBP和SMP出現了較大反彈,分別增加到了1.122m3/kg VS和0.661m3CH4/kg VS,增幅高達152.7%和167.6%;但在此之后再次下降.分析可能是由于停電期間溫度降低短暫影響了微生物酶活性,使得系統進料中的有機物降解不完全,部分殘留有機物在溫度和攪拌恢復后的系統中被降解,從而使SBP和SMP在短時間內增大;而此后的再次下降,則可能是系統內有機酸積累、pH值降低(圖3(a)和(c)),微生物活性受到抑制,系統效能受影響.在第83d將OLR提升為4.0kg VS/(m3·d)后,SBP、SMP和VS去除率持續降低,至第86d,降幅分別為33.1%、42.4%和5.3%.
運行第 87d反應器內出現了大量密集而穩定的泡沫,并持續了 43d (泡沫期,87~129d).泡沫期間,反應器內物質明顯分層,上層為棕色泡沫層,下層為黑色污泥層.反應器側面中上部出料口出料,對上層泡沫進行取樣,可觀察到上層泡沫實際由大量棕色細小氣泡構成,在空氣中較穩定、不易破裂;反應器底部出料時可觀察到下層污泥中也有大量細小氣泡不斷向上涌出.記錄反應器內泡沫含量(FC)變化,繪制曲線如圖 3(d).根據 FC的大小,將泡沫期分為泡沫前期(87~103d,FC>30%)、泡沫中期(104~114d,13%<FC<30%)和泡沫后期(115~129d,10%<FC<13%).泡沫期的SBP、SMP和 VS去除率與穩定期相比,均顯著降低(t檢驗,95%置信區間) (表1).而泡沫后期進料負荷降低,系統效能開始有所恢復,FC也逐漸減小,最后系統進入恢復期(130~138d).與泡沫期相比較,恢復期的 SBP和 SMP均有顯著提高(t檢驗,95%置信區間)(表 1).而恢復期的效能參數與穩定期相比較,沒有顯著性的差異,證明系統效能恢復.
從圖2中可看出,穩定期的累積SBP曲線前段斜率較大,說明進料后微生物能夠迅速有效地降解有機物進行產氣活動.約 9h后,由于可用的底物開始受限,產氣速率逐漸減緩.馴化期的產氣曲線與穩定期類似,但前段斜率更小,說明馴化期的微生物產氣活性不如穩定期高.擾動期內,停電擾動后產氣曲線在進料后出現了約3h的停滯期,可能由于微生物受停電擾動帶來的溫度波動影響從而活性降低,電力恢復后微生物活性需要一定時間進行修復.負荷提升后,產氣曲線斜率較負荷提升前有所降低,可能由于負荷提升導致系統抑制性物質積累,一定程度上抑制了產甲烷微生物的活性.而泡沫期的3條累積SBP曲線的最大斜率呈初期>后期>中期的趨勢,說明泡沫初期的產氣活性最大,泡沫中期產氣活性最小,而泡沫后期通過采用降低負荷等策略,系統產氣活性得到了一定程度的恢復.總體來說,產氣活性大小呈:穩定期>馴化期>泡沫初期>泡沫后期>停電擾動>泡沫中期>負荷擾動.

圖2 各階段代表性24h累積SBPFig.2 Typical cumulative specific biogas production for a 24-h period in different stages
2.2 厭氧消化反應器穩定性
從圖3(b)可看出,TAN在整個運行期間的總體趨勢是逐漸上升的,但在第 35~38d,112~117d, 125~130d出現了3個低峰,每次低峰過后TAN水平均再次升高,運行結束時,TAN達3477mg/L.從圖3(a)~(c)可看出,FAN由于受pH值的影響,其變化趨勢與pH值的類似,而pH值變化趨勢也明顯受系統內TVFA濃度的影響,且VFA/TA值的變化趨勢也與TVFA類似.
馴化期,TVFA維持在較低水平(1331±279) mg/L,此時,VFA/TA、pH值和FAN分別維持在(0.32±0.06)、(7.32±0.06)和(23±4)mg/L.穩定期,除TAN外的各個穩定性參數均維持比較穩定的狀態,TVFA和VFA/TA較馴化期明顯降低,分別為(605±392)mg/L和(0.08±0.05),而pH值和FAN均較馴化期有所上升,分別為(7.65±0.08)和(100 ±33)mg/L.擾動期,TVFA的持續上升,導致pH值持續下降,從穩定期末的7.67降到了6.98,均值為7.42,產甲烷菌活性受抑制;VFA/TA在擾動期間迅速增大,停電擾動之后馬上超過了穩定性閾值0.350[12],達到 0.434(第 75d),表明系統受抑制;之后該比值繼續增大,最高達0.803,均值0.528.泡沫初期,TVFA和VFA/TA值繼續迅速增大,即使停止進料(89~92d,圖 1(a))也未能使其降低;泡沫中期,第105~109d系統停止進料(圖1(a)),TVFA和VFA/TA值有所回落,但第 110d恢復進料 2.0kg VS/(m3·d)后,再次增大;最后將進料間隔延長為2d從而進一步降低日均負荷后(112~129d,圖1(a)),TVFA和VFA/TA才逐漸降低,而pH值也逐漸恢復.恢復期時,VFA/TA值降至0.350以下,維持在(0.244±0.054)的水平;此時 TVFA仍在繼續降低,pH值繼續上升.但pH值的升高,以及TAN的持續升高,一起引起了 FAN的升高,從泡沫期的(83±36)mg/L 上升到恢復期的(323±85)mg/L,最終運行結束時高達 415mg/L,雖然高出了文獻中的抑制閾值 200mg/L[14],但從穩定的效能等參數來看,此時的高FAN濃度并沒有對系統產生明顯抑制.
從圖 3(c)和(d)可看出,馴化期,VFAs以乙酸和丙酸為主要成分,分別占 TVFA 的(35.68± 10.21)%和(37.60±4.87)%,其次是正戊酸、異丁酸、異戊酸和正丁酸.而穩定期,乙酸所占比例上升,丙酸相對下降,分別為(54.88±10.68)%和(27.36±9.75)%;正戊酸占(15.70±4.27)%,且正丁酸、異丁酸和異戊酸維持在較低的水平,比例均值均小于 2%.擾動期內,乙酸濃度最初大幅升高,但在達到頂峰后再迅速下降,此時丙酸替代乙酸迅速上升,并使得TVFA繼續呈上升趨勢,乙酸、丙酸濃度在擾動期分別為(3257±601)和(749±14) mg/L.泡沫期,丙酸濃度迅速升高,遠遠高于乙酸,成為主導 VFAs((67.21±11.84)%),最高值為13978mg/L,均值9715mg/L.而正戊酸也迅速升高,并在第 94d開始超過乙酸,最高值為 3017mg/L,均值2054mg/L.而其他VFAs也有所升高,但濃度水平仍然不高.泡沫后期,乙酸緩慢回升,其他VFAs尤其是丙酸和正戊酸則迅速降低.直至恢復期,乙酸再次成為主導 VFAs((53.06±26.31)%),丙酸比例(35.53±22.81)%,其他VFAs比例均值均小于5%.

圖3 厭氧消化反應器穩定性參數Fig.3 Stability parameters of the studied anaerobic digester“┆”表示運行階段的劃分界線;圖3(d)中,第89~96d,實際泡沫界面高出了反應器側邊玻璃視窗頂部,無法準確測量泡沫層實際高度,統一以視窗頂部高度計算泡沫含量,計算值為49.46%,但其實際含量應>49.46%
2.3 PCR—DGGE結果分析
對系統泡沫前后的污泥樣品中的細菌進行PCR-DGGE分析,利用Quantity one軟件對細菌DGGE圖譜進行條帶識別,得到泳道/條帶識別圖,如圖4所示.從圖4可以看出,不同階段細菌群落組成基因圖譜均表現出了明顯的差別.再分別從多樣性、聚類和主成分等幾方面分析對比泡沫前后系統內細菌群落結構變化,并尋找與泡沫相關的特征細菌.
2.3.1 多樣性分析 對所識別的條帶圖譜進行數字化,計算各階段樣品細菌多樣性指數,結果見表2.從表2可以看出,穩定期的細菌Simpson指數值最高,為0.92,表示穩定期的樣品中細菌群落較均勻;隨著反應器的運行,細菌Simpson指數逐漸降低,尤其是泡沫中后期,下降至 0.82,表明細菌群落均勻度降低;而恢復期又稍微回升. Shannon-Winner指數在泡沫前期的泡沫層中值最大為2.74,但與穩定期的2.62相差不大,隨著運行的進行逐漸減小,最后在恢復期有一個回升,說明泡沫層樣品中細菌多樣性反而最高,泡沫后期最低,而恢復期有所回升.綜上,兩個指數得出的結果一致,即穩定期的細菌群落多樣性最高,系統失穩以及泡沫出現后多樣性逐漸降低,但在系統恢復后多樣性重新回升.
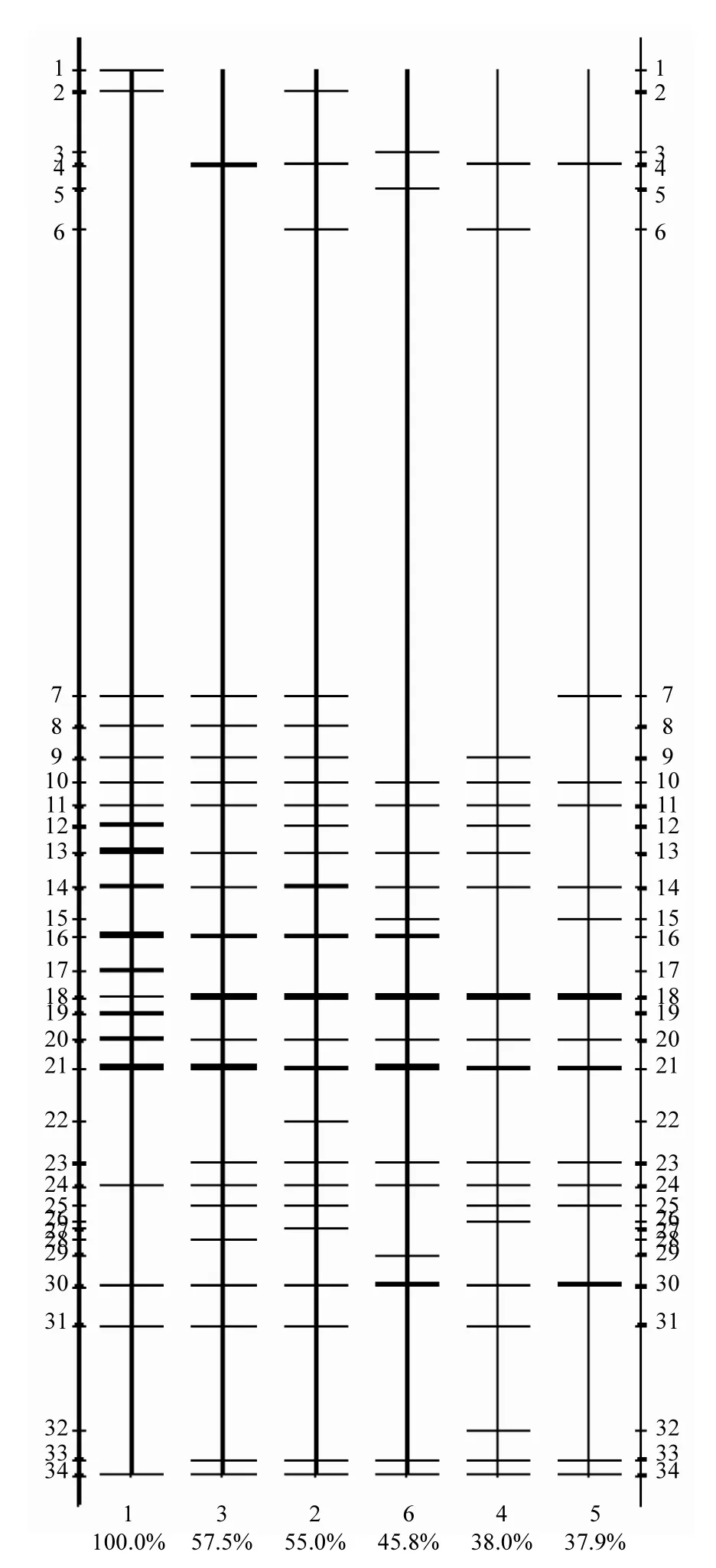
圖4 各階段樣品泳道/條帶識別Fig.4 Lane images of samples from different stages條帶識別均以1#樣品為基準,兩側數據表示泳道內條帶數,圖下方的百分數表示各個樣品與1#樣品的相似性程度
2.3.2 聚類分析和主成分分析 從圖 5(a)可以看出,泡沫初期泡沫層2#樣品和污泥層3#樣品細菌群落結構相似性最高,聚類指數為0.84,泡沫中期 4#樣品與泡沫后期 5#樣品相似度也比較高,聚類指數為0.82.來自泡沫期的2#、3#與4#、5#樣品的聚類指數也相對較高,為0.71.而恢復期6#樣品與泡沫期樣品的聚類指數為0.69,穩定期1#樣品與其他樣品的聚類指數最低,僅為0.47,說明穩定期的細菌群落結構在經歷了泡沫抑制后發生了較大的變化.從PCA分析結果圖5(b)中也可看出,除2#與3#、4#與5#,以及2#、3#與4#、5#距離較近以外,其他的點與點之間的距離都較大,驗證了上述聚類分析的結果,即細菌群落結構經歷了泡沫抑制后發生了較大變化.
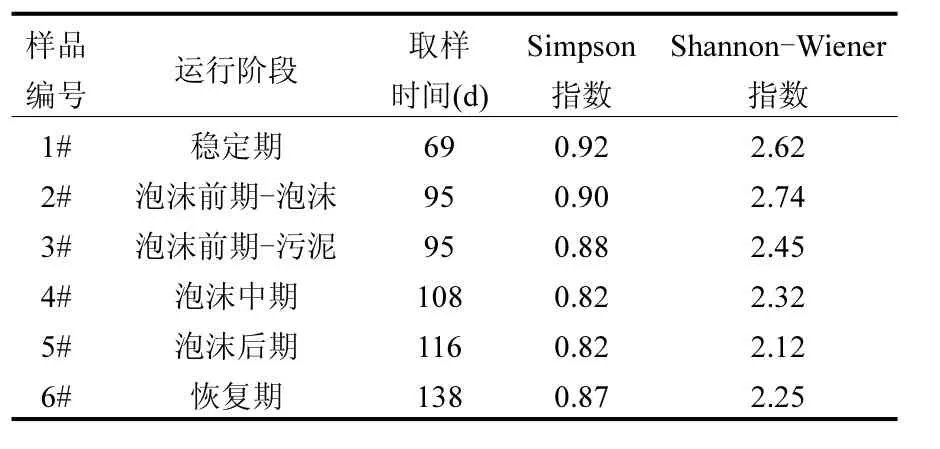
表2 各階段樣品細菌多樣性參數Table 2 Bacteria diversity in different stages
2.3.3 測序結果分析 為了尋找泡沫特征細菌,對代表性條帶和優勢條帶進行測序.然后,通過NCBI搜索測序所得16S rRNA基因序列的相似序列,結果見表3.
從表3可看出,所測條帶序列大多屬于擬桿菌門,擬桿菌門的細菌主要涉及水解和酸化過程,可生成脂肪酶、蛋白酶和纖維素酶以及其他胞外酶[15].例如,檢測到的屬于 Natronoflexus屬的條帶 9,可將多種碳水化合物發酵生成乙酸和琥珀酸
[17].條帶10和11分別屬于Alkalitalea屬和Mangroviflexus屬,其最終發酵產物主要為丙酸和乙酸[18-19].Petrimonas sulfuriphila(條帶 13)在穩定期條帶強度最高,可發酵多種單糖和多糖生成乙酸、H2和CO2的中溫厭氧發酵細菌[20].條帶20所屬的Solitalea屬是典型的酸化細菌,可發酵葡萄糖、水解明膠等[21].而 Cytophagafermentans (條帶 21)是屬于擬桿菌門的兼性厭氧黏細菌,可在發酵過程中產生大量粘液[22].另外,也檢測到一些厚壁菌門的成員,如條帶 2只存在于穩定期和泡沫前期污泥樣品中,屬于Dethiobacter屬,可利用短鏈脂肪酸和H2作電子供體[16].條帶 31的最近親緣屬于厚壁菌門Sporobacter屬,是典型的同型產乙酸菌[25].此外,條帶24的最近親緣是Longilinea arvoryzae;條帶25的最近親緣屬于Levilinea屬,均為綠彎菌門的嚴格厭氧絲狀菌,并具有長度超過 100μm的多細胞絲狀結構[23-24].
而由于L. arvoryzae和Levilinea的絲狀生長的生理特性,C. fermentans產生大量粘性代謝產物的特性,以及在泡沫期樣品尤其是泡沫層樣品中的更高條帶強度,這些微生物被認為是本試驗中的泡沫特征微生物.

圖5 細菌聚類分析和PCA圖Fig.5 Cluster analysis and PCA of bacteria
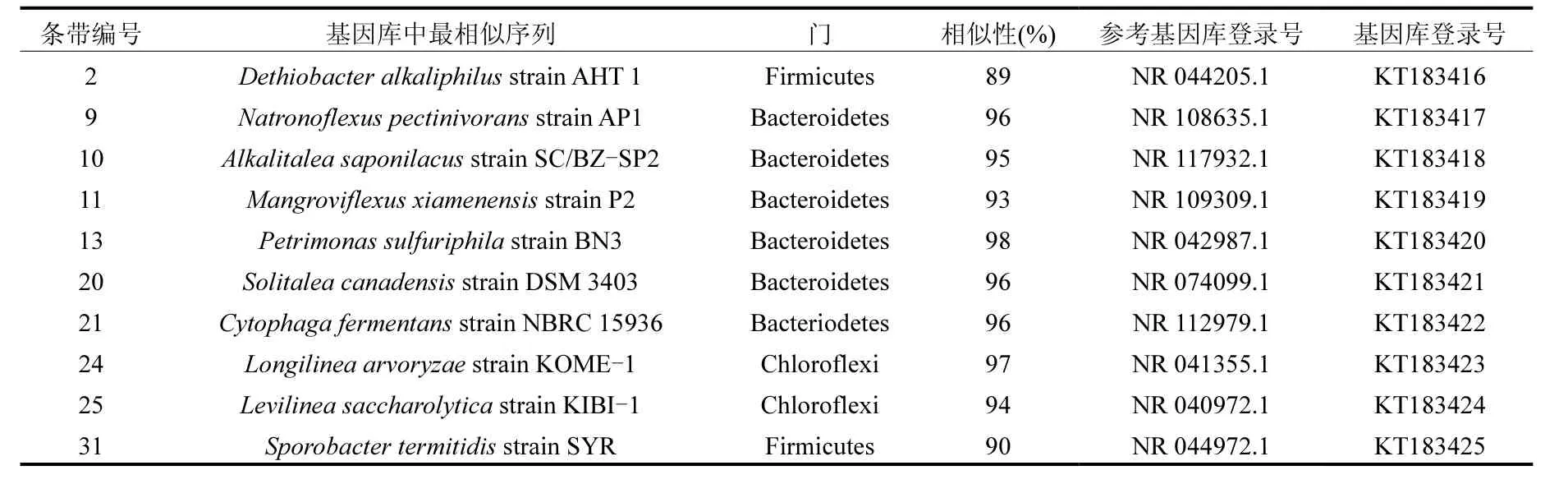
表3 細菌DGGE條帶16S rRNA基因序列的親緣關系比對結果Table 3 Phylogenetic affliation of the 16S rRNA gene sequences from DGGE bands of bacteria.
3 討論
3.1 泡沫對厭氧消化反應器效能的影響
第15~70d系統在3.0kg VS/(m3·d)負荷下穩定運行,SBP和SMP分別穩定在(0.950 ± 0.104) m3/kg VS和(0.574 ± 0.072) m3CH4/kg VS,與Li等[12]所報道的水平相近.VS去除率穩定在(87.14 ± 2.76)%.反應器分別在71、72和75d經歷了連續 3次由實驗室事故停電引起的溫度波動和攪拌停止,再將OLR從3.0提升到4.0kg VS/(m3·d)后,反應器在第87d形成了大量密集泡沫,甚至在第 89~96d,泡沫層體積超過了污泥層體積的49.46%.Kougias等[26]在對橄欖油廠廢水和豬糞聯合厭氧消化的研究過程中,在相近的負荷3.6kg VS/(m3·d)下也觀察到了泡沫現象.
泡沫期間,由于產甲烷過程的抑制作用,以及大量氣泡滯留在污泥內部尤其是上層泡沫中, SBP和 SMP波動較大,分別為(0.717 ± 0.100) m3/kg VS和(0.426 ± 0.075) m3CH4/kg VS,與穩定期相比,均顯著降低(t檢驗,95%置信區間),均值分別下降24.5%和24.8%.相比之下,VS去除率雖然只比穩定階段低3.3%,但經t檢驗,變化仍然顯著(95%置信區間).Kougias等[26]報道稱其反應器在經歷泡沫事件后VS去除率降低了11.22%,并將此歸因于固體有機顆粒在氣液界面積累,造成有機物不能得到有效降解.但本研究中的 VS去除率降低則更可能是由于微生物活性受抑制,從而系統對有機物的降解效率下降.
3.2 泡沫可能的原因簡析
3.2.1 VFAs積累 在密集泡沫出現前,反應器內觀察到了一定程度的VFAs積累現象,總VFA最高積累到 7372mg/L(86d,其中乙酸主導).隨后在泡沫期發生了嚴重的過酸化現象,總VFA最高達到 18658mg/L (121d).而且在泡沫期,泡沫層中的 VFAs濃度高于液體層(例如,第 95d,泡沫層14284mg/L,液體層12356mg/L);另外丙酸迅速替代乙酸成為VFAs的主要成分(圖3(c)).Zhang等[9]的餐廚垃圾厭氧消化反應器在經歷了泡沫后,也觀察到了同樣的 VFAs成分轉變.而這種轉變可能是由于系統氫積累后,酸化細菌利用高揮發性脂肪酸如丙酸、戊酸來積累電子[27].
猜測 VFAs積累可能對泡沫的引發有貢獻,因為VFAs(如丙酸)的羧基端,表現出表面活性劑性質,它們趨于隨微小的沼氣氣泡上升,并在氣液界面積累,然后減小消化液的表面張力,增強泡沫趨勢[3].而且,Ganidi等[5]也報道稱VFA積累是污泥消化反應器中起泡的原因之一.
3.2.2 泡沫特征微生物 對比泡沫期與穩定期的細菌DGGE圖譜,發現一些可能與泡沫相關的微生物.L. arvoryzae最初在穩定期的1#樣品中被檢測到具有較低的條帶強度,隨后在泡沫初期尤其是泡沫層樣品中條帶強度顯著增大,隨后在泡沫中期和后期隨起泡強度的減小而逐漸減小.Levilinea最初在泡沫期被檢測到,且在泡沫層中條帶強度要高于液體層,其條帶強度也隨泡沫比例的下降而減小.它們都是嚴格厭氧的絲狀菌,具有長度超過100μm的多細胞絲狀結構,猜測其絲狀結構對泡沫的產生有一定的貢獻.因絲狀菌特有的絲狀結構,使其捕捉到細小的沼氣氣泡,而其細胞表面的疏水性驅使其隨沼氣氣泡一同上升至氣液界面,從而絲狀菌在氣液界面積累,并同時產生生物表面活性物質,導致消化液表面張力減小,促進泡沫的形成.Subramanian和 Pagilla[28]的試驗結果也證明,當剩余活性污泥消化系統中缺少泡沫產生的主要因子絲狀菌時,通過提高OLR、降低混合等策略并不能成功誘導反應器產生泡沫.而且眾所周知,絲狀菌是污水廠污泥厭氧消化反應器中泡沫的主要原因之一[5].例如, Lienen等[7]發現工業規模有機廢物厭氧消化反應器中出現過量泡沫時,與對照發酵罐相比,存在高豐度的微絲菌M. parvicella. Ganidi等[6]在污水污泥批次和工業規模厭氧消化反應器中檢測到了幾株屬于Microthrix和Nostocoida屬的絲狀菌.然而,這些絲狀菌是經進料剩余活性污泥或初沉污泥引入消化反應器的,而本研究中并未使用剩余活性污泥而是使用餐廚垃圾作為消化底物,故沒有檢測到這類絲狀菌.而且這類絲狀菌雖是好養微生物,但報道稱它們也能在缺氧或厭氧條件下生存[5];并由于最佳溫度較低而常在污水廠的春季和冬季大量繁殖.故而污泥厭氧反應器因進料污泥中絲狀菌的季節性爆發隨之產生季節性的泡沫現象[7].而本實驗中發現的絲狀菌均為嚴格厭氧菌,它們的大量繁殖可能是系統不穩定導致產酸菌的代謝產物(如VFAs)積累而誘發的.
C. fermentans最早由Bachmann[22]發現,是屬于擬桿菌門的兼性厭氧黏細菌,可在發酵過程中產生大量粘液.雖然C. fermentans不具有絲狀結構,但其代謝產物——含氮粘性物質對于起泡也有一定的貢獻.因粘性物質趨于在沼氣氣泡周圍形成一層液體膜,防止氣泡破滅,從而促進泡沫的形成,提高其穩定性.Kougias等[8]在研究經受泡沫事件的糞便消化反應器時觀察到的Lactobacillus, Bacillus等,也是通過所產生的具有表面活性的代謝產物(如乳酸或環脂肽表面活性素)對泡沫的形成產生貢獻.另外,C. fermentans的條帶強度隨反應器的運行而逐漸增大,并在泡沫期和恢復期成為優勢菌.而C. fermentans產生的大量粘液類似于含氮物質,故需要大量的氮源,而其最佳氮源——銨鹽隨時間的持續積累(圖3(b)),可能是C. fermentans條帶強度隨時間增大的原因.雖然C. fermentans條帶強度逐漸增大,但泡沫比例并未因此而上升,而是隨著 VFAs的迅速降低以及絲狀菌豐度的減小而減小,故推測C. fermentans的大量繁殖可能對系統最初的泡沫產生有一定的貢獻,但在泡沫末期和恢復期,由于缺少了絲狀菌和 VFAs積累兩個因子,其起泡作用效果就不明顯了.另外,由于C. fermentans大量的繁殖,并可發酵葡萄糖產生幾乎等摩爾量的乙酸、丙酸和丁二酸,所以它也對失穩階段的VFAs積累有一定程度貢獻.
3.2.3 厭氧消化泡沫 停電擾動所造成的溫度降低使得微生物尤其是產甲烷菌活性降低,反應器內進料底物和有機酸積累.恢復中溫后,微生物恢復部分活性并高負荷降解系統中積累的有機物.7d后提升的進料負荷再次增大了微生物代謝負荷,由于增殖速率更大,產酸細菌為適應高底物環境而快速繁殖,其產酸量逐漸超過增殖速率較小的產甲烷菌所能消耗的量,故而系統內 VFAs開始積累[29-30].而由于酸積累導致的 pH值下降進一步抑制產甲烷菌的活性,加劇了 VFAs的積累,系統失穩.隨后絲狀菌 L. arvoryzae和Levilinea大量繁殖.而底物中的含氮物質轉化為氨氮也在系統中持續積累,為粘細菌 C. fermentans的大量繁殖提供了充足的氮源.而泡沫的產生則是 VFAs積累和泡沫特征微生物的大量繁殖的結果.絲狀菌利用其特有的絲狀結構捕捉沼氣氣泡,而 VFAs和粘細菌產生的粘性物質則附著在氣泡周圍的液膜中,減小表面張力,增強氣泡穩定性.最后氣泡上升并在液面積累形成泡沫層.泡沫后期由于采取降低負荷等措施,隨著系統中抑制物 VFAs逐漸被消耗,產甲烷菌活性緩慢恢復.而 VFAs濃度的降低以及絲狀菌的減少導致沼氣氣泡不能得到足夠的表面活性物質和絲狀結構以形成泡沫,雖然粘細菌在充足的氮源下仍繼續增長繁殖,但其產生粘性物質的量不足以形成泡沫,故系統中的泡沫量逐漸減少.而隨著抑制物被逐漸消耗系統最終恢復穩定.
4 結論
4.1 經歷泡沫事件后系統SBP、SMP和VS去除率顯著降低,降幅分別為24.5%、24.8%和3.3%.
4.2 泡沫事件發生前,出現了VFAs的快速積累,且對泡沫趨勢具有增強作用的丙酸比例上升;泡沫期,VFAs繼續大量積累((13449 ± 4079) mg/L),且丙酸((67.21 ± 11.84)%)完全取代乙酸成為VFAs主要成分.
4.3 細菌群落結構經歷泡沫后發生了變化,且多樣性有所下降;發現泡沫特征微生物絲狀菌 L. arvoryzae和Levilinea,黏細菌C. fermentans在泡沫期樣品中條帶強度明顯增大.
4.4 引起泡沫出現的原因是復雜的,本研究中的泡沫可能是由大量 VFAs積累以及泡沫特征微生物大量繁殖的聯合作用引起的.
[1] Tanimu M I, Ghazi T I M, Harun M R, et al. Effects of feedstock carbon to nitrogen ratio and organic loading on foaming potential in mesophilic food waste anaerobic digestion [J]. Applied Microbiology and Biotechnology, 2015,99(10):4509-4520.
[2] Kougias P G, Boe K, O-Thong S, et al. Anaerobic digestion foaming in full-scale biogas plants: a survey on causes and solutions [J]. Water Science and Technology, 2014,69:889-895.
[3] Moeller L, G?rsch K, Müller R A, et al. Formation and suppression of foam in biogas plants-practical experiences [J]. Agricultural Engineering (Landtechnik), 2012,67(2):110-113.
[4] Boe K, Kougias P G, Pacheco F, et al. Effect of substrates and intermediate compounds on foaming in manure digestion systems [J]. Water Science and Technology, 2012,66(10):2146-2154.
[5] Ganidi N, Tyrrel S, Cartmel E. Anaerobic digestion foaming causes — A review [J]. Bioresource Technology, 2009,100:5546—5554.
[6] Ganidi N, Tyrrel S, Cartmell E. The effect of organic loading rate on foam initiation during mesophilic anaerobic digestion of municipal wastewater sludge [J]. Bioresource Technology, 2011,102(12):6637-6643.
[7] Lienen T, Kleyb?cker A, Verstraete W, et al. Foam formation in a downstream digester of a cascade running full-scale biogas plant: Influence of fat, oil and grease addition and abundance of thefilamentous bacterium Microthrix parvicella [J]. Bioresource Technology, 2014,153:1-7.
[8] Kougias P G, Francisci D, Treu L, et al. Microbial analysis in biogas reactors suffering by foaming incidents [J]. Bioresource Technology, 2014,167:24—32.
[9] Zhang Y, Banks C J, Heaven S. Anaerobic digestion of two biodegradable municipal waste streams [J]. Journal of Environmental Management, 2012,104:166-174.
[10] APHA. Standard methods for the examination of water and wastewater [M]. Washington, DC: American Public Health Association, America Water Works Association, Water Environment Federation, 1999.
[11] Casamayor E O, Sch?fer H, Ba?eras L, et al. Identification of and spatio-temporal differences between microbial assemblages from two neighboring sulfurous lakes: comparison by microscopy and denaturing gradient gel electrophoresis [J]. Applied and Environmental Microbiology, 2000,66(2):499-508.
[12] Li L, He Q, Wei Y, et al. Early warning indicators for monitoring the process failure of anaerobic digestion system of food waste [J]. Bioresource Technology, 2014,171:491-494.
[13] Gupta P, Ahammad S Z, Sreekrishnan T R. Improving the cyanide toxicity tolerance of anaerobic reactor: Microbial interactions and toxin reduction [J]. Journal of Hazardous Materials, 2016,315:52-60.
[14] 唐 波,李 蕾,何 琴,等.總氨氮在餐廚垃圾厭氧消化系統中的積累及其抑制作用 [J]. 環境科學學報, 2016,36(1):210-216.
[15] Supaphol S, Jenkins S N, Intomo P, et al. Microbial community dynamics in mesophilic anaerobic co-digestion of mixed waste [J]. Bioresource Technology, 2011,102(5):4021—4027.
[16] Sorokin Y, Tourova T P, Mu?mann M, et al. Dethiobacter alkaliphilus gen. nov. sp. nov., and Desulfurivibrio alkaliphilus gen. nov. sp. nov.: two novel representatives of reductive sulfur cycle from soda lakes [J]. Extremophiles, 2008,12(3):431-439.
[17] Sorokin Y, Panteleeva A N, Tourova T P, et al. Natronoflexus pectinivorans gen. nov. sp. nov., an obligately anaerobic and alkaliphilic fermentative member of Bacteroidetes from soda lakes [J]. Extremophiles, 2011,15(6):691-696.
[18] Zhao C, Gao Z, Qin Q, et al. Mangroviflexus xiamenensis gen. nov., sp. nov., a member of the family Marinilabiliaceae isolated from mangrove sediment [J]. International Journal of Systematic and Evolutionary Microbiology, 2012,62(8):1819-1824.
[19] Zhao B, Chen S. Alkalitalea saponilacus gen. nov., sp. nov., an obligately anaerobic, alkaliphilic, xylanolytic bacterium from a meromictic soda lake [J]. International Journal of Systematic and Evolutionary Microbiology, 2012,62(11):2618-2623.
[20] Grabowski A, Tindall B J, Bardin V, et al. Petrimonas sulfuriphila gen. nov., sp. nov., a mesophilic fermentative bacterium isolated from a biodegraded oil reservoir [J]. International Journal of Systematic and Evolutionary Microbiology, 2005,55(3):1113-1121.
[21] Weon H Y, Kim B Y, Lee C M, et al. Solitalea koreensis gen. nov., sp. nov. and the reclassification of [Flexibacter] canadensis as Solitalea canadensis comb. nov [J]. International Journal of Systematic and Evolutionary Microbiology, 2009,59(8):1969-1975.
[22] Bachmann B J. Studies on Cytophaga fermentans, n. sp., a facultatively anaerobic lower myxobacterium [J]. Microbiology, 1955,13(3):541-551.
[23] Yamada T. Anaerolinea thermolimosa sp. nov., Levilinea saccharolytica gen. nov., sp. nov., and Leptolinea tardivitalis gen. nov., sp. nov., novel filamentous anaerobes, and description of the new classes Anaerolineae classis nov., and Caldilineae classis nov. in the bacterial phylum Chloroflexi [J]. International Journal of Systematic and Evolutionary Microbiology, 2006,56(Part 6):1331-1340.
[24] Yamada T, Imachi H, Ohashi A, et al. Bellilinea caldifistulae gen. nov., sp. nov. and Longilinea arvoryzae gen. nov., sp. nov., strictly anaerobic, filamentous bacteria of the phylum Chloroflexi isolated from methanogenic propionate-degrading consortia [J]. International Journal of Systematic and Evolutionary Microbiology, 2007,57(6):2299-2306.
[25] Liu F H, Wang S B, Zhang J S, et al. The structure of the bacterial and archaeal community in a biogas digester as revealed by denaturing gradient gel electrophoresis and 16S rDNA sequencing analysis [J]. Journal of Applied Microbiology, 2009,106(3): 952-966.
[26] Kougias P G, Kotsopoulos T A, Martzopoulos G G. Effect of feedstock composition and organic loading rate during the mesophilic co-digestion of olive mill wastewater and swine manure [J]. Renewable Energy, 2014,69:202-207.
[27] Ali Shah F, Mahmood Q, Maroof Shah M, et al. Microbial ecology of anaerobic digesters: the key players of anaerobiosis [J]. The Scientific World Journal, 2014.
[28] Subramanian B, Pagilla K R. Anaerobic digester foaming in full-scale cylindrical digesters—Effects of organic loading rate, feed characteristics, and mixing [J]. Bioresource Technology, 2014,159:182-192.
[29] 李 蕾,何 琴,馬 垚,等.厭氧消化過程穩定性與微生物群落的相關性 [J]. 中國環境科學, 2016,36(11):3397-3404.
[30] 王祥錕,閔祥發,李建政,等.產氫產乙酸和產甲烷反應對厭氧消化的限速作用 [J]. 中國環境科學, 2016,36(10):2997-3002.
Foaming phenomenon in anaerobic digestion system treating food waste.
HE Qin, LI Lei, PENG Shuang, ZHAO Xiao-fei, QU Li, WANG Xiao-ming, PENG Xu-ya*(Key Laboratory of Three Gorges Reservoir Region’s Eco-Environment, Ministry of Education, Chongqing University, Chongqing 400045, China). China Environmental Science, 2017,37(3):1040~1050
A serious foaming incident occurred in a mesophilic food waste digester. The effects of foaming on reactor efficiency parameters were investigated, including specific biogas production (SBP), specific methane production (SMP) and volatile solids (VS) removal rate. The possible causes of foaming were evaluated according to a series of stability parameters including volatile fatty acids (VFAs), the ratio of VFA to total alkalinity (VFA/TA) combined with the ammonia nitrogen concentration (TAN), as well as the bacterial community structure in pre- and post-foaming system. The SBP, SMP and VS removal rate during the stable stage were (0.950 ± 0.104) m3/kg VS, (0.574 ± 0.072) m3CH4/kg VS and (87.14 ± 2.76)%, respectively. However, those parameters decreased to (0.717 ± 0.100) m3/kg VS, (0.432 ± 0.070) m3CH4/kg VS and (84.24 ± 4.44)% with the appearance of the foaming incident, which indicated that the efficiency of the digester had been significantly influenced by the foaming incident. Prior to the foaming, there appeared to be a rapid accumulation of VFAs along with a reduction in the proportion of acetic acid in VFAs. The propionic acid, which is believed to play a major role in enhancing the foaming tendency, increased in its proportion in VFAs as well. The filamentous bacteria Longilinea arvoryzae, Levilinea and the myxobacterium Cytophaga fermentans had stronger band intensities after foaming. Their filamentous structure or mucilage can be a significant contributor to the initiation of foaming to some extent. In conclusion, foaming may be caused by the combination of VFAs accumulation and the proliferation of specific bacteria.
food waste;anaerobic digestion;foaming phenomenon;microorganism
X705
A
1000-6923(2017)03-1040-11
何 琴(1988-),女,四川遂寧人,重慶大學環境科學與工程專業博士研究生,研究方向為固體廢物污染控制與資源化.
2016-08-02
國家“十一五”科技支撐計劃資助項目(2010BAC67B01)
* 責任作者, 教授, xypeng33@126.com

