鐵粉礦在HIsarna工藝中預還原行為的研究
曲迎霞,邢力勇,張 立,鄒宗樹(東北大學冶金學院, 沈陽110819)
鐵粉礦在HIsarna工藝中預還原行為的研究
曲迎霞,邢力勇,張 立,鄒宗樹
(東北大學冶金學院, 沈陽110819)
通過高溫實驗與理論分析研究了鐵粉礦顆粒在高溫下的熱分解和熔化行為,以及熔化后氣體與熔融粉礦液滴之間的還原動力學.當溫度高于FeO熔點且產物層中有FeO生成時,鐵粉礦顆粒會出現熔化現象.還原反應前210 ms伴隨著劇烈的熱分解反應,主要是Fe2O3分解成Fe3O4.熔化后的鐵粉礦顆粒產物層是液態的FeO,顆粒中心是未反應的固態Fe3O4,還原反應發生在顆粒表面.Fe3+在產物層中的擴散是還原反應的限制性環節,通過計算得到氣體與熔融鐵粉礦顆粒還原反應的表觀活化能約為141 kJ/mol.
HIsarna工藝;旋風熔化爐;熱分解;熔化;還原動力學
HIsarna[1-2]是一種煤基鐵浴法熔融還原煉鐵工藝,是歐洲超低二氧化碳煉鋼項目(ULCOS)的一部分.該突破性熔融還原煉鐵技術可以直接利用粉煤和粉礦作為原燃料,省去了造球、燒結及煉焦這三個輔助環節.不僅縮小了煉鐵廠的占地面積,而且減少了對環境的污染.與高爐煉鐵技術相比,HIsarna工藝能使噸鐵CO2排放量降低約20%,如果結合CO2捕集技術(Carbon Capture and Storage),可減少CO2排放量約80%.HIsarna工藝主體部分主要由兩個反應器組成:旋風熔化爐和熔融還原爐.旋風熔化爐位于熔融還原爐的上部,形成一個貫通的高溫反應器.旋風熔化爐內的平均溫度可達 1 400 ~ 1 500 ℃ 左右.粉礦、熔劑以及氧氣通過旋風熔化爐底部的水冷噴槍一同切向噴吹到爐內,形成一個漩渦流.氧氣在旋風熔化爐內與從熔融還原爐進入的煤氣發生燃燒反應釋放出大量的熱,粉礦則在高溫下飛行過程中發生熱分解及還原反應,同時被熔化,得到預還原度約為20%的熔融產物.熔化后的粉礦液滴飛行一段時間后會黏結到旋風熔化爐的水冷爐壁上,并順著爐壁流淌、滴落到熔融還原爐內.熔融還原爐的熔池上方噴吹氧氣和粉煤,預還原粉礦在熔池內與碳發生直接還原反應,產生熱態金屬鐵,并且進行渣鐵分離.本文針對鐵粉礦在旋風熔化爐內飛行過程中的熱分解和熔化行為,以及熔化后氣體與熔融粉礦液滴的還原動力學進行了實驗研究與理論分析,并建立了動力學模型.
1 實 驗
1.1 實驗原料及分析
實驗原料選用的是赤鐵粉礦,實驗前先將鐵粉礦放入150 ℃的烘干箱內保溫3 h,除去水分;然后采用振動篩對干燥的鐵粉礦進行篩分,獲得實驗所需的粉礦粒度;采用激光粒度分析儀對篩分后的粉礦進行粒度分析.本文所選用的粒度是45~53 μm,測得其平均粒度為50 μm.鐵粉礦的化學分析如表1所示,主要成分為Fe2O3,其質量分數為93.1%,還含有少量的SiO2和Al2O3等成分.

表1 鐵粉礦的主要成分(質量分數)
1.2 實驗裝置及方法
實驗設備采用的是高溫管式滴落爐(HDTF),其主體是一個高溫管式豎爐,爐體采用6根SiC加熱棒進行加熱,最高工作溫度為 1 873 K.爐頂安裝了一個水冷加料管,爐子底部安裝了一個水冷接料管,接料管底端連接一個接料器用于收集反應后的鐵粉礦.高溫反應區為水冷加料管底端到水冷接料管頂端之間的區域,長度為41 cm.為了防止高溫下鐵粉礦顆粒之間發生黏結現象,加料速度控制在1 g/h.
升溫過程中爐內采用流量為1 L/min的N2作為保護氣體,當高溫豎爐溫度升至實驗預定溫度時,將N2切換成還原氣體并啟動加料器.鐵粉礦隨載氣從水冷加料管進入爐內,余下還原氣體從爐頂氣體入口通入,鐵粉礦顆粒與高溫還原氣體在加料管出口相遇,并在向下運動的過程中發生還原反應,反應后的粉礦顆粒與氣體一同進入水冷接料管,進而鐵粉礦收集在接料器內,氣體排出.
1.3 實驗方案
本研究考察鐵粉礦顆粒在1 650、1 700和1 750 K 三個溫度下的熱分解與還原行為,還原實驗所采用的氣體組成(體積分數)為42.2%CO+57.8%CO2,熱分解實驗所采用的氣體為100%CO2.通過牛頓第二定律和斯托克斯定律計算得到鐵粉礦顆粒在高溫反應區內的停留時間.實驗條件如表2所示.

表2 實驗條件
2 結果與討論
鐵粉礦熱分解和還原反應都是失氧的過程,因此本文均采用失重率f來表征其還原度或分解度,表達式如公式(1)所示,其中,Δmoxygen為鐵粉礦在反應過程中失去的氧的質量,mtot-oxygen為反應前鐵粉礦中與鐵元素結合的總氧量.實驗采用化學分析法測得反應后鐵粉礦中的全鐵含量w(TFe)、二價鐵含量w(Fe2+)和三價鐵含量w(Fe3+),進一步根據公式(1),還原度或分解度可由樣品中各價態鐵元素的含量計算得到,如公式(2)所示.
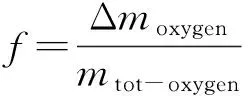
(1)
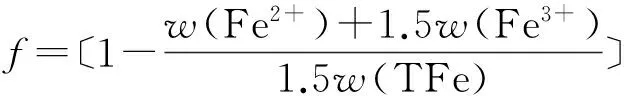
(2)
2.1 鐵粉礦的還原與熱分解結果
對于高溫還原后的鐵粉礦,取出一部分樣品采用化學分析法測得各價態鐵元素含量,從而計算得到在每個反應條件下鐵粉礦的還原度和每個時間段的平均反應速率,如表3所示.從計算結果可以看出,還原度f隨著反應時間t和溫度T的增加而升高.在 1 750 K 的溫度下,平均還原速率r隨時間t的變化而逐漸減小,當反應時間為970 ms 時,還原反應達到了平衡狀態,還原度也達到了最大值.根據Fe-O-C系平衡圖[3]可知,當溫度高于 1 650 K、還原氣體中CO含量為42%時,鐵氧化物還原的最終產物是FeO且達到平衡時的還原度約為26.5%.本研究中實驗得到的最大還原為26.3%~26.6%,與理論分析一致.
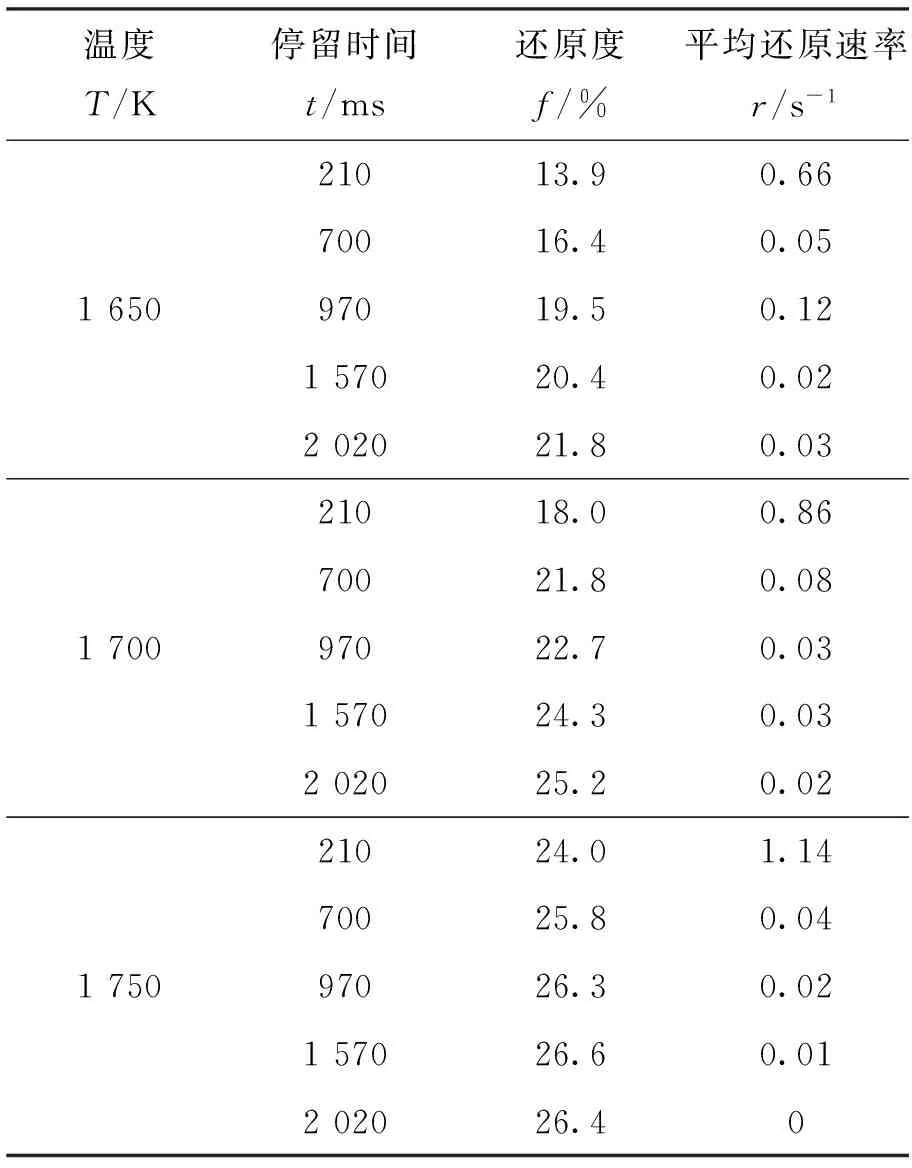
表3 1 650~1 750 K的溫度下獲得的還原度和平均還原速率
此外,由表3中計算得到的平均反應速率可知,前 210 ms 的平均反應速率明顯大于 210 ms 之后的平均反應速率.根據熱力學分析可知,這主要是因為反應前期伴隨著Fe2O3的熱分解.對于鐵粉礦在100%CO2氣氛下的熱分解行為在作者的另一篇論文中做了詳細的闡述[4],在本文中只給出主要相關結論.實驗設備和除了氣氛外的其它實驗條件與還原反應實驗相同.研究中發現,Fe2O3在高溫下會迅速地發生熱分解反應,但在本研究的溫度和反應時間范圍內,沒有檢測到Fe3O4和FeO的熱分解反應.分解度隨著溫度的升高先是增大而后保持在11%左右,但不隨反應時間的增加而發生變化.這說明Fe2O3的分解反應非常迅速,且發生在前210 ms.在反應前210 ms的分解度與還原度的對比結果如圖1所示.假設在還原性氣氛下,鐵粉礦先發生熱分解反應,然后發生還原反應,那么還原反應獲得的還原度可由總的還原度減去分解度.由圖可見,在 1 650~ 1 700 K 的溫度下,熱分解產生的還原度較大,而在 1 750 K 的溫度下,氣-固還原反應產生的還原度較大.
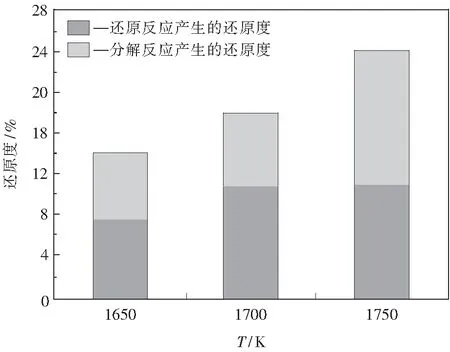
圖1 鐵礦粉在前210 ms的熱分解度與還原度Fig.1 Thermal decomposition degree and reduction degree of the iron ore powder in the first 210 ms
2.2 鐵粉礦顆粒的微觀形貌
為了進一步研究鐵粉礦顆粒在高溫下的熔化行為和反應機理,研究中采用SEM技術觀察了鐵粉礦顆粒的表面和剖面微觀形貌.未經還原的鐵粉礦顆粒具有不規則的形狀,且表面光滑、結構致密.還原后(如圖2所示),在 1 650 K 的溫度下,即使反應時間為 2 020 ms,仍有大部分鐵粉礦顆粒沒有熔化;在 1 700 K 的溫度下,當反應時間為 210 ms 時,存在少部分顆粒具有不規則的形狀,但當還原時間為 700 ms 時,鐵粉礦顆粒則全部熔化成球形,也就是說 700 ms 及以后發生的是氣體與鐵粉礦液滴(氣-熔滴)之間的還原反應;在 1 750 K 的溫度下,當反應時間為 210 ms 時,鐵粉礦顆粒則都會全部熔化成球形.根據鐵氧化物的物理性質可知,Fe2O3,Fe3O4和FeO的熔點分別約為 1 838, 1 870 和 1 644 K[5],故可推斷當溫度高于 1 644 K,且鐵粉礦顆粒中產生一定量的FeO時,鐵粉礦顆粒就會熔化成球形.
在光學顯微鏡下,對鐵粉礦顆粒的剖面進行觀察發現,顆粒邊緣存在一個環形區域,且結構相對致密,中心區域與環形區域不在同一平面上,因此得不到清晰的圖片,如圖3(a)所示.采用SEM-EDS分析技術可觀察到,中心區域的結構與環形區域不同,且鐵元素在中心區域的含量相對較低,而在環形區域的含量相對較高.結合化學分析結果可知,中心區域為固態的Fe3O4,環形區域為液態的FeO,如圖3(b)所示.

圖2 SEM(100x)還原后鐵粉礦顆粒 Fig.2 SEM photos of particles for the iron ore powder after reduction(a)―1 650 K, t=2 020 ms; (b)― 1 700 K , t=700 ms; (c)―1 750 K, t=210 ms
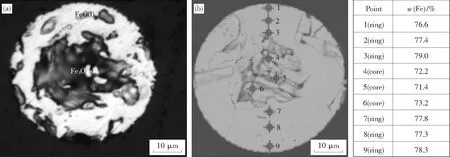
圖3 1 700 K 溫度下熔化后鐵粉礦顆粒的剖面微觀形貌Fig.3 SEM of the polished sections of molten iron ore particles (a)—光學顯微鏡觀察, t=970 ms; (b)—SEM-EDS觀察, t=2 020 ms
2.3 鐵粉礦還原的動力學分析
由對高溫還原后鐵粉礦的還原度和微觀形貌分析可知,鐵粉礦在1 650 K及以上溫度下進行還原,就會發生熔化現象,但只有當溫度為 1 700 K 、還原時間≥700 ms和1 750 K、還原時間≥210 ms時,鐵粉礦顆粒才會全部熔化,即所有顆粒發生的都是氣-熔滴之間的還原反應.這是由于不同鐵粉礦顆粒本身的物理性質存在差異,如顆粒尺寸、孔隙度和成分等.當發生氣-熔滴還原反應時,顆粒中心存在一個逐漸縮小的未反應核即固態Fe3O4,產物層是液態FeO.根據未反應核模型理論且經過分析得出[6],氣-熔滴還原反應的機理如下:
(1) 固態Fe3O4中的Fe3+和O2-溶解到固-液界面處的液態FeO中;
(2) CO氣體從氣相本體穿過氣相擴散邊界層擴散到氣-液界面;
(3) Fe3+離子從固-液界面穿過液態產物層擴散到氣-液界面;
(4) 在氣-液界面發生化學反應生成CO2氣體;
(5) CO2氣體從氣-液界面穿過氣相擴散邊界層擴散到氣相本體中.
實驗中所采用的氣體流量排除了氣體的外擴散為限制性環節,即步驟(2)和(5).此外,根據前人研究[7-10],固相在液相中的溶解一般不是反應的限制性環節.本研究采用模型函數配合法,分別假設鐵粉礦顆粒的氣-熔滴還原反應為化學反應控制(Mckwan公式)、擴散控制(Ginstling-Brounshtein公式)和混合控制.通過對實驗數據的擬合得出,Fe3+離子從固-液界面穿過液態產物層擴散到氣-液界面是氣-熔滴還原反應的限制性環節,還原度f與反應時間t的關系式如下,
(3)
將公式(3)中1-2/3f-(1-f)2/3對反應時間t作圖,如圖4所示,進一步采用最小二乘法計算得到不同溫度下的反應速率常數k(s-1).由于在 1 750 K 的反應溫度下,當反應時間大于 970 ms 時,還原反應即達到了平衡狀態,還原度幾乎不發生變化,因此不采用這部分實驗數據進行動力學分析.通過計算得到, 1 700 K 下的反應速率常數為1.57×10-3s-1, 1 750 K下的反應速率常數為2.09×10-3s-1.已知不同溫度鐵粉礦的反應速率常數,則可根據Arrhenius公式(公式(4)),將lnk對1/T作圖,通過直線斜率求出還原反應表觀活化能E,通過截距求出指前因子A.基于上述分析結果,可計算得到鐵粉礦氣-熔滴還原反應的表觀活化能為 141 kJ/mol,指前因子為34 s-1,則反應速率常數的表達式如公式(5)所示,Rg為摩爾氣體常數.
(4)
(5)

圖4 1 700~1 750 K下的反應速率常數Fig.4 Reaction rate constants at 1 700~1 750 K
3 結 論
通過對鐵粉礦在不同溫度下、運動中發生的熔化、熱分解行為,以及鐵粉礦顆粒在熔融狀態下發生還原反應的動力學研究,可得出以下結論:
(1) 鐵粉礦在高溫下發生的還原反應非常迅速,還原速度隨著溫度的升高而加快,在反應前期(前210 ms內)伴隨著劇烈的熱分解反應;
(2) 在本實驗條件下,鐵粉礦中Fe2O3會發生劇烈的熱分解反應生成Fe3O4,但Fe3O4不會進一步發生分解反應,鐵粉礦的最大還原度約為26.5%,還原的最終產物是FeO.
(3) 鐵粉礦顆粒發生熔化現象,是因為顆粒產物層生成了FeO且還原溫度高于FeO的熔點,即1644K,顆粒內部仍然是固態的Fe3O4.
(4) 鐵粉礦顆粒熔化后的還原反應發生在顆粒表面,即氣-液反應界面,Fe3+在液態產物層的擴散是還原反應的限制性環節,通過計算得到反應表觀活化能為141 kJ/mol.
[1]Link J. IRMA―Flowsheet model examples of application[J]. La Revue de Metallurgie, 2009, 106(10): 398-403.
[2]Meijer K, Guenther C, Dry R J. HIsarna pilot plant project[C]// METEC conference. Dusseldorf. Germany, July 2011.
[3]Biswas A K. Principles of blast furnace ironmaking[M]. Cootha Publishing House, Brisbane Australia, (1981): 74-75.
[4]Qu Y, Yang Y, Zou Z,etal. Thermal decomposition behaviour of fine iron ore particles [J]. ISIJ International, 2014, 54(10): 2196-2205.
[5]McKewan W M. Kinetics of iron oxide reduction[J]. Trans Met Soc AIME, 1962, 218(2): 2-6.
[6]Qu Y, Yang Y, Zou Z,etal. Kinetic study on gas molten particle reduction of iron ore fines at high temperature [J]. Ironmaking and Steelmaking, 2015, 42(10): 763-773.
[7]Takeuchi N, Nomura Y, Ohno K,etal. Kinetics analysis of spherical wusitite reduction transported with CH4gas[J]. ISIJ International, 2007, 47(3): 386-391.
[8]Han Y H, Wang J S, Lan R Z,etal. Kinetic analysis of iron oxide reduction in gas recycling oxygen blast furnace[J]. Ironmaking and Steelmaking, 2012, 39 (5): 313-317.
[9]Parkash S, Ray H S. Prediction of reduction kinetics of iron ore under fluctuating temperature conditions [J]. ISIJ International, 1990, 30 (3): 183-190.
[10]Itaya H, Sato M, Taguchi S. Circulation and reduction behaviour of iron-ore in a circulating fluidized-bed[J]. ISIJ International, 1994, 34 (5): 393-400.
Study on the pre-reduction behavior of iron ore powder in HIsarna process
Qu Yingxia, Xing Liyong, Zhang Li, Zou Zongshu
(School of Metallurgy, Northeastern University, Shenyang 110819, China)
The melting behaviour, thermal decomposition behaviour and the reduction kinetics between the gas and the molten particle were investigated with the experiments and the theoretical analysis. It was found that melting of the iron ore particles happens when the temperature is higher than that of the melting point of FeO and when FeO is formed on the product layer of the iron ore particle. The accompanied by the thermal decomposition of Fe2O3prior to 210 ms, the reduction begins. The product layer of the molten particle is liquid FeO, while the unreacted core is solid Fe3O4. The reduction takes place on the surface of the iron ore particles. The mass transfer of Fe3+in the product layer is the reaction rate controlling step. The apparent activation energy of the gas-molten particle reduction was calculated to be 141 kJ/mol.
HIsarna process; melting cyclone; thermal decomposition; melting; reduction kinetics
10.14186/j.cnki.1671-6620.2017.01.002
TF 521
A
1671-6620(2017)01-0008-05

