銅螯合親和層析分離抗氧化活性蠶豆蛋白酶解物
李雪芬 韓 濤 夏曉楠 丁 軻 卞 科
(北京農學院食品科學與工程學院1,北京 102206)
(河南工業大學2,鄭州 450052)
銅螯合親和層析分離抗氧化活性蠶豆蛋白酶解物
李雪芬1韓 濤1夏曉楠1丁 軻1卞 科2
(北京農學院食品科學與工程學院1,北京 102206)
(河南工業大學2,鄭州 450052)
采用銅離子螯合親和層析柱對不同銅螯合能力的蠶豆蛋白酶解物組分進行分離,并探討其抗氧化活性機制與銅螯合能力之間的關系。結果表明,金屬親和層析的最優條件為:平衡緩沖液為pH 5.0,濃度為0.05 mol/L的NaAc-HAc;上樣量為20 mg/mL的蠶豆蛋白酶解物1 mL;洗脫劑為0.04 mol/L咪唑。洗脫得到不能螯合銅的蠶豆蛋白酶解物組分F1及能螯合銅的組分F2,測定其總還原力、抑制羥自由基能力與銅螯合量,發現抗氧化活性的關系為F2>蠶豆蛋白酶解物>F1(P<0.05),銅螯合量的關系也為F2>蠶豆蛋白酶解物(未經分離)>F1(P<0.05),表明蠶豆蛋白酶解物的銅螯合活性越高,其抗氧化活性越高。
蠶豆蛋白 酶解物 銅螯合能力 抗氧化 銅離子螯合親和層析柱
蠶豆是一種重要的植物蛋白資源,其蛋白質質量分數約25%~35%。我國是世界上蠶豆栽培面積最大且總產量最多的國家,但主要用作蔬菜和飼料[1]。目前食品加工業主要利用蠶豆生產粉絲,而其中含量豐富的蛋白質并未得到有效利用。先前的研究表明,蠶豆肽具有抗氧化活性[2]。
體內金屬離子如銅和鐵離子均含有未配對電子,作為Fenton反應的主要催化劑,是產生自由基的重要來源,因此能夠結合銅和鐵離子的食物成分可阻斷自由基的產生,實現抗氧化[3]。近年來的研究表明,蛋白質及其體外酶解得到的肽段具有金屬離子螯合能力,如酪蛋白磷酸肽能螯合鈣離子[4]、鷹嘴豆蛋白酶解物具有螯合銅離子的能力并可抑制β-胡蘿卜素的氧化[5]。其他如大豆蛋白[6]、豬血蛋白[7]、阿拉斯加鱈魚皮[8]、芝麻蛋白[9]等水解物等都被證明具有金屬螯合能力。大量研究證明金屬螯合肽通常富含組氨酸、谷氨酸、天冬氨酸、亮氨酸。這些氨基酸能提供吲哚基、咪唑基、巰基以及羧基等功能集團與金屬離子螯合,同時能提供如N、O或S等能參與螯合的原子[10-14]。蠶豆蛋白中組氨酸質量分數為2.24%~2.71%,谷氨酸15.80%~19.41%,天門冬氨酸12.36%~14.36%[15],有螯合金屬離子的可能性。但目前有關蠶豆的研究多集中在蠶豆蛋白的提取及其酶解工藝的確定上[1,2,15-16],從蠶豆中提取分離銅螯合肽并測定其抗氧活性的研究鮮見報道。
金屬離子螯合親合層析(Immobilized Metal Affinity Chromatography,IMAC)是一種很好的蛋白質和多肽純化技術,其高選擇性可有效地將金屬離子螯合能力不同的肽段分開,已得到廣泛應用[17]。本文采用金屬離子螯合親合層析,將不同銅螯合能力的蠶豆肽進行分離,并探究其銅螯合能力與抗氧化活性之間的關系。
1 材料與方法
1.1 材料與試劑
干蠶豆:市售;堿性蛋白酶(活性≥20 000 U/g):北京奧博星生物有限責任公司;FLF01 Folin-酚蛋白定量試劑盒:北京鼎國昌盛生物技術有限責任公司;Ni-瓊脂糖凝膠6FF:柱層析用,恒輝公司;羥自由基測定試劑盒:南京建成生物工程研究所;其他試劑均為化學純。
1.2 儀器與設備
SJ-5 pH計:上海雷磁;LGJ-18型冷凍冷凍干燥機:北京四環科學儀器廠;Anke TDL-40B離心機:上海安亭科學儀器廠;T6新世紀紫外可見分光光度計:北京普析通用儀器有限責任公司;B260-恒溫水浴鍋:上海亞榮生化儀器廠;HL-2S恒流泵:上海滬西分析儀器廠。
1.3 試驗方法
1.3.1 樣品制備
稱取一定量的干蠶豆,清水浸泡12 h,去殼,用0.5%的Na2SO3和0.01%的NaOH混合溶液浸泡12~16 h,45℃干燥,粉碎,過60目篩。稱取適量蠶豆粉,按固液比(g/mL)1∶15加入蒸餾水,攪拌,用2 mol/L NaOH溶液調節至pH 8.0,50℃浸提60 min,浸提液經4 000 r/min、10 min離心,用2 mol/L HCl調至蠶豆蛋白等電點4.2,靜置0.5 h,攪拌均勻,3 000 r/min離心15 min,收集沉淀物,水洗2遍,將溶液調至中性,攪拌溶解,冷凍干燥即為蠶豆蛋白。把蠶豆蛋白按照3%(m/V)的比例溶于水中,將pH用2 mol/L NaOH(或HCl調節)調至9.0,溫度調至65℃,加入堿性蛋白酶(酶底比:16 000 U/g)在此溫度下水解4 h,待反應結束后,在100℃水浴中滅酶10 min。冷卻到室溫,離心(3 000 r/min,20 min)收集上清液即為蠶豆蛋白酶解物,真空冷凍干燥得到凍干粉備用[16]。
1.3.2 肽含量測定
采用Folin-酚蛋白定量試劑盒進行測定,肽含量以蛋白含量計,以牛血清白蛋白(BSA)作標準。
1.3.3 抗氧化活性指標的測定
1.3.3.1 總還原力測定
取樣品液2 mL,加入2 mol/L pH 6.6的磷酸鹽緩沖溶液混合,再加入2 mL 1%的鐵氰化鉀充分混合。混合物在50℃下加熱20 min。再加入2 mL 10%的TCA,混合。混合物離心(3 000 r,10 min)。取上層清液2 mL加入2 mL蒸餾水和0.4 mL 0.1%的FeCl3,三者充分混合。反應10 min后,于700 nm下測定吸光值。以蒸餾水為對照,蠶豆肽的還原能力以U(樣品的吸光值—對照的吸光值)表示[18]。
1.3.3.2 羥自由基清除活性
采用羥自由基試劑盒測定各樣品的羥自由基清除活性,其主要依據的為產生羥自由基的Fenton反應,H2O2的量和Fenton反應產生的OH·量成正比,當給予電子受體后,用griess試劑顯色,形成紅色物質,其呈色與OH·的多少量成正比關系。
1.3.4 金屬離子螯合親和層析
將IDA-Sepharose 6B(25 mL)裝入柱(2.6 cm× 10 cm)中,加入40 mL 0.2 mol/L CuSO4螯合銅離子30 min[銅螯合量為(93.5±2.2)μmol/mL濕膠,(467.6±3.6)μmol/g干膠]。柱子經8~9倍床體積的去離子水清洗,平衡緩沖液平衡。蠶豆蛋白酶解物凍干粉20 mg溶解在1 mL平衡緩沖溶液,上樣,靜止30 min。平衡緩沖液洗脫,收集洗脫液體命名為未吸附的組分F1。結合到銅柱上的蠶豆肽分別采用不同的洗脫劑洗脫,收集洗脫液命名為F2。洗脫過程流速為1 mL/min,紫外檢測儀檢測吸光值,室溫。柱子的再生:5~10倍柱床體積的0.05 mol/L的EDTA洗柱,后用純凈水流洗5~10個柱床體積,流速為1 mL/min。
1.3.4.1 不同pH平衡緩沖液對蠶豆肽吸附能力的影響
蠶豆肽吸附試驗所用的緩沖液:(A)緩沖液為0.05 mol/L的NaAc-HAc、pH 5.0;(B)緩沖液為0.05 mol/L的NaAc-HAc,pH 5.5;(C)0.05 mol/L的2-嗎啉乙磺酸[(2-(4-Morpholino)ethanesulfonic acid,MES)],用NaOH調整到pH 6.0;(D)0. 05mol/L的2-嗎啉乙磺酸[(2-(4-Morpholino)ethanesulfonic acid,MES)],用NaOH調整到pH 6. 5;(E)0.05 mol/L的Tris-HCl,pH 7.5。
1.3.4.2 不同上樣量對蠶豆肽吸附能力的影響
蠶豆蛋白酶解物吸附試驗所用的上樣量分別為:10、20、30、40 mg/mL。上樣體積為1 mL。
1.3.4.3 不同洗脫劑對吸附到親和層析柱上蠶豆蛋白酶解物洗脫效果
使用的洗脫劑為:(F)0.02 mol/L磷酸氫二鈉(Na2HPO4);(G)0.02 mol/L磷酸二氫鈉(NaH2PO4);(H)0.02 mol/L的咪唑;(I)0.02 mol/L的氯化銨(NH4Cl);(J)0.04 mol/L的咪唑。
1.3.5 銅螯合能力的測定
采用平衡透析法及原子吸收測定樣品中的銅含量。取凍干的蠶豆蛋白酶解物,用pH 7.4、0.01 mol/L的Tris-HCl緩沖液配制濃度為10 mg/mL的蠶豆蛋白酶解物溶液,取2 mL與0.5 mL 60 mmol/L的CuSO4混合震蕩,反應半小時,離心,取上清液,放入500 u透析袋中,于500 mL、pH 7.4、0.01 mol/L的Tris-HCl緩沖液中透析24 h,每4 h更換透析液。對照為不含蠶豆蛋白酶解物,僅加入等量CuSO4的Tris-HCl緩沖液。透析結束,取透析袋溶液,測定肽的量及銅含量。試驗設置3個平行。
透析袋處理方法:將透析袋置于含有2%的NaHCO3和1 mol/L EDTA的溶液中煮沸10 min,去離子水沖洗,再使用1 mol/L EDTA溶液煮沸10 min后,去離子水沖洗2遍。
1.3.6 數據處理
所有試驗均重復3遍,數據均表示為平均值±標準差(SD)。采用SPSS16.0的one-way(ANOVA)進行方差分析,Duncan多重檢驗確定數據間的顯著性差異。
2 結果與分析
2.1 不同pH的平衡緩沖液、上樣量及洗脫劑對蠶豆蛋白酶解物在銅離子親和層析柱上吸附行為的影響
為確定銅螯合柱分離蠶豆蛋白酶解物的最佳條件,研究了不同pH緩沖液、上樣量及洗脫劑對蠶豆蛋白酶解物在銅離子親和層析柱上吸附行為的影響。
當選用上樣濃度為20 mg/mL、上樣體積為1 mL的蠶豆蛋白酶解物進行上樣時,分別用不同pH的平衡緩沖液對柱子進行洗脫,洗脫60 min后,得到各平衡緩沖液對應未吸附組分的峰面積如表1所示。

表1 不同pH平衡緩沖液對應未吸附組分的峰面積
用平衡緩沖液洗脫下來的即為不能夠吸附在銅柱上的蠶豆蛋白酶解物,峰面積越大,表示不能吸附在銅柱上的蠶豆蛋白酶解物越多。表1表明,隨著pH的提高,不能吸附在銅柱上的蠶豆蛋白酶解物增加,表明相應的蠶豆蛋白酶解物與銅離子的親和力下降。有研究顯示,蛋白質與金屬間螯合配體間的作用主要包括配位作用和靜電作用,其中以靜電作用為主,而靜電作用的大小取決于金屬螯合配體和蛋白質所帶的電荷,兩者差異越大,靜電作用越強[19]。金屬螯合配體和蛋白質所帶電荷與溶液pH有關。通常弱酸和堿性介質中,金屬螯合配體帶負電荷,而蛋白質所帶電荷的正負性隨pI和溶液pH改變。無論是pH大于或小于pI,隨著pH的增加,兩者所帶電荷差異都會縮小,導致靜電作用減弱,蛋白質與金屬螯合配體間總的作用力減弱,蛋白質在金屬柱上的吸附能力降低[20]。蠶豆蛋白酶解物在銅柱上吸附的量隨pH的變化可能也是基于此原因。為讓更多的蠶豆蛋白酶解物吸附在銅柱上,選擇pH 5.0NaAc-HAc為平衡緩沖液。
確立了pH 5.0 NaAc-HAc為平衡緩沖液后,對金屬親和層析的條件進一步的優化,探索最優上樣量。選擇10、20、30、40 mg/mL 4個上樣量,上樣體積為1 mL。使用平衡緩沖液洗脫,其對應的樣品洗脫液峰面積如表2所示。

表2 不同上樣量對應未吸附組分的峰面積
一根銅柱上能夠螯合的蠶豆蛋白酶解物是有限的,當上樣量超過一定量時,不能吸附在銅柱上的蠶豆蛋白酶解物就會被平衡緩沖液洗脫下來。表2表明,當上樣量由10 mg/mL增加到20 mg/mL,其峰面積增加了約1.5倍,而當上樣量由20 mg/mL增加到30 mg/mL時,峰面積增加了約2倍,未吸附組分峰面積的增加速率開始大于上樣濃度的增加速率,說明當上樣量為20 mg時,吸附在銅柱上的蠶豆蛋白酶解物已呈飽和狀態,多余的蠶豆蛋白酶解物都被平衡緩沖液洗脫下來,導致峰面積增加速率加快。最后選定上樣量為20 mg/mL的蠶豆蛋白酶解物1 mL。
上樣量確定后,進一步對洗脫劑進行選擇。圖1為所選用的4種洗脫劑對應洗脫效果圖,濃度均為0.02 mol/L。

圖1 不同洗脫劑對應的洗脫效果
由圖1可以看出,NaH2PO4、NH4Cl洗脫效果不明顯,NaH2PO4、咪唑有一定的洗脫效果。咪唑的峰波動大于NaH2PO4,但是峰面積仍較小。選用0.04 mol/L咪唑進行洗脫,與0.02 mol/L的咪唑洗脫效果進行對比得到圖2。
圖2表明當咪唑濃度為0.04 mol/L時,出峰明顯,洗脫得到的蠶豆蛋白酶解物量較多。表3列出了不同洗脫劑洗脫液的對應峰面積。由此可看出0.04 mol/L的咪唑洗脫效果最好。
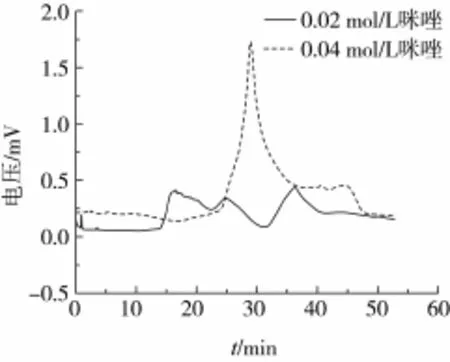
圖2 不同濃度咪唑作為洗脫劑得到的洗脫液效果

表3 不同洗脫劑對應洗脫液的峰面積
根據結果,pH 5.0 NaAc-HAc為平衡緩沖液、上樣量為20 mg/L的蠶豆蛋白酶解物1 mL、0.04 mol/L的咪唑作為洗脫劑將不同銅結合能力的蠶豆蛋白酶解物組分進行分離,得到了不能吸附在銅柱上被平衡緩沖液洗脫下來的組分,記為F1;能吸附在銅柱上被洗脫液洗脫下來的組分,記為F2。收集一次洗脫后一根銅柱上所得的F1、F2,并測定它們及上樣蠶豆蛋白酶解物肽的量得到表4。

表4 各組分中肽的量
由表4可知F1及F2的肽的質量合計為14.81 mg,占上樣蠶豆蛋白酶解物肽量的93.73%,即經過平衡緩沖液與0.04 mol/L咪唑的洗脫后,銅柱上幾乎不再殘有蠶豆蛋白酶解物。表4中F1與F2的肽的量比例與表2和表3呈現的未吸附組分與吸附組分的比例存在一定差異,主要因為使用Folin-酚蛋白定量試劑盒只能測定肽鍵的含量,而在金屬親和層析的過程中,使用紫外吸收檢測儀測定的是220 nm下肽的吸收,由于很多物質在此波長下也會有一定的吸收,其中就包括從銅柱上帶下來的部分銅離子,因此導致測定峰面積比真實的只有肽的情況下的值較大,所以導致前后比例有了些許差異。最后采用0.04 mol/L的咪唑為洗脫劑。
圖1表明NaH2PO4、NH4Cl幾乎不具有洗脫與銅結合的蠶豆蛋白酶解物的能力,咪唑、Na2HPO4具備一定的洗脫能力,這說明洗脫劑種類及溶液pH值都是影響洗脫效果的重要因素。可能因為磷酸基團并不能削弱蠶豆蛋白酶解物與銅離子的結合,導致NaH2PO4不具備洗脫能力,而能夠提供氨基的咪唑則因為能夠與蠶豆蛋白酶解物形成對銅離子螯合的競爭,從而實現對蠶豆蛋白酶解物的洗脫。報道表明含有20%~30%組氨酸的鷹嘴豆多肽具有很強的銅螯合能力[6],這更證明,蠶豆蛋白酶解物與銅離子的結合位點大部分可能為氨基。同樣含有磷酸基團的Na2HPO4卻具備一定的洗脫能力,這可能與Na2HPO4溶液呈堿性有關。有研究表明,洗脫液的pH值會影響蛋白與金屬螯合體間的作用力,隨著洗脫液pH值的升高,兩者之間的作用力減弱,蛋白更易被洗脫下來[20],因此,由于能夠提供氨基的NH4Cl溶液呈酸性,因而無法將蠶豆蛋白酶解物從銅柱上洗脫。
2.2 蠶豆蛋白酶解物及F1、F2的銅螯合能力及抗氧化能力比較
根據確定的金屬親和層析條件,收集F1、F2組分,測定上樣蠶豆蛋白酶解物及F1、F2的抗氧化活性及銅螯合量,得到結果如表5。

表5 各組分抗氧化活性
采用測定總還原力及抑制羥自由基能力2種方法評價蠶豆蛋白酶解物及F1、F2的抗氧化活性。F2的總還原力為(145.34±1.63)U/g顯著高于蠶豆蛋白酶解物(30.72±0.30)U/g及F1(14.9±0.22)U/g(P<0.05),蠶豆蛋白酶解物與F1之間也存在顯著差異。F2的抑制羥自由基能力為(445.99±3.46)U/mg,顯著高于蠶豆蛋白酶解物(234.23±1.48)U/mg及F1(131.02±1.50)U/mg(P<0.05),三者的抗氧化活性之間的關系皆為F2>蠶豆蛋白酶解物>F1。同時,在銅螯合量方面,F2為(16.42±0.10)μg/mg,顯著高于蠶豆蛋白酶解物(5.88±0.29)μg/mg及F1(2.58±0.15)μg/mg(P<0.05)。這也說明銅螯合活性越高的組分,其抗氧化活性也越高。因此,經過金屬親和層析分離的幾乎不具備銅螯合能力的組分F1的總還原力及抑制羥自由基能力都顯著低于蠶豆蛋白酶解物及F2。而經過金屬親和層析分離的具有銅螯合能力的組分F2,其每毫克肽的總還原力及抑制羥自由基能力也顯著高于未經分離純化的上樣蠶豆蛋白酶解物。
呂瑩等[21]在研究核桃肽的抗氧化機制時發現,核桃蛋白質酶解物具有與鐵螯合的能力,且鐵結合能力越強抗氧化活性越高。采用銅離子親和層析柱分離純化后的鷹嘴豆蛋白酶解物及向日葵蛋白酶解物的抗氧化活性隨著銅螯合活性的提高而得到了進一步的提高[22]。近年來的研究表明,體內游離的金屬離子如銅離子和鐵離子是機體產生自由基的重要來源,眾多抗氧化活性肽正是因為能夠結合這些金屬離子,阻斷自由基的生成,實現抗氧化的作用[23]。綜上,可以表明蠶豆蛋白酶解物的抗氧化活性與其銅結合能力有一定的關系。
3 結論
采用銅離子螯合親和層析柱對不同銅螯合能力的蠶豆蛋白酶解物進行分離,確定金屬螯合親和層析的最優條件為:平衡緩沖液為pH 5.0,濃度為0.05 mol/L的NaAc-HAc;上樣量為20 mg/mL的蠶豆肽1 mL;洗脫劑為0.04 mol/L咪唑,得到了不能螯合銅離子的蠶豆蛋白酶解物組分F1及能夠螯合銅離子的蠶豆蛋白酶解物組分F2,比較兩組分及未經分離的蠶豆蛋白酶解物的抗氧化活性,發現銅螯合活性高的組分抗氧化活性也高,因此可以推測蠶豆蛋白酶酶解物的抗氧化活性與其銅螯合能力有關。本研究為進一步從蠶豆中提取銅螯合肽并研究其抗氧化機制提供參考,下一步可考慮利用反相-高效液相色譜對具有銅螯合能力的組分F2進一步分離純化,然后利用質譜等方法對其氨基酸組成及結構進行鑒定分析。
[1]王春明,劉洋.蠶豆組成及加工利用進展[J].農業機械,2011(17):91-93 Wang C M,Liu Y.The composition and the processing progress of broad bean[J].Journal of Agricultural Machinery,2011(17):91-93
[2]劉淳,張海英,韓濤,等.Alcalase堿性蛋白酶酶解蠶豆蛋白的研究[J].中國糧油學報,2011,26(12):29-33 Liu C,Zhang H Y,Han T,et al.Study on hydrolyzing of protein from broad bean by alcalase protease[J].Joumal of the Chinese Cereals and Oils Association,2011,26(12):29-33
[3]李建喜,楊志強,王學智.活性氧自由基在動物機體內的生物學作用[J].動物醫學進展,2006,27(10):33-36 Li J X,Yang Z Q,Wang X Z.Biological function of reactive Oxygen free radicals in Animals[J].Journal of Progress in Veterinary Medicine,2006,27(10):33-36
[4]Sato R,Noguchi T,Naito H.Casein phosphopeptides(CPP)enhances calcium absorption from the ligated segment of ratsmall intestine[J].Journal of Nutritional Science and Vitaminology,1986,32(1):67-76
[5]Megías M,Pedroche J,Yust M M,et al.Affinity purification of copper chelating peptides from chickpea protein hydrolysates[J].Journal of Agricultural Food and Chemistry,2007,55:3949-3954
[6]Lü Y,Liu Q,Bao X,et al.Identification and characteristics of iron-chelating peptides from soybean protein hydrolysates using IMAC-Fe3+[J].Journal of Agricultural and Food Chemistry,2009,57(11):4593-4597
[7]Lee S H,Song K B.Article isolation of a calcium-binding peptide from enzymatic hydrolysates of porcine blood plasma protein[J].Journal of the Korean Society for Applied Biological Chemistry,2009,52(3):290-294
[8]Guo L,Hou H,Li B,et al.Preparation,isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J].Journal of Process Biochemistry,2013,48(5):988-993
[9]汪嬋,陳敏,李博.芝麻蛋白制備金屬螯合肽的酶解工藝研究[J].食品科技,2011,36(9):184-189 Wang C,Chen M,Li B.Preparation of metal(Fe2+,Zn2+)chelating peptides from sesame protein by enzymatic hydrolysis[J].Journal of Food Science and Technology,2011,36(9):184-189
[10]Glahn R P,Van Campen D R.Iron uptake is enhanced in Caco-2 cell monolayers by cysteine and reduced cysteinyl glycine[J].The Journal of Nutrition,1997,127(4):642-647
[11]Torres-Fuentes C,Alaiz M,Vioque J.Affinity purification and characterisation of chelating peptides from chickpea protein hydrolysates[J].Food Chemistry,2011,129(2):485-490
[12]Lee S H,Song K B.Purification of an iron-binding nona -peptide from hydrolysates of porcine blood plasma protein[J].Process Biochemistry,2009,44(3):378-381
[13]Storcksdieck S,Bonsmann G,Hurrell R.Iron-binding properties,amino acid composition,and structure of muscle tissue peptides from in vitro digestion of different meat sources[J].Journal of Food Science,2007,72(1):S019-S029
[14]Huang G,Ren L,Jiang J.Purification of a histidine-containing peptide with calcium binding activity from shrimp processing byproducts hydrolysate[J].European Food Research and Technology,2011,232(2):281-287
[15]宗緒曉.蠶豆蛋白的營養特點加工技術及利用途徑[J].中國糧油學報,1993(8):51-54 Zong X X.Nutritional characteristics、processing technology and the utilization way of broad bean[J].Journal of the Chinese Cereals and Oils Association,1993,8:51-54
[16]蘇海玲,張海英,李紅衛,等.蠶豆蛋白酶解工藝及響應面法的優化[J].中國食品學報,2013(5):39-46 Su H L,Zhang H Y,Li H W,et al.Study on enzymatic hydrolysis of broad bean with papain and alkaline proteinase[J]Journal of Chinese Institute of Food Science and Technology,2013(5):39-46
[17]孫旭東,李紅旗,隋洪艷,等.金屬螯合親和層析分離蛋白質的研究[J].生物工程學報,2000,16(4):495-499 Sung X D,Li H Q,Sui H Y,et al.Study on protein separat ion using immobilized metal ion affinity chromatography[J].Chinese Journal of Biotechnology,2000,16(4):495-499
[18]Hwang J Y,Shyu Y S,Wang Y T,et al.Antioxidative properties of protein hydrolysate from defatted peanut kernelstreated with esperase[J].LWT-Food Science and Technology,2010,43(2):285-290
[19]李蓉,邸澤梅,陳國亮.金屬螯合親和色譜中固定金屬與蛋白質的作用[J].分析化學,2002,30(5):552-555 Li R,Di Z M,Chen G L.Interaction between immobilized metal and protein in metal chelate affinity chromatography[J].Chinese Journal of Analytical Chemistry,2002,30(5):552-555
[20]蔣加慶,蔡海波,胡爽,等.pH值和鹽濃度對金屬螯合親和層析分離人胰高血糖素樣肽-1融合蛋白的影響[J].中國生物制品學雜志,2010,23(9):999-1004 Jiang J Q,Cai H B,Hu S,et al.Effects of pH value and salt concentration on purification of human glucagonlike peptide-1 fusion protein by immobilized metal ion affinity chromatography[J].Chinese Journal of Biologicals,2010,23(9):999-1004
[21]呂瑩,劉靜,陳湘寧.鐵離子螯合親和層析分離抗氧化活性核桃肽[J].中國糧油學報,2013,28(1):65-69 Lü Y,Liu J,Chen X N.Separation of antioxidant walnut peptides with immobilized metal affinity chromatography[J].Joumal of the Chinese Cereals and Oils Association,2013,28(1):65-69
[22]Megías M,Pedroche J,Yust M M,et al.Production of copper-chelating peptides after hydrolysis of sunflower proteins with pepsin and pancreatin[J].LWT-Food Science and Technology,2008,41(10):1973-1977
[23]張君慧,張暉,王興國,等.抗氧化活性肽的研究進展[J].中國糧油學報,2008,23(6):227-233 Zhang J H,Zhang H,Wang X G,et al.Advancement of research on antioxidant peptide[J].Journal of the Chinese Cereals and Oils Association,2008,23(6):227-233.
Separation of Antioxidant Hydrolysates from Broad Bean Protein with Immobilized Metal Affinity Chromatography(IMAC)
Li Xuefen1Han Tao1Xia Xiaonan1Ding Ke1Bian Ke2
(College of Food Science and Engineering,Beijing University of Agriculture1,Beijing 102206)
(Henan University of Technology2,Zhengzhou 450052)
Immobilized metal affinity chromatography(IMAC)was used to separate broad bean protein hydrolysates with different copper binding ability,the relationship between antioxidant activity and the copper binding ability of broad bean protein hydrolysates was discussed as well.The results showed that the optimal conditions for metal affinity chromatography were balance buffer,0.05 mol/L sodium acetate-acetic acid(NaAc-HAc)buffer at pH 5.0,loading sample:1 mL of broad bean protein hydrolysate solution(20 mg/mL),elution buffers,0.04 mol/L imidazole.After being eluted,F1(the broad bean hydrolysates component not binding to copper column)and F2(component binding to copper column)were separated.Furthermore,copper binding abilities and antioxidant activities of broad bean protein hydrolysates,F1 and F2 were investigated.The results were shown F2>the broad bean protein hydrolysates>F1(P<0.05)in both copper binding abilities and antioxidant activities.These results presented that the stronger copper binding ability of the broad bean protein hydrolysate,the higher antioxidant activities.
broad bean,protein hydrolysates,copper binding ability,antioxidant,IMAC
TS214
A
1003-0174(2017)01-0119-06
果蔬貯藏加工營養安全研究(KCT2014025),農產品加工及貯藏工程-北京市重點建設學科資助(PXM 2014-014207-000029)
2015-05-26
李雪芬,女,1990年出生,碩士,農產品加工及貯藏
韓濤,男,1963年出生,教授,功能食品

