“未知溶液的離子鑒別”教學設計
曾瑤

摘要:以“未知溶液的離子鑒別”為例,探討如何通過“從做中學”的實驗探究手段構建及鞏固《化學1》中的核心觀念“微粒觀”和“分類觀”。通過設計半開放式實驗,引導學生在自主探究中構建核心觀念,并發展自己的能力,使學生真正成為學習的主體。
關鍵詞:微粒觀;分類觀;離子鑒別;半開放式實驗
文章編號:1008-0546(2017)04-0070-04 中圖分類號:G633.8 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2017.04.024
一、指導思想與理論依據
杜威的“從做中學”的教學理論,提供了一種構建化學核心觀念的方法。“從做中學”也就是“從活動中學”“從經驗中學”,它使得知識的獲得與活動聯系了起來,學習者能從那些真正有教育意義和有興趣的活動中學習,從而有助于學習者的成長和發展。
在化學學科中,這種活動就是實驗探究,因此“從做中學”就是“從實驗中學”,以實驗探究的方式來構建和落實核心觀念。本課就是以實驗“未知溶液的離子鑒別”為載體,通過實驗探究來構建和落實“分類觀”和“微粒觀”。在本實驗探究中,首先由教師提出問題“如何鑒別未知溶液中的陰陽離子”并提供試劑,學生明確問題并設計方案,接著通過共同討論進一步改進和優化實驗方案,并通過動手實驗來驗證方案是否可行、是否能夠解決問題,最后進行歸納總結,得到“未知溶液的離子鑒別”的一般規律。這就是著名的“從做中學”的五步教學法,讓學生從半開放式實驗中建立起“分類觀”和“微粒觀”。為了進一步鞏固和落實這兩個核心觀念,本課最后設計了“未知固體的組成推斷”的練習。通過這種“從做中學”的方式,教學不再是簡單地注入知識,而是運用一種最有效的方法,引導學生在自主探究中構建核心觀念,并發展自己的能力,使學生真正成為學習的主體。
二、教學內容及學生情況分析
授課內容為人教版《化學1》復習課“未知溶液的離子鑒別”,共2課時,授課時間安排在學習完必修1所有課程之后。
離子反應是整個高中階段的一個非常重要的知識點,貫穿、延伸于中學化學元素化合物學習的始終。在人教版《化學1》中的第二章第二節引入離子反應,學生通過宏觀反應現象開始認識“微粒”及其相互作用,從而建立起“微粒觀”,有了離子的概念,并學會離子反應方程式的書寫。在第三章和第四章金屬和非金屬化合物的學習中,學生了解常見陰陽離子的鑒別方法和具備相應的實驗技能。然而由于高一學生接觸離子反應的時間較短,沒有形成系統的微粒觀,不能從微粒的角度全面理解物質性質,不能從離子的角度看待問題、分析問題和解決問題。
本課作為必修1的復習課,在學生已建立的離子反應基礎上,首先以“未知溶液的離子鑒別”為載體,以學生自主探究為手段,以任務為驅動,應用“分類觀”和“微粒觀”,解決未知溶液的離子鑒別的現實問題,幫助學生建立未知溶液的離子鑒別的一般程序和思路。第二部分則加大難度到“未知固體的組成推斷”,進一步鞏固并加深對“微粒觀”和“分類觀”的認識,從而在理解的基礎上深化對離子的認識,提高學生解決問題的綜合能力,引導學生有效進行整個高中階段的化學學習,具有承前啟后的作用。
三、教學目標
(1)知識與技能:了解溶液中常見陰陽離子的種類及鑒別方法;學會常見離子檢驗的實驗技能。
(2)過程與方法:通過方案設計、實驗驗證和歸納總結的過程學習離子鑒別的基本思路;培養學生通過觀察實驗現象,判斷溶液中離子是否存在的能力。
(3)情感態度與價值觀:體會分類觀在離子鑒別中的應用;體會實驗是研究物質的重要方法;體會小組合作的學習方式在化學課程的重要意義,培養團隊合作意識。
四、教學重難點
(1)教學重點:溶液中常見陰陽離子的鑒別方法,未知溶液的離子鑒別一般思路。
(2)教學難點:分類觀在離子鑒別中的應用,未知固體分子式的推斷。
五、教學過程
1. 整體思路設計(圖1)
2. 教學活動的具體實施
(1)課前預習,布置任務
[任務1]PPT展示以下內容:
實驗名稱:未知溶液的離子鑒別
實驗提供藥品:一未知無色溶液25mL:含有兩種陽離子和兩種陰離子,溶液中離子濃度均大于0.1mol/L;(不考慮H+及OH-)。
稀溶液各25mL:HCl,H2SO4,HNO3,NaOH,Na2CO3,KSCN,AgNO3,BaCl2,pH試紙及實驗室常見儀器。
實驗設計中用流程圖表示鑒別步驟。
實驗完成目標:通過所提供試劑,將未知溶液的離子鑒別出來,并填在給定表格里。
已知:2Al3++3CO32-+3H2O[=]2Al(OH)3↓+3CO2↑
[學生]以小組為單位,自主討論、設計實驗方案,并于課前提交實驗設計報告。
[設計意圖] 學生已學習過常見金屬及非金屬的性質,可據此完成初步的實驗方案設計。
(2)提出問題,引入新課
[引入]在上幾周的課程中,我們已經學習了金屬以及非金屬的性質,而在水溶液中,這些金屬以及非金屬元素主要是以離子形式存在。為了檢驗是否掌握,現提供常見試劑和儀器,設計實驗將溶液中的兩種陰陽離子分別鑒別出來。
[設計意圖]結合學生學過的金屬與非金屬性質和離子反應,提出一個實際問題,引入新課。
[任務2]這是某一組的實驗設計方案,每組對照自己的設計,討論一下這個實驗設計的優點,并指出這個實驗設計的錯誤。
[展示設計方案]PPT展示以下內容:
[學生]觀察,思考,分組討論,在方案上標記,總結,匯報。
[設計意圖]以一個小組設計方案為例,引導學生找出方案的優點,存在的錯誤(現象結論不匹配,試劑滴加順序錯誤,重要離子的遺漏等),得到一個初步可行的方案。
[學生]思考,小組討論,回答問題。
[追問]提問取試劑時量的多少,反應容器選用試管還是燒杯。
[講解]無明顯現象也是一個重要的實驗現象,從無明顯現象雖然不能推斷出溶液中含有什么離子,但有時候可以推測出一定不含某些離子。因此實驗記錄時,不能忽視對無明顯現象的記錄和分析。
[設計意圖]強調對定性試管實驗量的概念,以及對無明顯現象的記錄及分析。
(3)學生動手實驗
[任務3]小組改進實驗設計。
[學生]思考,分組討論,完成實驗設計的修改。
[教師]巡視,適當幫助學生進行方案修改。
[設計意圖]根據討論的結果,對本組方案進行改進,保證方案的可行性。巡視時重點留意實驗設計較薄弱的小組,適當引導幫助修改方案。
[引導]實驗是檢驗設計是否可行的唯一標準,下面我們就通過實驗來驗證一下。
[任務4]學生分組實驗。
[學生]動手實驗,記錄實驗現象,上傳實驗記錄至在線文檔,鑒別結果登記在黑板。
[教師]巡視學生實驗,確保學生實驗過程規范操作,督促及時做好實驗記錄。
[設計意圖] 利用實驗檢驗方案是否可行,觀察NaOH從少量到過量的實驗現象的異同,體會實驗在化學學習中的作用。
[公布結果] 此無色溶液中存在的四種離子為Al3+、NH4+、SO42-和Cl-。
[引導]實驗結果錯誤的小組,結合在線文檔中的實驗記錄,引導學生分析錯誤原因。
[設計意圖]根據實驗結果總結小組完成情況,對鑒別結果出現錯誤的小組通過查看實驗記錄,引導學生自己分析出現錯誤的原因。
(4)總結離子鑒別思路
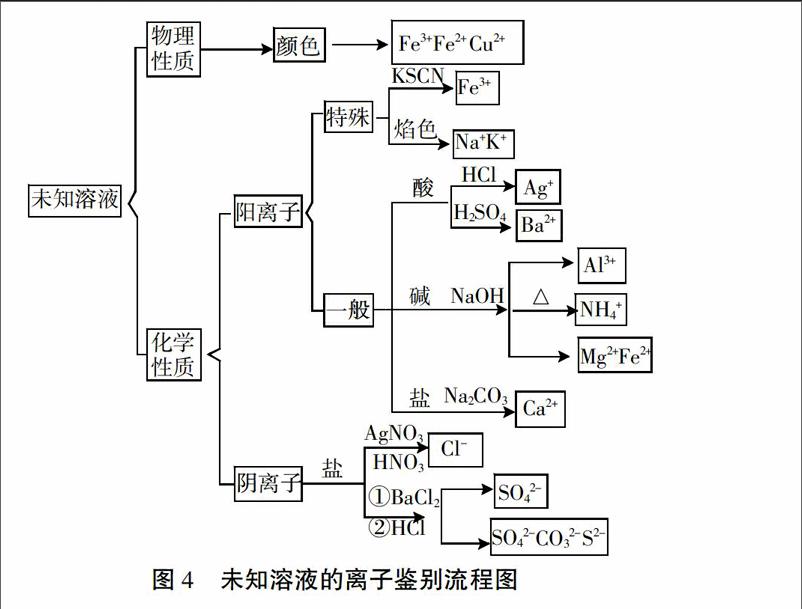
[引導] 現在我們來總結一下未知溶液的離子鑒別的思路。對未知溶液進行分析,從性質入手,可以分為哪兩類?
[學生]物理性質和化學性質。
[提問]對于物理性質,可以觀察溶液的顏色,判斷出哪些離子的存在?
[學生]Fe3+,Fe2+ 和Cu2+。
[設計意圖]引導學生對未知溶液進行分類,先從物理性質入手,通過顏色判斷Fe3+,Fe2+ 和Cu2+ 的存在。
[引導]為了便于鑒別,可以把溶液中的離子分成兩類,分別是什么?
[學生]陽離子和陰離子。
[設計意圖]通過分類觀,對溶液的離子進行陰陽離子分類后再逐一鑒別。
[引導]對于陽離子,第一步總是先把有特殊顏色反應的離子先鑒別出來。這種特殊的陽離子是什么?鑒別需要滴加的是?
[學生]Fe3+,用KSCN溶液鑒別。
[提問] 另外還有兩種陽離子無法通過滴加試劑產生沉淀,但有一種特殊的方法來鑒別,這種方法是什么?
[學生]焰色反應來鑒別Na+和K+。
[講解]對于其他陽離子,沒有特殊的顏色反應,我們只能通過出現沉淀和氣體的現象來鑒定。通常我們將滴加試劑分成酸、堿、鹽三類,依次滴加,根據現象具體判斷。
[提問]常見的酸有哪些?能鑒別出哪些離子?
[回答]可以用鹽酸來鑒別Ag+,H2SO4來鑒別Ba2+。
[提問]常見的堿呢?滴加之后有可能出現什么現象?證明有哪些離子?
[學生]NaOH溶液,先產生白色沉淀后消失的是 Al3+,白色沉淀不消失的是Mg2+,白色沉淀迅速變成灰綠色,最后變成紅褐色是Fe2+,加熱后使濕潤的石蕊(pH)試紙變藍的是NH4+。
[講解]鑒別Al3+注意滴加NaOH溶液從少量到過量;鑒別NH4+離子一定要加熱,pH試紙需潤濕。
[提問]還有一種常見的鹽能很快鑒別一種常見的陽離子,這種鹽和對應的陽離子是什么?
[學生]用Na2CO3溶液鑒別Ca2+。
[設計意圖]通過分類觀,將滴加試劑分為酸、堿、鹽三類,再根據現象依次鑒別。
[提問]對于陰離子,常見的陰離子都有相應的試劑和對應的現象可以鑒別,比如Cl-,如何鑒別?
[學生]用HNO3酸化的AgNO3溶液可以鑒別Cl-。
[提問]最后,可以通過先加BaCl2溶液,再滴加稀鹽酸將其他常見的陰離子都鑒別出來,可能出現哪些現象,說明有哪些離子存在?
[學生]先滴加BaCl2溶液再滴加稀鹽酸,白色沉淀不消失的是SO42-,白色沉淀消失,產色無色氣味的是CO32-,有刺激性氣味的氣體的是SO32-,有臭雞蛋氣味的是S2-。
[設計意圖]常見陰離子種類較少,并基本可以通過對應的試劑一一鑒別,直接引導學生對常見的陰離子歸納,逐一進行鑒別。
[總結]未知溶液的離子鑒別是從溶液可能含有的離子出發,對離子進行分類,再選擇相應的試劑根據實驗現象來判斷是否存在該離子。
(5)重新設計方案,加深理解
[任務5]根據未知溶液的離子鑒別思路,重新設計本實驗的實驗方案,并寫出對應的實驗現象,判斷溶液中的陰陽離子。
[講解]重新設計的實驗方案只需要四步實驗,依次滴加KSCN、NaOH溶液并加熱、AgNO3溶液和稀硝酸、BaCl2溶液和稀鹽酸,就可以將溶液中的四種離子鑒別出來,相比于學生最初的實驗設計,思路清晰,方法簡單。
[設計意圖]讓學生重新設計實驗方案,對比最初的方案,體會剛總結的離子鑒別思路的簡明高效。
[總結]未知溶液的離子鑒別,不是根據提供的試劑進行隨機滴加,根據現象來判斷離子種類;而是需要根據溶液中可能存在的離子先進行分類,并選擇對應的試劑,根據現象來進行判斷。
[設計意圖]再次總結升華離子鑒別的思路,強調分類觀的思想。
(6)鞏固練習,提高拓展對未知固體的鑒別
[任務6]現有一淺綠色固體,為無機復鹽。已知復鹽是由兩種金屬離子(或銨根離子)和一種酸根離子構成的鹽。請利用實驗室常見試劑及儀器設計方案檢驗該無機復鹽離子的組成。
[學生]小組討論,設計方案。
[提示]對于固體,一定要先溶解成溶液再進行實驗。
[設計意圖]學生再次體會離子鑒定流程圖的思路,鞏固并提高難度。
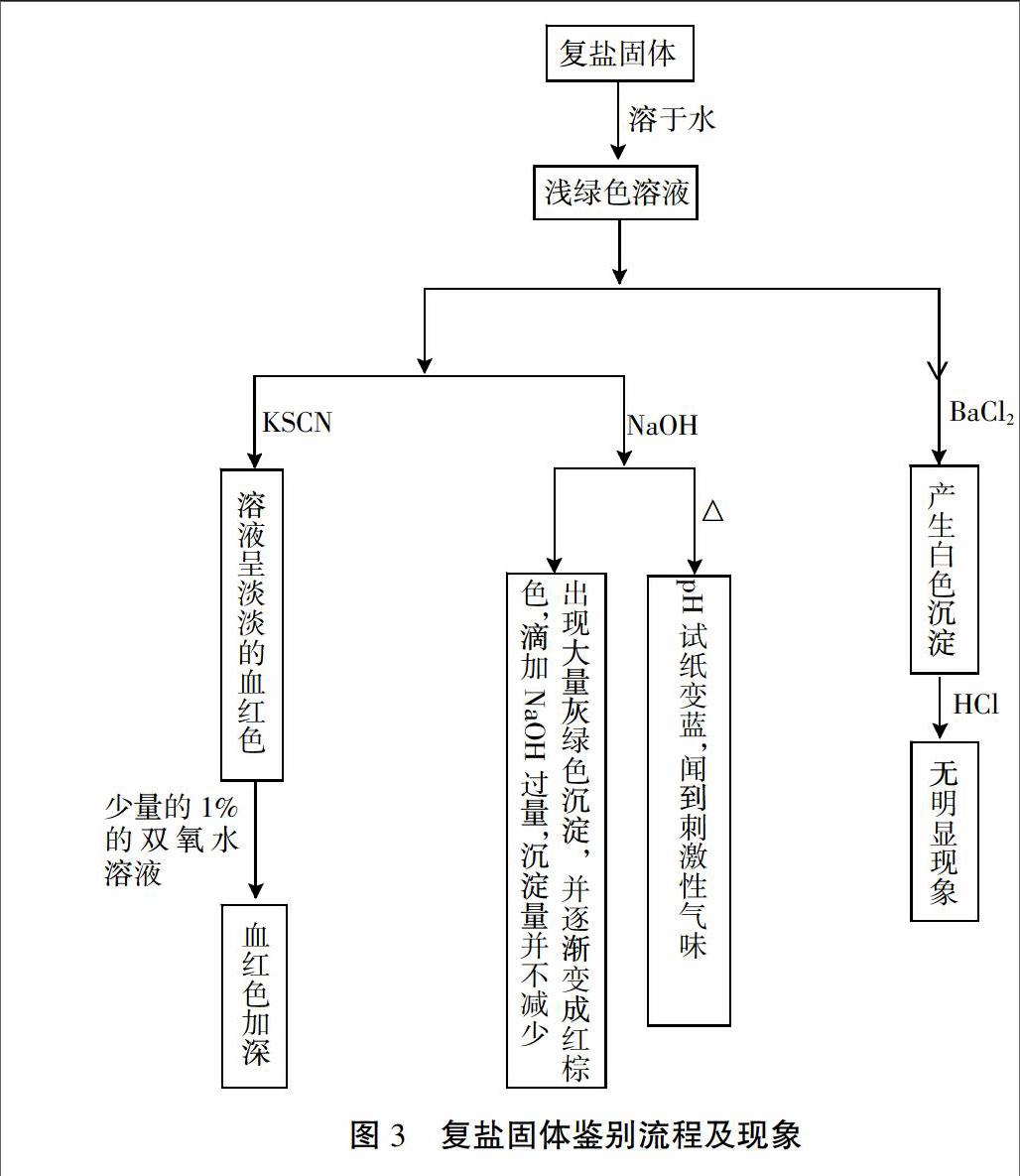
[任務7]已知該復鹽的摩爾質量為392 g/mol,含有6個結晶水,下圖是某同學對該復鹽進行檢驗的實驗步驟及現象。請推測該復鹽的化學式。
[學生]復鹽化學式是(NH4)2Fe(SO4)2·6H2O。
[設計意圖]引入具體實例,再次讓學生體會離子鑒別的流程。加大難度,將離子鑒別推廣到固體化學式的測定,小結本課內容,及時鞏固加深印象。
3. 板書設計
六、教學反思
1. “從做中學”落實核心觀念
離子反應是人教版必修1中的經典內容,教學資源較多,然而大多教學設計存在的主要問題是強調離子反應的書寫、條件等知識點,而忽略了讓學生從離子這一微觀角度來認識物質,用離子反應解決實際問題的能力的培養。在本教學設計中,以“未知溶液的離子鑒別”為載體,以半開放式實驗探究為手段,以七個任務為驅動,激發學生的好奇心,促使學生主動進入分析問題和解決問題的活動中。學生從課前主要關注單純物質的性質,到設計最初方案時開始關注離子的性質,通過實驗探究經歷離子鑒別的過程,最終鞏固總結,能夠從“分類觀”和“微粒觀”的角度理解未知溶液的離子種類并掌握離子鑒別的一般流程,從而對物質的認識從感性上升為理性。
2.“從做中學”學生收獲頗豐
課后調查問卷表明學生“從做中學”收獲很大,完成了本課的三維目標。學生寫到“通過實驗設計時鍛煉了分析問題的能力,通過實驗操作復習和掌握很多離子的性質,幫助記住很多離子反應方程式。”“分析能力變強,考慮問題更全面。”“學習了分類的方法對未知溶液進行鑒別,相比課前自己設計的方案中胡亂滴加試劑,更有邏輯更高效率。”
通過“從做中學”這種自主探究的方式,激發學生的學習興趣,讓學生真正成為學習的主體,整個教學中通過“做”的過程,促進“思”的升華,最終完成對“學”的積累,達到鞏固落實“分類觀”和“微粒觀”的目的,培養學生綜合運用知識解決實際問題的能力。
參考文獻
[1] 劉鴻雁.杜威的“從做中學”理論在高職教學中的應用研究[J].讀與寫雜志,2010,7(7):75
[2] 王磊,張毅強,喬敏.觀念建構為本的化學教學設計研究[J].化學教育,2008,29(6):7-12

