從多角度探究NH4HCO3與少量NaOH溶液反應的實質
吳家軍+朱梅麗

摘要:向NH4HCO3溶液中逐滴加入少量NaOH溶液涉及多個反應,這些反應間是存在絕對的先后順序,還是同時進行,反應程度是否不同?經過實驗探究與微觀理論辨析可以得出確定的結論:OH-與HCO3-、NH4+同時反應,但與NH4+反應程度更大一些。
關鍵詞:NH4HCO3溶液;少量NaOH溶液;反應實質;實驗探究;微觀辨析
文章編號:1008-0546(2017)04-0093-03 中圖分類號:G633.8 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2017.04.032
在近兩年的高三備考復習中,有關“向NH4HCO3中滴入少量NaOH溶液”的離子方程式書寫或正誤判斷的題目在不同的輔導書和考題中反復出現,所給出的參考答案都是:HCO3-+OH-[=]CO32-+H2O, 百度百科給出的答案也是如此。向NH4HCO3溶液中逐滴加入少量NaOH溶液主要涉及兩個反應:NH4++OH-[=]NH3·H2O、HCO3-+OH-[=]CO32-+H2O,這兩個反應間是存在絕對的先后順序,還是同時進行,反應程度是否不同?本文將從實驗探究與微觀理論探析兩個角度展開,以期得出確定的結論。
一、實驗探究的角度
1. 定性實驗探究
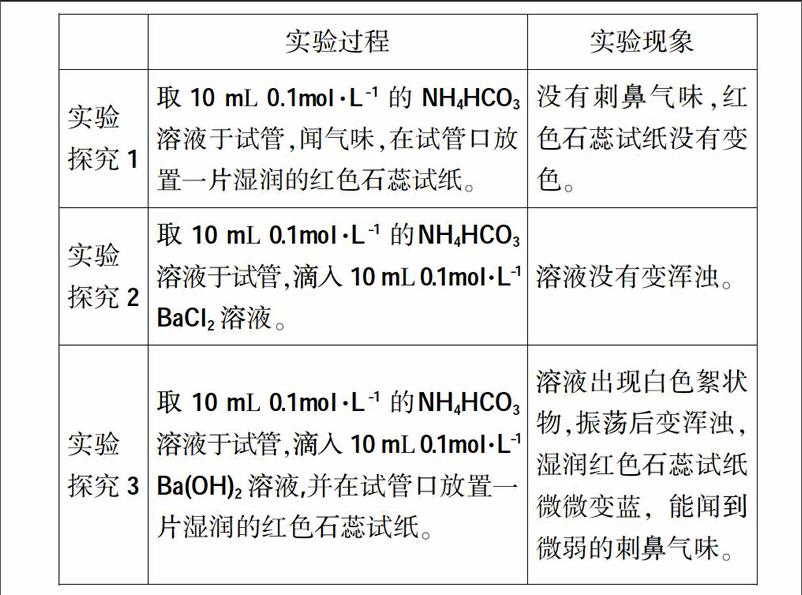
(1)實驗操作過程及實驗現象
(2)實驗結果
結論1:0.1mol·L-1 的NH4HCO3溶液在室溫下沒有分解生成氨氣。
結論2:0.1mol·L-1 的NH4HCO3溶液與0.1mol·L-1 BaCl2沒有反應生成BaCO3。
結論3:0.1mol·L-1 的NH4HCO3溶液與0.1mol·L-1 Ba(OH)2發生反應了,生成BaCO3和少量氨氣。
2. 定量實驗探究
(1)實驗操作過程
取10.00mL 0.10mol·L-1 的NH4HCO3溶液于小燒杯中,測pH值,再向其中滴入0.10mol·L-1的NaOH溶液,每增加1.00mL NaOH溶液并振蕩,充分反應后測定溶液pH值,平行實驗三次,然后推算溶液中HCO3-、NH4+的濃度。
(2)實驗用品
氫氧化鈉(分析純,天津濱海科迪化學試劑有限公司)、碳酸氫鈉(分析純,天津致遠化學試劑有限公司)、電子天平、250mL容量瓶、堿式滴定管、小燒杯、數顯筆式酸度計(型號pH-2011,精確度±0.05,自動補溫)。
(3)實驗數據(表1)
(4)HCO3-、NH4+的濃度的推算
實驗測得0.10mol·L-1的NH4HCO3溶液的pH=9.057,是因為以HCO3-的水解為主,NH4+的水解為輔,且HCO3-的水解程度遠遠大于NH4+的。經過計算,溶液中c(NH4+)近似等于0.10mol·L-1,c(HCO3-)約為0.0954mol·L-1。
向10.00mL 0.10mol·L-1 的NH4HCO3溶液中滴入0.10mol·L-1 的NaOH溶液VmL。假設下列兩個反應都發生:NH4++OH-[=]NH3·H2O(K1)、HCO3-+OH-[=]CO32-+ H2O(K2),根據NH3·H2O的電離常數 (Kb=1.8×10-5)、H2CO3的電離常數(Ka1=4.5×10-7,Ka2=4.7×10-11)和水的離子積(Kw=1.0×10-14)[1]推算出兩個反應的平衡常數(K1和K2)表達式為(1)和(2),又因為溶液中的氮原子和碳原子是恒定的,得出物料守恒表達式(3)和(4)。
K1==(1)
K2==(2)
c(NH4+)+c(NH3·H2O)+c(NH3)=
=(3)
c(HCO3-)+c(CO32-)+c(H2CO3)=
=(4)
由于在稀溶液中反應,c(NH3)和c(H2CO3)的值極小,所以它們在(3)和(4)式中可以忽略,再將(1)和(3)、(2)和(4)分別結合整理得到下列表達式(5)和(6):
c(NH4+)·[1+]=(5)
c(CO32-)·[1+·c(OH-)]=(6)
然后,將實驗測得pH值轉換成c(OH-)代入(5)和(6),得出反應后溶液的c(NH4+)和c(HCO3-),其數值(單位為mol·L-1)如表2,并將測量數據繪制成濃度-體積曲線圖,如圖1。
(5)實驗結果
結論1:0.1mol·L-1 的NH4HCO3溶液呈弱堿性。
結論2:向0.1mol·L-1 的NH4HCO3溶液逐漸滴入0.10mol·L-1 的NaOH溶液,c(NH4+)和c(HCO3-)均在減小,前期階段c(NH4+)減小幅度遠大于c(HCO3-)的,NH4+大量被消耗,隨著NaOH量的增加,c(NH4+)減小幅度就沒有c(HCO3-)的顯著了。
3. 實驗探究的結論
通過定性和定量實驗探究,可以清楚準確的得出如下結論:向NH4HCO3溶液中滴入少量的NaOH溶液,OH-與HCO3-、NH4+同時發生反應,但OH-與NH4+反應程度更大一些,不存在反應的先后順序問題。
二、微觀探析的角度
宏觀的實驗結果一定是微觀原理的直接反映。溶液中的離子反應也必然是離子間接觸性碰撞后才能反應,向NH4HCO3溶液中滴入少量的NaOH時,數目巨大的OH-與HCO3-、NH4+相接觸的機會是均等的,反應的機會也是均等的,這樣就不存在反應的先后順序,必然是同時進行反應。那么,為什么又會出現OH-與NH4+反應程度更大一些的實驗結果呢?
1. 從粒子立體結構的角度
路易斯碰撞理論認為:反應物分子間的互相碰撞是反應進行的必要條件,當分子以合適的取向碰撞才能發生反應[2]。也將能使化學反應發生的碰撞稱為有效碰撞。
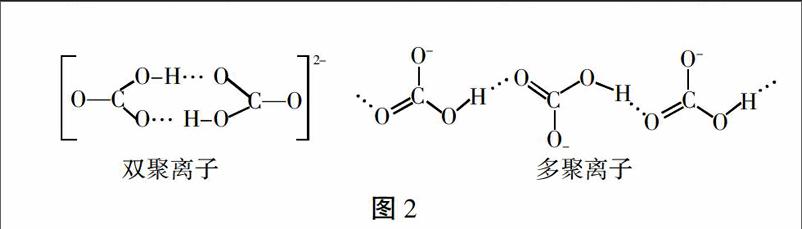
NH4+是由四個等同的s-sp3 σ鍵形成的正四面體結構。HCO3- 中的碳原子以sp2雜化軌道與三個氧原子的p軌道形成σ鍵,碳原子的另一個未參與雜化的p軌道與氧原子的p軌道形成π鍵,分子呈平面三角形[3]。NH4HCO3溶液中的NH4+和HCO3-自由無規則運動著,當與NaOH溶液混合時,OH-與NH4+和HCO3-分別發生碰撞,NH4+的正四面體結構決定它有四個幾率均等的方向與OH-發生有效碰撞,但平面三角形的HCO3-只有連有羥基的一端可以與OH-發生有效碰撞,OH-與NH4+發生有效碰撞的空間選擇性要比和HCO3-的大很多。另外,HCO3-在溶液中通過氫鍵形成雙聚(HCO3)22- 和多聚鏈狀(HCO3)nn- 離子[4],如圖2,這樣更加減少了能與OH-發生有效碰撞的HCO3-離子數目,使得反應HCO3-+OH-[=]CO32-+H2O的反應程度下降。
基于此,可以推理出“向NH4HCO3溶液中滴入少量的NaOH溶液,OH-與HCO3-、NH4+同時反應,但與NH4+反應程度更大一些。”的論點。
2. 從靜電作用的角度
靜電作用是物質組成和物質變化過程中普遍的作用力。OH-與NH4+和HCO3-的反應過程也必然與靜電作用力有關。
(1)離子間的靜電
NH4+是帶一個正電荷的原子團,OH-和HCO3-都帶一個負電荷。當NH4HCO3溶液與NaOH溶液混合時,NH4+與OH-之間的靜電吸引力就能使其較大程度地“親密”接觸,而HCO3-與OH-之間的靜電排斥力就會使其無法接觸“親密”。這種因素也會使OH-與NH4+反應程度提高,與HCO3-的反應程度降低。
(2)化學鍵和氫鍵
化學反應是舊鍵斷裂與新鍵形成的過程。由表3 [5]可知:NH4+中N-H的鍵能接近389kJ·mol-1,HCO3-中O-H的鍵能接近465kJ·mol-1,發生化學反應時,NH4+中N-H比HCO3-中O-H更容易斷裂,這也說明了OH-與NH4+反應程度比與HCO3-的大。
氫鍵常用X-H···Y的形式表示,是分子間作用力的一種,成鍵時X、H和Y盡可能三原子共線,當X、Y的電負性越大,原子半徑越小時,形成的氫鍵越強。H、N和O原子的電負性大小關系為:O>N>H,它們產生的氫鍵鍵能如表4[6]所示。
NH4HCO3溶液與NaOH溶液混合時,HCO3-、NH4+分別與OH-的反應過程必然有通過氫鍵作用形成反應的中間狀態(如圖3),氫鍵的強弱也會影響NH4+、HCO3-在反應中斷鍵的難易程度。由表4可知:NH4+與OH-之間的氫鍵鍵能約為20.9kJ·mol-1,HCO3-與OH-之間的氫鍵鍵能約為18.8kJ·mol-1,這就使得NH4+中H原子比HCO3-中H原子更容易脫離離子體,形成水分子。氫鍵的作用也使得OH-與NH4+ 反應程度比與HCO3-的大。
3. 微觀探析的結論
離子是自由運動、自由接觸而反應的,HCO3-、NH4+分別與OH-的反應是同時發生的,不存在先后順序。而HCO3-、NH4+的結構不同,又決定了二者與OH-反應的程度不同,從各種角度分析得出:NH4+與OH-反應的程度更大一些。
三、結論
綜上所述,向NH4HCO3溶液中滴入少量的NaOH溶液,會同時發生兩個反應:NH4++OH-[=]NH3·H2O、HCO3-+OH-[=]CO32-+H2O ,第一個反應的程度更大一些,不存在二者反應的先后順序問題。
另外,“向NH4HCO3溶液中滴入少量NaOH溶液”的離子方程式不能寫成:HCO3-+OH-[=]CO32-+H2O,也不能寫成:NH4++OH-[=]NH3·H2O,這兩種書寫都是與實驗結果不吻合的,而應該把兩個離子反應方程式都分別分開書寫出來,這樣才與實驗結果吻合。
在實際教學中,關于“向NH4HCO3溶液中滴入少量NaOH溶液”的問題要么繞開,要么給學生一個準確的解釋,不能給予不確定的結果或錯誤的答案。當然,“向NH4HCO3溶液中滴入過量NaOH溶液”的反應離子方程式為:NH4++HCO3-+2OH-[=]NH3·H2O+CO32- + H2O ,它是確定的,可以用來考查學生。
參考文獻
[1] 華彤文,卞江等.普通化學原理(第4版)[M].北京:北京大學出版社,2013:471
[2] 北京師范大學等,無機化學考研室.無機化學(上冊第四版)[M].北京:高等教育出版社,2002:285-288
[3][4]北京師范大學等.無機化學(下冊第四版)[M].北京:高等教育出版社,2002:567-568
[5] 周公度,段連運.結構化學基礎(第4版)[M].北京:北京大學出版社,2008:184
[6] 華彤文,卞江等.普通化學原理(第4版)[M].北京:北京大學出版社,2013:304
[7] 季慧.利用數字化實驗驗證稀NH4HCO3溶液中滴入少量稀NaOH溶液的反應順序[J].科學大眾(科學教育),2014,9

