化學能量變化之“重”“難”“熱”
內蒙古赤峰市巴林左旗林東一中(025450)
劉志龍● 王曉波●
化學能量變化之“重”“難”“熱”
內蒙古赤峰市巴林左旗林東一中(025450)
劉志龍● 王曉波●
一個確定的化學反應在發生過程中是吸收能量還是放出能量與反應條件沒有必然的聯系,決定于反應物總能量與生成物總能量的相對大小.這個總能量讓很多師生難以釋懷.本文就此將能量變化的重難熱點加以梳理,以備師生借鑒和參考.

解析 圖中曲線(Ⅰ)未使用催化劑(Ⅱ)使用了催化劑,催化劑的使用只是降低了反應所需要的活化能.
由Ea=E活-E反Ea′=E活-E生
二者相減得到:Ea-Ea′=E生-E反=ΔH
即由圖所示ΔH=E2-E1
根據反應熱的定義,可逆反應的ΔH與反應的條件、可逆反應的程度和反應物的轉化率等無關,ΔH不變.然而可逆反應不可能進行完全,所以在密閉容器中若按方程式中化學計量數完全反應時,反應體系的熱效應Q<|ΔH|=|E2-E1|
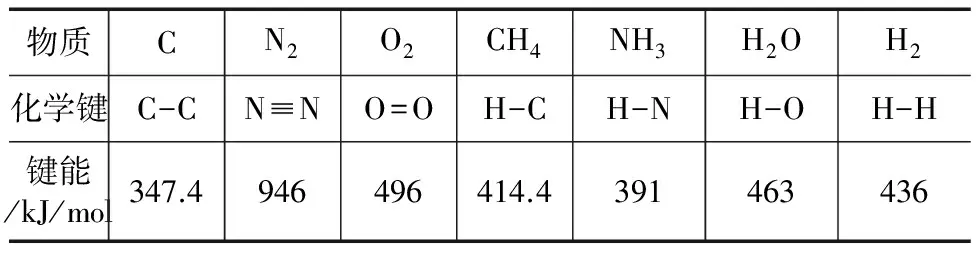
答案:Q 點評 由圖所示,推導出ΔH的計算公式,再根據可逆反應的特點,從而確定出Q和|ΔH|的大小關系. 例2 下表中的數據為各物質的鍵能. 物質CN2O2CH4NH3H2OH2化學鍵C-CN≡NO=OH-CH-NH-OH-H鍵能/kJ/mol347.4946496414.4391463436 完成下列兩個小題: (1)上述物質中能量最低的是____,形成氫化物最不穩定的是____. (2)相同條件下,N2、H2、O2分別和H2反應,當消耗等量的H2時,吸收或放出的熱量最多的是____. 解析 從非金屬性角度來說,元素的非金屬性越弱,單質的活潑性就越弱,單質越不易與H2化合,形成的氫化物越不穩定.等量的單質與H2化合產生的熱效應就越小. 從能量角度而言,物質的鍵能表示破壞1 mol物質中的共價鍵所消耗的能量,因此共價鍵的鍵能越大,物質本身所具有的能量越低,物質需要更多的能量解離,物質就越穩定.等量的單質與H2化合產生的熱效應就越小. 答案:(1)N2CH4(2)H2O 點評 一個確定的化學反應在發生過程中吸收能量或放出能量ΔH=反應物的化學鍵鍵能之和-生成物的化學鍵鍵能之和=生成物能量之和-反應物能量之和. ΔH1=Q1kJ/mol ① ΔH2=Q2kJ/mol ② ΔH3=Q3kJ/mol ③ 室溫下使16g純甲醇充分燃燒,再恢復到室溫放出的熱量為多少? 將①/2+2×②-③即可得到室溫下酒精燃燒熱的方程式: 1 0.5 CO2(g)+2H2O(l) ΔH=0.5ΔH1+2ΔH2-ΔH3 0.5Q1+2Q2-Q3 Q 答案:Q=0.5(0.5Q1+2Q2-Q3)kJ 點評 利用蓋斯定律解題必須首先確定目標反應,然后根據已知反應,通過四則混合運算的方法確定換算的最佳結果.同時在運算時ΔH的“+”、“—”也按照相同的方式進行計算. 重難點闡釋:化學反應中的總能量變化包括:物質化學能的變化和化學鍵鍵能的變化.這兩種能量變化不是割離的而是有必然聯系的.由ΔH兩個互為相反數的計算公式以及化學反應的總能量與總鍵能的反比關系.不難得出:反應物化學能之和+反應物中化學鍵鍵能之和=生成物化學能之和+生成物中化學鍵鍵能之和. 熱點預測:高考對蓋斯定律的考查僅局限于定律的簡單應用,考查程度不深.以后的復習備考中務必傾向于將蓋斯定律與原電池和電解池的知識點結合起來,這樣有利于考查學生的綜合應用和理解能力,也可能成為高考出題的亮點. 總結歸納: (1)對于任意一個化學反應而言: 反應物總能量之和+反應物總鍵能之和=生成物總能量之和+生成物總鍵能之和. ΔH=反應物中化學鍵鍵能之和-生成物中化學鍵鍵能之和=生成物化學能之和-反應物化學能之和. ΔH=Ea-Ea′(Ea為反應物的活化能;Ea′為生成物的活化能) (2)同一主族元素的單質和H2化合時:元素的非金屬性越弱,單質越不活潑,與H2就越不容易化合,生成的氫化物就越不穩定,形成化合物的共價鍵鍵能越小.物質本身具有的能量越高.等量的單質和H2化合,放出的熱量就越少. G632 B 1008-0333(2017)07-0075-01