基于微粒觀的鹽溶液性質(zhì)復(fù)習(xí)研究
賴增榮
摘要:以NaHSO3溶液性質(zhì)的教學(xué)設(shè)計(jì)為例,介紹了溶液中存在微粒的判斷方法、微粒之間的平衡關(guān)系;從靜態(tài)到動態(tài)、定性到定量、單相體系到多相體系等視角了解離子平衡的應(yīng)用等。構(gòu)建了微粒觀統(tǒng)領(lǐng)下認(rèn)識溶液性質(zhì)的思路,有利于學(xué)生加深宏觀現(xiàn)象與微觀探析關(guān)系的理解,提高問題解決的能力,同時(shí)也促進(jìn)教師專業(yè)素養(yǎng)提升。
關(guān)鍵詞:微粒觀;鹽溶液性質(zhì);復(fù)習(xí)離子平衡認(rèn)識思路
文章編號:1005–6629(2017)3–0035–06 中圖分類號:G633.8 文獻(xiàn)標(biāo)識碼:B
1 微粒觀在鹽溶液性質(zhì)復(fù)習(xí)中的指導(dǎo)作用
高中學(xué)生通過各模塊知識的學(xué)習(xí),對微粒觀有了一定的認(rèn)識。但許多學(xué)生僅將微粒觀以知識的形態(tài)儲存于大腦中,認(rèn)為化學(xué)觀念與其他具體化學(xué)知識一樣,僅僅是一種學(xué)科知識;不能自覺地將微粒觀作為學(xué)習(xí)化學(xué)的指導(dǎo)思想。構(gòu)建化學(xué)微粒觀的根本目的之一是能從微粒視角思考、解決溶液中的離子平衡問題,探析或推測溶液中離子反應(yīng)所表現(xiàn)出來的宏觀現(xiàn)象。利用微粒觀來分析解決有關(guān)溶液中的化學(xué)問題,既能加深對微粒觀的認(rèn)識與理解,又能從微觀視角探析溶液的宏觀性質(zhì),充分體現(xiàn)化學(xué)觀念在認(rèn)識物質(zhì)性質(zhì)過程中的特殊作用。一定層次的微粒觀又能指導(dǎo)宏觀變化的研究[1];在高三復(fù)習(xí)課教學(xué)中,引導(dǎo)學(xué)生建立“從微粒觀的視角分析、解決化學(xué)問題”的基本思路,既能加深對微粒觀念的理解,又能發(fā)揮微粒觀對復(fù)習(xí)的指導(dǎo)和統(tǒng)領(lǐng)作用,還能提升復(fù)習(xí)效率,體現(xiàn)微粒觀構(gòu)建在不同教學(xué)階段中的螺旋上升,令人耳目一新[2]。
2 鹽溶液中的微粒觀
2.1 微粒觀主要內(nèi)容
綜合不同研究者對微粒觀的描述,其觀點(diǎn)主要包括:物質(zhì)是由分子、原子、離子等微粒構(gòu)成的,這些微粒很小;微粒是不斷運(yùn)動的;微粒之間存在相互作用[3];化學(xué)是在分子、原子水平上研究物質(zhì)的組成、結(jié)構(gòu)、性質(zhì)及其變化的學(xué)科[4];微粒觀也可以從內(nèi)容屬性(即學(xué)科知識)和思維屬性(解決問題的思路和方法)兩個(gè)維度進(jìn)行理解[5];微粒觀是從微觀的角度,從微粒的種類、微粒的存在、微粒的相互作用、微粒的運(yùn)動和變化以及微粒數(shù)量等層面,形成對化學(xué)物質(zhì)及其變化的認(rèn)識[6]。
2.2 課標(biāo)對鹽溶液微粒觀的要求
溶液的性質(zhì)是由溶液中存在的微粒種類、微粒數(shù)量的多少及其相互之間關(guān)系決定的[7]。課程標(biāo)準(zhǔn)對溶液中的微粒觀要求,可以從認(rèn)識角度、學(xué)習(xí)深度、應(yīng)用等方面進(jìn)行描述,具體如表1。
2.3 學(xué)生現(xiàn)有微粒觀的認(rèn)識水平
2.3.1 將微粒觀作為一種陳述性知識
頭腦中只有微粒觀的知識,沒有轉(zhuǎn)化為觀念。在實(shí)際情境中,不能自覺或敏感地從微粒的視角分析問題、解決問題。
例如在表述NaHCO3溶液與足量的石灰水反應(yīng)的離子方程式時(shí),學(xué)生按以下順序來完成任務(wù):
寫出化學(xué)方程式→將溶于水的強(qiáng)電解質(zhì)改寫成離子→刪去式子兩邊相同的離子→得出離子方程式。
作為初學(xué)者,按上述程序書寫離子方程式無可厚非。但是在學(xué)習(xí)完溶液中的離子平衡后再按上述步驟書寫離子方程式,就說明微粒觀的認(rèn)識水平處于低級狀態(tài)或僅僅將微粒觀看成是一種陳述性知識。
從微粒觀視角來書寫上述反應(yīng)的離子方程式的要求:依據(jù)離子反應(yīng)之間定量關(guān)系,直接寫出離子方程式。
2.3.2 微粒觀認(rèn)識處于靜態(tài)水平
在分析“分別用相同物質(zhì)的量濃度的鹽酸、醋酸溶液中和相同量的NaOH,所需兩種酸的體積大小關(guān)系”問題時(shí),許多學(xué)生認(rèn)為所需醋酸溶液體積大,他們的理由是:醋酸屬于弱電解質(zhì),其電離產(chǎn)生的[H+]較小。
顯然,學(xué)生不知道弱電解質(zhì)在溶液中存在電離平衡,也不知道電離平衡是動態(tài)的、可移動的。這些情況均說明學(xué)生的微粒觀的認(rèn)識處于靜態(tài)水平。
2.3.3 微粒觀認(rèn)識處于定性水平
在分析“25℃,將0.1 mol·L-1醋酸鈉溶液加水稀釋時(shí),水解平衡向什么方向移動?移動后溶液中[OH-]如何變化?”問題時(shí),不少學(xué)生認(rèn)為水解平衡向右移動,因?yàn)槿芤涸较。x子之間結(jié)合機(jī)會越少;稀釋后溶液中[OH-]變大,因?yàn)樗馄胶庀蛴乙苿樱a(chǎn)生了更多的OH-。
這些學(xué)生只能從定性角度來分析問題,無法從溶液中各種離子濃度之間存在的定量關(guān)系加以分析;當(dāng)有多個(gè)因素同時(shí)對一個(gè)問題發(fā)生影響時(shí),可能就無法得出正確的結(jié)論。
若從Q(濃度商)與水解平衡常數(shù)K的相對大小、以及K=[OH-]·[CH3COOH]/[CH3COO-]的關(guān)系分析,則上述問題迎刃而解。
3 微粒觀統(tǒng)領(lǐng)下鹽溶液的性質(zhì)專題復(fù)習(xí)案例研究
以NaHSO3溶液的性質(zhì)為例,在微粒觀統(tǒng)領(lǐng)下復(fù)習(xí)鹽溶液性質(zhì)的教學(xué)設(shè)計(jì)如下:
3.1 依據(jù)學(xué)生微粒觀水平確定學(xué)習(xí)目標(biāo)
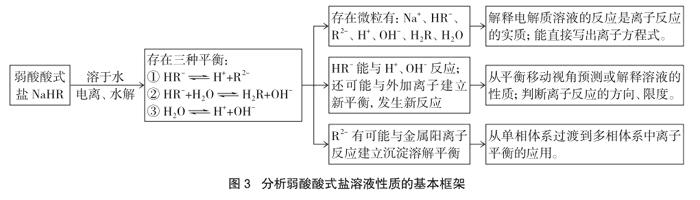
(1)以NaHSO3溶液與Ba(OH)2溶液的反應(yīng)為例,能正確判斷鹽溶液中存在的離子、分子的種類以及它們之間的定量關(guān)系,解釋產(chǎn)生這些微粒的原因;并能從微粒的視角直接寫出反應(yīng)的離子方程式(突出微粒產(chǎn)生途徑及其定量關(guān)系、從微粒角度分析化學(xué)反應(yīng));
(2)以NaHSO3溶液為例,能找出鹽溶液中微粒之間的平衡體系,知道影響這些平衡的因素以及移動的結(jié)果(突出微粒觀、平衡觀、動態(tài)觀);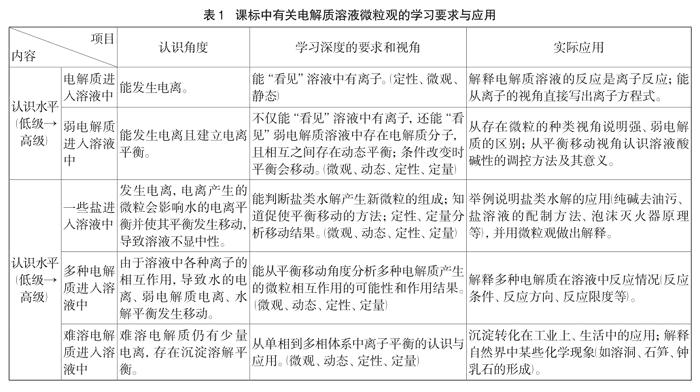
(3)能依據(jù)溶液中存在的微粒及平衡,預(yù)測鹽溶液可能具有的性質(zhì),并能設(shè)計(jì)實(shí)驗(yàn)加以證明(突出運(yùn)用微粒觀預(yù)測鹽溶液的宏觀性質(zhì));
(4)給定兩種電解質(zhì)溶液,能分析其反應(yīng)方向、反應(yīng)限度;能分析多相體系(固、液相)中離子平衡及其移動的應(yīng)用(突出微粒之間的定量關(guān)系、多相體系中離子平衡的應(yīng)用);
(5)構(gòu)建從微粒觀視角認(rèn)識鹽溶液性質(zhì)的基本思路,并能進(jìn)行遷移。
3.2 教學(xué)過程設(shè)計(jì)
3.2.1從微粒觀認(rèn)識鹽溶液的組成與性質(zhì)
[學(xué)生活動1]
在0.1 mol·L-1 NaHSO3溶液中加入少量Ba(OH)2溶液,產(chǎn)生白色沉淀。
①用化學(xué)用語表示NaHSO3溶液中存在的離子、分子(H2O除外)的產(chǎn)生過程[已知: Ka1(H2SO3)=1.23×10-2;Ka2(H2SO3)=5.6×10-8]。
②先分析NaHSO3溶液、Ba(OH)2溶液中存在的主要離子及其數(shù)目關(guān)系,再分析將這兩種溶液混合后,微粒之間反應(yīng)情況,直接寫出反應(yīng)的離子方程式(不要通過“先寫反應(yīng)的化學(xué)方程式,再改寫為離子方程式”的方法書寫離子方程式),說明分析思路。
③至少提出三種使0.1 mol·L-1 NaHSO3溶液中的c(HSO3-)減小的措施。
[問題①設(shè)計(jì)意圖]
落實(shí)“鹽溶于水時(shí),能發(fā)生電離,還可能發(fā)生水解,從而產(chǎn)生各種離子、分子”的觀念認(rèn)識,落實(shí)能“看見”鹽溶液中離子、分子的目標(biāo);并學(xué)會用微觀符號表征有關(guān)微粒變化;認(rèn)識到微粒產(chǎn)生的過程可能存在動態(tài)平衡。具體分析思路及結(jié)果如表2。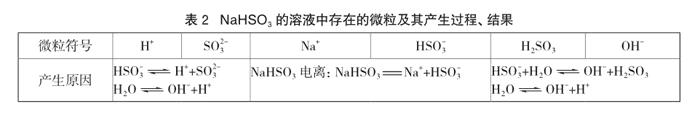
[問題②設(shè)計(jì)意圖]
引導(dǎo)學(xué)生從溶液中存在的主要微粒及其反應(yīng)的定量關(guān)系分析離子反應(yīng),落實(shí)微粒觀中的定量觀。分析思路和結(jié)果如圖1。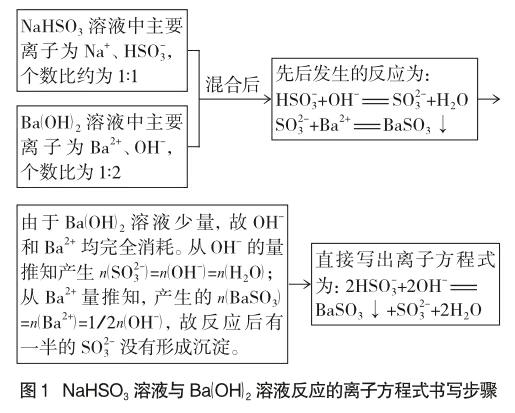
[問題③設(shè)計(jì)意圖]
通過該問題的解剖分析,落實(shí)“鹽溶液中的微粒之間存在平衡,平衡是動態(tài)的、可以移動的”平衡觀、動態(tài)觀的目標(biāo)。
3.2.2 從微粒觀預(yù)測溶液的性質(zhì)
[學(xué)生活動2]
依據(jù)NaHSO3溶液存在的微粒及平衡關(guān)系,請你預(yù)測NaHSO3溶液可能具有的性質(zhì),說明你的預(yù)測理由;設(shè)計(jì)實(shí)驗(yàn)證明你對溶液具有“還原性”的判斷。將結(jié)果填入表3。
[設(shè)計(jì)意圖]
(1)構(gòu)建“從微粒種類、微粒之間的平衡、核心元素化合價(jià)等視角預(yù)測鹽溶液的宏觀性質(zhì)”的基本思路。

3.2.3 從離子平衡判斷鹽溶液的反應(yīng)方向與限度
[學(xué)生活動3]
NaHSO3溶液與Na2CO3溶液能否發(fā)生反應(yīng)?若能反應(yīng),主要反應(yīng)產(chǎn)物是什么?
[設(shè)計(jì)意圖]
要求學(xué)生依據(jù)化學(xué)平衡常數(shù),分析離子之間能否發(fā)生反應(yīng)和反應(yīng)的限度,以探查學(xué)生在新情境中分析電解質(zhì)溶液之間反應(yīng)結(jié)果的能力,并歸納出解決問題的策略。
K1很大,表明反應(yīng)趨勢很大,只要溶液中反應(yīng)物離子濃度很小即可滿足Q K2較小,表明反應(yīng)趨勢很小,即使溶液中反應(yīng)物離子濃度較小,仍可能導(dǎo)致Q>K,因此反應(yīng)較難向右進(jìn)行,且平衡時(shí)反應(yīng)限度也很小。 [方法歸納] 找出溶液中存在的離子及存在的平衡→混合溶液中微粒之間可能存在的新平衡,并求出其平衡常數(shù)K→利用K大小判斷相關(guān)反應(yīng)的方向和限度。 3.2.4 離子平衡的應(yīng)用 [學(xué)生活動4] 工業(yè)上制備NH2OH·HCl(鹽酸羥胺)的一種工藝流程片段如下圖2所示。 4 實(shí)踐反思 通過本課時(shí)的設(shè)計(jì)與教學(xué)活動,教師、學(xué)生都會有較大收獲。 4.1 學(xué)生方面 能更為深刻理解溶液所表現(xiàn)出的各種宏觀性質(zhì),均是由溶液中的微粒的種類、離子平衡移動決定的;知道用微粒觀可以預(yù)測或探析溶液的許多性質(zhì);體驗(yàn)了運(yùn)用微粒觀構(gòu)建分析問題、解決問題的基本思路,進(jìn)一步認(rèn)識到用化學(xué)觀念看待化學(xué)問題的價(jià)值意義,最終養(yǎng)成在新情境中自覺運(yùn)用化學(xué)基本觀念解決問題的習(xí)慣。構(gòu)建學(xué)科基本觀念,不僅能使學(xué)生對學(xué)科思想有深刻的領(lǐng)悟,也能培養(yǎng)學(xué)生學(xué)習(xí)遷移能力,提高學(xué)生解決問題的能力[8]。 4.2 教師方面 在教學(xué)設(shè)計(jì)過程中,教師必須認(rèn)真梳理課標(biāo)要求,從課標(biāo)中抽提出微粒觀的基本內(nèi)容及其價(jià)值,同時(shí)在教科書中尋找落實(shí)微粒觀構(gòu)建與應(yīng)用的教學(xué)內(nèi)容,概括出中學(xué)化學(xué)微粒觀的基本內(nèi)容、學(xué)習(xí)要求、應(yīng)用價(jià)值,結(jié)合學(xué)生的微粒觀已有水平確定教學(xué)目標(biāo),再設(shè)計(jì)相關(guān)的教學(xué)事件將教學(xué)目標(biāo)逐一落實(shí)到位。上述一系列思考和分析過程,對提升教師學(xué)科素養(yǎng)和專業(yè)能力大有裨益; 在教學(xué)實(shí)施時(shí),由于對學(xué)生的認(rèn)知要求遵循由淺入深、由易到難的順序:宏觀到微觀、定性到定量、靜態(tài)到動態(tài)、單相體系到多相體系,所以在教學(xué)過程中勢必會出現(xiàn)這樣那樣的問題,這就要求教師善于捕捉課堂動態(tài),尋找課堂中生成的教學(xué)資源,充分發(fā)揮自身的智慧,及時(shí)調(diào)整教學(xué)行為,以便更好地落實(shí)教學(xué)目標(biāo),在此過程中教師的教育教學(xué)能力也得到提升。 參考文獻(xiàn): [1]程紹山.運(yùn)用微粒觀開發(fā)復(fù)分解反應(yīng)教學(xué)價(jià)值的實(shí)踐與研究[J].化學(xué)教育,2015,(15):29. [2]張彩玲.基于微粒觀構(gòu)建“換個(gè)角度看世界”主題復(fù)習(xí)教學(xué)設(shè)計(jì)[J].化學(xué)教學(xué),2013,(6):28. [3]畢華林,盧巍.化學(xué)基本觀念的內(nèi)涵及其教學(xué)價(jià)值[J].中學(xué)化學(xué)教學(xué)參考,2011,(6):5. [4]朱玉軍.中學(xué)化學(xué)的基本觀念探討[J].中國教育學(xué)刊,2013,(11):72~73. [5]陳瑞雪.以微粒觀促進(jìn)學(xué)生對化學(xué)知識的深入理解[J].化學(xué)教育,2013,(1):19. [6]楊梓生,吳菊華.中學(xué)化學(xué)教師專業(yè)發(fā)展的十二堂必修課[M].上海:華東師范大學(xué)出版社,2015:96. [7]賴思恒.立足微粒認(rèn)識的初中元素化合物教學(xué)研究與實(shí)踐[J].化學(xué)教學(xué),2013,(9):21. [8]王琦,胡小璐.運(yùn)用觀念構(gòu)建復(fù)習(xí)溶液中微粒濃度關(guān)系的課例[J].中學(xué)化學(xué)教學(xué)參考,2013,(5):37.