利用基因芯片技術檢測李痘病毒主要株系的研究
陳定虎+何春梅++蘇斐+馮黎霞+熊仁廣+鄭傳發+陳文聰+劉運+方騰奎

摘 要:針對我國檢疫性植物病毒即李痘病毒主要6個株系設計了6個特異性探針,同時設計了擴增該6個株系的一對通用引物,并確定了靶基因的PCR擴增體系和芯片雜交體系。對6個探針核酸序列進行同源性比對,結果表明探針之間的同源性只有39-61%,而各探針與本株系的同源性達到95%以上,因此適合作為檢測李痘病毒主要株系的探針。成功設計的李痘病毒各主要株系的通用引物能夠一次性擴增6個株系中的任何一個株系,而不需要做多重PCR,標記的擴增片段即可同芯片進行雜交,不但可以檢測出李痘病毒,而且還能夠明確是該病毒的哪個株系,檢測結果直觀明了,易于判定。芯片特異性好,能夠正確區分6個株系,而且與其他植物病毒沒有交叉反應。芯片的靈敏度高,可達到5pg/μL DNA模板濃度。
關鍵詞:基因芯片;李痘病毒;主要株系;檢測
李痘病毒(Plum pox virus, PPV)是我國2007年頒布的進境植物檢疫性有害生物,是核果類果樹危險性最大的病毒之一,屬于馬鈴薯Y病毒科(Potyviridae)中的馬鈴薯Y病毒屬(Potyvirus),其自然寄主主要是李屬的木本植物,侵染李、杏、桃、櫻桃等核果類果樹后,使葉片和果實均受到嚴重危害,未成熟果實大量脫落,造成果實品質下降,產量降低。病毒遠距離擴散則主要靠感染病毒的植物繁殖材料的調運。根據病毒的來源和侵染植物的不同,該病毒的目前主要株系有6個,它們分別為PPV-D, PPV-M,PPV-C, PPV-EA, PPV-W,PPV-Rec,其中D株系和M株系是目前最主要的流行株系。
由于植物病毒的特殊性,即一般種子和苗木帶毒率是非常低的,加上進出境量通常非常之多,如果抽樣量過少,則漏檢的機率就一定非常之大,把關作用就會大大消弱;為了最大限度的提高檢測率,避免漏檢,就必須加大抽樣量,這樣就會導致樣品眾多,不僅會加大檢測的工作量,而且會極大的影響檢測速度,推遲通關速度,進而影響進出境貿易的正常進行,因此急需具有高通量檢測的儀器設備和方法,而基因芯片技術正好適合這一要求。
基因芯片(gene chip)的最早是80年代中期由Dulbecco首次提出且目前已經在許多方面得到了廣泛的應用[1,2,3,4],其本質上仍然是核酸分子雜交方法,具體系指將大量(通常每平方厘米點陣密度高于400)探針分子固定于支持物上后與標記的樣品分子進行雜交,通過檢測每個探針分子的雜交信號強度進而獲取樣品分子的數量和序列信息。基因芯片技術由于同時將大量探針固定于支持物上,所以可以一次性對樣品大量序列進行檢測和分析,從而解決了傳統核酸印跡雜交技術操作繁雜、自動化程度低、操作序列數量少、檢測效率低等不足;而且,通過設計不同的探針陣列、使用特定的分析方法可使該技術具有多種不同的應用價值,如基因表達譜測定、實變檢測、多態性分析、基因組文庫作圖及雜交測序等。
目前基因芯片技術已經在許多方面得到了廣泛的應用,但是在李痘病毒主要不同株系檢測鑒定方面還未見諸報道,本項目預期達到的最終目標是研制出一次同時能夠高通量檢測李痘病毒主要株系的基因芯片和檢測方法。
1 研究材料
1.1 李痘病毒毒株來源
1.1.1 D(Dideron)株系: Tey (X16415)、PENN2(AF401296)、Fan (AY912056)、Rankovic (M21847)、Skiernevice(S73776)。
1.1.2 M(Marcus)株系: SK68(M92280)、PS (AJ243957)、06 (S57405)、S57404(1768bp)。
1.1.3 EA(El Amar)株系:X56258,AM157175。
1.1.4 C(Cheery)株系:Y09851、AY184478、X97398。
1.1.5 W(Winona) 株系:AY912055。
1.1.6 Rec (Recombinants between D and M) 株系:AY028309。
以上株系均購自美國GADIA公司,其標準序列來自NCBI,括號中為其核酸序列登陸號。
1.2 芯片雜交材料
1.2.1 醛基載玻片:購自北京博奧晶典生物技術有限公司。
1.2.2 探針:本實驗探針是人工合成的,長度41bp,并在合成的寡聚核苷酸探針末端(5'端)帶上氨基修飾,這種探針需要點制在醛基基片上。
1.2.3 點樣液:購自北京博奧晶典生物技術有限公司;點樣液的目的是使點出的點圓潤均勻。
1.2.4 雜交液:購自北京博奧晶典生物技術有限公司。
1.2.5 洗液1:500ML: 量取440ml蒸餾水倒入1000ml試劑瓶中,加入50ml 20XSSC,混勻,再加入10ml 10%SDS,混勻,室溫儲藏。
1.2.6 洗液2:500ML: 量取495ml蒸餾水倒入1000ml試劑瓶中,加入5ml 20XSSC,混勻,室溫儲藏。
1.2.7 梯度PCR儀,Peltier Thermal Cycler 220:MJ Research,USA。
1.2.8 凝膠成像分析系統:Hema,德國。
1.2.9 核酸濃度測定儀,ND-1000 Spectrophotometer:NanoDrop Technologies Inc.,USA。
1.2.10 核酸干燥儀,DNA120 SpeedVac System:Thermo Speed
Vac,USA。
1.2.11 晶芯PersonalArrayer 16TM個人點樣儀、CapitalBio Corporation 雜交儀、LuxScanTM10K掃描儀、芯片盒,載玻片盒等均由北京博奧晶典生物技術有限公司生產。
2 研究方法
2.1 李痘病毒主要株系探針設計
采用軟件DNAStar 6.0的序列比較功能Meglign軟件對六種株系內和株系間的序列進行比較,特別是針對外殼蛋白編碼的基因序列進行比對,找出其共同部分和特異部分,并對特異序列在NCBI中進行核酸Blast搜索(http://www.ncbi.nlm.nih.gov/BLAST),以便設計出PCR擴增的通用引物,并用通用引物對六個株系分別進行PCR擴增,以檢測通用引物的實用性和特異性。
2.2 六株系PCR擴增的特異性通用引物設計及檢測
2.2.1 六株系PCR擴增的特異性通用引物設計
對以上六株系序列進行多序列比較,設計出了PCR擴增這六個株系的通用特異性引物:
上游引物:PPV-chip-P1:5'- CCCATTTTCAC(G/A)CCAGCA(A/G)C -3'
下游引物:PPV-chip-P2:5'- TCGCATGATCCAACAATGGC -3'
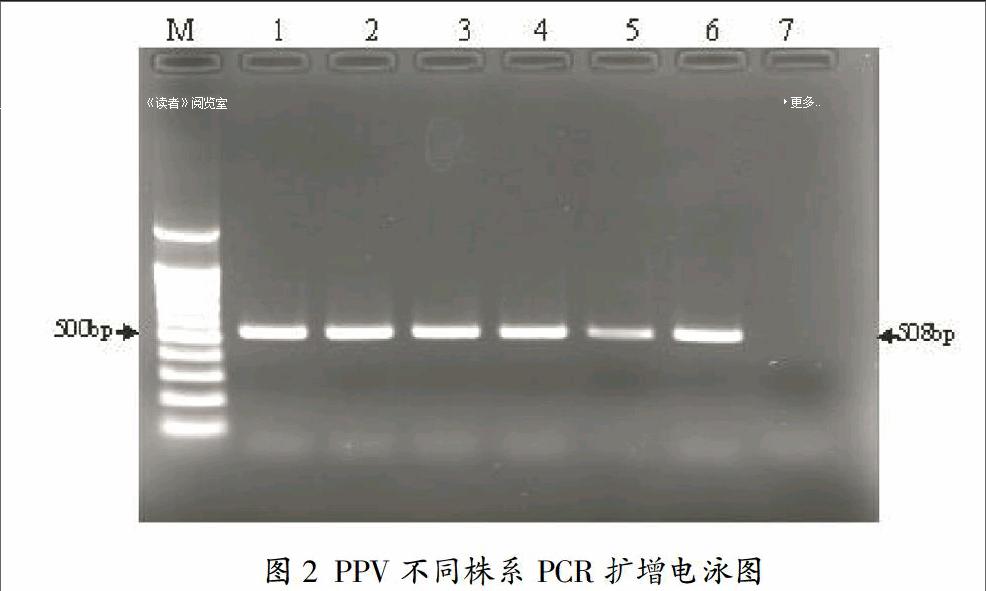
擴增片段長度:508bp.
2.2.2 通用引物檢測
(1)感病植物總RNA提取
根據廣州普博生物技術公司提供的方法,稱取0.1g 感病植物組織,然后按照Trizol試劑盒方法提取其總RNA。
(2)反轉錄
在裝有去離子水9.5?滋L的0.2mL PCR管中,加入上步提取的總RNA 2?滋L,Oligo(dT)15 0.5?滋L(0.5ug), dNTPs(10?滋mol/L)1uL,混合均勻,70℃水浴 5min后立即置于冰上2min,3000rpm離心30秒后加入5×cDNA第一鏈合成緩沖液4?滋L,0.1mol/L DTT 1?滋L,RNase 抑制劑 1?滋L(30U),M-MLV反轉錄酶1?滋L(20U),40℃水浴60min。
(3)PCR 擴增
通用引物PCR 擴增:在0.2mL PCR管中,加入10×PCR擴增緩沖液2.5?滋L, dNTPs(10mmol/L)1?滋L,通用引物PPV-chip-P1 1 ?滋mol/L,PPV-chip-P2 1 ?滋mol/L,反轉錄合成反應液2?滋L,加水至25?滋L,Taq 聚合酶 0.5?滋L(2.5U);94℃ 3分鐘;94℃ 40s,55℃ 40s,72℃ 1min,循環35次;72℃ 10min;4℃保存。
雜交用PCR擴增:此時PCR擴增用的引物5'末端用熒光染料HEX進行標記,即:在0.2mL PCR管中,加入10×PCR擴增緩沖液2.5?滋L, dNTPs(10mmol/L)1?滋L,通用引物PPV-chip-P1(Cy3 標記) 1 ?滋mol/L,PPV-chip-P2(Cy3 標記) 1 ?滋mol/L,反轉錄合成反應液2?滋L,加水至25?滋L,Taq 聚合酶 0.5?滋L(2.5U);94℃ 3分鐘;94℃ 40s,55℃ 40s,72℃ 1min,循環35次;72℃ 10min;4℃保存。這樣擴增產物都會被標記上HEX熒光素,以便用于雜交反應。
(4)電泳分析
用1XTAE緩沖液配置1%的瓊脂糖凝膠,然后對5?滋L PCR產物進行電泳分析。一般而言,引物的擴增長度設計在300~1000bp之間,適當的擴增長度,可以保證有較強的熒光信號,但是過長的靶基因,會加大它與探針雜交的空間位阻,同時也更容易產生非特異性雜交或與擁有部分相同序列的同種病毒其他株系的交叉雜交。本實驗PCR片段長度是508bp,長度大小和通用性及特異性都能夠滿足實驗要求。
2.3 基因芯片點樣
取5ul純化探針,加點樣液(100% DMSO,其中含1:100000的Cy3-dCTP)5ul混勻,探針濃度為10?滋m;然后加到晶芯PersonalArrayer 16TM個人點樣儀的384孔板上,每孔加40μL,將寡核苷酸探針點在醛基玻片上,并通過探針5'末端的氨基基團進行共價固定。
2.4 陣列設計
陣列排布示意圖如圖1所示,點與點的中心距離為740μm,點的直徑為500μm,樣品包括探針、陽性對照(定位基因)、陰性對照(DMSO)及空白對照(三蒸水),每個樣品點20個重復點,每塊玻片點兩個重復陣列。
陰性對照是用50%的DMSO,陽性對照是標記有熒光染料HEX的λDNA,陰性對照和陽性對照的作用是確認芯片質量合格及反應條件正常與否,以保證反應結果的有效性。正常情況下陽性對照應該有熒光信號,而陰性對照則沒有熒光信號。另外陽性對照還起到一個位置標志的作用,讓實驗者可以方便的找到各個株系探針的位置。
2.5 芯片預處理
預處理的目的就是通過紫外光的照射(紫外交聯),使基因芯片上的核酸探針與基片牢固地結合在一起,以便與樣品雜交。點樣儀中干燥好芯片于65℃烘箱中固定1h,將芯片點有DNA的一面在60℃水浴鍋上水合10s,芯片距水面距離2-3cm,在空氣中室溫自然干燥后,再進行一次水合。之后將點有探針的一面朝上,放在紫外交聯儀中250mJ交聯,后再將芯片放在42℃預熱的0.5% SDS中洗滌10min(42℃條件下水浴搖床80rpm),再用42℃預熱的蒸餾水清洗4min,最后用無水乙醇清洗2min。2000rpm離心5min去除芯片表面的液體后,密封,室溫保存備用。
2.6 芯片的雜交
制備好芯片放置在北京博奧晶典生物技術有限公司生產的專用雜交盒中。
10uL雜交液的配制:100%甲酰胺 5uL,10% SDS 0.2uL,20 X SSC 1.5uL,PCR樣品標記物3.3uL。(以不含標記樣品的水做參照)。將標記樣品與雜交液的混合物混勻后,3000rpm,離心30s,于95℃沸水中變性處理3min,冰浴驟冷1min,然后用移液器將雜交混合液分別加注到雜交芯片的蓋片上的小孔中,使預雜交液覆蓋于點樣區,然后蓋緊雜交盒的蓋,放入42℃的水浴中,雜交2h,使樣品與探針充分混合。
2.7 芯片的清洗
雜交結束后,在暗室內取出芯片,雜交面朝上放于清洗盒中,放在水平搖床上用42℃預熱洗液1清洗4min,以便洗去沒有與探針特異性結合的樣品;然后迅速地用鑷子將芯片轉移到盛放有洗液2的清洗盒中,雜交面朝上,放在水平搖床上用42℃預熱洗液1清洗4min。清洗結束后,1500rpm,1min離心干燥,除去玻璃表面上的液體,在4小時內進行掃描。
2.8 芯片的掃描分析
利用基因芯片激光共聚焦掃描儀LuxScanTM10K掃描儀掃讀芯片信息,先打開掃描軟件是LUXSCAN 3.0,然后開倉,將芯片插入機器內,關倉,使用綠色熒光通道,先使用4偽彩進行預掃一次,以便選擇掃描區域,再進行精掃,掃描參數為掃描分辯率為10μm,激發光源波長532nm,接收的熒光信號中心波長570nm,檢測靈敏度小于一個熒光分子/um2,激光功率值(Laser Power)100%,光電倍增管效率值(PMT Gain)600。
2.9 數據處理與結果判定
掃描后圖像將通過判讀軟件(CapitalBio)自動進行分析,通過比較分析信號中位值和信號平均值的輸出數據,以其中最能反應本試驗芯片雜交圖像信息的參數值進行結果分析。當芯片上呈現綠色信號且HEX質控信號呈現綠色信號時即可判定陽性反應,對于反應強烈的可以直接從掃描圖片上熒光的反應判斷檢測結果。
2.10 芯片的特異性試驗
將PPV不同的株系PCR標記擴增的PCR產物分別與制備好的芯片進行雜交,以檢測芯片的特異性。
2.11 芯片的靈敏性試驗
靈敏度實驗是指基因芯片所能檢測的最低DNA濃度,取決于目的基因制備時PCR擴增的靈敏度。本試驗將D株系的標記PCR擴增后的DNA稀釋成以下濃度:20pg/μL、10pg/μL、5pg/μL及2.5pg/μL,再與雜交液混勻后與檢測芯片進行雜交,經熒光掃描儀掃讀信號,驗證檢測芯片的靈敏度。
2.12 應用芯片對植物病毒的驗證檢測
用同樣是果樹上非常重要的病毒同時也是我國重要的進境檢疫性病毒即李壞死環斑病毒做驗證試驗材料,采用與李痘病毒樣品處理相同的方法,提取其總RNA,設計其PCR擴增引物并進行5'端標記:PNRSV1:5'-gatggtttgccgaatttgcaatc-3', 下游引物PNRSV2:5'-ctagatctcaagcaggtcct-3',然后做反轉錄RT,再用熒光標記的特異性引物做PCR擴增, 反應條件:94℃ 變性3min,然后94℃ 40s,60℃ 40s,72℃ 1min,35個循環,然后72℃延伸10min,最后再與李痘病毒的芯片進行雜交。
3 結果與分析
3.1 PPV六種株系PCR鑒定
經過對PPV六種株系的序列進行比對,找出了這六個株系的特性的保守片段,并設計了檢測它們的通用引物,本實驗PCR片段長度是508bp,長度大小和通用性及特異性都能夠滿足實驗要求,電泳結果顯示用通用PCR引物能擴增出個株系的特異性DNA片段,如圖2,為制備標記靶基因奠定了基礎。
3.2 探針的設計與合成
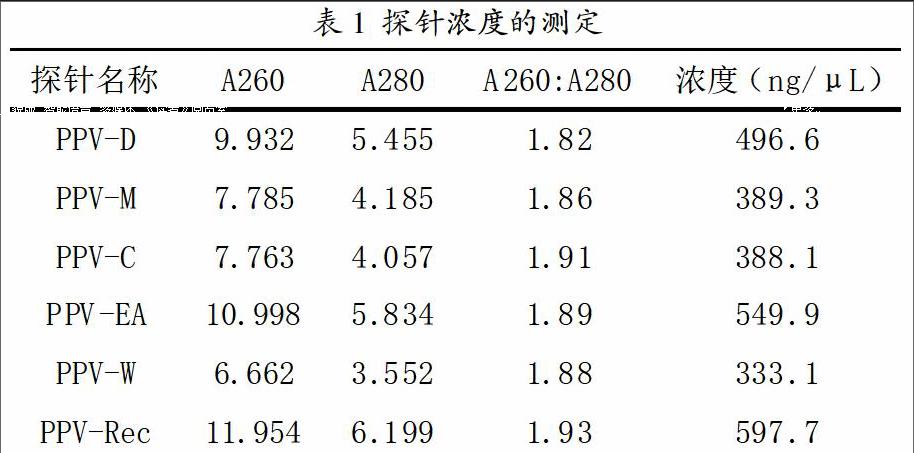
根據序列比對,最后設計各株系特異性探針長度都是41bp,序列分別如下:5'- 3';探針濃度的測定值如表1所示,其A260:A280比值都超過1.8,純度符合實驗要求。
PPV-D-X16415.1-CP:
C A A C A A A A C C A G T T T C A C A G G T G C C A G G A C C T C A A C T G C A A
PPV-M-AJ243957.1-CP:
C G G T A A G A C C A G T T C C T C C A A T T T C A G G G A C C A A A C C G C G G
PPV-EA-X56258-CP:
C C A C T A G G A C A G T G C C T C A C A C A A C A A C T A C T A C A C C T C C T
PPV-Rec-AY028309-CP:
C G A T A A G A C C A G T T T C T C C A A T T T C A G G G G C C A C A C C G C A G
PPV-W-AY912055-CP:
G C G T G A A G C C A A C T A C A T C A G C A A C A A T T A A C C C A A C G T C T
PPV-C-Y09851-CP:
A T G T G A G A C C G A T T G C A C C A G T A G T G A C A A G T C C A T T C T C G
通過對檢測靶基因即PCR產物的同源性分析,能夠評價一個基因是否適合用于檢測某一種病毒,同時也為雜交反應提供理論依據,是一個重要的指標。探針的選擇是構建檢測芯片最核心的內容之一。作為檢測探針,必須根據探針在屬或種內保守性及特異性的兩大原則來設計,本實驗設計的各個探針與同株系PCR產物即靶標之間的同源性達到95%以上,而與非同株系的靶標之間的同源性只有39-61%,這樣就確保了檢測靶基因間不會產生交叉雜交現象,保證了實驗的檢測特異性。同源性分析結果表明,本實驗所選用的6個DNA序列片段適合用作構建檢測李痘病毒6個主要株系的基因芯片的探針。
3.3 芯片的特異性雜交試驗
將PPV不同的株系PCR標記擴增的PCR產物分別與制備好的芯片進行雜交,結果顯示每個株系的探針只與其相同株系的PCR擴增產物雜交,并顯示出強烈的熒光信號,而與其他株系的PCR標記擴增產物沒有任何反應,熒光暗淡。此雜交結果表明,檢測芯片具有良好的特異性,且雜交信號強度好,掃描圖像上雜交斑點明顯,檢測結果目視即可判定,有利于應用該芯片對植物樣品中該病毒進行檢測,如圖3-8。
3.4 芯片的靈敏性試驗
將D株系的標記PCR擴增后的DNA稀釋成不同的濃度后雜交表明在模板DNA濃度在5~20pg/μL范圍內,都有明顯的雜交信號,雜交斑點明顯;模板DNA濃度為2.5pg/μL時,無雜交信號,SNR為0.40,信號值小于100,肉眼看不到雜交斑點,表明檢測芯片的檢測靈敏度可達到5pg/μL。如圖9所示。
3.5 芯片的特異性試驗
首先用同樣為木本植物的檢疫性病毒即李壞死環斑病毒進行驗證,用PNRSV的熒光標記的特異性引物做RT-PCR擴增,可以擴增出675bp的特異性片段,結果如下圖10所示,然后將擴增的標記產物與PPV芯片雜交,結果顯示PPV芯片除了陽性質控出現強烈熒光外,并不能與李壞死環斑病毒的擴增物雜交上,如圖11.表明PPV芯片具有一定的特異性。
M:100bp分子量標準;
1. PNRSV及PPV二重PCR擴增產物
2. PPV PCR 擴增產物(243bp)
3. PVRSV PCR 擴增產物(675bp)
4 討論
特異性探針的設計是基因芯片檢測技術的核心內容,芯片中所用的探針為核酸分子探針,是指特定的已知序列的核酸片段,能與互補核酸序列發生雜交。因此可以利用探針檢測樣品中特定基因的特征片段或測定未知基因的序列。根據核酸分子探針的來源及其性質可以分為基因組DNA探針、CDNA探針、RNA探針及寡核苷酸探針等。可以根據檢測對象和要求的不同選用不同類型的探針。但并不是任意一段核酸片段均可作為探針。探針選擇正確與否,將會直接影響到雜交結果的分析。探針選擇最基本的原則是應具有高度特異性,兼而考慮來源及制備的方便等因素。本實驗是通過核酸序列比對從李痘病毒外殼蛋白編碼基因的種的保守序列中尋找株系的核酸序列的特異性,并基于此設計出了6個株系的特異性探針,通過序列再比較并在NCBI中通過BLAST比對發現這6條探針具有高度的特異性,完全可以作為株系探針來檢測和區分李痘病毒不同株系。
芯片基片的選擇非常重要,各種各樣的芯片表面修飾中,目前最常用的具有活性氨基或活性醛基基團修飾。氨基化芯片適用于點制PCR產物、cDNA和蛋白質等大分子,表面的氨基在中性的條件下帶正電荷,與DNA骨架上帶負電荷的磷酸基團通過靜電相互作用相結合,這種結合方式與靶基因的序列組成和空間排列沒有關系。在一般的實驗條件下,氨基基片均能表現出較低的自發熒光和低的背景熒光,但是對于比較短DNA片段如40bp左右的寡核苷酸,由于片段比較短小,為了其有更好的雜交效率,一般要對其進行氨基修飾,并點在醛基基片更為合適,由于本實驗設計的探針都只有41bp,故本實驗選用醛基基片,并對探針的5'端進行氨基修飾,以便使氨基與醛基包被的基片結合,從而將探針固定在基片上。
芯片雜交的特異性取決于選取靶基因的同源性。本研究中所選取的靶基因均為同種病毒內保守序列,但探針相互之間的同源性在39-61%以下,確保在雜交過程中不出現交叉雜交的現象。
對于一種檢測方法,必須要明確其最低的檢測濃度即靈敏度,以避免由于DNA濃度的影響而造成假陰性的結果。在本試驗中,選取李痘病毒的D株系的PCR產物進行進行靈敏性試驗,結果表明基因芯片檢測的靈敏度為5pg/μLDNA模板濃度。
基因芯片技術雖然目前已經在許多方面得到了廣泛的應用,但是在李痘病毒6個主要不同株系檢測鑒定方面還未見諸報道,因此本項目的研究對植物病毒的檢測特別是對李痘病毒的檢測具有一定的現實意義并為其他植物病毒的檢測提供了一定的參考價值。
參考文獻
[1]步恒富,祝慶余.基因芯片技術在致病微生物研究中的應用[J].國外醫學:微生物學分冊,2001,24(1):8-11.
[2]楊國淋,文心田,曹三杰,等.基因芯片技術在雞病毒性疾病診斷中的應用[J].中國獸醫雜志,2015,51(10):57-60.
[3]邱秀文,吳小芹,黃霖,等.基因芯片技術在生物研究中的應用進展[J].江蘇農業科學,2014,42(5):60-62.
[4]生物芯片分析[M].張亮,等譯.北京:科學出版社,2004:100,112,13
5,258.
作者簡介:陳定虎(1985,5-),男,漢族,籍貫:湖北荊州,博士研究生,高工,研究方向:植物病毒檢疫。

