二(2,2-二硝基丙基)硝胺的合成及熱性能
劉衛孝,姬月萍,2,陳 斌,高福磊,汪營磊,劉亞靜,潘永飛,閆崢峰
(1.西安近代化學研究所,西安 710065;2.氟氮化工資源高效開發與利用國家重點實驗室,西安 710065)
二(2,2-二硝基丙基)硝胺的合成及熱性能
劉衛孝1,姬月萍1,2,陳 斌1,高福磊1,汪營磊1,劉亞靜1,潘永飛1,閆崢峰1
(1.西安近代化學研究所,西安 710065;2.氟氮化工資源高效開發與利用國家重點實驗室,西安 710065)
以2,2-二硝基丙醇為原料,經縮合、硝化反應合成了二(2,2-二硝基丙基)硝胺(BDNPN)。用紅外光譜、核磁共振、元素分析對中間體及目標化合物的結構進行了表征。優化了反應條件,硝化反應的最佳條件為nBDNPA:nHNO3=1∶30,反應溫度為50 ℃,反應時間為1 h,收率92.1%。用DSC和TG-DTG考察了目標化合物的熱性能。結果表明, BDNPN的熱分解峰溫為212.3 ℃,具有較好的熱穩定性。
有機化學;二(2,2-二硝基丙基)硝胺;BDNPN;合成;表征;熱性能
0 引言
偕二硝基類含能化合物具有能量適中、安定性好等特點,被廣泛用于推進劑及炸藥中[1-6]。二(偕二硝基丙基)硝胺(BDNPN)是偕二硝基類含能化合物的一個典型代表,其熱穩定性好,與硝化棉等大多數材料的相容性好,其能量與RDX相當,非常有望作為RDX替代物,用于推進劑、發射藥配方中[7]。 2010年,美國陸軍軍備研究、開發與工程中心以BDNPN取代RDX,用于改性單基發射藥中,彈藥鈍感性能明顯提升,且不會過多損失能量,相關配方在60 mm火炮中進行了演示驗證,各項指標非常優異[8]。然而,在上述研究前,國內外關于BDNPN合成和熱性能的相關研究未見公開報道。2012年,Saikia A[9]等以BDNPA為起始原料,利用微波輔助合成手段,成功制備了BDNPN,收率達到85%,但文中未提及二(2,2-二硝基丙基)胺(BDNPA)的制備方法。
本研究以2,2-二硝基丙醇(DNPOH)為起始原料,與氨經mannich縮合,得到中間體BDNPA,并參考文獻[9]合成路線,利用常規加熱方式,以硝酸為硝化劑對BDNPA進行硝化,得到目標化合物BDNPN;通過對合成反應條件進行優化,降低了硝化反應溫度(文獻值65 ℃[9]),提高了反應收率;采用DSC、TG-DTG熱分析方法,對中間體和目標化合物的熱分解性能進行了研究,為應用研究提供參考。
1 實驗
1.1 試劑及儀器
2,2-二硝基丙醇,純度≥98%(HPLC),自制;乙酸銨,乙酸酐、濃硫酸等均為分析純;硝酸(質量分數≥98%)為工業品。
NEXUS 807型傅里葉變換紅外光譜儀,美國熱電尼高力公司;AV 500型(500 MHz)超導核磁共振儀,瑞士BRUKER公司;VARIO-EL-3型元素分析儀,德國EXEMENTAR公司;LC-2010A型高效液相色譜儀(歸一化法),日本島津公司;Q-200型差示掃描量熱儀,美國TA公司;TA 2950熱重儀,美國Nicolet公司;X-6型顯微熔點儀,北京泰克儀器有限公司。
1.2 合成路線
以2,2-二硝基丙醇為原料,經縮合反應生成中間體二(2,2-二硝基丙基)胺(BDNPA),再經過硝化反應得到目標化合物二(2,2-二硝基丙基)硝胺(BDNPN),合成路線如圖1所示。
1.3 化合物的合成
1.3.1 二(2,2-二硝基丙基)胺(BDNPA)的合成
將DNPOH(11.3 g,0.075 mol)和20 ml水加入反應瓶中,溶解后,加熱升溫至60 ℃,攪拌下分批加入乙酸銨(2.3 g,0.03 mol),保溫20 min后,降至室溫,析出大量白色固體,經過濾、水洗、干燥得二(2,2-二硝基丙基)胺(BDNPA)6.8 g,收率80.1%,純度98.5%,熔點66~69 ℃。
1H NMR(DMSO-d6,500 MHz),δ:2.08(s,6 H,CH3),3.23(m,1 H,NH),3.72(m,4 H,CH2);IR(KBr),υ(cm-1):3 383(N—H);2 932(—CH3):1 336,1 576(—NO2);元素分析(C6H11O8N5,%):計算值,C25.31,H3.92,N23.75;實驗值,C25.62,H3.92,N24.91。
1.3.2 二(2,2-二硝基丙基)硝胺(BDNPN)的合成
在反應瓶中加入20 ml濃硝酸,攪拌下加熱升溫至50 ℃,分批加入BDNPA(5 g,0.018 mol),反應過程放熱明顯,加完后保溫1 h,迅速倒入冰水中攪拌,出現大量白色沉淀,過濾、水洗至洗滌液呈中性,干燥得白色固體6.04 g,收率92.1%,純度98.7%,熔點189.3 ℃(DSC,10 ℃/min)。
1H NMR(DMSO-d6,500 MHz),δ:2.36(s,6 H,CH3),5.39(s,4 H,CH2);IR(KBr),υ(cm-1):2 940(—CH3):1 342,1 603(—NO2);元素分析(C6H10O10N6,%):計算值,C22.08,H3.07,N25.76;實驗值,C22.22,H3.01,N24.18。
1.4 BDNPA和BDNPN的熱性能
采用差示掃描量熱(DSC)、熱失重(TG-DTG)熱分析方法,研究了BDNPA和BDNPN的熱分解性能。
2 結果與討論
2.1 縮合反應條件優化
2.1.1 反應物料摩爾比對BDNPA收率的影響
考察了在反應溫度為60 ℃、反應時間為20 min的情況下,不同反應物料摩爾比對BDNPA收率(η)的影響,結果如表1所示。
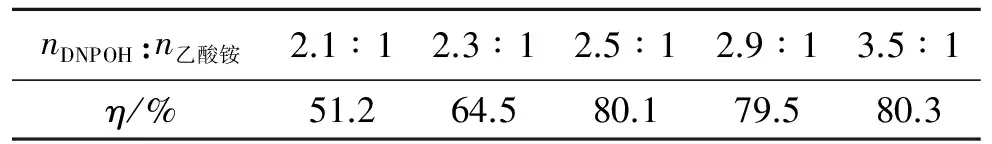
表1 反應物料摩爾比對BDNPA收率的影響
由表1可看出,BDNPA的收率受反應料比的影響較大。隨著DNPOH加入量的增加,反應收率明顯提高,當DNPOH和乙酸銨的摩爾比為2.5∶1時,收率為80.1%,繼續增加DNPOH的加入量收率變化不大。因此,綜合考慮,最佳的反應料比為2.5∶1。
2.1.2 反應溫度對BDNPA收率的影響
在nDNPOH:n乙酸銨為2.5∶1,反應時間為20 min的情況下,考察了反應溫度(T)對BDNPA收率(η)的影響,結果如表2所示。
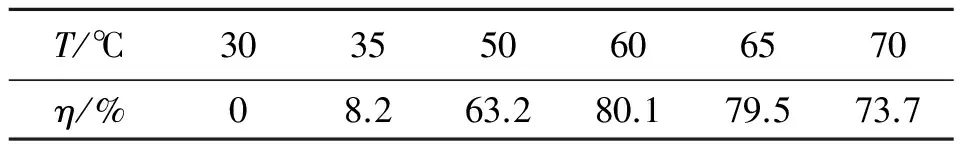
表2 反應溫度對BDNPA收率的影響
由表2可看出,當反應溫度低于30 ℃時,幾乎不反應,隨著溫度的逐漸升高,反應收率明顯提高,當反應溫度為60 ℃時,收率為80.1%,之后繼續升高,反應溫度就會因為副反應的加強而影響收率。因此,60 ℃為反應的最佳溫度。
2.2 硝化反應條件優化
2.2.1 硝化劑和反應物料摩爾比對BDNPN收率的影響
控制硝化反應溫度在50 ℃,反應1 h,考察不同硝化體系和反應物料摩爾比對BDNPN收率(η)的影響,結果如表3所示。表3中,H2SO4和(CH3CO)2O均作為脫水劑。
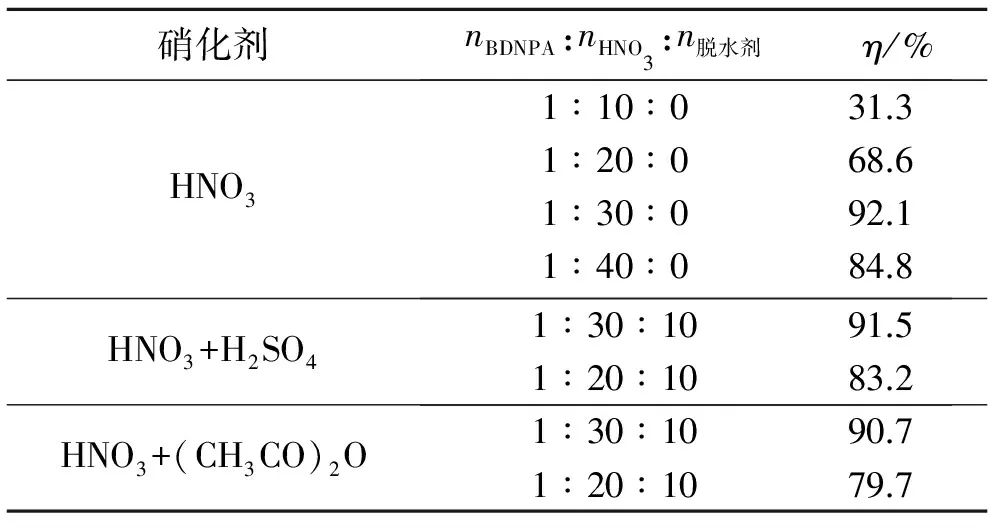
表3 硝化劑和反應物料摩爾比對BDNPN收率的影響
在硝化反應中,硝化體系和用量對反應結果有很大的影響。本實驗選用3種常用的硝化體系進行硝化反應。從表3中可看出,隨著硝酸用量的增加,收率逐漸增加,當nBDNPA:nHNO3達到1∶30時,再增加硝酸用量,收率沒有明顯增加;此外,在硝酸用量相同的情況下,通過加入H2SO4和(CH3CO)2O作為脫水劑,收率依然沒有明顯提高。因此,綜合考慮,選擇HNO3作為硝化劑,HNO3與底物的最佳摩爾比為1∶30。
2.2.2 反應溫度對BDNPN收率的影響
物料比nBDNPA:nHNO3=1∶30,反應時間為1 h,考察了不同反應溫度(T)對BDNPN收率(η)的影響,結果如表4所示。
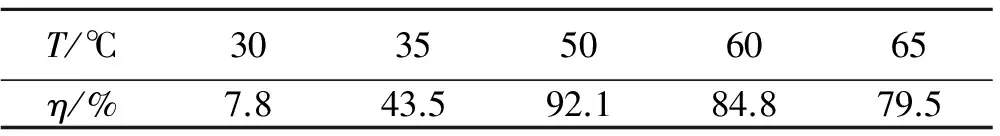
表4 反應溫度對BDNPN收率的影響
在高溫硝化時,需要外界提供一定的熱量,以維持反應的進行,但溫度過高,又會導致產物分解和促進副反應的發生,從而影響反應收率。表4中給出的結果表明,隨著反應溫度的升高,收率隨之增加,當溫度大于50 ℃時,反應的收率開始降低。因此,最適宜的硝化溫度為50 ℃。
2.3 BDNPA和BDNPN的熱性能
圖2為升溫速率為10 ℃/min時BDNPA的熱分解DSC曲線。從圖2可看出,曲線上存在1個強的吸熱峰和1個放熱峰,在65.5 ℃處較尖的吸熱峰為BDNPN的熔點,與熔點儀測試的結果基本一致,173.7 ℃為BDNPA分解放熱峰,放熱峰出現一個臺階,說明樣品的分解不是一步完成。
圖3為BDNPA在常壓下的TG-DTG曲線。從圖3可看出,當溫度低于110 ℃失重很小,累積失重僅0.4%,說明液態BDNPA在較大的溫度范圍內仍較穩定;在溫度從120 ℃上升到200 ℃的過程中,該物質快速分解失重,累積失重達到95.1%,在失重峰曲線下行時,同樣出現了一個臺階,從而進一步證實了該物質存在二次分解的觀點。
圖4為升溫速率為10 ℃/min時BDNPN的熱分解DSC曲線。從圖4可看出,曲線上存在1個吸熱峰和1個放熱峰,在189.3 ℃處吸熱峰為BDNPN的熔點,熔化完畢后,隨即開始分解,這與通過熔點儀測試熔點時,當觀察到樣品即將熔化時,立刻變成棕黃色的現象一致,212.3 ℃為BDNPA分解放熱峰。
圖5為BDNPN在常壓下的TG-DTG曲線。從圖5可看出,當溫度低于170 ℃時,熱穩定性很好,累積失重僅0.7%; 171 ℃時,失重速率開始增加,當溫度到達255 ℃時,分解后的殘余僅2.5%。結合其DSC和TG-DTG熱分析結果可看出, BDNPN熱分解溫度較高,分解后殘留少,是一種熱性能優異的含能材料。
通過對比圖2和圖4可看出,BDNPN的熱分解溫度明顯高于BDNPA,主要因為BDNPA分子中亞氨基上活潑氫的酸性降低了化合物的熱穩定性,活潑氫被硝基取代后,熱穩定性大幅提高。
3 結論
(1)以2,2-二硝基丙醇為原料,經縮合、硝化反應合成了二(2,2-二硝基丙基)硝胺(BDNPN)。用紅外光譜、核磁共振、元素分析,對中間體及目標化合物的結構進行了表征。
(2)縮合反應的最佳反應條件為nDNPOH:n乙酸銨=2.5∶1,反應溫度為60 ℃,反應時間為20 min,收率80.1%,純度98.5%;硝化反應的最佳反應條件為nBDNPA:n硝酸=1∶30,反應溫度為50 ℃,反應時間為1 h,收率92.1%,純度98.7%。
(3)BDNPA和BDNPN的熱分解峰溫分別為173.7 ℃和212.3 ℃,熱穩定性均較好,有望在固體推進劑和發射藥中得到應用。
[1] 姬月萍, 李普瑞, 汪偉, 等. 含能增塑劑的現狀和發展[J]. 火炸藥學報, 2005, 28(4):47-51.
[2] 劉亞靜, 陳斌, 劉衛孝, 等. 綠色方法合成2,2-二硝基-1,3-丙二醇[J]. 含能材料, 2010, 18(6):623-626.
[3] 張麗潔, 姬月萍, 陳斌, 等. 1,3,5,5-四硝基六氫嘧啶的高收率合成[J]. 含能材料, 2012, 20(4):441-444.
[4] 張壽忠, 朱天兵, 馮曉晶, 等. 2, 2 -二硝基丁醇的合成及其應用[J]. 化學推進劑與高分子材料, 2012, 10(3):27-29.
[5] 陳斌, 張志忠, 姬月萍. 偕二硝基類含能增塑劑的合成及應用[J]. 火炸藥學報, 2007, 30(2):67-70.
[6] 王文浩, 周集義. BDNPA/F增塑劑的合成及其發展[J]. 含能材料, 2007, 15(1):90-93.
[7] Rozumov E, Chiu D, Manning T G, et al. RDX and BDNPN as composite fillers for propellant formulations[C]//Proceedings of the 42nd JANNAF Combustion Subcommittee. Boston, Massachusetts, 2008.
[8] Eugene Rozumov, Thelma Manning, Duncan Park, et al. BDNPN as an energetic additive for propellant formulations[C]//41st International Annual Conference of ICT, 2010.
[9] Saikia A, Sivabalan R, Gore G M, et al. Microwave-assisted quick synthesis of some potential high explosives[J]. Propellants Explos. Pyrotech., 2012, 37(5):540-543.
(編輯:崔賢彬)
Synthesis and thermal performance of bis(2,2-dinitropropyl)nitramine
LIU Wei-xiao1, JI Yue-ping1,2, CHEN Bin1, GAO Fu-lei1, WANG Ying-lei1,LIU Ya-jing1, PAN Yong-fei1, YAN Zheng-feng1
(1.Xi'an Modern Chemistry Research Institute, Xi'an 710065, China;2.State Key Laboratory of Fluorine & Nitrogen Chemicals, Xi'an 710065, China)
Bis(2,2-Dinitropropyl)nitramine(BDNPN) was synthesized via condensation and nitration using 2,2-dinitropropanol as starting material.The structures of intermediate and target compound were characterized by IR,NMR,elemental analysis. The factors influencing the condensation and nitration were investigated.The optimized nitration conditions were determined that the molar ratio ofnBDNPN:nHNO3was 1∶30 for 1 hours at 50 ℃,the yield of BDNPN is 92.1%. The thermal performance of target compound was studied using DSC and TG-DTG.The result shows that the peak temperature of the exothermic decomposition reaction of BDNPN is 212.3 ℃, revealing that BDNPN has preferable thermal stability.
organic chemistry;bis(2,2-dinitropropyl)nitramine;BDNPN;synthesis;characterization;thermal performance
2016-11-12;
2016-12-26。
劉衛孝(1983—),男,工程師,研究方向為含能材料合成。E-mail:liuwx1983@126.com
V512
A
1006-2793(2017)02-0204-04
10.7673/j.issn.1006-2793.2017.02.013

