麥草酸水解提取木糖的探究
馬 浩 吉興香,,3,* 田中建,4 房桂干 陳嘉川 楊桂花
(1.齊魯工業大學制漿造紙科學與技術教育部重點實驗室,山東濟南,250353;2.中國林業科學研究院林產化學工業研究所,江蘇南京,210042;3.華南理工大學制漿造紙工程國家重點實驗室,廣東廣州,510640;4.廣西大學,廣西南寧,530004)
·麥草酸水解·
麥草酸水解提取木糖的探究
馬 浩1吉興香1,2,3,*田中建1,4房桂干2陳嘉川1楊桂花1
(1.齊魯工業大學制漿造紙科學與技術教育部重點實驗室,山東濟南,250353;2.中國林業科學研究院林產化學工業研究所,江蘇南京,210042;3.華南理工大學制漿造紙工程國家重點實驗室,廣東廣州,510640;4.廣西大學,廣西南寧,530004)
探究了不同條件下麥草硫酸水解木糖溶出的變化。結果表明,在水解溫度120℃,水解時間60 min,硫酸的質量分數4%時,木糖提取量達到最大值0.20 g/g麥草,木糖的溶出過程隨著水解反應強度的增強可分為三個階段。X射線衍射、傅里葉紅外光譜和環境掃描電鏡分析表明,硫酸質量分數和水解溫度是影響水解過程中麥草纖維素結晶區破壞的主要因素,在木糖提取量最大時,半纖維素幾乎完全降解溶出。
麥草;酸水解;木糖
農業秸稈是一種重要的可再生資源,我國年產量超過8億t[1]。從農業秸稈等可再生資源轉化獲得新材料、能源和化工原料是解決化石能源日益枯竭難題的重要途徑,將秸稈等生物質轉化為清潔燃料或化工原料是21世紀的重要研究課題。在木質纖維組織結構中,半纖維素以氫鍵和共價鍵的形式與木素和纖維素分子結合,因此難以從纖維中分離,資源化利用受到限制[2]。如何充分充分利用半纖維素資源,使其轉化成高附加值的產品已成為近年來的研究熱點[3- 4]。
從木質纖維中提取半纖維素的方法主要有酸水解熱、堿水解、水水解和飽和蒸汽預水解[5-7]等。在各種生物質預處理工藝中,稀酸水解工藝一直受到研究人員的關注。稀酸水解濃度低,應用過程簡單,適合規模化生產。近年來,超低濃度酸水解逐漸成為研究熱點,由于超稀酸的質量分數一般較低(0.1%以下),對設備的腐蝕性小,同時減少了pH值回調所需試劑量,表現出降低環境污染和降低成本的優勢[8]。但是超低濃度酸水解一般需要在高溫高壓的條件下進行,水解產生的糖類極易發生進一步降解,生成酶解或者發酵抑制物,對后續的酶解或者發酵過程產生不良影響[9]。在酸法預處理過程中,不僅使原料中的半纖維素水解生成可發酵的五碳糖,同時破壞纖維結晶結構,使原料結構疏松,提高原料的酶解性能。酸水解法一般采用的酸為硫酸、鹽酸、磷酸和硝酸等,在眾多的預處理方法中,稀酸是最早被研究、研究得最深入、應用最廣泛、最有效和相對廉價的預處理方法之一[10]。稀硫酸預處理適用于許多生物質纖維原料,如玉米芯和玉米秸稈等[11]。稀酸可以有效水解半纖維素,可以使80%~90%的半纖維素發生水解變為單糖,并有利于纖維素的酶水解糖化。有研究表明,麥稈經質量分數為4%的稀硫酸在常壓和80 ℃溫度條件下預處理后用纖維素酶進行水解,其葡萄糖得率比未經酸預處理直接進行酶解時高50%[12]。但是纖維原料經過酸處理以后的殘渣及其水解液進行酶解或者發酵時,其pH值較低,不是酶或者微生物的最適環境,需要另外增加pH值調節步驟,這就會造成化學藥品的消耗,使得成本增加而且調節pH值的過程中會加入更多的無機鹽。影響稀酸水解的因素很多,如原料的粒度、反應溫度、固液比、酸的濃度和水解時間等。對于不同的生物質原料,其最佳水解條件也不同。只有在適宜的水解條件下,生物質原料才能得到較高的纖維水解效率。
本實驗在不同水解條件(溫度、時間和硫酸質量分數)下對麥草進行酸水解處理,通過對水解液中低聚糖和木糖提取量以及水解殘渣的分析,研究了麥草中半纖維素的溶出和解聚規律,探討酸水解條件對半纖維素水解液中木糖含量變化的影響,確定酸水解中最高的木糖提取量,為麥草中半纖維素的提取和綜合利用提供技術參考。
1 實 驗
1.1 實驗原料
麥草取自山東泉林紙業有限責任公司,含有少量的麥草葉。原料中纖維素、半纖維素和木素含量的分析按美國可再生能源實驗室(NREL)的方法測定[13]。麥草各組分含量見表1。

表1 麥草化學成分 %
1.2 麥草酸水解
稱取5.0 g 40目~60目的絕干麥草粉末于容量為120 mL的高溫耐壓瓶中,加入60 mL(固液比1∶12)[14]一定質量分數的硫酸溶液,放入轉子密封后放入已預熱到一定溫度的可控溫磁力攪拌油浴鍋中,水解一段時間后,將耐壓瓶放置到冷水中冷卻,然后經真空過濾,分離水解液和水解殘渣。將水解殘渣充分洗凈,放入聚乙烯袋中保存;取部分水解液稀釋中和后,測定其聚糖含量,再取部分水解液加入一定量、質量分數72%的硫酸,調節水解液中的硫酸質量分數為4%,然后在121℃下油浴加熱60 min[15],稀釋中和后測定木糖含量。
1.3 分析與檢測
1.3.1 聚糖的檢測
采用ICS-5000型離子色譜儀測定酸解液中聚糖含量。色譜條件:分析柱為CarboPacPA100(3 mm×150 mm),保護柱為CarboPac PA100(3 mm×30 mm);EC檢測器(Au為工作電極,Ag/AgCl為參比電極);進樣量25 μL;柱溫30℃;流動相為100 mmol/L的NaOH、300 mmol/L的NaAC的混合溶液和100 mmol/L的NaOH梯度淋洗,流速為1 mL/min。
1.3.2 單糖的檢測
采用ICS-5000型離子色譜儀測定酸解液中單糖含量。色譜條件:分析柱為CarboPacPA20(3 mm×150 mm),保護柱為CarboPac PA20(3 mm×30 mm);EC檢測器(Au為工作電極,Ag/AgCl為參比電極);進樣量25 μL;柱溫30℃;流動相為250 mmol/L NaOH和蒸餾水梯度淋洗,流速為0.4 mL/min。
1.3.3 結晶度檢測
采用型號為D8-ADVANCE的X射線衍射儀(德國布魯克AXS公司)測試得到XRD能譜。具體參數:輻射源為銅靶X光管(λ=1.54184 nm),工作電流為40 mA,工作電壓為40 kV,掃描速度為1.8°/min,掃描范圍2θ為 5~45°。
衍射曲線利用Lorentzian函數進行分峰,4個結晶峰對應101、101、002、040晶面,無定形的結晶峰的最大值對應于101和002晶面之間的波谷。結晶度Xd[16]按式(1)計算。
(1)
式中,Sa是無定形峰的面積,Scr是結晶峰的面積之和。
1.3.4 紅外光譜檢測
采用溴化鉀壓片法,取一定量的樣品置于瑪瑙研缽中,按照1∶100的比例加入適量的干燥溴化鉀,用力研磨直到樣品為粉末狀為止。將適量的粉末狀混合物置于壓片模具中,10 MPa下停留60 s后取出,送入德國生產的Vertex70型傅里葉紅外光譜測定儀中進行測定,在400~4000 cm-1下,掃描32次。
1.3.5 環境掃描電鏡分析
麥草和水解殘渣的表面微觀形貌的觀察是由Quanta 200環境掃描電子顯微鏡(FEI公司)完成,工作電壓為200 kV。實驗中取少量樣品鋪在導電膠帶上,吹掉多余顆粒,留下薄薄一層,然后樣品進行鍍金處理增強其導電性,最后在顯微鏡下進行觀察。
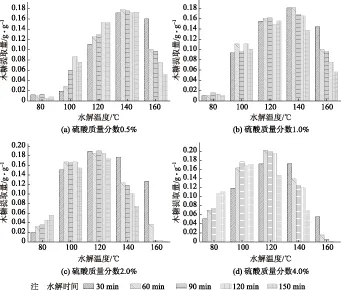
圖1 硫酸質量分數對麥草酸水解木糖提取量的影響
2 結果與討論
2.1 不同條件下酸水解對木糖提取量的影響
圖1為硫酸質量分數對水解麥草木糖提取量的影響。從圖1總體來看,木糖提取量會隨著水解溫度的升高先升高后降低,但是隨著硫酸質量分數的升高使得木糖提取量最大值出現的溫度逐漸降低。在水解溫度120℃、水解時間60 min、硫酸質量分數4.0%時,木糖提取量達到最大值,為0.20 g/g麥草。當水解溫度為80℃時,硫酸質量分數為0.5%和1.0%的條件下,木糖提取量非常低;在硫酸質量分數為2.0%和4.0%的條件下,木糖提取量開始升高,同時木糖提取量隨著水解時間的延長而升高,這說明在硫酸質量分數較低的情況下,延長水解時間不能增加半纖維素的降解。在100℃時,硫酸質量分數0.5%的木糖提取量出現與硫酸質量分數2.0%和4.0%在80℃時相似的情況,而硫酸質量分數為1.0%、2.0%和4.0%的木糖提取量基本達到一個穩定值,不會隨時間的延長而升高或降低。120℃時4種不同反應條件下木糖提取量基本達到穩定值,不再隨水解時間的變化而變化,但是木糖的提取量會隨著硫酸質量分數的升高逐漸升高。
綜合從較低水解溫度下不同時間、不同硫酸質量分數木糖提取量的變化來看,半纖維素的降解大致可分為3個不同的階段,第一個階段:水解溫度80℃、硫酸質量分數0.5%和1.0%,此階段木糖提取量低于0.02 g/g麥草,且木糖提取量隨著水解時間延長沒有增加,在此階段半纖維素支鏈上最易降解的糖苷鍵斷裂,這部分糖苷鍵短時間內幾乎完全斷裂,不會隨水解時間的增加而繼續斷裂;第二階段:水解溫度100℃、硫酸質量分數0.5%,水解溫度80℃、硫酸質量分數為2.0%和4.0%,此階段木糖提取量在0.02~0.12 g/g麥草,木糖提取量隨著水解時間的延長逐漸升高,這個階段半纖維素主鏈上一批較易斷裂的糖苷鍵開始斷裂,這部分糖苷鍵數量比較多,會隨著水解時間的延長逐漸斷裂的;第三階段:溫度100℃、硫酸質量分數1.0%、2.0%和4.0%時,此階段木糖提取量在0.12~0.20 g/g麥草,與第一階段相似,木糖提取量不會隨著水解時間的延長而升高,這個階段隨著反應強度增大,LCC(木素-半纖維素復合體)中的糖苷鍵開始斷裂,這部分糖苷鍵數量較少,當達到一定的反應強度時才能完成斷裂。由此說明半纖維素不同部分糖苷鍵斷裂的難易程度不同,當反應強度達到糖苷鍵斷裂的條件時,糖苷鍵才會開始斷裂。
水解溫度在140℃和160℃時,除硫酸質量分數為0.5%的條件之外,其他條件下木糖提取量開始隨著水解時間的延長下降,尤其是當溫度為160℃,硫酸質量分數為2.0%和4.0%時,長時間水解的情況下,木糖已基本檢測不到,說明在此條件下木糖脫水生成糠醛等其他物質[17]。
通過對水解液中聚糖和葡萄糖的檢測發現,在水解溫度為80℃和100℃的較低溫度下,水解液中會含有少量的聚木糖且聚木糖主要為木二糖、木三糖和木四糖,而溫度升高到120℃之后聚木糖含量極少,并且硫酸質量分數為0.5%、1.0%、水解溫度160℃和硫酸質量分數為2.0%、4.0%、水解溫度140℃時會出現纖維二糖,而葡萄糖含量在溫度160℃時出現大幅升高,說明在較高溫度的酸性條件下聚木糖進一步降解為單糖,并且隨著溫度的繼續升高,部分纖維素開始降解生成纖維二糖和葡萄糖。
2.2 麥草酸水解殘渣結晶度的分析
纖維素Ⅰ型的X射線衍射峰出現在15.1°、16.1°和22.7°,其分子鏈在晶胞內是平行堆砌,而纖維素Ⅱ型的衍射峰出現在21.7°、20.3°和12.2°,其分子在晶胞內是反平行鏈的堆砌。其中纖維素分子中氫鍵作用的強度主要由15°和22°的衍射峰的強度來體現。
圖2為麥草和酸水解殘渣的X射線衍射圖。由圖2可知,麥草水解后纖維素結構沒有發生改變,仍然是纖維素Ⅰ型結構,表明硫酸水解并沒有完全破壞麥草的纖維素結晶結構,由式(1)計算出不同條件下酸水解后的結晶度見表2~表4。圖2中麥草水解前后在26.7°和21.0°的峰為SiO2的特征吸收峰,水解后峰強度之所以變大,可能是因為隨著麥草纖維素、半纖維素和木素的脫除,更多的Si元素暴露出來,使衍射峰的強度增大。
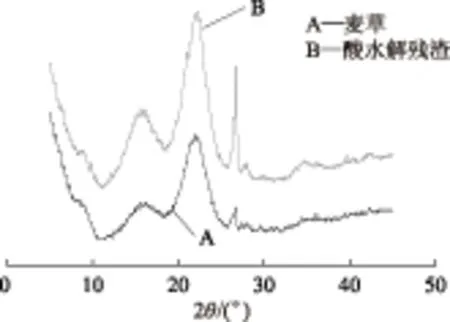
圖2 麥草和酸水解殘渣的X射線衍射圖
表2為不同水解時間下麥草酸水解殘渣的結晶度。從表2中可以看出,在水解溫度120℃、硫酸質量分數為0.5%時,麥草酸水解殘渣的結晶度要高于麥草的結晶度,而且結晶度沒有隨著水解時間的延長而變化。說明在此條件下半纖維素沒有降解溶出,所以在麥草的結晶區沒有被破壞。

表2 不同酸水解時間下麥草酸水解殘渣的結晶度
注 水解溫度120℃,硫酸質量分數0.5%。
表3為硫酸質量分數對酸水解殘渣結晶度的影響。從表3中可以看出,水解時間60 min、水解溫度120℃的條件下,麥草酸水解殘渣的結晶度隨著硫酸質量分數的升高開始下降,說明此條件下隨著硫酸質量分數的升高木糖提取量增加,半纖維素溶出量增加,纖維素結晶區逐步被破壞,造成結晶度逐步降低,硫酸質量分數的增加可以提高對纖維素結晶區的破壞。

表3 硫酸質量分數對麥草酸水解殘渣結晶度的影響
注 水解時間60 min,水解溫度120℃。
表4為不同水解溫度下酸水解殘渣的結晶度。從表4中可以看出,在水解時間60 min,硫酸質量分數為2%時,隨著水解溫度的升高,酸水解殘渣的結晶度隨著溫度的升高開始下降,說明溫度的提高可以提高硫酸對纖維素結晶區的破壞。
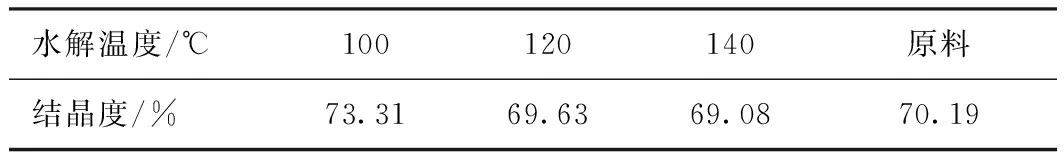
表4 不同水解溫度下麥草酸水解殘渣的結晶度
注 水解時間60 min,硫酸質量分數2%。
2.3 麥草與酸水解殘渣的紅外光譜圖分析
圖3~圖5為麥草和不同水解條件下酸水解殘渣的紅外光譜圖。從圖3可見,麥草和酸水解殘渣的紅外光譜圖基本相同,表明麥草經過酸水解后大部分的結構沒有發生大的變化。在酸水解前后有較大變化的峰為1725 cm-1處的酯鍵特征吸收峰;1245 cm-1處的乙酰基特征吸收峰;1035 cm-1處的C—OH骨架振動和C—O—C吡喃環骨架振動吸收峰和1104 cm-1處的C—O—C吡喃環振動吸收峰。
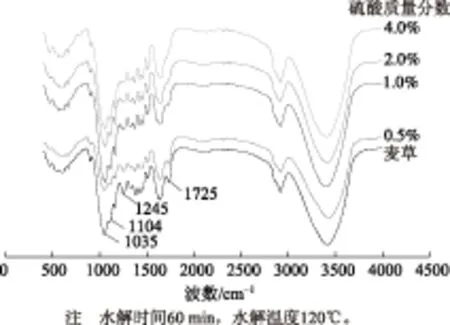
圖3 麥草與不同硫酸質量分數下酸水解殘渣的紅外光譜圖
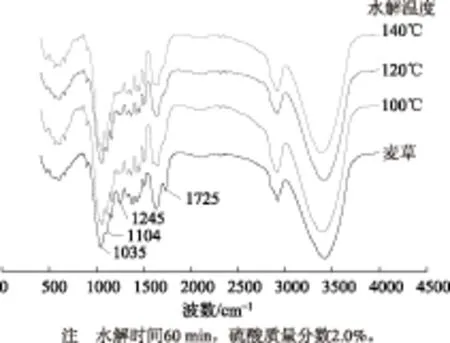
圖4 麥草與不同水解溫度下酸水解殘渣的紅外光譜圖
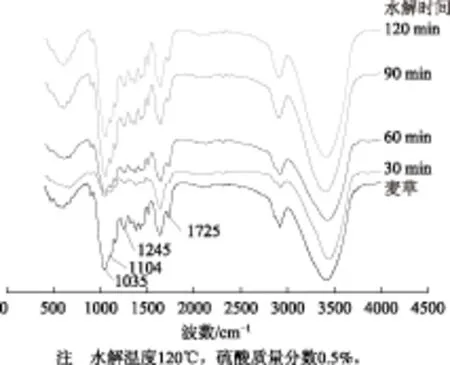
圖5 麥草與不同水解時間下酸水解殘渣的紅外光譜圖

圖6 麥草與酸水解殘渣的環境掃描電鏡圖
從圖3中可以看出,在水解時間60 min、水解溫度120℃的條件下,隨著硫酸質量分數的逐漸升高,1725 cm-1和1245 cm-1處的酯基和乙酰基特征吸收峰逐漸變弱,在硫酸質量分數最高4.0%時已基本消失,也表明隨著硫酸質量分數的提高,半纖維素水解程度逐漸升高,在硫酸質量分數4.0%時,半纖維素基本完全水解,這與木糖提取量在硫酸質量分數4.0%時提取量達到最大值相一致。
而1035 cm-1處的C—OH骨架振動和C—O—C吡喃環骨架振動吸收峰隨著硫酸質量分數的提高,峰逐漸增強,并且變為兩個峰,1104 cm-1處的C—O—C吡喃環振動吸收峰在原料中不明顯,水解后出現較強的峰,可能是因為酸水解過程中由葡萄糖的C5位羥基與C1位醛基縮合生成C—O—C吡喃環。
從圖4中可以看出,在硫酸質量分數2.0%、水解時間60 min的條件下,水解溫度從100℃升高至140℃的過程中,酸水解殘渣的紅外光譜圖基本沒有變化,此時是糖苷鍵斷裂的第三階段,說明100℃時,半纖維素糖苷鍵已經大部分斷裂。
從圖5中可以看出,在水解溫度120℃、硫酸質量分數0.5%,不同水解時間條件下,酸水解殘渣的紅外光譜圖與麥草相比,1035 cm-1處的C—OH骨架振動和C—O—C吡喃環骨架振動吸收峰沒有明顯變化,說明依然有一部分半纖維素沒有降解,這與木糖提取量只達到0.12g/g麥草相一致。
2.4 麥草與酸水解殘渣形貌分析
圖6為麥草與酸水解殘渣的環境掃描電鏡圖。從圖6可看出麥草結構緊密、表面比較光滑,酸水解后隨著反應強度的增大,表面逐漸變得粗糙,可能是半纖維素的逐漸降解溶出,導致麥草表面變得粗糙,而在水解溫度120℃、水解時間60 min、硫酸質量分數4.0%的條件下,麥草酸水解殘渣已經變為單根的纖維,說明半纖維素基本全部溶出,這與在此條件下木糖提取量達到最大值相一致。
3 結 論
探究了不同條件下麥草硫酸水解木糖溶出的變化。
3.1 麥草硫酸水解提取木糖的較佳條件為,水解溫度120℃,水解時間60 min,硫酸質量分數4.0%。在此條件下,木糖的提取量最高,可達0.20 g/g麥草,考慮到生產成本以及后續酸中和的處理,建議采用水解溫度140℃,水解時間90 min,此條件下木糖提取量可達0.18 g/g麥草,硫酸用量為60 kg/t麥草。同時此條件下麥草中的半纖維素已經基本完全水解。
3.2 硫酸質量分數和水解溫度是影響水解過程中纖維素結晶區破壞的兩個重要因素。
[1] LI Zhong-zheng. The Status of Agricultural Residues Resources Available for China’s Paper Industry[J]. China Pulp & Paper, 2014, 33(3): 56. 李忠正. 我國造紙用農業秸稈資源現狀[J]. 中國造紙, 2014, 33(3): 56.
[2] Lawther J M, Sun R, Banks W B. Extraction, fractionation, and characterization of structural polysaccharides from wheat straw[J]. Journal of Agricultural & Food Chemistry, 2002, 43(3): 667.
[3] Cao B. Converting a Kraft Pulp Mill into an Integrated Forest Biorefinery[J]. Pulp & Paper Canada, 2006, 107(6): 38.
[4] LIN Da, PENG Hong, YU Zi-ping, et al. Reseach Progress in Separation and Purification of Hemicellulose[J]. China Pulp & Paper, 2011, 30(1): 60. 林 妲, 彭 紅, 余紫蘋, 等. 半纖維素分離純化研究進展[J]. 中國造紙, 2011, 30(1): 60.
[5] Kou Wei, Zhao Yong, Yan Changguo, et al. Corn straw expansion pretreatment to improve enzymolysis reducing sugar yield[J]. Transactions of the CSAE, 2010, 26(11): 265. 寇 巍, 趙 勇, 閆昌國, 等. 膨化預處理玉米秸稈提高還原糖酶解產率的效果[J]. 農業工程學報, 2010, 26(11): 265.
[6] Li Xudong, Wang xia. Study on Preteatment of Crop[J]. Food and Fermentation Industries, 2008, 34(4): 111. 李旭東, 王 霞. 玉米秸稈預處理研究[J]. 食品與發酵工業, 2008, 34(4): 111.
[7] Zhao Zhigang, Cheng Keke, Zhang Jianan, et al. Advances in pretreatment technology of lignocellulose renewable biomass[J]. Modern Chemical Industry, 2006, 26(z2): 39. 趙志剛, 程可可, 張建安, 等. 木質纖維素可再生生物質資源預處理技術的研究進展[J]. 現代化工, 2006, 26(z2): 39.
[8] Zhang Yimin, Yang Jing, Lv Xuebin,et al. Research Process in Acid Hydrolysis of Lignocellulose Biomass[J]. Word SCI-TECH R&D, 2007, 29(1): 48. 張毅民, 楊 靜, 呂學斌, 等. 木質纖維素類生物質酸水解研究進展[J]. 世界科技研究與發展, 2007, 29(1): 48.
[9] Schell D J, Farmer J, Newman M, et al. Dilute-sulfuric acid pretreatment of corn stover in pilot-scale reactor[J]. Applied Biochemistry & Biotechnology, 2003, 105/108(3): 69.
[10] Taherzadeh M J, Keikhosro K. Acid based hydrolysis processes for ethanol from lignocellulosic materials: a review. BioResources[J]. Bioresources, 2007, 2.
[11] Yang B, Wyman C E. Pretreatment: the key to unlocking low-cost cellulosic ethanol[J]. Biofuels Bioproducts & Biorefining, 2008, 2(2): 26.
[12] Wang Dong, Gong Dachun, Tian yihong, et al. Study on the process of hydrolysis of wheat str aw lignocellulose by acid-enzymatic method[J]. Renewable Energy Resoures, 2008, 26(2): 50. 王 棟, 龔大春, 田毅紅, 等. 酸法-酶法處理麥稈木質纖維素的工藝研究[J]. 可再生能源, 2008, 26(2): 50.
[13] Sluiter A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass, in: Laboratory Analytical Procedure (LAP)[S]. National Renewable Energy Laboratory, 2008.
[14] Liu Gaomei, Ren Haiwei. Production of xylose from distiller’s grains(DG) by acid hydrolysis and the structural change of DG[J]. Food and Fermentation Industries, 2013, 39(3): 106. 劉高梅, 任海偉. 白酒丟糟酸水解制備木糖及其結構變化[J]. 食品與發酵工業, 2013, 39(3): 106.
[15] Li H, Abrar S, Msarwar J, et al. Hemicellulose Removal from Hardwood Chips in the Pre-Hydrolysis Step of the Kraft-Based Dissolving Pulp Production Process[J]. Journal of Wood Chemistry & Technology, 2010, 30(1): 48.
[16] Focher B, Palma M T, Canetti M, et al. Structural differences between non-wood plant celluloses: evidence from solid state NMR, vibrational spectroscopy and X-ray diffractometry[J]. Industrial Crops & Products, 2001, 13(3): 193.

(責任編輯:常 青)
Study on Xylose Dissolution from Wheat Straw in Sulfuric Acid Hydrolysis
MA Hao1JI Xing-xiang1,2,3,*TIAN Zhong-jian1,4FANG Gui-gan2CHEN Jia-chuan1YANG Gui-hua1
(1.KeyLabofPulpandPaperScience&Technology,MinistryofEducation,QiluUniversityofTechnology,Ji’nan,ShandongProvince, 250353; 2.InstituteofChemicalIndustryofForestryProducts,Nanjing,JiangsuProvince, 210042; 3.StateKeyLabofPulpandPaperEngineering,SouthChinaUniversityofTechnology,Guangzhou,GuangdongProvince, 510640; 4.GuangxiUniversity,Nanning,GuangxiZhuangAutonomousRegion, 530004)
(*E-mail: xxjt78@163.com)
The xylose dissolution of wheat straw in sulfuric acid hydrolysis were explored under different conditions, which demonstrated that when hydrolysis was carried out at 120℃ for 60 min, with sulfuric acid concentration of 4%, the xylose extraction efficiency of wheat straw reached the maximum amount of 0.20 g/g. Moreover, xylose dissolution process could be divided into three stages along with the increase of hydrolysis reaction strength. X-Ray Diffraction (XRD), Fourier Transform Infrared Spectroscopy (FT-IR) and Environmental Scanning Electron Microscopy (ESEM) analyses confirmed that sulfuric acid concentration and temperature were the main factors to damage wheat straw fiber crystallization area. When the xylose extraction efficiency was maximized, hemicellulose was almost completely degraded and dissolved.
wheat straw; acid hydrolysis; xylose
馬 浩先生,在讀碩士研究生;研究方向:制漿造紙綠色化學技術與生物質資源化利用。
2016- 10- 28(修改稿)
國家自然科學基金(31400511、31670590和31670595);山東省科技發展計劃(2014GNC113002)。
TS245.8;TQ353.6
A
10.11980/j.issn.0254- 508X.2017.04.007
*通信作者:吉興香,博士,教授;研究方向:制漿造紙綠色化學技術與生物質資源化利用。

