我國仿制藥一致性評價品種探析
丁錦希+劉瑩芳+鄭翠微+姚雪芳+吳逸飛

摘 要 仿制藥一致性評價作為提升仿制藥質量重要舉措,對促進醫藥產業升級、推進國家供給側改革、提高公眾健康福利有著重要意義。本文通過分析我國和日本評價品種范圍及分階段評價情況,并結合我國一致性評價實際推進情況,著重剖析我國一致性評價初期面臨的品種問題,在此基礎上,為我國一致性評價品種相關政策的完善提供建議。
關鍵詞 仿制藥一致性評價 評價品種 品種分類 分階段評價
中圖分類號:R954 文獻標識碼:C 文章編號:1006-1533(2017)07-0054-06
Analysis of the varieties of generics for quality consistency evaluation in China
DING Jinxi*, LIU Yingfang, ZHENG Cuiwei, YAO Xuefang, WU Yifei
(School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT Quality consistency evaluation of generics is an important initiative to improve drug quality in China and also plays a significant role in promoting the upgrading of the pharmaceutical industry, the national supply-side structural reform and the public health and welfare. The variety problems which will be faced in the initial stage of generics quality consistency evaluation were focused on by analysis of the variety scope and the phased evaluation status in China and Japan based on the actual advancement of consistency evaluation so as to to provide academic reference for perfecting policies related to generics quality consistency evaluation.
KEY WORDS generics quality consistency evaluation; evaluation object; drug classification; phased evaluation
我國仿制藥同劑型、同規格的藥品品種甚多,數十家甚者上百家企業在同一品種的狹小領域進行激烈的價格競爭。相關數據顯示,我國共有藥品生產企業5 029 家,此次仿制藥一致性評價工作幾乎牽涉到了68%以上的藥品生產企業[1]。目前,我國一致性評價仍處于起步階段,政策已初步明確劃定評價品種范圍,并給出了首批評價名單及評價時限。本文將基于我國一致性評價品種政策規定和實踐推進進度,理清我國一致性評價面臨的問題,并借鑒域外一致性評價經驗,從政策制定和企業實施層面為我國一致性評價的推進提供合理建議。
1 評價品種的內涵與意義
評價品種指的是仿制藥質量一致性評價所針對的評價對象。具體涉及兩方面內容:一方面,評價品種范圍問題,需確定已上市仿制藥需要開展一致性評價的品種類型及時間分界點;另一方面,一致性評價的品種選擇問題。具體選擇過程中存在兩對矛盾。
其一,品種與資源間的矛盾。我國仿制藥數量大、質量參差不齊,理應全數進行一致性評價,從而保證與原研藥間的可替代性。但無論從企業、還是審核機構的角度來看,時間及資金均屬有限,無法同時負擔所有品種的評價工作。因此,需要考慮評價品種的開展次序問題。
其二,成本與效益間的矛盾。對于企業而言,一致性評價意味著高額的評價成本以及多方面的風險成本,但與之相對的效益優勢尚未完全體現。在這樣的情況下,政府如何界定評價品種、以怎樣的標準進行品種分批,都將直接影響企業的品種選擇決策,繼而影響仿制藥產業的變革。
綜上,在一致性評價過程中厘清評價品種的問題至關重要。
2 日本品質再評價品種分析
日本在上世紀70年代曾批準大量仿制藥,以致市場上出現仿制藥品目繁多、質量參差不齊等現象。為了規制藥品市場,日本先后進行過3次仿制藥再評價。第3次再評價工程旨在通過溶出度評價手段提升仿制藥質量,同時建立每一品種的參比制劑多條特征溶出曲線以確保仿制藥質量在未來始終能處于較高水準,并能確保每批樣品質量均一穩定。本文選取與我國的仿制藥一致性評價工作最為類似的第3次藥品品質再評價工程為例,對其評價品種范圍進行說明。
2.1 評價品種范圍
日本于1998年7月啟動《藥品品質再評價工程》,確定采用溶出度試驗手段對已上市的口服固體制劑進行再評價。固體口服制劑之所以成為日本再評價工程的考察目標,是因為口服固體制劑給藥之后,藥物從制劑中的溶出、釋放直接影響著制劑的吸收[2],與進入體內無需崩解的口服液體制劑或注射液相比,其體外溶出度對療效具有較大影響。
日本再評價工程的評價品種范圍是1997年前獲批的處方藥,具體劑型包括片劑(糖衣片、薄膜衣片、素片)、腸溶片劑、緩控釋片劑、膠囊劑(包括硬膠囊與軟膠囊)、腸溶膠囊劑、緩控釋膠囊劑、細粒劑、散劑、腸溶散劑、顆粒劑、干混懸劑。例外情形包含:《日本藥典》中已收載溶出試驗項的品種、已規定溶出度試驗的品種(1995年后申報的仿制藥皆要求進行全面溶出比對研究)、非通過吸收發揮藥效的品種、無必要采取溶出度評價[3]。
2.2 分階段評價模式
由于口服固體制劑類別藥品眾多,開展評價難度較大,因此,厚生省選取“有效成分”作為分階段指標,自1997年2月起,每隔約3個月發布一份《再評價藥品有效成分范圍資料要求》(《醫療用醫薬品再評価に関し資料提出を必要とする有効成分等の範囲》)。《要求》中將明確列出該次納入再評價的有效成分清單,含有該有效成分的藥品均需開展再評價。具體信息如表1:
截至2012年1月,工作接近尾聲,并已取得顯著成效。根據上表內容,日本藥品品質再評價以有效成分為指標,共完成30次有效成分范圍確定,計636種有效成分。同時,厚生省發布36次再評價結果通知,共705種有效成分,1 361個制劑規格,共通過4 133個文號[5]。
綜上,日本一致性評價分階段推進的分批標準可歸納為“有效成分+劑型”。日本將同類有效成分同批審評并分批次推進,有利于評價工作的連貫性,同時也提高了再評價工作效率。
3 我國一致性評價品種現狀分析
3.1 評價品種范圍
我國自2012年首次提出“仿制藥質量一致性評價”這一概念以來,政府對于評價品種范圍的界定也在不斷發展,從模糊到明確。根據《國家食品藥品監督管理局關于開展仿制藥質量一致性評價工作的通知》(國食藥監注[2013]34號)(以下簡稱“34號文”),我國一致性評價品種范圍為:首先開展口服固體制劑的評價;其次開展注射劑的評價;最后開展其他劑型的評價。
我國首批仿制藥一致性評價工作的具體品種范圍為:2018年底前,國家基本藥物目錄(2012年版)中2007年10月1日前批準上市的化學藥品仿制藥口服固體制劑完成一致性評價。具體品種來源包括:國產仿制藥、進口仿制藥和原研藥品地產化品種[6]。
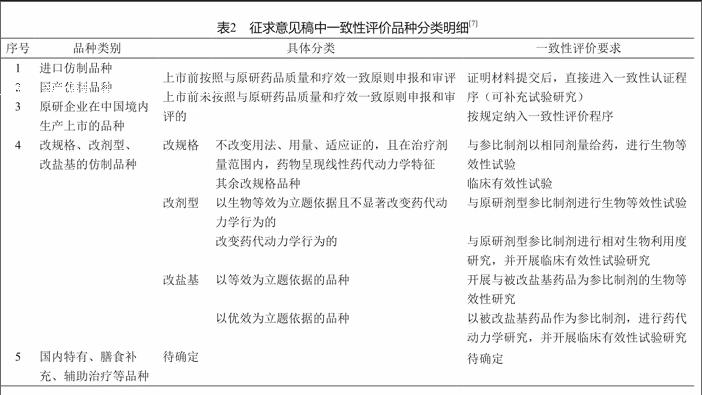
為進一步細化評價品種,CFDA于2016年11月29日組織起草了《仿制藥質量和療效一致性評價品種分類的指導意見(征求意見稿)》,列出五大類需要進行評價的藥品品種(表2)。
此外,我國相關政策對已達到國際水平的仿制藥予以“視同通過一致性評價”規定,即在評價品種范圍中將其剔除,包括:國內藥品生產企業已在歐盟、美國或日本獲準上市的仿制藥;在中國境內用同一條生產線生產上市并在歐盟、美國或日本獲準上市的藥品。此類“國際化”品種,經一致性評價辦公室審核批準視同通過一致性評價。
3.2 評價品種進度安排
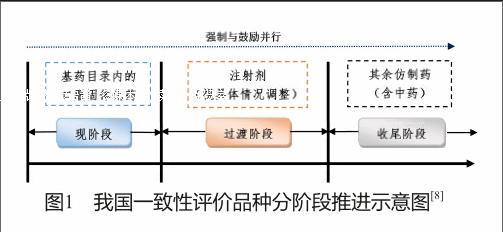
我國作為仿制藥大國,擁有的仿制藥批準文號數量極多,由此可見,開展仿制藥一致性評價所涉及的范圍極廣,難度極大,為保證評價工作的有序進行,分階段推進具有重要意義。根據34號文要求,我國仿制藥一致性評價“分階段實施”基本思路如圖1所示。
現階段,總局于2016年5月,發布關于落實《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》有關事項的公告(2016年第106號)(以下簡稱“106號文”)中正式提出首批納入評價的藥品品種及評價時限,“(二)凡2007年10月1日前批準上市的列入國家基本藥物目錄(2012年版)中的化學藥品仿制藥口服固體制劑,原則上應在2018年底前完成一致性評價”。
據統計,首批一致性評價藥品品種名單,共289種。該目錄的統計日期是截至2016年3月5日為止,統計范圍為2007年10月1日前批準的、且在有效期內的國產和進口口服固體基本藥物化學藥品。此次國家規定的首批評價品種所涉及的批準文號就有17 740個(包括17 636個國產批準文號和104個進口藥品注冊證),藥品涉及1 817家國內企業和42家進口企業[9]。
對于非“289目錄”口服固體制劑、注射劑和其他品種的一致性評價,目前尚未做出具體評價規定。但隨著評價工作的推進,對其余劑型及品種的一致性評價工作也將逐步開展。以中藥為例,現階段其品種同樣存在低水平仿制的現象[10],理應及早建立質量一致性評價體系,提高中藥品種總體質量標準。
綜上所述,我國分階段評價細分標準可歸納為“基本藥物+劑型”。從劑型角度講,口服固體制劑具有使用量大面廣的特點;從公眾利益角度講,我國從基藥入手可以直接把握住對普遍大眾影響最大的一部分藥品類別,即可首先保障基礎用量最大、供應量最具有保障的一部分藥品的可替代性,有利于提高公眾健康福利。
3.3 評價品種推進情況
參比制劑作為仿制藥一致性評價的關鍵要素,為了保障目錄品種能夠按時完成評價工作,CFDA啟動參比制劑備案與推薦程序。由于我國一致性評價仍處于起步階段,尚未有企業完成相關品種的評價,因此,本文將從參比制劑備案中的品種和企業情況,間接呈現評價工作推進情況。
3.3.1 備案品種數目
目前,根據中檢院對外公布的企業參比制劑備案最新信息,截至11月4日(國家最新發布日期),中檢院已經接到企業申報的仿制藥一致性評價備案共3 502件,其中屬于“289目錄”的品種有1 913件,非“289目錄”1 589件。289個基藥品種已備案227個[1]。
“289目錄”品種按照通用名計備案率已達79%,絕大多數要求品種已經得到企業回應,將在未來開展相關一致性評價工作。但是仍有約21%的基藥品種尚未有企業提出任何備案,可能是因為參比制劑查找困難,亦或該品種市場份額不大,企業還處于躊躇之中。與此同時,非“289目錄”品種備案件數占總備案件數約45%。該結果表明,企業非常看重非“289目錄”品種的長遠市場,積極布局,可能是因為非“289目錄”產品在市場中占據更大份額或更多利潤。
3.3.2 備案企業
目前,中檢院11月份公布的備案數據顯示,已有461家企業備案或申報(少數廠家名稱前后不一)。備案最多的企業是山東新華制藥股份有限公司,其次為石藥集團歐意藥業有限公司。根據政策規定,一致性評價辦公室在60個工作日內未提出異議的,企業即可開展相關工作研究。截至2017年2月,預計大部分企業在完成備案任務以后,已逐步開始實施仿制藥一致性評價的工作。
4 我國一致性評價品種面臨的問題
通過上述我國評價品種現狀分析,與日本相比,可以看出,我國一致性評價實踐進度與政策要求時限并不匹配,“289目錄”品種能否在2018年前全部完成一致性評價尚無十足把握。這一顯著的差異可能源于評價品種數量多,要求時限短,品種間差異大等多重因素。下文將基于評價品種從三方面對我國仿制藥一致性評價面臨的問題進行剖析。
4.1 品種數量多,時限短
我國首批一致性評價共289個品種,所涉及的批準文號17 740個。根據總局2016年8月發布的《關于2018年底前須仿制藥質量和療效完成一致性評價品種批準文號信息》[12],本文統計了不同品種所涉及批準文號數量(圖2),其中僅涉及1個批準文號的藥品為23個。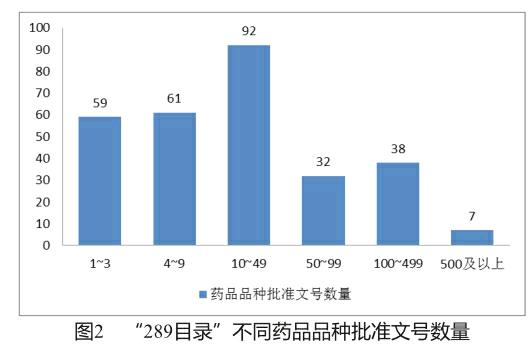
基于以上分析,“289目錄”中大部分品種所涉批準文號較多,其市場競爭也相應激烈。由此可見,首批開展仿制藥一致性評價所涉及的企業的范圍之廣,對一致性評價的開展造成了一定的難度。因此,品種數量多且時限短是我國仿制藥一致性評價工作的顯著問題。
此外,一些非“289目錄”品種,由于存在采購政策優惠情況,例如,同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方面不再選用未通過一致性評價的品種[13]。很多非“289目錄”品種由于和“289目錄”品種是替代產品,或者品種利潤較大,企業為搶占先機,也在積極備案、開展。
綜上,我國目前的分批標準和市場引導政策,使眾多企業、眾多品種均在首批評價期限內集中在一起評價,而時間有限,導致一致性評價通道擁擠。因此,使得短時間內資源和品種的矛盾加劇。
4.2 品種間差異大,推進情況不一
本文通過分析“289目錄”品種錄備案情況發現,部分藥品單品種待評價品種數量較多,也有一些品種備案數目較為冷清,目前,競爭最激烈的品種為阿莫西林膠囊、辛伐他汀片等,以阿莫西林膠囊為例,目前共有96條備案信息。然而,還有一些品種無人問津。截至2016年11月4日,仍有72個品種尚未完成備案,其中49個品種藥品尚不存在可替代品種,占未備案品種數的68%。究其原因,部分品種未備案可能歸因于以下幾種情況:
其一,企業在面臨高昂成本及緊迫時間的雙重壓力下,企業趨于選擇回報高的熱門品種;而小品種藥則由于患者需求及購買量較小,生產成本相對較高等特點被忽略,因此,部分企業考慮放棄邊緣藥品[14],保障自己收益與成本達到平衡。此外,企業基于“成本-效益”考量,一些非“289目錄”品種,已被納入一致性評價目標,爭先備案。
其二,部分品種一致性評價在實際操作中存在困難,例如麻醉藥品和精神藥品。此類產品屬于嚴格管制的藥品,從市場上購買參比制劑很難。此外,出于倫理考慮,該類藥品無法做生物等效性試驗,如含有嗎啡的制劑,選擇健康人作為受試者去服用嗎啡不符合國內相關要求。
其三,還有一部分品種是我國自研自創的藥品,包括有些復方制劑,以及含有中藥成分的產品。此類品種的參比制劑難以獲取,可能另需其他評價方法保障其藥品質量,如自研自創基藥品種可采取小規模的臨床有效性試驗,對其安全性與有效性進行再評價。
由此可見,我國仿制藥品種間差異較大,其推進情況亦大相徑庭,部分品種過度競爭,未備案品種如果被徹底放棄,2018年底大限到來后,將會從市場競爭中消失,其對應病種患者將失去用藥保障。同時,也會造成短時間內一致性評價通道過度擁擠,資源不足,而企業積極推進的這些品種是否符合臨床需求、醫保政策要求也需進一步確定。
4.3 分階段評價的劃分標準尚待完善
基于以上分析,我國仿制藥一致性評價分批標準可以歸納為“基本藥物+劑型”,日本則以“有效成分+劑型”為分批劃分標準。本文將對這兩者間的差異進行利弊比較分析(表3)。
根據上表,我國一致性評價目前的分階段劃分標準在藥品可及性方面,具有明顯優勢,但基本藥物僅為我國眾多仿制藥中極少的一部分,以此作為分批標準將面臨以下問題:
首先,基藥大部分利潤空間較小,但一致性評價投入卻極大,其收益與風險存在巨大反差,這可能造成企業放棄品種備案,不利于政策推進;其次,“基本藥物”是一種鋪開面較廣的指標,但往往會忽略我國現存的一些特殊但突出的問題,比如對嚴重疾病藥品質量的保障、對與原研藥間的質量或價格存在巨大差異的仿制藥可替代性保障,均考慮較少,不利于全面提高我國藥品可及性。由此可見,我國具體分批標準的制定仍面臨諸多影響因素,有待商榷。
5 我國一致性評價品種完善建議
根據前文分析,我國仿制藥一致性評價具體實施過程中難度較大,因此,本文從評價品種角度,分別從政策制定層面和企業實施層面,為我國仿制藥一致性評價進一步推進提出建議:
5.1 政策制定層面
5.1.1 對已公布評價品種進行再分類
基于我國仿制藥品種現狀,首批一致性評價面臨品種數量多,且品種間差異大,而導致推進情況不一的問題。因此,本文建議我國對已公布品種進行再分類,如對于醫保費用較高和市場容量比較大的品種,可從政策上鼓勵并從市場上引導企業盡快完成一致性評價。對于一些特殊類型的品種,如國內自研自創品種、麻醉藥品和精神藥品等,可采取其他評價方式對其進行評估。也可借鑒日本經驗,考慮是否可將“有效成分”作為評價品種的再分類標準。
5.1.2 結合國情,合理設置完成期限
根據前文研究,一致性評價面臨的期限壓力較大,一方面是短時間內完成的品種數量太多;另一方面是未通過一致性評價的品種在集中招標采購中可能不再被選用。若2018年前預定的一致性評價目標無法完成,優質藥品將出現臨床供應短缺的局面。因此,本文建議,在細分評價品種的同時,可根據實際操作難度,對不同品種給予合理的評價期限,制定分階段、分批評價品種推進方案。
5.2 企業實施層面
5.2.1 對自有品種開展一致性評價的成本-效益分析
企業作為仿制藥一致性評價主體,仿制藥一致性評價工作的開展將直接對企業的經營產生影響。企業在一致性評價品種選擇時,應對自有品種開展一致性評價的成本和市場效益進行科學測算,通過一致性評價開展成本-效益分析,就目標品種的立項可行性做出合理選擇。
5.2.2 充分了解市場,避免集中申報
一致性評價為企業帶來機遇的同時,也存在一定的風險,在一致性評價浪潮中,部分企業可能面臨經營方式重組。企業在品種選擇時,除了分析其成本和效益外,還應充分考慮一致性評價品種競爭風險,如目前阿莫西林膠囊已有96條備案信息,而政策規定,未來集中招標采購中,通過一致性評價的品種超過3家時,將不選用其余品種。因此,企業在品種選擇時應綜合考量風險范圍,充分了解市場,避免集中申報。
參考文獻
[1] 胡林峰, 虞忠. 仿制藥一致性評價的產業影響研究[J]. 中國醫藥工業雜志, 2016, 47(8): 1097-1101.
[2] 鄭潔, 陳玉文. 日本藥品品質再評價工程對我國仿制藥一致性評價的借鑒[J]. 中國藥業, 2014, 23(18): 6-7.
[3] 謝沐風. 謝沐風解讀《日本藥品品質再評價工程》官方報告[EB/OL]. (2016-07-26)[2017-03-13]. http://www. tongxieyi.com/xieyihui/?act=view&vID=1209.
[4] 再評價資料集. 再評價審查通知[EB/OL]. [2017-03-13]. http://www.fpmaj-saihyoka.com/quality/index.html.
[5] 四方田千佳子. ジェネリック醫薬品の品質と生物學的同等性試験ガイドラインにおける最近の動き[J]. Bull Natl Inst Health Sci, 2012(130): 1-12.
[6] 國家食品藥品監督管理總局. 關于落實《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》有關事項的公告(2016年第106號)[EB/OL]. (2016-05-26)[2017-02-27]. http://www.sda.gov.cn/WS01/CL0087/154042.html.
[7] 國家食品藥品監督管理總局. 總局辦公廳公開征求仿制藥質量和療效一致性評價品種分類的指導意見的意見[EB/OL]. (2016-11-29) [2017-03-05]. http://www.sda.gov.cn/ WS01/CL1757/166836.html.
[8] 國家食品藥品監督管理總局. 關于開展仿制藥質量一致性評價工作的通知(國食藥監注[2013]34號)[EB/OL].(2013-02-16)[2017-02-27]. http://www.sda.gov.cn/WS01/ CL0844/78516.html.
[9] 許琳. 中國-東盟共謀藥品合作發展新愿景[N]. 中國醫藥報, 2016-12-13(001).
[10] 徐亞靜. 中藥也應進行質量一致性評價[N]. 中國醫藥報, 2013-03-07(001).
[11] 中國食品藥品檢定研究院. 企業參比制劑備案情況的信息公開[EB/OL]. (2017-01-13) [2017-03-05]. http://www.nifdc. org.cn/fzy/CL0741/8953.html.
[12] 國家食品藥品監督管理總局. 關于2018年底前須仿制藥質量和療效完成一致性評價品種批準文號信息[EB/OL].(2017-08-17)[2017-03-06]. http://www.sda.gov.cn/WS01/ CL1757/163161.html.
[13] 國務院辦公廳. 國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見(國辦發〔2016〕8號)[EB/OL].(2016-02-06)[2017-03-13]. http://www.gov.cn/zhengce/ content/2016-03/05/content_5049364.htm.
[14] 張敏. 仿制藥一致性評價掀起行業供給側改革:50%藥品批文陷入“生死劫”[N]. 證券日報, 2016-05-30(C02).

