光電化學生物分析研究進展
阮弋帆 張楠 朱圓城 趙偉偉 徐靜娟 陳洪淵
(南京大學化學化工學院,生命分析化學國家重點實驗室,南京210023)
光電化學生物分析研究進展
阮弋帆 張楠 朱圓城 趙偉偉*徐靜娟*陳洪淵
(南京大學化學化工學院,生命分析化學國家重點實驗室,南京210023)
光電化學生物分析是近年來新出現并發展迅速的一種分析技術,其檢測原理是基于在光照下識別元件和目標分子之間的生物識別作用造成光電活性物質產生的電信號的改變,以實現對待測物的定量測定。由于其靈敏選擇性檢測的優點及其在生物分析中的巨大潛力,該方法吸引了較多的關注,并且在檢測性能和生物傳感應用等方面也取得了較大進步。本文針對光電化學生物分析中常見的四種應用領域,即直接光電化學檢測、光電化學酶檢測、光電化學核酸檢測以及光電化學免疫分析,綜述了近年來國內外在光電化學生物分析研究領域的最新進展,并對其未來發展進行了展望。
光電化學;生物分析;酶;核酸;免疫
1 引言
光電化學過程指光電活性物質在光照作用下經由電子激發及電荷轉移產生的光電轉換過程1-6。當一束能量大于或等于半導體帶隙(Eg)的光照射在半導體光電材料上時,電子(e-)受激發由價帶躍遷至導帶,并在價帶上產生空穴(h+);電子與空穴有效分離,一定條件下在電極上發生相應的電化學反應產生電信號。光電化學分析是近年建立起來的一種基于物質的光電轉換特性進行檢測的新型分析方法,它具有靈敏度高、設備簡單、易于微型化等特點。在光電化學檢測中,光作為激發源激發光電活性物質,而通過光激發所產生的電信號則作為檢測信號。由于光電化學過程的激發信號和檢測信號分屬于不同的能量形式,其傳感信號的背景將低于傳統的電化學方法,較低的信噪比將有利于檢測限的進一步降低。待測物與光電活性物質之間直接或間接的相互作用過程所產生的光電流(或光電壓)的變化數值與待測物濃度間的關系,是光電化學定量分析的基礎。光電化學生物分析則是將光電化學分析應用于生物分析領域;其基本原理是通過光電活性物質在光照條件下將檢測體系中發生的高特異性識別反應轉變為電信號的變化,以實現對待測物的定量測定7,8。目前的光電化學生物分析一般集中于電流型生物分析,也即將光電流數值變化作為檢測信號的光電化學生物傳感研究。而諸多生物大分子甚至細胞所具備的生物光電活性9-12,也使得光電化學檢測技術在生物分析領域具有廣闊的應用前景。本文針對光電化學生物分析中常見的四種應用領域即直接光電化學檢測,光電化學酶檢測,光電化學核酸檢測以及光電化學免疫分析進行了總結。

阮弋帆,1993年生。2015年本科畢業于南京大學化學化工學院,2015年至今就讀于南京大學化學化工學院分析化學專業。主要研究方向為光電化學生物傳感新方法與應用。

張楠,1992年生。2013年本科畢業于吉林大學化學院,2013年至今就讀于南京大學化學化工學院分析化學專業。主要研究方向為光電化學生物傳感新方法與應用。

朱圓城,1993年生。2014年本科畢業于南陽師范學院化學與制藥工程學院,2014年至今就讀于南京大學化學化工學院分析化學專業。主要研究方向為光電化學生物傳感新方法與應用。

趙偉偉,1983年生。2005年和2008年于南京航空航天大學分別獲得學士和碩士學位,2012年于南京大學獲理學博士學位并留校擔任助理研究員。2014年晉升副教授。現主持國家自然科學基金青年項目和面上項目、江蘇省自然科學基金等項目。主要研究方向:光電化學DNA傳感、光電免疫分析、生物催化及細胞相關檢測。

徐靜娟,1968年生。1990年獲武漢大學學士學位,1997、2000年獲南京大學碩士和博士學位。2000年起在南京大學化學系任教,2006年被聘為教授。主要研究方向:各類電化學、電致化學發光和光電化學納米傳感器、生物分析微流控芯片。

陳洪淵,1937年生。1961年畢業于南京大學化學系。現為南京大學教授,中國科學院院士(2001年當選)。主要研究方向:仿生催化、生物電化學、化學生物學、納米和超分子電化學、超微電極與生物分子電子器件、微全分析系統等。
2 光電化學生物分析系統
光電化學生物分析需要在光電檢測系統中實現。如圖1所示4,此系統主要包括激發光源、吸收池以及包含光電換能器(一般是光電活性物質構成的基底)作為工作電極的三電極電化學體系。在光激發條件下,光電活性材料的表面將發生電荷-空穴的分離與電荷轉移,進而在電極表面發生一定的氧化還原反應,并在外電路產生電流。這一過程產生的電信號及其變化由電化學裝置記錄并用于特定檢測對象的測定。在一個典型的光電化學檢測中,探針分子(例如特異性的抗原抗體)首先被固定于光電換能器表面作為識別原件,之后待測物在電極表面與探針分子間相互作用,導致光電流信號的增強或降低。光電化學生物分析即是通過特異性識別反應前后光電流的信號變化來實現定量檢測。
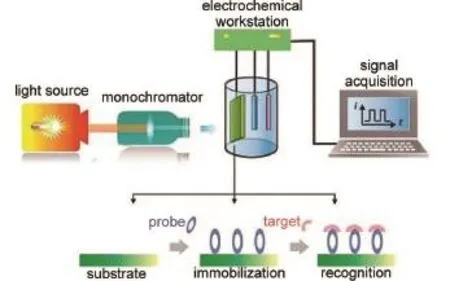
圖1 光電化學生物檢測機理示意圖Fig.1 Schematic of thegeneral instrumentation and working p rincipleof photoelectrochem ical(PEC) bioanalysisAdapted from Ref.4,Copyright?2016Royal Society ofChemistry.
以光電活性物質為主的光電換能器作為光電化學分析的核心部分,在檢測系統中起到信號發生作用。光電活性材料的選擇與生物分析的性能密切相關,理想的光電活性材料應該具有較低的電子空穴復合率,以便獲得穩定的光電流密度;目前常見的光電活性材料集中于各類無機、有機半導體及其復合材料13。例如,SnO2、TiO2和CdS等無機半導體納米材料通常被用于各種光電化學生物檢測中,而具有制備簡單、穩定性高、吸收譜范圍較寬、表面修飾的多樣化等特點的量子點(QDs)使用的尤其廣泛14-18;有機半導體材料同樣被用于光電化學生物分析,其中釕聯吡啶配合物由于其可見光吸收強、激發態穩定等特點使用較為廣泛3;復合半導體材料則作為兩種不同禁帶寬度的半導體復合物,其受激產生的電子和空穴能夠在兩種半導體材料之間發生快速的電荷轉移,從而有效阻止兩者之間的復合,使得光電轉換效率得到大幅度提高19。圖2表示了典型的半導體納米粒子光電流產生過程3。當半導體納米粒子吸收的光子能量高于其能帶間隙時,電子從價帶躍遷
至導帶,因此產生了電子空穴對(e--h+);這一過程通常伴隨電子-空穴的復合或電荷轉移。如存在有效的電子供體/受體時,電子-空穴的復合將被抑制,使得電荷得以快速轉移從而產生穩定的陽極或陰極光電流。
3 光電化學生物分析應用
3.1 直接光電化學檢測
直接光電化學檢測不借助于酶或其他物質的輔助,而是將待檢測物質直接作為電子供體/受體參與電極表面的光電化學反應來實現檢測。當電解質溶液中存在適當的電子供體/受體時,光電活性物質自身的電子-空穴復合過程被減弱,使得電荷轉移能夠持續穩定地發生,表觀上將使得光電流信號相對于溶液中不存在待測物質時增強。該方法簡單方便,常被用于生物體系中大量存在且具有重要研究意義的生物分子檢測,如煙酰胺腺嘌呤二核苷酸(NADH)、半胱氨酸、谷胱甘肽、葡萄糖和抗壞血酸等;這些待測分子在特定的光電極上能夠發生氧化還原反應產生電信號,從而實現檢測。但是,因為僅僅依賴于直接氧化還原過程,這種方法通常對目標分子的響應特異性較差。
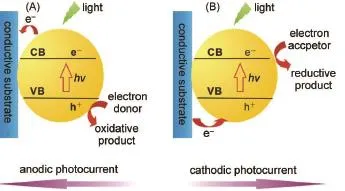
圖2 典型的無機半導體材料的陽極(A)和陰極(B)光電流產生機理示意圖Fig.2 Anodic(A)and cathodic(B)photocurrent generationmechanism of inorganic sem iconductor in connection with electrodesCB:conduction band;VB:valenceband.Adapted from Ref.3,Copyright?2014 American Chem ical Society.
如圖3所示,徐靜娟課題組20利用多巴胺敏化TiO2膜,增強了該基底在可見光區域的信號響應,該工作對NADH實現了檢測限為1.4×10-7mol·L-1的靈敏檢測。戴宏課題組21通過構建p-n節結構敏化g-C3N4基底實現了對于膽堿的檢測。沈清明課題組22通過對CdS量子點敏化的Au-SnO2納米結構實現了對于半胱氨酸的信號響應。鄭耿峰課題組23利用氯高鐵血紅素(hem in)敏化構建IrO2-hem in-TiO2NWs array(納米線陣列)復合結構,實現了對谷胱甘肽的靈敏檢測,檢測限達200 nmol·L-1。宋宏偉課題組24構建了類似的CdS/CuO基底實現了對于葡萄糖的檢測。張躍課題組25,26分別利用Cu2O/ZnO NRsarray(納米管陣列)及CdS/RGO(還原型氧化石墨烯)/ZnO NWs array(納米線陣列)實現了對于谷胱甘肽的響應。上述的工作通過半導體材料的敏化,使兩種或多種半導體材料之間的復合,使得材料對于待測物質的響應更加靈敏,降低了傳感器的檢測限。而針對使用的電極基底材料進行結構修飾,也可以在敏化基底的基礎上通過位阻或吸附特性等其他物理性質增加檢測設計的選擇性。如圖4所示,匡勤和孔祥建課題組27構筑的在ZnO NRs array外包裹ZIF-8MOFs(金屬有機框架材料)的納米異質結構,利用充當電子供體的待測物的分子尺寸不同,實現了對于H2O2和抗壞血酸(AA)的檢測,并同時將其運用于血漿檢測。
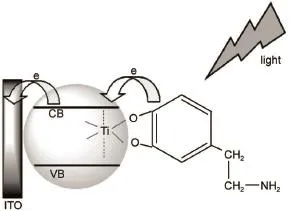
圖3 ITO電極上多巴胺敏化TiO2光電化學檢測NADH示意圖Fig.3 Schematic illustration of PEC sensing ofNADH via dopam ine sensitized TiO2on the ITO electrodeNADH:dihydronicotinam ide adenine dinucleotide,ITO:indium tinoxide.Adapted from Ref.20,Copyright?2016 Elsevier B.V. All rights reserved.
總的來說,直接光電化學生物分析簡單地將待測物質作為電子供體/受體在材料表面與光生空穴/電子發生光電化學反應,進而利用所產生光電流實現定量分析。這種檢測機制可以作為對于一類特定生物分子的檢測手段,也為更為復雜的檢測體系奠定了基礎。
3.2 光電化學酶檢測
利用酶作為催化劑,光電化學酶催化檢測具有對待測物的高特異性。該方法的一種常見模式是依賴酶催化反應過程中的底物或產物作為電子供體/受體;另一種模式則基于酶催化反應中酶與光電活性材料兩者間的直接或間接電荷轉移來產生光電流。

圖4 ZnO@ZIF-8納米棒陣列對H2O2和AA的光電化學檢測機理示意圖Fig.4 Schematic illustration of ZnO@ZIF-8 nanorodsand PEC detection of H2O2and ascorbic acid(AA)FTO:fluorine-doped tinoxide.Adapted from Ref.27,Copyright?2013American Chemical Society.
Willner課題組28最早將酶傳感機制引入光電化學生物分析體系,通過將乙酰膽堿酯酶(AChE)以酰胺鍵的形式固定于CdS量子點表面,特異性催化硫代乙酰膽堿反應產生電子供體,使得光電流強度相對在未經催化時有較大的提升,從而實現了對AChE酶活性及其抑制劑的分析。如圖5所示,Tanne等29則使用O2同時作為CdSe/ZnS量子點的電子受體以及葡萄糖氧化酶(GOD,glucose oxidaseenzyme)催化反應的底物之一,利用兩者對O2的競爭實現了對葡萄糖的檢測。如圖6所示,陳洪淵課題組30利用堿性磷酸酶(ALP,alkaline phosphatase)將抗壞血酸磷酸鹽氧化為抗壞血酸,后者能夠同時敏化TiO2基底導致光電流的增強,該方法被成功應用于酶抑制劑的檢測。Choi課題組31通過引入葡萄糖氧化酶,借助酶催化反應和輔酶FAD+/FADH2,將葡萄糖氧化反應在graphene-WO3-Au(石墨烯-氧化鎢-金納米粒子)復合電極材料上最終轉移為H2O2/O2(或H2O/O2)的反應,實現了對于葡萄糖在0.5-7mmol·L-1濃度區間的檢測。鞠熀先課題組32利用乳酸鹽脫氫酶(LDH)修飾于TiONT-PANI-GNP(二氧化鈦納米管-聚苯胺-金納米粒子)復合電極,經由輔酶NAD+/NADH實現了對于L-乳酸鹽的檢測,檢測范圍為0.5-210 μmol·L-1,檢測限達到0.15μmol·L-1。
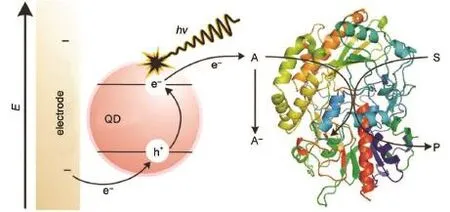
圖5 基于葡萄糖氧化酶催化的光電生物檢測機理示意圖Fig.5 Schem atic of PEC detection based on the use of glucose oxidase enzymeQD:quantum dot;A:acceptor;S:substrate;P:product.Adapted from Ref.29,Copyright?2011American Chem ical Society.
酶與光電活性基底進行電子交換的檢測模式也被廣泛運用。一些含有亞鐵血紅素(heme)的酶,其活性中心能夠與電極進行直接電子交換,可以通過將其直接固定于光電極上來開發酶傳感器。鄭耿峰課題組33通過將辣根過氧化物酶(HRP)固定在二氧化鈦納米線陣列上,現了對于過氧化氫的特異性檢測,并且進一步通過檢測過氧化氫濃度評定了細胞的代謝水平。其檢測過氧化氫的最低濃度達7.7 nmol·L-1,并通過一系列可以分辨的實時刺激-信號產生曲線,獲得了在受到外源刺激下細胞產生過氧化氫濃度的不同變化趨勢,實現對于幾種細胞類型的分辨。HRP屬于酶活性中心相對暴露的類型,因此檢測中不需要借助其他的介質來完成電子轉移。但是,大部分的酶的活性中心通常都深埋于酶蛋白質結構的內部,導致其與外界進行電子傳輸的速率較低,使得通常情況下酶活性中心很難與電極直接進行電子交換。在這種情況下,可借助外界的電子媒介體在酶活性中心與光電極之間傳遞電子,間接地完成這一電子交換過程。Willner課題組34借助[Ru(bpy)3]2+作為固定在酶附近的電子媒介體,在光照條件下作為GOD與金電極之間電子傳遞的橋梁,實現了對葡萄糖的檢測;劉紹琴課題組35則在GOD與CdSe@CdS敏化的TiO2電極之間以([Co(Phen)3]2+/3+作為電子媒介體參與電子轉移,同樣實現了葡萄糖的檢測。
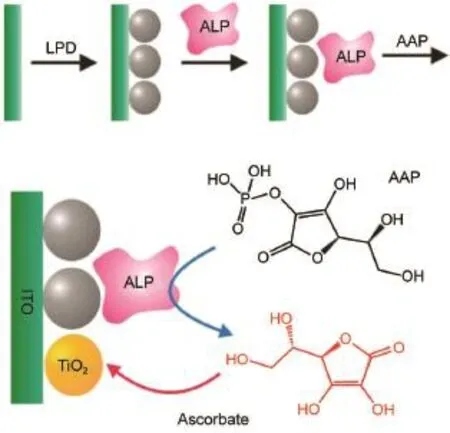
圖6 基于ALP酶催化的光電化學生物檢測示意圖Fig.6 Schematic representation of PEC bioanalysisbased on theALPcatalysisALP:alkaline phosphatase;AAP:ascorbic acid 2-phosphate; LPD:liquid phase deposition.Adapted from Ref.30, Copyright?2013American ChemicalSociety.
基于酶催化的光電化學生物檢測解決了直接檢測的特異性問題,但這種基于特異性酶催化反應的檢測過程的適用范圍依然較窄,一般只能針對一些特定的小分子開發相應的傳感體系。此外,部分酶催化過程需要相應的輔酶分子或媒介分子,這在一定程度上增加了整個檢測體系的復雜程度,對于研究實際體系較為不利。但不可否認的是,酶的引入使光電流信號得以有效放大,顯著增加了檢測的靈敏度和特異性。
3.3 光電化學核酸檢測
核酸(nucleic acid)是核苷酸聚合成的生物大分子化合物,其中運用較為廣泛的是脫氧核糖核酸(DNA),其具有獨特的A-T和C-G堿基配對原則,可以通過鏈雜交反應實現對于核酸鏈的特異性檢測;同時部分經體外篩選得到的寡核苷酸序列作為適配體(aptamer),能與相應的配體(特異性蛋白或離子)進行高親和力和強特異性的結合,實現對于特定生物分子或離子的檢測。基于DNA或適配體的特異性識別能力,一系列的光電化學生物傳感方法被開發出來3,36-41。
周玉祥課題組42首先通過在雙鏈DNA(dsDNA)中嵌入Ru(bpy)2(dppz)2+,實現對dsDNA的定量檢測。唐波課題組43通過DNA雜化形成雙鏈后,利用DNA雜交進行雙鏈增長,再將[(ppy)2Ir(dppz)]+PF6-作為嵌入物嵌入雙鏈溝壑,實現光電信號的放大和目標DNA的靈敏檢測,線性范圍為0.025-100 pmol·L-1,檢測限達9.0 fmol·L-1。同樣利用Ru(bpy)2(dppz)2+,張書圣課題組44通過引入磁珠分離的競爭方法實現對于ATP的檢測,檢測限達到3.2 nmol·L-1。郭良宏課題組45則利用Ru(bpy)2(dppz)2+實現了對于外源性DNA甲基化損傷的檢測與修復。該工作在使用DNA修復酶對具有甲基化腺嘌呤的dsDNA進行修復后去除了其甲基化基團,使得具有光電響應活性的Ru化合物能嵌入雙鏈結構,通過作為嵌入劑的Ru化合物定量地標定產生的光電流大小。不同于直接嵌入具有光電化學活性的信號分子,鞠熀先課題組46選擇替代光源的化學發光化合物作為嵌入分子。嵌入dsDNA的FeTMPyP作為化學發光物質提供光電檢測體系所需的光照條件,借由光照強度與光電流正相關的原則,成功構筑了化學發光-光電化學檢測系統。
Willner課題組47通過將適配體標記具有光電活性的CdS量子點,使得識別反應前后光電流信號從無到有,實現了對可卡因的特異性檢測。胡成國課題組48在基底探針捕獲目標DNA的基礎上,再利用一條標記有全碳基結構光電活性物質的互補鏈與被捕獲的目標DNA分子末端尚未互補配對的部分相結合,實現了在同一片電極的不同檢測區域對于多種待檢測DNA分子的檢測。郭良宏課題組49嘗試在8-oxodGuo損傷的雙鏈DNA的受損部分共價性連接上標記有生物素(biotin)的精氨酸衍生物,而標記有鏈霉親和素(streptavidin)的Ru化合物則通過生物素-親和素(biotin-avidin)特異性親和,使得光電活性物質標記在受損的dsDNA上。修復后的dsDNA失去光電活性物質的標記,從而實現對于DNA損傷程度和修復效果的定量分析。朱俊杰課題組50通過分別位于基底和DNA標記末端的具備光電活性的半導體或染料分子之間的復合作用,增強原有的光電流信號,實現了對特定序列DNA的檢測。
借助量子點與貴金屬納米粒子之間的能量共振轉移(ET)或激子-等離子體相互作用,可以高效抑制量子點的光電轉換,利用此現象可以開發新穎的光電化學生物分析模式。如圖7所示,陳洪淵課題組51通過在互補DNA單鏈的末端修飾Au納米粒子,利用CdS量子點與其之間的能量轉移過程實現了對目標DNA的檢測,檢測限達2.0 fmol· L-1。利用量子點及Au納米粒子間距離的關系,該課題組隨后實現了對于TATA序列特異性結合蛋白(TBP)的信號放大檢測52。如圖8所示,TBP蛋白與dsDNA的結合會導致粒子間間距的變化,導致光電流的變化,從而實現對目標蛋白TBP的檢測,檢測限達到了0.05 pg·m L-1。類似地,該課題組還報道了對于DNA53及凝血酶54的檢測。戴志暉課題組55則在以癌胚抗原作為模型分子進行檢測時引入競爭機制,通過適配體競爭結合的方式定量地確定溶液中目標蛋白的含量,從而實現高靈敏的生物分析。雷建平課題組56使用Pb2+的適配體形成G-四聯體(G-Quadruplex),實現了基于能量轉移過程的信號放大光電化學Pb2+檢測。朱俊杰課題組57利用T-Hg2+-T的特異性結合作用,使得原本被互補鏈上Au納米粒子的激子能量轉移猝滅的染料分子靠近并敏化光電活性基底,實現對于Hg2+的檢測。

圖7 基于能量轉移過程的光電化學DNA檢測示意圖Fig.7 Schem atic diagram of the energy transfer-based PEC system for DNA detectionEDC:1-ethyl-3-[3-dimethylaminopropyl]carbodiimidehydrochloride;NHS:N-hydroxysuccinimide;MEA:mono ethanolamine.Adapted from Ref.51,Copyright2016?RoyalSociety of Chemistry.
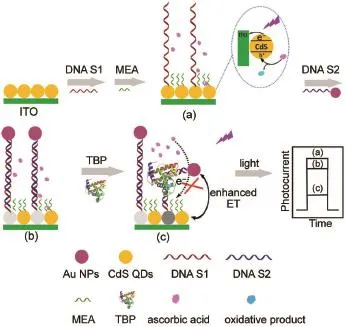
圖8 基于能量轉移效應信號放大的光電化學TBP生物傳感Fig.8 Schematicsof theenergy transfer-based PEC TBP(TATA binding protein)biosensingAdapted from Ref.52,Copyright?2016 American Chem ical Society.
酶聯信號放大也被應用于光電化學核酸檢測。鞠熀先課題組58利用DNA雜交及MboI酶切割光電極上的探針DNA,未被切割的探針DNA通過末端修飾的生物素連接親和素修飾的HRP,競爭消耗作為電子受體的H2O2,實現了目標DNA的檢測。朱俊杰課題組59的工作則利用DNA鏈末端修飾酶產生電子供體實現檢測信號的放大。該工作在已經捕獲的待測物DNA鏈上通過TdTase(末端脫氧核酸轉移酶)催化擴增連接上經過生物素修飾的dUTP堿基,進而利用biotin-avadin反應連接親和素修飾的ALP酶產生抗壞血酸作為電子供體,實現了對待測DNA分子的檢測。王光麗課題組60則通過形成G-四聯體結構包裹hem in酶進行催化,產生光誘導電子轉移效應,使得體系的光電效率提升,并以此為基礎實現了對特定DNA以及凝血酶的檢測。
從基于核酸的光電化學生物檢測體系的構建來看,通過嵌入或標記的形式引入信號分子來影響光電流的變化,可以實現放大特異性識別反應造成的信號放大;通過借助各類核酸酶改變核酸鏈的長度、末端堿基修飾以及對特定序列進行循環切割或延伸,也可以實現對檢測信號的高效放大。核酸本身的結構、性質及豐富的修飾可能性,拓展了基于核酸構建的光電化學分析體系的構建和應用領域,使之成為光電化學生物分析的重要組成部分61-66。
3.4 光電化學免疫分析
抗體與抗原作為一對特異性結合的分子,能夠實現相互間的特異性識別。基于抗原-抗體特異性結合的光電化學免疫分析也迅速發展。按照標記與否,光電化學免疫分析體系可以分為無標記和標記型兩種類型。
無標記的光電免疫分析體系通常僅利用抗原-抗體結合時產生的位阻效應,結構相對簡單。例如,徐靜娟課題組67設計的基于位阻效應的光電化學免疫傳感器即實現了對于小鼠免疫球蛋白G (mouse IgG)的特異性檢測。如圖9所示,當目標抗原被俘獲到固定有抗體的電極基底上時,電極表面的位阻效應增大,阻礙了電子供體向電極的擴散,造成光電流信號下降,從而實現對目標抗原的定量檢測。其他的無標記光電免疫傳感器也與該工作類似,在不引入其他信號放大機制的前提下單純利用免疫相互作用實現對于待測抗原或抗體的檢測。

圖9 小鼠IgG抗原無標記光電化學檢測示意圖Fig.9 Schematicsof the label-free PEC immunosensor for mouse IgG detectionPDDA:poly dially ldimethylammonium chloride;TGA:thioglycollic acid;BSA:bovine serum albumin.Adapted from Ref.67,Copyright?2009American ChemicalSociety.
標記型免疫分析體系由于可以修飾更多的信號放大基團而被更為廣泛地運用。基于酶催化信號放大,陳洪淵課題組開發了一系列該類型的光電化學免疫分析體系。如圖10所示,該課題組通過引入酶催化沉積作用產生沉淀阻礙電子供體的傳輸來抑制光電流信號68;或者通過標記酶來催化電解質溶液中的底物產生相應的電子供體增強光電流信號69-73。這兩種檢測模式都在一定程度上放大了檢測信號,提高了光電化學免疫分析的性能。在此基礎上,該課題組還建立了一種將信號放大與檢測分離的新型免疫傳感模式,實現了對HIV-1 p24蛋白的免疫檢測74。朱俊杰課題組75對于α-胎蛋白的標記型光電化學免疫分析通過其合成的AFP-CdTe-GOD生物復合結構實現。利用競爭結合機理,該工作實現了對于待測抗原間接的雙重信號放大檢測。同時,該課題組通過三明治免疫反應,在二抗上修飾SiO2納米粒子,進一步增大了結構的位阻,使得信號的下降更為明顯76。此外,戴志暉課題組77通過在基底上固定一定量的CEA抗原分子,利用競爭反應測定溶液中的抗原含量。基于相似的原理,魏琴課題組78利用修飾包被有Cd2+的TiO2納米粒子實現了對于抗體標記,通過加入S2-將Cd2+轉化為CdS與基底復合產生更強的光電流,實現了對于溶液中地塞米松的檢測。
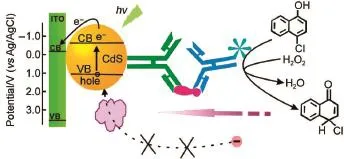
圖10 HRP標記催化沉積的光電化學免疫檢測示意圖Fig.10 Schemeof theam plified QD-Based sandw ich PEC immunoassay w ith HRP-catalyzed BCPHRP:horse radish peroxidase;BCP:biocatalytic deposition.Adaptedfrom Ref.68,Copyright?2011American Chemical Society.
相較無標記的檢測模式,標記型的信號放大機制在一定程度上使得免疫檢測的檢測限降低;同時競爭型的免疫設計也使得簡單的抗原-抗體結構能夠實現信號放大。但由于免疫結構相較核酸體系更為簡單的特點,目前針對光電化學免疫分析的著眼點更多地放在了信號放大方法的改進以及新機制的引入上;一些新穎的體系也使得光電化學免疫分析的方式更為多樣化79-83。
4 結語
光電生物分析系統的高靈敏性及其豐富的信號放大機制,已經在生物分析領域引起了廣泛關注。近年來,其研究范圍從簡單的生物小分子,迅速拓展到酶傳感、核酸檢測、免疫分析及細胞相關檢測等領域84,其傳感模式也不斷創新。目前,光電化學生物分析的發展趨勢包含如下幾個方面:(1)新型光電活性材料的運用。納米技術及材料科學的發展為光電化學生物分析的材料選擇提供了新的機遇。選擇具備更低電子空穴復合率、更高光電轉化率的光電活性材料可以獲得更穩定的檢測信號。(2)新生物分析體系的構建。各類探針分子(如affibodies,nanobodies以及anticalins等)、細胞及組織的引入,為開發各類新穎光電化學生物分析體系提供了可能,更進一步拓寬了其應用范圍。(3)生物分子與半導體納米的材料的結合。各類生物分子-半導體納米材料的巧妙結合將進一步促進電子轉移過程,提高信號傳導效率,從而使得光電化學生物分析傳感具有更好的性能。(4)檢測系統的微型化、陣列化、便攜化。微流控、紙芯片、化學發光等技術的引入85-88使光電化學生物分析的檢測速度及自動化程度的提高,陣列化設計在提供多通道檢測的同時更會進一步降低檢測成本。(5)單細胞及更小尺度的檢測。光電化學生物分析技術與電化學掃描顯微鏡等其它技術的結合89,90,有望在單細胞甚至單分子層面上實現對待測物精準測量,并進一步將此技術拓展到活體檢測領域。伴隨著近年來的納米科技的快速發展,檢測技術的不斷提高和相關研究的不斷深入,我們相信光電化學生物分析將會在未來的臨床診斷、環境監測、食品安全和醫藥研究等諸多領域發揮出更加重要的作用。
(2)Hagfeldt,A.;Boschloo,G.;Sun,L.;K loo,L.;Pettersson,H. Chem.Rev.2010,110(11),6595.doi:10.1021/cr900356p
(3)Zhao,W.W.;Xu,J.J.;Chen,H.Y.Chem.Rev.2014,114(15), 7421.doi:10.1021/cr500100j
(4)Zhao,W.W.;Xu,J.J.;Chen,H.Y.Chem.Soc.Rev.2015,44 (3),729.doi:10.1039/C4CS00228H
(5)Zhao,W.W.;Xiong,M.;Li,X.R.;Xu,J.J.;Chen,H.Y. Electrochem.Commun.2014,38,40.doi:10.1016/j. elecom.2013.10.035
(6)Zhao,W.W.;Wang,J.;Zhu,Y.C.;Xu,J.J.;Chen,H.Y.Anal. Chem.2015,87(19),9520.doi:10.1021/acs.analchem.5b00497
(7)Peng,F.;Zhu,D.R.;Si,S.H.;Xiao,H.Prog.Chem.2008,20 (4),586.[彭芳,朱德榮,司士輝,肖輝.化學進展,2008, 20(4),586.]doi:1005-281X(2008)04-0586-08
(8)Zhao,W.W.;Ma,Z.Y.;Xu,J.J.;Chen,H.Y.Chin.Sci.Bull. 2014,59(2),122.[趙偉偉,馬征遠,徐靜娟,陳洪淵.科學通報,2014,59(2),122.]doi:10.1360/972013-446
(9)Zhang,C.Y.;Feng,J.;Ci,Y.X.;Lang,A.D.;Huang,C.H. Bioelectrochem.Bioenerg.1998,46(1),145.doi:10.1016/ S0302-4598(98)00128-7
(10)Qingwen,L.;Guoan,L.;Jun,F.;Dawen,C.;Qi,O.Analyst 2000,125(11),1908.doi:10.1039/B006699K
(11)Ci,Y.X.;Zhang,C.Y.;Feng,J.Bioelectrochem.Bioenerg. 1998,45(2),247.doi:10.1016/S0302-4598(98)00097-X
(12)Feng,J.;Zhang,C.Y.;Ottova,A.L.;Tien,H.T. Bioelectrochemistry 2000,51(2),187.doi:10.1016/S0302-4598 (00)00071-4
(13)Zhang,X.;Guo,Y.;Liu,M.;Zhang,S.RSC Adv.2013,3(9), 2846.doi:10.1039/C2RA22238H
(14)Zhou,H.;Liu,J.;Zhang,S.Trends Anal.Chem.2015,67,56. doi:10.1016/j.trac.2014.12.007
(15)Yue,Z.;Lisdat,F.;Parak,W.J.;Hickey,S.G.;Tu,L.;Sabir,N.; Dorfs,D.;Bigall,N.C.ACSAppl.Mat.Interfaces2013,5(8), 2800.doi:10.1021/am3028662
(16)Freeman,R.;Girsh,J.;W illner,B.;W illner,I.Isr.J.Chem. 2012,52(11-12),1125.doi:10.1002/ijch.201200079
(17)Gill,R.;Zayats,M.;W illner,I.Angew.Chem.Int.Ed.2008,47 (40),7602.doi:10.1002/anie.200800169
(18)Katz,E.;Willner,I.;Wang,J.Electroanalysis2004,16(1-2), 19.doi:10.1002/elan.200302930
(19)Wang,G.L.;Xu,J.J.;Chen,H.Y.;Fu,S.Z.Biosens. Bioelectron.2009,25(4),791.doi:10.1016/j.bios.2009.08.027
(20)Wang,G.L.;Xu,J.J.;Chen,H.Y.Biosens.Bioelectron.2009, 24(8),2494.doi:10.1016/j.bios.2008.12.031
(21)Dai,H.;Zhang,S.;Xu,G.;Peng,Y.;Gong,L.;Li,X.;Li,Y.; Lin,Y.;Chen,G.RSCAdv.2014,4(102),58226.doi:10.1039/ c4ra09841b
(22)Shen,Q.;Jiang,J.;Liu,S.;Han,L.;Fan,X.;Fan,M.;Fan,Q.; Wang,L.;Huang,W.Nanoscale 2014,6(12),6315. doi:10.1039/C4NR00520A
(23)Tang,J.;Kong,B.;Wang,Y.;Xu,M.;Wang,Y.;Wu,H.;Zheng, G.Nano Lett.2013,13(11),5350.doi:10.1021/nl4028507
(24)Xia,L.;Xu,L.;Song,J.;Xu,R.;Liu,D.;Dong,B.;Song,H. Sci.Rep.2015,5,10838.doi:10.1038/srep10838
(25)Kang,Z.;Yan,X.;Wang,Y.;Bai,Z.;Liu,Y.;Zhang,Z.;Lin,P.; Zhang,X.;Yuan,H.;Zhang,X.;Zhang,Y.Sci.Rep.2015,5, 7882.doi:10.1038/srep07882
(26)Zhao,K.;Yan,X.;Gu,Y.;Kang,Z.;Bai,Z.;Cao,S.;Liu,Y.; Zhang,X.;Zhang,Y.Small2016,12(2),245.doi:10.1002/ sm ll.201502042
(27)Zhan,W.W.;Kuang,Q.;Zhou,J.Z.;Kong,X.J.;Xie,Z.X.; Zheng,L.S.J.Am.Chem.Soc.2013,135(5),1926. doi:10.1021/ja311085e
(28)Pardo-Yissar,V.;Katz,E.;Wasserman,J.;W illner,I.J.Am. Chem.Soc.2003,125(3),622.doi:10.1021/ja028922k
(29)Tanne,J.;Sch?fer,D.;Khalid,W.;Parak,W.J.;Lisdat,F.Anal. Chem.2011,83(20),7778.doi:10.1021/ac201329u
(30)Zhao,W.W.;Ma,Z.Y.;Xu,J.J.;Chen,H.Y.Anal.Chem.2013, 85(18),8503.doi:10.1021/ac402523p
(31)Devadoss,A.;Sudhagar,P.;Das,S.;Lee,S.Y.;Terashima,C.; Nakata,K.;Fujishima,A.;Choi,W.;Kang,Y.S.;Paik,U.ACS Appl.Mat.Interfaces2014,6(7),4864.doi:10.1021/ am4058925
(32)Zhu,J.;Huo,X.;Liu,X.;Ju,H.ACSAppl.Mat.Interfaces 2016,8(1),341.doi:10.1021/acsami.5b08837
(33)Wang,Y.;Tang,J.;Zhou,T.;Da,P.;Li,J.;Kong,B.;Yang,Z.; Zheng,G.Small2014,10(23),4967.doi:10.1002/ sm ll.201401059
(34)Tel-Vered,R.;Yildiz,H.B.;Yan,Y.M.;W illner,I.Small2010, 6(15),1593.doi:10.1002/sm ll.201000296
(35)Zheng,M.;Cui,Y.;Li,X.;Liu,S.;Tang,Z.J.Electroanal. Chem.2011,656(1-2),167.doi:10.1016/j. jelechem.2010.11.036
(36)Tel-Vered,R.;Kahn,J.S.;Willner,I.Small2016,12(1),51. doi:10.1002/sm ll.201501367
(37)Chao,J.;Zhu,D.;Zhang,Y.;Wang,L.;Fan,C.Biosens. Bioelectron.2016,76,68.doi:10.1016/j.bios.2015.07.007
(38)Freeman,R.;Girsh,J.;W illner,I.ACSAppl.Mat.Interfaces 2013,5(8),2815.doi:10.1021/am303189h
(39)Willner,I.;Patolsky,F.;Wasserman,J.Angew.Chem.Int.Ed. 2001,40(10),1861.doi:10.1021/ja028922k
(40)Xu,J.P.;Weizmann,Y.;Krikhely,N.;Baron,R.;Willner,I. Small2006,2(10),1178.doi:10.1002/sm ll.200600200
(41)Chen,Q.L.;Zhou,J.Z.;Liang,J.L.;Lin,L.L.Acta Phys.-Chim.Sin.2008,24(5),749.[陳巧琳,周劍章,梁金玲,林玲玲,林仲華.物理化學學報,2008,24(5),749.] doi:10.3866/PKU.WHXB20080503
(42)Liu,S.;Li,C.;Cheng,J.;Zhou,Y.Anal.Chem.2006,78(13), 4722.doi:10.1021/ac052022f
(43)Li,C.;Wang,H.;Shen,J.;Tang,B.Anal.Chem.2015,87(8), 4283.doi:10.1021/ac5047032
(44)Zhang,X.;Zhao,Y.;Li,S.;Zhang,S.Chem.Commun.2010,46 (48),9173.doi:10.1039/C0CC03595E
(45)Wu,Y.;Zhang,B.;Guo,L.H.Anal.Chem.2013,85(14),6908. doi:10.1021/ac401346x
(46)Zang,Y.;Lei,J.;Ling,P.;Ju,H.Anal.Chem.2015,87(10), 5430.doi:10.1021/acs.analchem.5b00888
(47)Golub,E.;Pelossof,G.;Freeman,R.;Zhang,H.;Willner,I. Anal.Chem.2009,81(22),9291.doi:10.1021/ac901551q
(48)Wang,J.;Liu,Z.;Hu,C.;Hu,S.Anal.Chem.2015,87(18), 9368.doi:10.1021/acs.analchem.5b02148
(49)Zhang,B.;Guo,L.H.;Greenberg,M.M.Anal.Chem.2012,84 (14),6048.doi:10.1021/ac300866u
(50)Fan,G.C.;Han,L.;Zhang,J.R.;Zhu,J.J.Anal.Chem.2014, 86(21),10877.doi:10.1021/ac503043w
(51)Zhao,W.W.;Wang,J.;Xu,J.J.;Chen,H.Y.Chem.Commun.2011,47(39),10990.doi:10.1039/C1CC13952E
(52)M a,Z.Y.;Ruan,Y.F.;Xu,F.;Zhao,W.W.;Xu,J.J.;Chen,H. Y.Anal.Chem.2016,88(7),3864.doi:10.1021/acs. analchem.6b00012
(53)Zhao,W.W.;Yu,P.P.;Shan,Y.;Wang,J.;Xu,J.J.;Chen,H.Y. Anal.Chem.2012,84(14),5892.doi:10.1021/ac300127s
(54)Xu,F.;Zhu,Y.C.;Ma,Z.Y.;Zhao,W.W.;Xu,J.J.;Chen,H.Y. Chem.Commun.2016,52(14),3034.doi:10.1039/ C5CC09963C
(55)Zeng,X.;Ma,S.;Bao,J.;Tu,W.;Dai,Z.Anal.Chem.2013,85 (24),11720.doi:10.1021/ac403408y
(56)Zang,Y.;Lei,J.;Hao,Q.;Ju,H.ACSAppl.Mat.Interfaces 2014,6(18),15991.doi:10.1021/am503804g
(57)Zhao,M.;Fan,G.C.;Chen,J.J.;Shi,J.J.;Zhu,J.J.Anal. Chem.2015,87(24),12340.doi:10.1021/acs. analchem.5b03721
(58)Wang,W.;Hao,Q.;Wang,W.;Bao,L.;Lei,J.;Wang,Q.;Ju,H. Nanoscale 2014,6(5),2710.doi:10.1039/C3NR04777F
(59)Shen,Q.;Han,L.;Fan,G.;Zhang,J.R.;Jiang,L.;Zhu,J.J. Anal.Chem.2015,87(9),4949.doi:10.1021/acs. analchem.5b00679
(60)Wang,G.L.;Shu,J.X.;Dong,Y.M.;Wu,X.M.;Zhao,W.W.; Xu,J.J.;Chen,H.Y.Anal.Chem.2015,87(5),2892. doi:10.1021/ac5043945
(61)Zang,Y.;Lei,J.;Zhang,L.;Ju,H.Anal.Chem.2014,86(24), 12362.doi:10.1021/ac503741x
(62)Yan,Z.;Wang,Z.;M iao,Z.;Liu,Y.Anal.Chem.2016,88(1), 922.doi:10.1021/acs.analchem.5b03661
(63)Yan,K.;Liu,Y.;Yang,Y.;Zhang,J.Anal.Chem.2015,87(24), 12215.doi:10.1021/acs.analchem.5b03139
(64)Zhuang,J.;Lai,W.;Xu,M.;Zhou,Q.;Tang,D.ACSAppl.Mat. Interfaces2015,7(15),8330.doi:10.1021/acsami.5b01923
(65)Li,J.;Tu,W.;Li,H.;Han,M.;Lan,Y.;Dai,Z.;Bao,J.Anal. Chem.2014,86(2),1306.doi:10.1021/ac404121c
(66)Ge,L.;Wang,P.;Ge,S.;Li,N.;Yu,J.;Yan,M.;Huang,J.Anal. Chem.2013,85(8),3961.doi:10.1021/ac4001496
(67)Wang,G.L.;Yu,P.P.;Xu,J.J.;Chen,H.Y.J.Phys.Chem.C 2009,113(25),11142.doi:10.1021/jp902069s
(68)Zhao,W.W.;Ma,Z.Y.;Yu,P.P.;Dong,X.Y.;Xu,J.J.;Chen, H.Y.Anal.Chem.2012,84(2),917.doi:10.1021/ac203184g
(69)Zhao,W.W.;Ma,Z.Y.;Yan,D.Y.;Xu,J.J.;Chen,H.Y.Anal. Chem.2012,84(24),10518.doi:10.1021/ac3028799
(70)Zhao,W.W.;Liu,Z.;Shan,S.;Zhang,W.W.;Wang,J.;Ma,Z. Y.;Xu,J.J.;Chen,H.Y.Sci.Rep.2014,4,4426.doi:10.1038/ srep04426
(71)Zhao,W.W.;Shan,S.;Ma,Z.Y.;Wan,L.N.;Xu,J.J.;Chen,H. Y.Anal.Chem.2013,85(24),11686.doi:10.1021/ac403691a
(72)Zhao,W.W.;Chen,R.;Dai,P.P.;Li,X.L.;Xu,J.J.;Chen,H. Y.Anal.Chem.2014,86(23),11513.doi:10.1021/ac503969e
(73)Zhang,N.;Ma,Z.Y.;Ruan,Y.F.;Zhao,W.W.;Xu,J.J.;Chen, H.Y.Anal.Chem.2016,88(4),1990-1994.doi:10.1021/acs. analchem.5b04579
(74)Zhao,W.W.;Han,Y.M.;Zhu,Y.C.;Zhang,N.;Xu,J.J.;Chen, H.Y.Anal.Chem.2015,87(11),5496.doi:10.1021/acs. analchem.5b01360
(75)Li,Y.J.;Ma,M.J.;Zhu,J.J.Anal.Chem.2012,84(23),10492. doi:10.1021/ac302853y
(76)Fan,G.C.;Zhao,M.;Zhu,H.;Shi,J.J.;Zhang,J.R.;Zhu,J.J. J.Phys.Chem.C 2016,120(29),15657.doi:10.1021/acs. jpcc.5b08131
(77)Zeng,X.;Tu,W.;Li,J.;Bao,J.;Dai,Z.ACSAppl.Mat. Interfaces2014,6(18),16197.doi:10.1021/am5043164
(78)Wang,X.;Yan,T.;Li,Y.;Liu,Y.;Du,B.;M a,H.;Wei,Q.Sci. Rep.2015,5,17945.doi:10.1038/srep17945
(79)Jin,L.Y.;Dong,Y.M.;Wu,X.M.;Cao,G.X.;Wang,G.L. Anal.Chem.2015,87(20),10429.doi:10.1021/acs. analchem.5b02728
(80)Shu,J.;Qiu,Z.;Zhuang,J.;Xu,M.;Tang,D.ACSAppl.Mat. Interfaces2015,7(42),23812.doi:10.1021/acsami.5b08742
(81)Zhuang,J.;Tang,D.;Lai,W.;Xu,M.;Tang,D.Anal.Chem. 2015,87(18),9473.doi:10.1021/acs.analchem.5b02676
(82)Da,P.;Li,W.;Lin,X.;Wang,Y.;Tang,J.;Zheng,G.Anal. Chem.2014,86(13),6633.doi:10.1021/ac501406x
(83)Hu,C.;Zheng,J.;Su,X.;Wang,J.;Wu,W.;Hu,S.Anal.Chem. 2013,85(21),10612.doi:10.1021/ac4028005
(84)Zhao,W.W.;Zhang,L.;Xu,J.J.;Chen,H.Y.Chem.Commun. 2012,48(76),9456.doi:10.1039/C2CC34543A
(85)Wang,P.;Ge,L.;Ge,S.;Yu,J.;Yan,M.;Huang,J.Chem. Commun.2013,49(32),3294.doi:10.1039/C3CC00149K
(86)Sun,G.;Zhang,Y.;Kong,Q.;M a,C.;Yu,J.;Ge,S.;Yan,M.; Song,X.J.Mater.Chem.B 2014,2(44),7679.doi:10.1039/ C4TB01119H
(87)Wang,Y.;Ge,L.;Wang,P.;Yan,M.;Ge,S.;Li,N.;Yu,J.; Huang,J.Lab on a Chip 2013,13(19),3945.doi:10.1039/ C3LC50430A
(88)Sun,G.;Zhang,Y.;Kong,Q.;Zheng,X.;Yu,J.;Song,X. Biosens.Bioelectron.2015,66,565.doi:10.1016/j. bios.2014.12.020
(89)Jiang,Y.;Qin,D.D.;Fan,Y.R.;Guo,H.X.;Wang,S.X.;Ning, X.M.;Lu,X.Q.RSCAdv.2015,5(70),56697.doi:10.1039/ C5RA08485G
(90)Aaronson,B.D.B.;Byers,J.C.;Colburn,A.W.;M cKelvey,K.; Unw in,P.R.Anal.Chem.2015,87(8),4129.doi:10.1021/acs. analchem.5b00288
New Developments in Photoelectrochemical Bioanalysis
RUANYi-Fan ZHANG Nan ZHU Yuan-Cheng ZHAOWei-Wei*XU Jing-Juan*CHEN Hong-Yuan
(SchoolofChemistry and ChemicalEngineering,Nanjing University,Nanjing 210023,P.R.China)
Photoe lectrochem ical(PEC)bioana lysis is a new ly emerged and rapidly developing ana lysis technique thatprovides an elegant route for sensitive bioanalysis.The sensingm echanism of PEC bioanalysis is based on the fact thatvariations in photocurrent signalcan be p roduced by biologicalinteractions between various recognition elements and their corresponding targets.Owing to its excellentsensitivity,selectivity,and great potential for future bioanalysis,PEC bioana lysis has drawn increasing research attention and substantial progress has beenmade in its analyticalapplications.Currently,ithas become a hot research topic and its recent momen tum has grow n rapid ly,as dem onstrated by the increased number of published research articles.Given the pace ofadvances in this area,this review first introduces the fundamentals and genera linstrumentation of this methodo logy.Then,with recent illustrative exam ples,we summarize the new deve lopments in PEC bioanalysis according to itsmain bioanalyticalapp lications,i.e.,direct PEC detection of biomo lecules,PEC enzymatic bioanalysis,PEC DNA detection,and PEC immunoassay.The future challenges and developments in this field a re also d iscussed.
Photoelectrochem istry;Bioana lysis;Enzym e;Nucleic acid;Imm uno
O 646;O 657.1
eter,L.M.Chem.Rev.1990,90(5),753.
10.1021/ cr00103a005
doi:10.3866/PKU.WHXB201611141
www.whxb.pku.edu.cn
Received:October 12,2016;Revised:November 14,2016;Published online:November 14,2016.
*Corresponding authors.ZHAOWei-Wei,Email:zww@nju.edu.cn;Tel:+86-25-89684862.XU Jing-Juan,Email:xujj@nju.edu.cn; Tel:+86-25-89687294.
The projectwas supported by the National Natural Science Foundation of China(21327902,21135003,21305063,21675080).
國家自然科學基金(21327902,21135003,21305063,21675080)資助項目?Editorialofficeof Acta Physico-Chim ica Sinica

