地上植食性昆蟲對土壤生態(tài)系統(tǒng)影響的研究進展①
周佳卉,吳紀華
(復旦大學生物多樣性科學研究所,生物多樣性與生態(tài)工程教育部重點實驗室,上海 200438)
地上植食性昆蟲對土壤生態(tài)系統(tǒng)影響的研究進展①
周佳卉,吳紀華*
(復旦大學生物多樣性科學研究所,生物多樣性與生態(tài)工程教育部重點實驗室,上海 200438)
地上地下生態(tài)系統(tǒng)之間存在著密切的聯(lián)系,二者相互作用,共同影響陸地生態(tài)系統(tǒng)過程。越來越多的研究表明,地上地下之間的相互聯(lián)系還受到植食性動物取食作用的調節(jié)。地上植食性昆蟲不僅可以改變地上植物或動物群落,還可以間接地影響土壤生態(tài)系統(tǒng)中的生物群落和相關的土壤過程,進而對地上生態(tài)系統(tǒng)形成反饋。本文綜述了地上植食性昆蟲對土壤食物網中不同營養(yǎng)級的生物群落,以及相關土壤過程的影響;在已有研究報道的基礎上,分析并歸納了地上植食性昆蟲影響土壤生態(tài)系統(tǒng)的途徑和調控因素等,旨在較為全面地總結地上植食性昆蟲對土壤生態(tài)系統(tǒng)的間接影響以及相關的影響機制,并對今后的研究方向作了初步展望。
植食性昆蟲;土壤生物;土壤過程;陸地生態(tài)系統(tǒng);反饋
陸地生態(tài)系統(tǒng)包括了地上和地下兩個部分,而地上地下生態(tài)系統(tǒng)之間并不是相互獨立的,二者聯(lián)系密切,可以對彼此產生強烈的影響[1]。近些年來,有關地上和地下生態(tài)系統(tǒng)的聯(lián)系以及相互作用得到了越來越多的關注[2–3]。而一些研究表明,這種地上地下生態(tài)系統(tǒng)間的相互聯(lián)系還會受到植食性動物的調節(jié)[4]。植食性動物不僅直接影響植物地上部分,還通過改變植物的營養(yǎng)運輸、分泌排泄物等方式對地下生態(tài)系統(tǒng)產生間接的影響,從而改變地上地下生態(tài)系統(tǒng)間的相互關系,最終影響陸地生態(tài)系統(tǒng)過程[2]。
植食性昆蟲是指主要取食植物的昆蟲,它們數(shù)量繁多且種類豐富,是植食性動物群落中的重要組成部分。根據活動區(qū)域和取食部位,植食性昆蟲可分為地上植食者和地下植食者;根據不同的取食方式,它們又可分為咀嚼式、刺吸式以及虹吸式等。大量實驗證明,植食性昆蟲的取食作用可以在植物個體水平或群落水平上影響植物的生物量[5–6]、次生代謝物合成[7–8]以及根系分泌[8–9]等。植物作為初級生產者,是土壤生態(tài)系統(tǒng)重要的資源供給來源,可以強烈影響土壤生態(tài)系統(tǒng)中的生物群落及其相關生態(tài)過程[1,2,10]。因此,在植食性昆蟲的取食壓力下,植物產生的變化會導致其向土壤輸送的資源質量和數(shù)量發(fā)生變化,從而間接影響土壤生態(tài)系統(tǒng)。事實上,已有較多的文獻報道,地上植食性昆蟲產生的影響不僅存在于地上部分,還可以穿越土壤界面擴展到地下生態(tài)系統(tǒng),包括土壤生物[6,11–12]以及相關的生態(tài)系統(tǒng)過程[13–15]。為了更好地了解地上植食性昆蟲在陸地生態(tài)系統(tǒng)中的作用,本文綜述了地上植食性昆蟲影響土壤生物以及某些土壤過程的研究進展,探討地上植食性昆蟲影響土壤生態(tài)系統(tǒng)的途徑,以及植食性昆蟲誘導的土壤變化對地上生態(tài)系統(tǒng)的潛在反饋作用。
1 地上植食性昆蟲對土壤生物的影響
微生物是土壤生態(tài)系統(tǒng)中重要的分解者,也是土壤食物網的基礎組分[16]。有研究顯示,地上植食性昆蟲的取食作用可以對土壤微生物產生強烈的影響。例如,蝗蟲對玉米植株低強度的取食作用(每株5只),可以誘導土壤微生物生物量增加 35%[17]。同樣,褐飛虱對水稻低強度的取食(每株4頭若蟲),也可以顯著增加土壤微生物的生物量碳和生物量氮[6]。但在褐飛虱高強度的取食壓力下(每株 12頭若蟲),水稻根際微生物生物量碳和生物量氮含量卻呈現(xiàn)出明顯的降低趨勢[6]。一項在半干旱森林生態(tài)系統(tǒng)的研究也表明,蚧殼蟲對松樹的吸食作用,可導致土壤微生物生物量降低80%,且微生物酶活性也顯著降低[18]。
除了對土壤微生物總量的影響,地上植食性昆蟲的取食作用還會影響植物根際菌根真菌的侵染率。有報道指出,斜紋夜蛾的嚼食性幼蟲取食大豆葉片 5天后,大豆植株根部的叢枝菌根真菌侵染率增加了17%[19]。而Wearn和Gange[20]在對英國南部兩處低地草原的研究則發(fā)現(xiàn),昆蟲的取食作用雖然對植物菌根真菌總侵染率沒有產生明顯的影響,但會顯著改變部分菌根真菌的數(shù)量。隨著微生物研究方法的不斷革新,研究者利用微生物群落水平的生理結構(community level physiological profiling, CLPP)、磷脂脂肪酸(phospholipid fatty acid, PLFA)以及變性梯度凝膠電泳(denaturing gradient gel electrophoresis, DGGE)指紋圖譜等分析方法[21]進一步證明,地上植食性昆蟲的取食作用還會對土壤微生物群落結構產生顯著的影響,包括細菌真菌比[13]、細菌群落中革蘭氏陽性菌和陰性菌的相對比例[18]以及菌根真菌的群落結構[20]等。
植食性昆蟲不僅可以影響土壤微生物,還會改變土壤中其他植食性動物的數(shù)量或群落結構。有文獻報道,蚜蟲對植物葉片的吸食作用可以顯著降低土壤中植食性線蟲的數(shù)量[22],或者影響地下植食性線蟲的群落結構[23]。此外,昆蟲的植食作用對土壤微生物和食根動物產生的影響,還可以通過食物網的上行控制作用進一步影響更高營養(yǎng)級的土壤動物,如線蟲、線蚓以及一些節(jié)肢動物等[12–13]。一項模擬野外草地植物群落的研究顯示,蚜蟲對植物的取食作用,可以影響土壤食物網中3個營養(yǎng)級的生物數(shù)量和群落結構,包括初級消費者中的微生物和植食性線蟲,次級消費者中的食細菌、食真菌線蟲和線蚓,以及三級消費者中捕食性線蟲[23]。另一項對蚜蟲的溫室實驗則證明,蚜蟲取食大麥植株后,植物根際土壤微生物、原生動物和食微線蟲的數(shù)量均顯著減少[22]。此外,一些研究在野外條件下也獲得了類似的結果。例如,在半干旱草原生態(tài)系統(tǒng)中,一種植食性的螞蟻(Messor andrei)可以誘導土壤食物網中微生物、線蟲以及小型節(jié)肢動物的數(shù)量顯著增加,導致土壤生物群落多樣性明顯提高[24]。在半干旱森林生態(tài)系統(tǒng)中,蚧殼蟲的取食不僅改變了土壤微生物的群落結構,還影響了土壤動物群落,其中甲螨數(shù)量增加了40%,前氣門目螨類的數(shù)量則增加了 23%[18]。對亞北極山地森林系統(tǒng)的研究也表明,兩種飛蛾幼蟲(Operophtera brumata, Epirrita autumnata)對樹木葉片的爆發(fā)性取食,不僅導致土壤微生物群落中的細菌數(shù)量顯著上升,也大幅增加了線蚓的數(shù)量[13]。
綜上所述,地上植食性昆蟲不僅會對土壤微生物和地下的植食性動物產生影響,這種影響也會通過食物網的級聯(lián)作用擴展到更高營養(yǎng)級的土壤動物,從而對整個土壤生物群落產生顯著的影響。
2 地上植食性昆蟲對土壤生態(tài)系統(tǒng)過程的影響
土壤生物對于土壤生態(tài)系統(tǒng)功能具有重要的調節(jié)作用[25]。比如,土壤微生物作為分解者,承擔了土壤有機質的分解作用,可以吸收、固定并釋放土壤養(yǎng)分,與土壤生態(tài)系統(tǒng)的營養(yǎng)狀態(tài)緊密相關[26]。某些土壤動物如線蟲、原生動物等,可以通過取食微生物來釋放微生物固定的營養(yǎng)物質,從而調節(jié)土壤生態(tài)系統(tǒng)的營養(yǎng)流動與循環(huán)[27–28]。如食微線蟲與微生物的相互作用有助于加快土壤氮營養(yǎng)循環(huán)速率[29]。這主要是因為線蟲的新陳代謝特點以及與微生物的碳氮比差異,會促使它將自身同化的大部分氮素以無機氮的形式釋放到土壤中,促進了氮的礦化作用,進而影響土壤無機氮的有效性[30]。因此,由地上昆蟲植食作用誘導的土壤生物群落變化可能會進一步影響土壤有機質的分解速率以及土壤營養(yǎng)循環(huán)等生態(tài)系統(tǒng)過程。
有研究表明,在農田生態(tài)系統(tǒng)中,褐飛虱對水稻低強度的植食作用(每株4頭若蟲)可以誘導土壤微生物數(shù)量顯著增加,刺激微生物活性,因而增加了土壤中水溶性有機碳和有機氮的含量,提高了土壤資源的可利用性[6]。植物在植食作用的誘導下,根系會分泌出大量的有機物,并間接促進土壤微生物的數(shù)量與活性,因此可以顯著增強土壤有機質分解速率和無機氮營養(yǎng)的有效性[31,55]。比如在亞北極山林生態(tài)系統(tǒng)中,斜紋夜蛾幼蟲的爆發(fā)性取食顯著增加了土壤關鍵分解者細菌以及線蚓的數(shù)量,從而導致土壤無機氮含量顯著增加,土壤碳氮比降低13%,土壤營養(yǎng)的周轉速率明顯加快[13]。同樣,在溫帶荒原生態(tài)系統(tǒng)中,甲蟲取食植物后,土壤氮礦化速率和凈硝化速率明顯加快,均為對照組的2.1倍[15]。
但是,地上昆蟲的取食作用也并不總對土壤有機質分解速率與營養(yǎng)循環(huán)產生促進作用。例如,在大麥植株的快速生長階段,蚜蟲對大麥的取食作用會抑制土壤原生動物以及食細菌線蟲的活性,降低根系分泌物的分解速率,因此阻礙了土壤的氮礦化作用[22]。另一項同質園研究也發(fā)現(xiàn),蚜蟲取食大豆葉片后,會導致土壤無機氮含量降低86%,而造成這種結果的原因可能是土壤微生物在碳資源限制的條件下增強了氮的固定作用[32]。在半干旱森林生態(tài)系統(tǒng)中,蚧殼蟲對樹木長期的取食(36 ~ 54年)導致土壤碳儲量降低了111%,氮儲量降低了96%[14]。同樣,對荒原生態(tài)系統(tǒng)的研究也獲得了類似的結果,即長期的昆蟲取食作用(6年)可能會降低土壤氮的可利用率[15]。
3 地上植食性昆蟲影響土壤生態(tài)系統(tǒng)的途徑
已有的結果發(fā)現(xiàn),地上植食性昆蟲的取食作用對土壤生物的影響可能是積極的[13],也可能是消極的[22];對土壤營養(yǎng)循環(huán)可能有促進作用[13],也可能產生抑制作用[14]。這些差異出現(xiàn)的主要原因可能與各研究所采用的生態(tài)系統(tǒng)和時空尺度不同有關,同時,也可能是因為植食性昆蟲可以通過多種不同的途徑來間接影響土壤生態(tài)系統(tǒng),而土壤生態(tài)系統(tǒng)最終的變化是特定條件下不同的途徑之間相互平衡的結果[2,4]。本文概括了地上植食性昆蟲影響土壤生態(tài)系統(tǒng)的可能途徑,如圖 1所示。
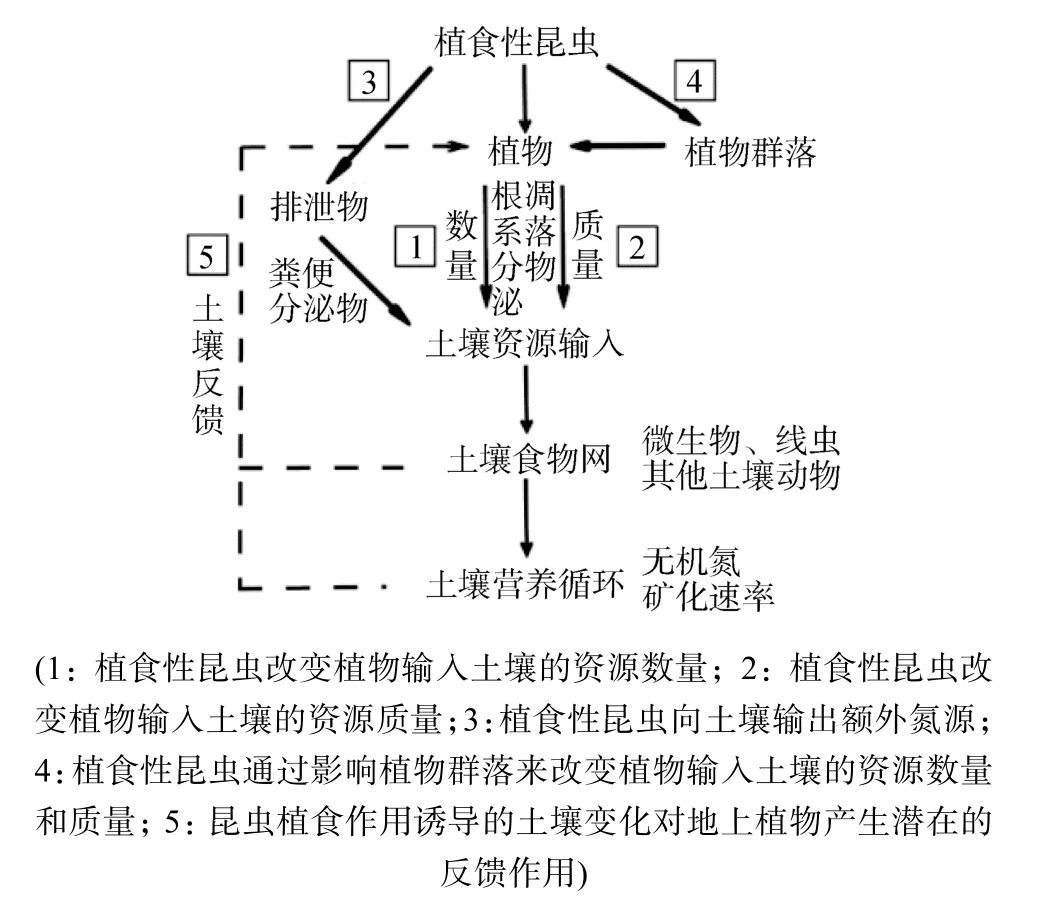
圖1 地上植食性昆蟲影響土壤生態(tài)系統(tǒng)的途徑Fig. 1 Pathway through which aboveground herbivorous insects influence soil ecosystem
3.1 地上植食性昆蟲改變植物輸入土壤的資源數(shù)量
昆蟲對植物的取食作用會誘導植物重新配置碳氮資源,改變根系分泌或凋落物的數(shù)量,從而影響植物對土壤的資源輸出。同位素標記法可以很好地追蹤昆蟲取食后植物資源配置的變化,比如14C標記實驗證實,玉米在蝗蟲的取食誘導下,植株對地上莖葉部分的碳資源分配減少了7%,對地下根系部分則增加了6%[33]。由于植物將更多的碳資源分配到根系生物量以及分泌物中,因而有利于提高土壤生物尤其是土壤微生物的群落豐富度[34]。另一項13C標記結果也顯示,植食作用會刺激植物根系的活碳流失,增強根際沉積作用,植物根系分泌糖類、氨基酸、有機酸等化合物,使得更多的資源由植物根系進入土壤[31]。同時,對半干旱森林系統(tǒng)的研究也發(fā)現(xiàn),蚧殼蟲的取食作用可以誘導松樹向土壤輸送的地上凋落物數(shù)量增加 21%[18]。但是,昆蟲植食作用對植物輸入土壤的資源數(shù)量并不一定總是積極的促進作用,有時候也可能是消極的抑制作用。比如,蚜蟲對大麥的高強度取食會導致植物減少向根系配置的光合產物數(shù)量,并減緩根系分泌物的降解速率[22]。同樣,蚜蟲對水稻的高強度取食作用也會顯著減少植物根系的生物量,降低水稻根莖比,降低土壤資源有效性,從而抑制根際土壤微生物和線蟲的數(shù)量以及活性[6]。此外,在森林生態(tài)系統(tǒng)中,蚧殼蟲的取食會降低松樹的生長速率,導致地上莖葉的生物量減少30%,因而地上凋落物的數(shù)量也隨之減少25%[35]。
3.2 地上植食性昆蟲改變植物輸入土壤的資源質量
昆蟲的植食作用會誘導植物組織內次級代謝物以及營養(yǎng)物的改變,從而影響植物對土壤資源輸出的質量。已有一些研究揭示了昆蟲取食后植物組織含氮量的變化,例如,象甲(Sitona flavescens)取食三葉草后,會誘導植物碳氮比顯著增加,根系含氮量降低,并改變根系分泌物的組成成分[9]。在松樹林中,蚧殼蟲和飛蛾(Dioryctria albovittella)的取食作用會顯著增加地上凋落物的氮含量,并且降低其單寧/氮以及碳/氮比例,從而提高地上凋落物的營養(yǎng)和質量,進一步促進土壤營養(yǎng)循環(huán)[36]。一項對美國北部森林的研究也發(fā)現(xiàn),蚧殼蟲取食松樹后,松針凋落物的含氮量增加了 50%[18]。此外,有報道指出,昆蟲的植食作用也會誘導植物次生代謝物的組成或濃度發(fā)生變化,從而影響凋落物的質量。比如昆蟲對玉米的取食作用可以誘導植物體內某些與次級代謝物合成相關的基因表達,使植物葉片組織合成茉莉酮酸酯等可揮發(fā)化合物來抑制植食性昆蟲的取食行為,因而降低了葉片凋落物的質量[37]。同樣,粉虱(Bemisia tabaci)取食辣椒葉片后,會誘導辣椒根系合成某些誘導抗性基因表達的信號(如水楊酸和茉莉酸),刺激了根際革蘭氏陽性細菌和某些真菌數(shù)量的增加,并進一步影響根際微生物群落結構[8]。總之,植食性昆蟲的取食作用間接影響了植物對土壤輸出的資源數(shù)量和質量,改變了土壤資源有效性和可利用率,從而進一步影響土壤生物群落和營養(yǎng)循環(huán),而這一途徑也通常被認為是短期內植食作用影響土壤生態(tài)系統(tǒng)的最重要途徑[4,38]。
3.3 地上植食性昆蟲向土壤輸入額外的氮源
植食性昆蟲的排泄物,如糞便、蜜露等,對于土壤生態(tài)系統(tǒng)來說是豐富的資源輸入。昆蟲的糞便常常含有較高濃度的易分解碳(糖類)以及氮(銨態(tài)氮和硝態(tài)氮),這些排泄物的營養(yǎng)價值和易分解性通常要高于凋落物等傳統(tǒng)的植物資源[39]。當植食性昆蟲的排泄物進入土壤后,可能在土壤表面形成高營養(yǎng)斑塊,刺激土壤分解者(如微生物)數(shù)量的增加和活性的增強,進而影響土壤碳氮營養(yǎng)循環(huán)以及植物的營養(yǎng)吸收[40]。比如在紅橡林中,毒蛾(Orygia leucostigma)向土壤排泄的糞便會顯著增加土壤總碳、總氮以及銨態(tài)氮含量,從而改變了土壤營養(yǎng)狀態(tài)[41]。同時,對一種食葉蟻(M. andrei)的研究結果也證實,在靠近蟻巢的土壤中,微生物、線蟲以及微型節(jié)肢動物的豐度和多度均要顯著高于非蟻巢區(qū)的土壤,這種結果可能源于蟻巢附近的土壤中含有較為豐富的螞蟻排泄物[24]。但對于蚜蟲而言,它在取食植物時分泌的蜜露可以顯著增加輸入土壤的糖類數(shù)量,刺激土壤微生物的豐度與活性,使得土壤微生物大量固定土壤氮,反而導致土壤無機氮含量降低了86%[32]。因此,植食性昆蟲對土壤生態(tài)系統(tǒng)的排泄物輸入可能加快也可能減緩土壤氮礦化速率,具體的結果要取決于昆蟲排泄物的碳氮比,若是含氮量高的排泄物會加速土壤氮礦化,增加土壤無機氮含量,含氮量低的排泄物則會刺激土壤微生物固定氮,從而降低氮礦化速率[42]。
3.4 地上植食性昆蟲導致植物群落水平的變化
Sch?dler等人[43]提取了9個實驗中的22組數(shù)據,對其進行整合分析后得出結論,昆蟲的取食作用會顯著降低植物群落的生產力,減少植物對土壤輸出的資源數(shù)量,從而對土壤生態(tài)系統(tǒng)產生潛在的消極影響。然而,他們進一步的野外實驗結果卻顯示,昆蟲的取食作用在植物群落水平上對生產力沒有明顯影響,但會導致植物根系碳氮含量顯著減少,改變植物對土壤輸出的資源質量,使得凋落物分解速率降低,土壤可利用氮含量減少,進而影響土壤微生物的數(shù)量和活動[44]。此外,昆蟲的取食作用也可能通過改變植物群落結構來影響土壤生態(tài)系統(tǒng)。例如,甲蟲(Trirhabda virgata)對植物群落中加拿大一枝黃花的專性取食,可以顯著提高植物群落物種豐富度,因而對土壤生態(tài)系統(tǒng)產生間接的積極影響[45]。蚜蟲的取食作用也可以通過誘導植物群落組成的改變,來進一步影響土壤食微線蟲和線蚓的群落[23]。綜上所述,地上昆蟲的植食作用可能在植物群落水平上改變生產力或群落結構,從而改變植物對土壤資源輸出的數(shù)量和質量,最終影響了土壤生物群落和營養(yǎng)循環(huán)。
4 影響土壤生態(tài)系統(tǒng)對昆蟲植食作用響應的其他因素
研究表明,植食性昆蟲的類型、取食的強度或時間,以及不同的植物品種也會影響土壤生態(tài)系統(tǒng)對昆蟲植食作用的響應[4]。例如,蚜蟲的物種特性可以影響土壤生態(tài)系統(tǒng)對昆蟲取食作用的響應,不同的蚜蟲品種對土壤微生物、線蟲以及線蚓群落的影響之間存在很大的差異[23]。有實驗發(fā)現(xiàn),蚧殼蟲和飛蛾的取食作用對松樹林凋落物數(shù)量的影響不同,而這種影響會進一步擴展到土壤生態(tài)系統(tǒng)的變化中[35]。此外,昆蟲取食的強度或持續(xù)時間也會對土壤系統(tǒng)響應產生很大的影響,蚜蟲低強度的取食作用可以誘導水稻根系生物量明顯增加,根莖比增加,從而增加土壤微生物的生物量,刺激微生物活性;但是,蚜蟲高強度的取食作用卻會導致水稻根系生物量顯著減少,抑制根際微生物的活動,因而降低了土壤可分解有機碳和有機氮的含量[6]。同樣,在溫帶荒原生態(tài)系統(tǒng)中,甲蟲短期(1年)的取食作用可以刺激土壤凈氮礦化速率明顯加快,而長期的取食(6年)卻會顯著降低土壤氮有效性[15]。這種土壤響應的差異也可能由于,短期內中低強度的植食作用可以刺激植物生產力的提高,使得植物輸入土壤的碳資源增加,從而對土壤微生物的數(shù)量和活動產生積極的影響[46–47]。對于同種地上植食性昆蟲來說,不同植物品種也會誘導不同的土壤生物響應[12]。比如在褐飛虱取食不同感抗品種的水稻后,土壤細菌、真菌和放線菌的數(shù)量變化在不同水稻品種間存在著明顯的差異[11];土壤線蟲總數(shù)量和屬數(shù)在水稻的感蟲品種上顯著增加,但在抗蟲品種上卻呈現(xiàn)明顯降低的趨勢[48]。
除了生物因素,一些非生物因素也會改變植食作用對土壤系統(tǒng)的影響。在已有的研究中,這些非生物因素主要考慮了土壤的營養(yǎng)狀態(tài)、含水率和溫度等因子。以土壤的營養(yǎng)狀態(tài)為例,在高營養(yǎng)的海洋苔原中,植食作用會刺激土壤微生物生物量的增加;而在低營養(yǎng)的陸地苔原中,植食作用對土壤微生物群落則是顯著的抑制作用[49]。這種差異性結果在同質園實驗中得到了進一步證實,在高營養(yǎng)水平的土壤中,黑芥被菜粉蝶幼蟲(Pieris rapae)取食后,可以比在低營養(yǎng)土壤中保持更高的葉片生長速率,對昆蟲取食造成的損傷有更強的補償生長能力,因而可以對土壤生物造成不同的影響[50]。此外,在某些受水分和溫度調節(jié)[51]影響較大的森林生態(tài)系統(tǒng)如半干旱森林中,土壤季節(jié)性的含水率、溫度等差異,對土壤微生物數(shù)量和群落結構的影響可能要大于植食性昆蟲產生的影響[18]。
5 地上昆蟲的植食作用與土壤反饋
植物–土壤反饋作用表明,土壤生態(tài)系統(tǒng)的變化對地上生態(tài)系統(tǒng)有著潛在的反饋作用[3]。因此,昆蟲植食作用誘導的土壤生態(tài)系統(tǒng)過程的改變可能會進一步影響地上生態(tài)系統(tǒng)[4]。有實驗發(fā)現(xiàn),昆蟲植食作用可能通過改變土壤致病菌或食根動物的取食壓力來影響地上植物的生長[52]。同樣,對千里光草的研究則表明,經過昆蟲取食誘導的土壤對地上植物生長的負反饋作用是最低的[53]。然而,迄今為止,對于植食性昆蟲誘導的土壤系統(tǒng)變化對地上植物反饋作用的研究并不充分。相反,對其他類型植食作用誘導的土壤反饋已有較多的研究,比如,哺乳動物的取食可以通過改變土壤食物網和植物營養(yǎng)的有效性來影響地上植物群落[54];人工模擬的植食作用,可以通過刺激植物根系分泌來促進微生物生物量和活性增強,增加根際土壤的氮礦化速率,提高土壤無機氮可利用率,使得植物氮吸收增強,植物在被取食后地上組織的氮含量顯著升高,從而有利于植物在植食壓力下的補償生長[31,55]。Mikola等[56]利用植物剪枝后的土壤來種植貓尾草幼苗,發(fā)現(xiàn)與對照相比,受人工模擬植食作用誘導的土壤中貓尾草含氮量更高,也就表明,植食作用誘導的土壤變化會進一步影響后期的植物生長。因此,由植食性昆蟲誘導的土壤變化對地上生態(tài)系統(tǒng)的潛在反饋作用研究還有待進一步深入。
6 研究展望
隨著對植食性昆蟲研究的不斷深入,地上植食性昆蟲對地下生態(tài)系統(tǒng)的影響愈發(fā)得到關注。結合已有的研究,在不同系統(tǒng)和時空尺度上均可觀察到地上植食性昆蟲對土壤生物和生態(tài)系統(tǒng)過程的影響。但是,由于在自然條件下,植食性昆蟲與土壤系統(tǒng)的相互關系還受到諸多生物和非生物因素的調節(jié),因此,對于二者的相互作用以及潛在的影響還需要深入地進行探討:
1) 昆蟲取食作用誘導的土壤響應對地上生態(tài)系統(tǒng)的反饋及其機制。已有較多文獻報道了植食作用可以導致土壤系統(tǒng)的反饋[55–56]。但正如本文所述,關于昆蟲植食作用誘導的土壤變化對地上植物尤其是動物群落的影響的研究還較少[53],因此,為了更好地預測植食性昆蟲對地上地下生態(tài)系統(tǒng)的潛在影響力,今后需要更多的研究來驗證昆蟲植食作用改變了土壤生態(tài)系統(tǒng)后,地上植物、動物所發(fā)生的變化及其影響途徑。
2) 植食性昆蟲取食不同植物物種后土壤系統(tǒng)響應的差異。不同的植物物種對昆蟲取食作用的響應本身就會存在差異[57],同時不同植物特性也會對土壤生態(tài)系統(tǒng)存在不同的影響[58]。因此,在同種昆蟲的取食壓力下,不同植物物種間的土壤微生物和線蟲變化存在著顯著的差異[11–12]。但是,還未有實驗全面揭示不同植物在昆蟲取食后,土壤生物以及生態(tài)系統(tǒng)過程的響應差異及其原因,而這也影響著植食昆蟲對植物群落水平的影響。未來的研究需要更多地比較植物物種對昆蟲誘導土壤響應的影響,從而更全面地考慮整個土壤生態(tài)系統(tǒng)的響應。
3) 在昆蟲取食作用的調節(jié)下,入侵植物對土壤生態(tài)系統(tǒng)的影響。關于入侵植物與植食性昆蟲,已有較多的研究證明了二者間的相互聯(lián)系[59]。同時,植食性昆蟲取食入侵植物后,也可影響入侵植物與土著植物之間的似然競爭關系,從而影響外來植物的成功入侵[60]。那么,這種由昆蟲取食作用誘導的似然競爭是否與土壤生態(tài)系統(tǒng)的變化有所關聯(lián)呢?迄今為止,還未有報道指出入侵植物在昆蟲取食壓力下對土壤系統(tǒng)的影響,也沒有相關的研究證明入侵地昆蟲的取食作用與植物入侵之間的潛在聯(lián)系。對此,今后的研究可以將植食性昆蟲、入侵植物與土壤生態(tài)系統(tǒng)三者聯(lián)系在一起考慮,從而為外來植物的入侵機制提供更全面的科學依據。
4) 量化昆蟲取食作用對土壤生態(tài)系統(tǒng)的影響。本文中列舉了一些較為典型的地上植食性昆蟲對土壤生物和生態(tài)系統(tǒng)過程影響的案例,并歸納了可能的影響途徑。然而,從文中列舉的不同研究中可以發(fā)現(xiàn),地上昆蟲對土壤生態(tài)系統(tǒng)的影響是紛繁復雜、趨勢各異的。不同的生態(tài)系統(tǒng)類型、昆蟲類型、取食強度、時空尺度條件下,各個實驗往往得到迥異的結果。如果將不同的案例按照系統(tǒng)類型、昆蟲類型等標準來劃分,是否可以獲得較為統(tǒng)一和具體的趨勢呢?因此,后續(xù)的研究方向可以放在用統(tǒng)計學方法整合分析昆蟲取食作用對土壤生物、碳氮狀態(tài)的具體影響,使土壤響應有量化的指標。同時,也可以通過分組比較來更直觀地得出影響土壤生態(tài)系統(tǒng)響應的諸多因素,為預測植食性昆蟲產生的潛在影響提供更為嚴謹?shù)慕y(tǒng)計依據。
[1] Wardle D A, Bardgett R D, Klironomos J N, et al. Ecological linkages between aboveground and belowground biota[J].Science, 2004, 304(5677): 1629–1633
[2] Bardgett R D, Wardle D A. Aboveground-belowground linkages[M]. New York: Oxford University Press, 2010: 113–161
[3] van der Putten W H, Bardgett R D, Bever J D, et al. Plant-soil feedbacks: the past, the present and future challenges[J]. Journal of Ecology, 2013, 101(2): 265–276
[4] Bardgett R D, Wardle D A. Herbivore-mediated linkages between aboveground and belowground communities[J]. Ecology, 2003, 84(9): 2258–2268
[5] Pastore A I, Russell F L. Insect herbivore effects on resource allocation to shoots and roots in Lespedeza capitata[J]. Plant Ecology, 2012, 213(5): 843–851
[6] Huang J, Liu M, Chen X, et al. Intermediate herbivory intensity of an aboveground pest promotes soil labile resources and microbial biomass via modifying rice growth[J]. Plant and Soil, 2013, 367(1/2): 437–447
[7] Gatehouse J A. Plant resistance towards insect herbivores: a dynamic interaction[J]. New Phytologist, 2002, 156(2): 145–169
[8] Yang J W, Yi H, Kim H, et al. Whitefly infestation of pepper plants elicits defence responses against bacterial pathogens in leaves and roots and changes the belowground microflora[J]. Journal of Ecology, 2011, 99(1): 46–56
[9] Murray P J, Hatch D J, Cliquet J B. Impact of insect root herbivory on the growth and nitrogen and carbon contents of white clover (Trifolium repens) seedlings[J]. Canadian Journal of Botany-Revue Canadienne de Botanique, 1996, 74(10): 1591–1595
[10] 雷海迪, 尹云鋒, 劉巖, 等. 杉木凋落物及其生物炭對土壤微生物群落結構的影響?[J]. 土壤學報, 2016: 1–10
[11] 蘇婷, 徐紅星, 韓海亮, 等. 褐飛虱脅迫對不同抗性水稻品種根際土壤酶活性和微生物含量的影響[J]. 中國水稻科學, 2014, (3): 322–326
[12] Huang J, Liu M, Chen F, et al. Crop resistance traits modify the effects of an aboveground herbivore, brown planthopper, on soil microbial biomass and nematode community via changes to plant performance[J]. Soil Biology and Biochemistry, 2012, 49: 157–166
[13] Kaukonen M, Ruotsalainen A L, Wali P R, et al. Moth herbivory enhances resource turnover in subarctic mountain birch forests?[J]. Ecology, 2013, 94(2): 267–272
[14] Classen A T, Chapman S K, Whitham T G, et al. Long-term insect herbivory slows soil development in an arid ecosystem[J]. Ecosphere, 2013, 4(UNSP 525)
[15] Uselman S M, Snyder K A, Blank R R. Impacts of insect biological control on soil N transformations in Tamarix-invaded ecosystems in the Great Basin, USA[J]. Journal of Arid Environments, 2013, 88: 147–155
[16] Bardgett R D, van der Putten W H. Belowground biodiversity and ecosystem functioning[J]. Nature, 2014, 515(7528): 505–511
[17] Holland J N. Effects of above-ground herbivory on soil microbial biomass in conventional and no-tillage agroecosystems[J]. Applied Soil Ecology, 1995, 2(4): 275–279
[18] Classen A T, Demarco J, Hart S C, et al. Impacts of herbivorous insects on decomposer communities during the early stages of primary succession in a semi-arid woodland[J]. Soil Biology and Biochemistry, 2006, 38(5): 972–982
[19] Tawaraya K, Shiozawa S, Ueda K, et al. Leaf herbivory by Spodoptera litura increases arbuscular mycorrhizal colonization in roots of soybean[J]. Soil Science and Plant Nutrition, 2012, 58(4): 445–449
[20] Wearn J A, Gange A C. Above-ground herbivory causes rapid and sustained changes in mycorrhizal colonization of grasses[J]. Oecologia, 2007, 153(4): 959–971
[21] 袁志輝, 王健, 楊文蛟, 等. 土壤微生物分離新技術的研究進展[J]. 土壤學報, 2014, 51(6): 1183–1191
[22] Vesterg?rd M, Bj?rnlund L, Christensen S. Aphid effects on rhizosphere microorganisms and microfauna depend more on barley growth phase than on soil fertilization[J]. Oecologia, 2004, 141(1): 84–93
[23] Wardle D A, Yeates G W, Williamson W M, et al. Linking aboveground and belowground communities: the indirect influence of aphid species identity and diversity on a three trophic level soil food web[J]. Oikos, 2004, 107(2): 283–294
[24] Boulton A M, Jaffee B A, Scow K M. Effects of a common harvester ant (Messor andrei) on richness and abundance of soil biota[J]. Applied Soil Ecology, 2003, 23(3): 257–265
[25] 邵元虎, 張衛(wèi)信, 劉勝杰, 等. 土壤動物多樣性及其生態(tài)功能[J]. 生態(tài)學報, 2015, 35(20): 6614–6625
[26] 周麗霞, 丁明懋. 土壤微生物學特性對土壤健康的指示作用[J]. 生物多樣性, 2007, (02): 162–171
[27] Paterson E. Importance of rhizodeposition in the coupling of plant and microbial productivity[J]. European Journal of Soil Science, 2003, 54: 741–750
[28] Christensen S, Bj?rnlund L, Vesterg?rd M. Decomposer biomass in the rhizosphere to assess rhizodeposition[J]. Oikos, 2007, 116(1): 65–74
[29] Ferris H, Venette R C, van der Meulen H R, et al. Nitrogen mineralization by bacterial-feeding nematodes: Verification and measurement[J]. Plant and Soil, 1998, 203(2): 159–171 [30] Ferris H, Venette R C, Lau S S. Population energetics of bacterial-feeding nematodes: Carbon and nitrogen budgets[J]. Soil Biology and Biochemistry, 1997, 29(8): 1183–1194
[31] Hamilton E W, Frank D A. Can plants stimulate soil microbes and their own nutrient supply? Evidence from a grazing tolerant grass[J]. Ecology, 2001, 82(9): 2397–2402
[32] Katayama N, Silva A O, Kishida O, et al. Herbivorous insect decreases plant nutrient uptake: The role of soil nutrient availability and association of below-ground symbionts[J]. Ecological Entomology, 2014, 39(4): 511–518
[33] Holland J N, Cheng W X, Crossley D A. Herbivore-induced changes in plant carbon allocation: Assessment of belowground C fluxes using carbon-14[J]. Oecologia, 1996,107(1): 87–94
[34] 孫波, 廖紅, 蘇彥華, 等. 土壤–根系–微生物系統(tǒng)中影響氮磷利用的一些關鍵協(xié)同機制的研究進展[J]. 土壤, 2015, (02): 210–219
[35] Schuster T D, Cobb N S, Whitham T G, et al. Relative importance of environmental stress and herbivory in reducing litter fall in a semiarid woodland[J]. Ecosystems, 2005, 8(1): 62–72
[36] Chapman S K, Hart S C, Cobb N S, et al. Insect herbivory increases litter quality and decomposition: an extension of the acceleration hypothesis[J]. Ecology, 2003, 84(11): 2867–2876
[37] Christensen S A, Nemchenko A, Borrego E, et al. The maize lipoxygenase, ZmLOX10, mediates green leaf volatile, jasmonate and herbivore-induced plant volatile production for defense against insect attack[J]. The Plant Journal, 2013, 74: 59–73
[38] Bardgett R D, Wardle D A, Yeates G W. Linking above-ground and below-ground interactions: How plant responses to foliar herbivory influence soil organisms[J]. Soil Biology and Biochemistry, 1998, 14(30): 1867–1878
[39] Wardle D A, Bonner K I, Barker G M. Linkages between plant litter decomposition, litter quality, and vegetation responses to herbivores[J]. Functional Ecology, 2002, 16(5): 585–595
[40] Belovsky G E, Slade J B. Insect herbivory accelerates nutrient cycling and increases plant production[J]. PNAS, 2000, 97(26): 14412–14417
[41] Frost C J, Hunter M D. Insect canopy herbivory and frass deposition affect soil nutrient dynamics and export in oak mesocosms[J]. Ecology, 2004, 85(12): 3335–3347
[42] Kagata H, Ohgushi T. Carbon to nitrogen excretion ratio in lepidopteran larvae: Relative importance of ecological stoichiometry and metabolic scaling[J]. Oikos, 2012, 121(11): 1869–1877
[43] Sch?dler M, Jung G, Auge H, et al. Does the Fretwell-Oksanen model apply to invertebrates?[J]. Oikos, 2003, 100(1): 203–207
[44] Sch?dler M, Alphei J, Scheu S, et al. Resource dynamics in an early-successional plant community are influenced by insect exclusion[J]. Soil Biology and Biochemistry, 2004, 36(11): 1817–1826
[45] Long Z T, Mohler C L, Carson W P. Extending the resource concentration hypothesis to plant communities: Effects of litter and herbivores[J]. Ecology, 2003, 84(3): 652–665
[46] Bardgett R D, Jones A C, Jones D L, et al. Soil microbial community patterns related to the history and intensity of grazing in sub-montane ecosystems[J]. Soil Biology and Biochemistry, 2001, 33(12/13): 1653–1664
[47] Sankaran M, Augustine D J. Large herbivores suppress decomposer abundance in a semiarid grazing ecosystem[J]. Ecology, 2004, 85(4): 1052–1061
[48] 劉滿強, 黃菁華, 陳小云, 等. 地上部植食者褐飛虱對不同水稻品種土壤線蟲群落的影響[J]. 生物多樣性, 2009, (05): 431–439
[49] Stark S, Grellmann D. Soil microbial responses to herbivory in an arctic tundra heath at two levels of nutrient availability[J]. Ecology, 2002, 83(10): 2736–2744
[50] Meyer G A. Interactive effects of soil fertility and herbivory on Brassica nigra[J]. Oikos, 2000, 88(2): 433–441
[51] 周桂香, 陳林, 張叢志, 等. 溫度水分對秸稈降解微生物群落功能多樣性影響[J]. 土壤, 2015, (05): 911–918
[52] Wardle D A, Williamson W M, Yeates G W, et al. Trickledown effects of aboveground trophic cascades on the soil food web[J]. Oikos, 2005, 111(2): 348–358
[53] Bezemer T M, van der Putten W H, Martens H, et al. Above- and below-ground herbivory effects on belowground plant-fungus interactions and plant-soil feedback responses[J]. Journal of Ecology, 2013, 101(2): 325–333
[54] Patra A K, Abbadie L, Clays-Josserand A, et al. Effects of grazing on microbial functional groups involved in soil N dynamics[J]. Ecological Monographs, 2005, 75(1): 65–80
[55] Hamilton E W, Frank D A, Hinchey P M, et al. Defoliation induces root exudation and triggers positive rhizospheric feedbacks in a temperate grassland[J]. Soil Biology and Biochemistry, 2008, 40(11): 2865–2873
[56] Mikola J, Ilmarinen K, Nieminen M, et al. Long-term soil feedback on plant N allocation in defoliated grassland miniecosystems[J]. Soil Biology and Biochemistry, 2005, 37(5): 899–904
[57] Knolhoff L M, Heckel D G. Behavioral assays for studies of host plant choice and adaptation in herbivorous insects[J]. Annual Review of Entomology, 2014: 59, 263–278
[58] Heil M. Plant-mediated interactions between above- and below-ground communities at multiple trophic levels[J]. Journal of Ecology, 2011, 99(1): 3–6
[59] Bezemer T M, Harvey J A, Cronin J T. Response of native insect communities to invasive plants[J]. Annual Review of Entomology, 2014, 59(1): 119–141
[60] Recart W, Ackerman J D, Cuevas A A. There goes the neighborhood: apparent competition between invasive and native orchids mediated by a specialist florivorous weevil[J]. Biological Invasions, 2013, 15(2): 283–293
Effects of Aboveground Herbivorous Insects on Soil Ecosystem
ZHOU Jiahui , WU Jihua*
(Ministry of Education Key Laboratory for Biodiversity Science and Ecological Engineering, Institute of Biodiversity Science, Fudan University, Shanghai 200438, China)
Aboveground and belowground biota interact intimately and influence the terrestrial ecosystem process together. Numbers of studies have revealed that the aboveground herbivorous insects can not only influence the aboveground parts of vegetation and other animal communities, but also exert indirect strong effects on belowground biota community and ecosystem process, which may further feedback to aboveground ecosystems. To gain a better understanding of the effects of aboveground herbivorous insects on soil ecosystem and the associated mechanisms, this review summarized the effects of aboveground herbivorous insects on soil biota at different trophic levels of soil food web and the relevant soil nutrient dynamics, discussed the pathways through which the insects affect soil ecosystem and the regulatory factors, and also proposed the future research directions.
Herbivorous insects; Soil biota; Soil process; Terrestrial ecosystem; Feedback
Q14
A
10.13758/j.cnki.tr.2017.02.004
國家自然科學基金項目(31570513)資助。
* 通訊作者(jihuawu@fudan.edu.cn)
周佳卉(1991—),女,江蘇南通人,碩士研究生,研究方向為地上地下生態(tài)系統(tǒng)的聯(lián)系。E-mail: jennyzhoujh@sina.com

