金絲桃苷抑制肺炎支原體肺炎模型小鼠的損傷
申冬冬, 侯江紅, 袁 飛
(河南省中醫院兒科, 河南 鄭州 450002)
金絲桃苷抑制肺炎支原體肺炎模型小鼠的損傷
申冬冬, 侯江紅△, 袁 飛
(河南省中醫院兒科, 河南 鄭州 450002)
目的: 探討金絲桃苷對肺炎支原體肺炎(MPP)小鼠的保護作用及其調控機制。方法:選取BALB/c小鼠40只,隨機分為對照組、模型組、金絲桃苷低劑量(12.5 mg/kg)組和金絲桃苷高劑量(50 mg/kg)組。以肺炎支原體國際標準株(MPFH)滴鼻造模,第2天開始治療,治療3 d后進行后續實驗。HE染色檢測肺組織病理改變;全自動生化分析儀檢測血清中C-反應蛋白(CRP)、丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、乳酸脫氫酶(LDH)和心肌型肌酸激酶同工酶(CK-MB)水平,檢測肺組織中活性氧簇(ROS)、超氧化物歧化酶(SOD)和谷胱甘肽(GSH)水平;ELISA和Western blot方法分別檢測血清和肺組織中白細胞介素1β(IL-1β)、IL-6、IL-18和腫瘤壞死因子α(TNF-α)水平;RT-qPCR和Western blot方法檢測NLRP3、ASC和caspase-1的mRNA和蛋白表達。結果:與對照組相比,模型組小鼠的肺組織中出現炎癥反應、肺泡間質增寬等病理變化;CRP、ALT、AST、LDH和CK-MB水平顯著上調(P<0.05);ROS水平顯著上升,而SOD和GSH水平顯著下降(P<0.05);IL-1β、IL-6、IL-18和TNF-α水平顯著上調(P<0.05);NLRP3、ASC和caspase-1的蛋白表達也顯著升高(P<0.05)。與模型組相比,金絲桃苷組中的上述癥狀明顯減輕,且高劑量比低劑量組的緩解效果更明顯。結論:金絲桃苷能夠抑制MPP小鼠的損傷,這可能與其抑制氧化應激和NLRP3炎性體的激活有關。
金絲桃苷; 肺炎支原體肺炎; 炎癥; 氧化應激; 炎性體
肺炎支原體肺炎(Mycoplasmapneumoniaepneumonia,MPP)是由肺炎支原體(Mycoplasmapneumo-niae,MP)引起的肺部急性炎癥病變,是常見的兒童肺炎之一,占20%左右,近年來其臨床發病率有明顯增高的趨勢[1]。小兒MPP是一種傳染性疾病,主要通過呼吸道傳染,通過血液流經全身,傳染性很強,在人多的地方傳染率高達50%。其臨床癥狀多樣,除呼吸系統外,還可引起腦炎、腎炎、心肌炎、免疫性溶血性貧血等多種疾病,常會導致多系統功能障礙,甚至引起患者死亡[2-3]。金絲桃苷(hyperoside,Hyp),又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一種天然的黃酮醇苷類化合物,存在于金絲桃科、薔薇科、桔梗科、唇形科等多種植物的果實及全草中,具有抗氧化[4]、抗炎[5]、抗腫瘤[6]等多種藥理學活性,對心肌缺血、肝損傷、胃損傷等多種疾病[7-9]有一定的治療效果,但Hyp對于MPP肺炎損傷的作用未見相關報道,因此,本研究用MP誘導MPP模型小鼠,觀察Hyp對模型小鼠肺損傷的作用并進行初步的機制探討,為臨床治療小兒MPP提供理論和實驗依據。
材 料 和 方 法
1 藥品、試劑和儀器
金絲桃苷標準品(純度質量分數≥98%)購于上海源葉生物科技有限公司;肺炎支原體國際標準株(MPFH)購于ATCC;PPLO肉湯培養基購于青島海博生物技術有限公司;胎牛血清購自Gibco;C-反應蛋白(C-reactive protein,CRP)、丙氨酸轉氨酶(alanine aminotransferase,ALT)、天冬氨酸轉氨酶(aspartate transaminase,AST)、心肌型肌酸激酶同工酶(MB isoenzyme of creatine kinase,CK-MB)、乳酸脫氫酶(lactate dehydrogenase,LDH)、活性氧簇(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)試劑盒、谷胱甘肽(glutathione,GSH)等檢測試劑盒均購于由南京建成生物工程研究所;ELISA試劑盒購于上海藍基生物公司;Trizol Reagent購自Invitrogen;逆轉錄試劑盒和SYBR Premix Ex Taq mixture 購自TaKaRa;PMSF、蛋白裂解試劑盒和BCA蛋白檢測試劑盒購自碧云天生物技術研究所;PVDF膜購自Millipore;抗IL-1β、IL-6、IL-18和TNF-α等Ⅰ抗購于Santa Cruz;抗NLRP3、ASC、caspase-1等Ⅰ抗購自Millipore;Ⅱ抗購自Pierce。
細胞培養箱和紫外分光光度計購自Thermo Fisher Scientific;7300實時PCR擴增系統購自Applied Biosystem;Western blot 設備和酶聯免疫檢測儀購自Bio-Rad。
2 方法
2.1 MP培養 將MPFH 干粉用PPLO完全培養液(含胎牛血清、酵母提取物、酚紅、青霉素等)充分混勻,培養于37 ℃生化培養箱中,待培養液由紅變橙黃時傳代。將處于對數生長期的 MP,CCU 定量,常規凍存,待用時用含 10% 胎牛血清的 DMEM 培養液調至所需濃度。
2.2 動物分組和MPP小鼠模型的建立 3周齡SPF級BALB/c小鼠,雌雄各半。體重(15±1)g,由鄭州大學實驗動物中心提供,將小鼠按隨機數字表隨機分為對照組、模型組(MP組)、Hyp低劑量(12.5 mg/kg)組和Hyp高劑量(50 mg/kg)組,每組10只。用乙醚將小鼠輕度麻醉后,模型組和金絲桃苷治療組的小鼠鼻內接種50 μL含有1×1010CCU/L的MP 菌液,對照組以等量生理鹽水處理,連續處理3 d。金絲桃苷治療組在MP 感染第2天后按12.5 mg/kg和50 mg/kg分別進行金絲桃苷灌胃,連續處理4 d。正常組和感染組以等量生理鹽水灌胃。模型建立后進行分離培養。各組動物分籠飼養,實驗組和對照組隔離飼養。
2.3 標本采集 給藥結束第2天,取各組小鼠眼球全血,分離血清。然后將小鼠引頸處死,取肺組織,其中一部分肺組織用4%多聚甲醛固定,進行組織病理形態學檢測;另一部分用來提取總RNA和總蛋白,進行RT-qPCR和Western blot檢測。
2.4 HE染色 取小鼠肺組織,4%多聚甲醛固定后,進行梯度乙醇脫水,脫鈣后進行石蠟包埋,切片。按照說明書步驟進行蘇木素-伊紅(HE)染色,在光學顯微鏡下觀察肺部組織學變化。
2.5 全自動生化分析儀檢測 將小鼠眼球全血以3 500 r/min離心 10 min,取上清液,即為血清。根據檢測試劑盒說明書,用全自動生化分析儀檢測血清中CRP、ALT、AST、LDH、CK-MB的水平;檢測肺部組織中SOD、ROS、GSH的水平。
2.6 ELISA檢測 ELISA 法檢測血清中IL-1β、IL-6、IL-18和TNF-α水平,操作嚴格按說明書進行。于酶標儀上測490 nm處的吸光度(A)后,根據各自標準質量濃度制定標準曲線,在標準曲線上查找相應的值。
2.7 RT-qPCR實驗 按Trizol Reagent的使用說明書,提取各組小鼠肺部組織的總RNA。紫外分光光度計測定 RNA 濃度和純度,用 1% 的變性瓊脂糖凝膠電泳驗證 RNA 的完整性。取總 RNA 2 μg,利用M-MLV 反轉錄酶進行反轉錄,具體操作參照產品說明。使用 7300 實時PCR擴增系統進行RT-PCR 擴增。擴增體系為20 μL,包括10 μL 2×的SYBR Premix Ex Taq mixture,0.2 μmol/L 的引物,2 μL cDNA 和RNA-free ddH2O。反應條件為95 ℃ 10 min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 1 min,40個循環;72 ℃ 3 min。以β-actin 為內參照,每個樣品做3次重復,采用2-ΔΔCt法對數據進行分析。
2.8 Western blot實驗 取肺部組織進行研磨,采用蛋白裂解液提取總蛋白,用BCA蛋白定量試劑盒法測定蛋白樣品濃度。根據標準曲線計算上樣量,然后進行SDS-PAGE,轉至PVDF膜,用5% BSA于37 ℃搖床封閉1 h。隨后進行I 抗孵育,包括兔源IL-1β(1∶1 000)、IL-6(1∶1 000)、IL-18(1∶1 000)、TNF-α(1∶1 000)、NLRP3(1∶500)、ASC(1∶500)、caspase-1(1∶500)和山羊源GAPDH(1∶1 000)等,4 ℃孵育過夜,漂洗3次(每次5 min)。再將PVDF膜轉入相應的山羊抗兔或驢抗山羊Ⅱ抗(1∶10 000)中室溫孵育1 h,漂洗4次(每次5 min)。經Odyssey紅外激光成像系統掃描,目的蛋白與內參照GAPDH灰度值的比值反映蛋白的表達水平。
3 統計學處理
采用GraphPad Prism 5.0統計軟件進行分析,計量資料以均數±標準差(mean±SD)表示,多組間均數比較采用單因素方差分析,組間兩兩比較采用Bonferroni檢驗,以P<0.05 為差異有統計學意義。
結 果
1 肺部組織的病理學檢測
從HE染色的結果可以看出,對照組肺泡結構均勻清晰,肺泡內無滲出,無炎癥反應;MP感染小鼠肺泡間質增寬,肺泡出現大量的滲出物,有大量淋巴細胞和巨噬細胞浸潤;相較于MP感染組,Hyp治療組的間質性炎癥反應明顯減輕,淋巴和巨噬細胞浸潤減少,且50 mg/kg比12.5 mg/kg劑量的效果更加明顯,見圖1。

Figure 1.The effects of Hyp on the lung tissue structure of MPP mice. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsMP group.
圖1 Hyp對MPP模型小鼠肺部組織結構的影響
2 血清生化指標檢測
如表1所示,模型組小鼠血清中CRP、ALT、AST、CK-MB和LDH水平明顯高于對照組(P<0.05),各劑量Hyp藥物保護組與模型組相比,血清中CRP、ALT、AST、CK-MB和LDH水平顯著降低(P<0.05),且Hyp劑量越高,降低效果越明顯。
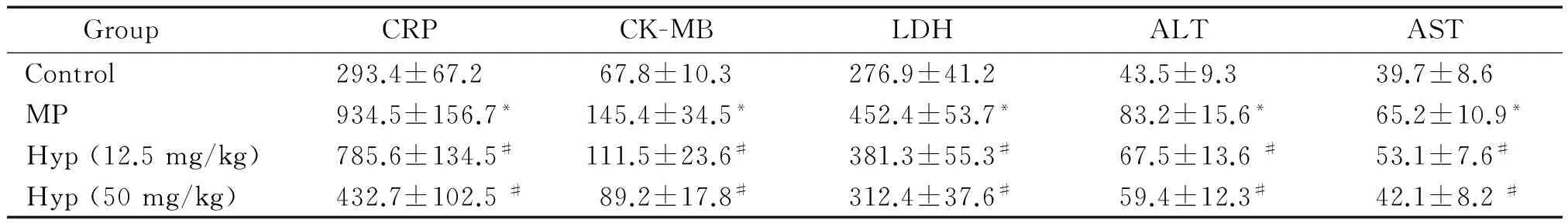
表1 Hyp對MPP模型小鼠血清中CRP、ALT、AST、CK-MB和LDH水平的影響
*P<0.05vscontrol group;#P<0.05vsMP group.
3 炎癥因子檢測
用ELISA方法檢測MPP小鼠血清中炎癥因子的水平,結果如表2所示,與對照組相比,模型組中IL-1β、IL-6、IL-18和TNF-α的表達水平顯著升高(P<0.05);與模型組相比,Hyp藥物組中IL-1β、IL-6、IL-18和TNF-α的表達水平顯著降低(P<0.05)。我們進一步用Western blot方法檢測肺部組織中IL-1β、IL-6、IL-18和TNF-α的蛋白表達差異,發現與對照組相比,模型組中IL-1β、IL-6、IL-18和TNF-α的蛋白表達顯著升高(P<0.05);與模型組相比,Hyp藥物組中IL-1β、IL-6、IL-18和TNF-α的蛋白表達顯著降低,見圖2。
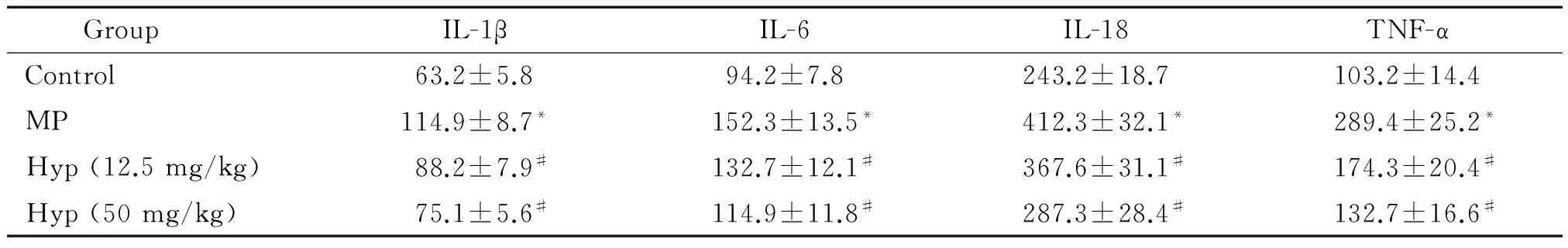
表2 Hyp對MPP模型小鼠血清中IL-1β、IL-6、IL-18和TNF-α水平的影響
*P<0.05vscontrol group;#P<0.05vsMP group.
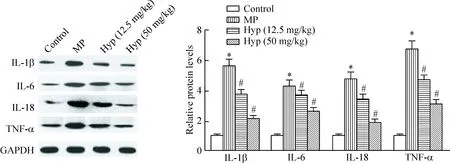
Figure 2.The effects of Hyp on the protein levels of IL-1β, IL-6, IL-18 and TNF-α in the lung tissues of MPP mice.Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsMP group.
圖2 Hyp對MPP模型小鼠肺部組織中IL-1β、IL-6、IL-18和TNF-α蛋白水平的影響
4 氧化應激指標檢測
如表3所示,與對照組相比,模型組小鼠肺部組織中ROS水平顯著升高,SOD和GSH水平顯著降低(P<0.05);各劑量Hyp藥物保護組與模型組相比,ROS水平顯著降低,SOD和GSH的水平顯著升高(P<0.05),且Hyp劑量越高,效果越明顯。
表3 Hyp對MPP模型小鼠肺部組織中SOD、GSH和ROS水平的影響
Table 3.The effects of Hyp on the levels of SOD, GSH and ROS in the lung tissues of MPP mice (Mean±SD.n=3)
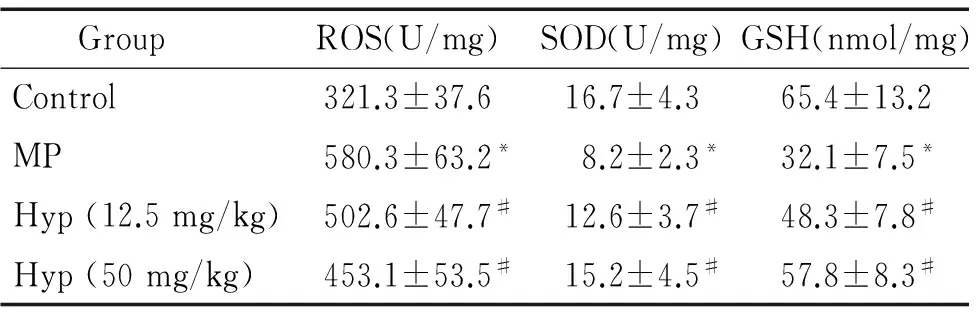
GroupROS(U/mg)SOD(U/mg)GSH(nmol/mg)Control321.3±37.616.7±4.365.4±13.2MP580.3±63.2*8.2±2.3*32.1±7.5*Hyp(12.5mg/kg)502.6±47.7#12.6±3.7#48.3±7.8#Hyp(50mg/kg)453.1±53.5#15.2±4.5#57.8±8.3#
*P<0.05vscontrol group;#P<0.05vsMP group.
5 NLRP3炎性體檢測
通過RT-qPCR和Western blot檢測了NLRP3、接頭蛋白ASC和caspase-1的表達水平差異。RT-qPCR和Western blot結果一致,與對照組相比,NLRP3、ASC和caspase-1在模型組中的表達水平上調,差異顯著(P<0.05)。與模型組相比,Hyp藥物處理顯著下調NLRP3、ASC和caspase-1的表達(P<0.05),且Hyp濃度越高,下調效果越顯著,見圖3。
討 論
MP為一類無細胞壁結構,大小介于細菌和病毒之間的原核微生物,是兒童呼吸道感染最常見的病原體之一,學齡期前后的兒童中多見因MP感染而引起的MPP[10]。隨著對其發病機制的深入研究,發現MPP患兒不僅表現出嚴重的肺部病變,全身多臟器多系統也受到損害,所以MP感染與兒童健康保健有著密切關系。當前國內外臨床對小兒MPP的治療首選大環內酯類藥物,近年來發現MP對大環內酯類抗生素有耐藥性,臨床上治療MP感染仍有很大的困難。為此,有效治療MP感染引起的MPP已成為各國學者致力研究的重點,其中中醫藥治療受到越來越多的關注。中醫藥對MPP的治療機理包括抑制肺炎支原體、調節免疫、改善微循環等方面,黃芩、麻黃和丹參等傳統中藥材因為其抗炎、抗氧化、免疫調節等功能而應用于MPP的治療[11]。Hyp因其抗氧化、抗炎作用在中醫藥研究中備受青睞,我們猜測Hyp能夠抑制MPP模型小鼠損傷。本實驗通過MP誘導小鼠MPP模型來研究 Hyp 對MPP損傷的作用。

Figure 3.The effects of Hyp on the levels of NLRP3, ASC and caspase-1 in the lung tissues of MPP mice. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsMP group.
圖3 Hyp對MPP模型小鼠肺部組織中NLRP3、ASC和caspase-1表達的影響
CRP是一種急性時相蛋白,因其不受性別、年齡、貧血等因素的影響,優于其它急性期反應物質。臨床檢測CRP的動態變化對判斷MPP病情嚴重程度及治療效果有重要意義。MP感染患兒由于呼吸功能障礙而引發心肌缺氧性損傷[12],治療期間應注意監測ALT、AST、CK-MB、LDH等生化指標,預防嚴重心肌損害的發生,對改善患兒預后具有非常重要的意義。本研究結果發現,MPP模型小鼠血清中CRP、ALT、AST、CK-MB和LDH水平均明顯升高,且肺部存在明顯的病理學改變,表明MP感染可導致小鼠肺部結構和功能損傷,并提示MPP小鼠造模成功。而Hyp能明顯降低MPP小鼠血清中CRP、ALT、AST、CK-MB和LDH水平,減輕肺部組織炎癥細胞浸潤和壞死程度,提示Hyp 能夠減輕MP誘導的肺炎損傷。
目前研究表明,MP作為致病原可激活免疫系統,誘導機體釋放各種細胞因子,保護機體抵抗病原體的侵蝕,但過量的細胞因子對機體有害,引發炎癥反應[13]。MP感染可誘發IL-1β和TNF-α的產生,作為最重要的炎癥介導因子,IL-1β和TNF-α不僅能夠促進炎癥反應,還能夠刺激其它炎癥因子的釋放,例如IL-6[14]。IL-6作為促炎癥細胞因子,是炎癥介質網絡的關鍵成分,在炎癥反應中起重要作用。有研究表明,IL-6水平與小兒社區獲得性肺炎嚴重程度高度相關,肺炎越嚴重則IL-6水平越高[15]。IL-18是多種細胞分泌的細胞因子,由活化的單核巨噬細胞和樹突狀細胞產生和分泌,具有多種免疫調節作用。本研究結果顯示,MPP模型小鼠血清中IL-1β、IL-6、IL-18和TNF-α濃度均明顯高于對照組,而在Hyp藥物組血清中顯著下調,說明Hyp能夠抑制MP感染誘導的炎性細胞因子的產生。
氧化應激廣泛存在于機體,發揮著重要的生理功能。一旦受到病原體感染等不良剌激,氧化-抗氧化動態平衡被打破,“過剩”的自由基即可以自身的分子、細胞等組分為靶細胞,對自身造成氧化損傷。有研究表明,肺炎支原體吸附在細胞膜表面后可伸出微管插入細胞內并釋放過氧化氫和超氧游離基,氧化應激引起的肺損傷與MPP的發生發展有重要關系[16],所以我們進一步評估了小鼠肺部的氧化應激程度。ROS是生物體內產生的超氧陰離子、過氧化氫、羥自由基、一氧化氮等活性含氧化合物的總稱。SOD和GSH是清除氧自由基的重要組分,是機體抗自由基損傷的重要防御機制。實驗結果顯示,MPP小鼠中 ROS 水平升高,而SOD和GSH水平降低。而Hyp 可明顯下調MPP小鼠ROS水平,上調SOD和GSH水平,表明 Hyp可能是通過清除自由基,增強抗過氧化能力而減輕MP感染引起的氧化損傷。Xing等[17]研究報道, Hyp在人肝細胞系L02中能夠通過激活Nrf2-ARE信號通路來減輕H2O2誘導的氧化損傷,而Nrf2-ARE信號通路的激活與Hyp調控p38/ERK/PI3K介導的GSK-3β磷酸化、調控Keap1 的表達以及調控microRNAs等作用有關,提示我們Hyp在MPP模型小鼠中可能是通過調控Nrf2-ARE信號通路發揮抗氧化損傷功能。
NLRP3炎性體是由NLRP3、ASC及caspase-1前體組成的一類大分子多蛋白復合體,屬于NOD 樣受體家族成員,是機體胞漿中重要的模式識別受體。NLRP3可識別機體自身危險信號及細菌等外源性危險信號,當其被激活后,通過接頭蛋白ASC招募caspase-1前體,使其水解,產生p20和p10大小亞基,形成p20/p10異二聚體,再形成4聚體,即有活性的caspase-1,進而對IL-1β、IL-18等前體進行剪切,促進有生物活性的IL-1β和IL-18釋放至細胞外,參與炎癥反應[18]。Bose 等[19]研究發現MP的CARDS毒素能夠和NLRP3分子進行反應,促進NLRP3炎性體的形成,激活一系列的炎癥反應。也有研究表明,ROS參與MP激活NLRP3炎性體的過程[20],所以我們進一步檢測了NLRP3炎性體的激活水平。結果發現,MP感染可顯著升高NLRP3、ASC和caspase-1的表達水平,而Hyp處理后,NLRP3、ASC和caspase-1的表達水平顯著降低,說明Hyp能夠抑制MP誘導的NLRP3炎性體的激活。
綜上所述,Hyp可抑制MP誘導的小鼠肺部損傷,發揮抗炎、抗氧化的保護作用,其機制可能與清除自由基、抑制NLRP3炎性體的激活有關。本研究為小兒MPP的發病機制研究和藥物治療提供了新的思路。但是,Hyp的抗氧化作用是否與Nrf2-ARE信號通路的激活有關,Nrf2-ARE信號通路與NLRP3炎性體的激活是否相關以及Hyp抑制肺炎損傷的其它分子機制,均需要進一步探討。
[1] 夏伏來. 小兒肺炎支原體感染 30 例臨床檢驗分析[J]. 中外婦兒健康: 學術版, 2011, 19(7):113.
[2] 李英姿, 溫小蘭, 李健雄. 112 例小兒肺炎支原體感染的臨床檢驗分析[J]. 中外醫學研究, 2012, 10(16):74-75.
[3] 粟順概. 小兒肺炎支原體肺炎的研究進展[J]. 中國醫藥指南, 2012, 10(2): 70-71.
[4] Kim YJ. Hyperin and quercetin modulate oxidative stress-induced melanogenesis[J]. Biol Pharm Bull, 2012, 35(11):2023-2027.
[5] Ku SK, Kwak S, Kwon OJ, et al. Hyperoside inhibits high-glucose-induced vascular inflammationinvitroandinvivo[J]. Inflammation, 2014, 37(5):1389-1400.
[6] Yang FQ, Liu M, Li W, et al. Combination of quercetin and hyperoside inhibits prostate cancer cell growth and metastasis via regulation of microRNA-21[J]. Mol Med Rep, 2015, 11(2):1085-1092.
[7] Li ZL, Hu J, Li YL, et al. The effect of hyperoside on the functional recovery of the ischemic/reperfused isolated rat heart: potential involvement of the extracellular signal-regulated kinase 1/2 signaling pathway[J]. Free Radical Biol Med, 2013, 57(1):32-40.
[8] Huang C, Yang Y, Li WX, et al. Hyperin attenuates inflammation by activating PPAR-γ in mice with acute liver injury (ALI) and LPS-induced RAW264.7 cells [J]. Int Immunopharmacol, 2015, 29(2):440-447.
[9] 梁 凱, 孔曉龍, 覃振明, 等. 金絲桃苷對過氧化氫損傷心肌細胞的保護作用研究[J]. 廣西醫學, 2012, 34(12):1600-1603.
[10]羅征秀, 羅 健, 徐秀娟, 等. 兒童肺炎支原體肺炎急性期氣道粘膜損害與預后的關系[J]. 第三軍醫大學學報, 2011, 33(2):190-192.
[11]姚艷青, 崔 紅. 小兒肺炎支原體肺炎的中醫藥研究進展[J]. 中國中西醫結合雜志, 2011, 31(10):1436-1440.
[12]徐建利, 吳志光. 肺炎支原體肺炎患兒血清心肌酶譜檢測的臨床意義[J]. 醫學檢驗與臨床, 2011, 22(4):12-14.
[13]Jacobs E.Mycoplasmapneumoniae: now in the focus of clinicians and epidemiologists[J]. Euro Surveill, 2012, 17(6): pii20084.
[14]Lai JF, Zindl CL, Duffy LB, et al. Critical role of macrophages and their activation via MyD88-NFκB signaling in lung innate immunity toMycoplasmapneumoniae[J]. PLoS One, 2010, 5(12): e14417.
[15]Michelow IC, Katz K, McCracken GH, et al. Systemic cytokine profile in children with community-acquired pneumonia[J]. Pediatr Pulmonol, 2007, 42(7):640-645.
[16]趙季文, 吳移謀, 葉元康. 支原體學[M]. 北京: 人民衛生出版社, 2007.
[17]Xing HY, Cai YQ, Wang XF, et al. The cytoprotective effect of hyperoside against oxidative stress is mediated by the Nrf2-ARE signaling pathway through GSK-3β inactivation[J]. PLoS One, 2015, 10(12): e0145183.
[18]喻思揚, 王 燕, 曾高峰, 等. 阿托伐他汀通過下調NLRP1炎性體表達抑制IL-1β和IL-18的釋放[J]. 中國病理生理雜志, 2016, 32(5):863-868.
[19]Bose S, Segovia JA, Somarajan SR, et al. ADP-ribosylation of NLRP3 byMycoplasmapneumoniaeCARDS toxin regulates inflammasome activity[J]. MBio, 2014, 5(6):e02186-14.
[20]張 涵, 馬 晶, 張云凌, 等. 肺炎支原體經ROS激活NLRP3炎性體誘導RAW264.7細胞分泌IL-1β[J]. 中國病理生理雜志, 2015, 31(12):2244-2248.
(責任編輯: 林白霜, 羅 森)
Hyperoside suppresses injury inMycoplasmapneumoniaepneumonia mice
SHEN Dong-dong, HOU Jiang-hong, YUAN Fei
(DepartmentofPediatrics,HenanProvinceHospitalofTraditionalChineseMedicine,Zhengzhou450002,China.E-mail:shiguirongtcm@163.com)
AIM: To investigate the protective effect of hyperoside (Hyp) onMycoplasmapneumoniae(MP) pneumonia (MPP) mice and the underlying regulatory mechanism. METHODS: BALB/c mice (n=40) were randomly divided into control group, model group, low-dose (12.5 mg/kg) Hyp group and high-dose (50 mg/kg) Hyp group. The MPP model was established using MP standard strains (MPFH) through nasal dripping. The treatment started on the second day, and the follow-up experiments were performed after 3 d. The lung histopathology were detected by HE staining. The levels of C-reactive protein (CRP), alanine aminotransferase (ALT), aspartate transaminase (AST), lactate dehydrogenase (LDH) and MB isoenzyme of creatine kinase (CK-MB) in the serum, and the levels of reactive oxygen species (ROS), superoxide dismutase (SOD) and glutathione (GSH) in the lung tissues were measured by automatic biochemical analyzer. ELISA and Western blot were used to detect interleukine-1 beta (IL-1β), IL-6, IL-18 and tumor necrosis factor-alpha (TNF-α) levels in the serum and lung tissues, respectively. The expression of NLRP3, ASC and caspase-1 at mRNA and protein levels was evaluated by RT-qPCR and Western blot. RESULTS: Compared with control group, the inflammation and alveolar interstitial widening were observed in the lung tissues of model mice, and the CRP, ALT, AST, LDH and CK-MB levels were significantly up-regulated (P<0.05). The ROS level was increased, while SOD and GSH levels were significantly decreased (P<0.05). The levels of IL-1β, IL-6, IL-18 and TNF-α were markedly up-regulated (P<0.05). The protein expression of NLRP3, ASC and caspase-1 was also obviously increased (P<0.05) in model group. Compared with model group, the symptoms above were significantly relieved in Hyp group, and the effect of high-dose Hyp was more apparent than that of the low-dose one. CONCLUSION: Hyperoside suppresses the injury in MPP mice, which may be related to the inhibition of oxidative stress and NLRP3 inflammasome activation.
Hyperoside;Mycoplasmapneumoniaepneumonia; Inflammation; Oxidative stress; Inflammasomes
1000- 4718(2017)05- 0884- 06
2016- 08- 22
2017- 02- 20
R725.6; R363.2+1
A
10.3969/j.issn.1000- 4718.2017.05.019
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0371-60905533; E-mail: shiguirongtcm@163.com

