bcl-3基因通過cyclin D1及Bax蛋白影響人結腸癌RKO細胞的凋亡*
王少敏, 葉 孟, 倪曙民, 葉小磊
(1 寧波大學醫學院附屬醫院腫瘤內科,2寧波市醫學科學研究所,浙江 寧波 315020)
bcl-3基因通過cyclin D1及Bax蛋白影響人結腸癌RKO細胞的凋亡*
王少敏1, 葉 孟1, 倪曙民1, 葉小磊2△
(1寧波大學醫學院附屬醫院腫瘤內科,2寧波市醫學科學研究所,浙江 寧波 315020)
目的: 研究bcl-3基因對人結腸癌RKO細胞遷移及凋亡的影響及機制。方法: 采用人bcl-3基因的RNA干擾慢病毒載體沉默人結腸癌RKO細胞bcl-3基因的表達后,劃痕實驗觀察bcl-3基因沉默前后RKO細胞遷移能力的變化,Annexin V/PI雙染色法檢測bcl-3基因沉默前后RKO細胞凋亡率的變化,Western blot法檢測bcl-3基因沉默前后細胞周期蛋白cyclin D1及凋亡相關蛋白Bax、Bcl-2的變化。結果: 劃痕實驗顯示,劃痕后36 h,bcl-3基因沉默前后RKO細胞劃痕愈合率分別為84.00%及40.00%,差異具有統計學意義(P<0.05)。Annexin V/PI雙染色法流式細胞術分析顯示,bcl-3基因沉默前后的RKO細胞均經5 μmol/L順鉑處理24 h后,沉默前后的RKO細胞凋亡率分別為12.89%及59.67%,差異具有統計學意義(P<0.05)。Western blot法檢測顯示bcl-3基因沉默后cyclin D1蛋白表達顯著下降(P<0.05),Bax蛋白表達顯著上升(P<0.05),但Bcl-2表達無明顯變化(P>0.05)。結論: 沉默bcl-3基因后,RKO細胞遷移能力下降,凋亡率增加,并伴細胞周期蛋白cyclin D1及凋亡相關蛋白Bax表達的變化。bcl-3基因可能通過改變cyclin D1及Bax蛋白的表達而影響RKO細胞的凋亡。
bcl-3 基因; 結直腸腫瘤; 細胞凋亡; 細胞遷移
bcl-3基因定位于19q13。Bcl-3蛋白屬于IκB家族蛋白,具有調節核轉錄因子NF-κB的亞細胞轉位及其DNA結合活性。Bcl-3蛋白表達于多種實體腫瘤及血液腫瘤,在腫瘤的形成及發展中發揮著重要的作用,并與腫瘤的耐藥有一定的相關性[1-5]。同樣結直腸癌組織及細胞中均可見Bcl-3的高表達,在結直腸癌細胞中Bcl-3/NF-κB復合物可通過磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)而激活AKT生長途徑[6]。Bcl-3在結直腸癌轉移灶的表達與預后也存在一定相關性[7]。另有研究顯示Bcl-3對炎癥相關的結直腸癌形成有著抑制作用[3],因此Bcl-3蛋白對腫瘤發生發展的影響可能視細胞類型及環境而改變。本研究小組前期研究發現bcl-3基因高表達于大腸癌RKO細胞并可影響RKO細胞的增殖能力及藥物敏感性[8]。在前期沉默RKO細胞中bcl-3基因表達的基礎上,本研究進一步研究Bcl-3對RKO細胞侵襲凋亡的影響及其機理。
材 料 和 方 法
1 材料
DMEM培養基(Gibco);人結腸腺癌細胞株RKO(中科院上海生化細胞所細胞庫);兔抗人cyclin D1多抗、Bax多抗、Bcl-2多抗及β-actin多抗(Santa Cruz);HRP標記的羊抗兔II抗(武漢博士德生物科技有限公司);Annexin V-FITC 凋亡檢測試劑盒(BD);流式細胞儀(BD)。
2 方法
2.1 細胞培養 RKO細胞常規培養于含10%小牛血清的DMEM培養液中。置于37 ℃、飽和濕度、5% CO2培養箱中。3~4 d傳代1次。取對數生長期細胞,按規定的濃度接種培養用于實驗。
2.2 pLKO.1-TRC-shRNA重組質粒載體構建及轉染 構建含有bcl-3 shRNA的慢病毒質粒載體,進行重組慢病毒顆粒包裝,慢病毒轉染RKO細胞后鑒定轉染效果,篩選成功沉默bcl-3基因表達的RKO細胞。同時將含空載體質粒慢病毒轉染的RKO細胞設為對照。將RKO細胞分設空載體組(vector組)及bcl-3 shRNA穩定干擾組(bcl-3 shRNA組)。具體實驗步驟及方法參見本研究小組前期發表的論文[8]。
2.3 Western blot實驗 分別取vector組細胞及bcl-3 shRNA組細胞進行常規培養,取對數生長期的細胞予以消化,接種于6孔培養板,常規培養48 h后,細胞裂解液裂解細胞,提取總蛋白。BCA法測定蛋白濃度。按照每樣品取60 μg蛋白進行SDS-PAGE,轉至硝酸纖維素膜,封閉過夜,加入 I 抗孵育2 h,TBST洗滌 10 min×3次,加入 II 抗室溫孵育1 h,TBST洗滌 10 min×3次,加顯色發光液,暗室內顯影定影。每組3個復孔細胞,實驗重復3次。掃描膠片后用Quantity One軟件分析各條帶的灰度值, 所得灰度值與對應β-actin蛋白灰度值之比為目的蛋白的相對表達量。
2.4 劃痕試驗 分別取vector組細胞及bcl-3 sh-RNA組細胞加入6孔培養板常規培養,每孔加入約5×105個細胞,培養過夜后取單層融合的RKO細胞,用1 mL槍頭在細胞層上垂直劃痕,以PBS洗細胞3次,去除劃下的細胞,加入無血清培養基,置37 ℃、飽和濕度、5% CO2培養箱內培養。在培養0 h、12 h、24 h及36 h后取樣拍照,用圖像分析軟件ImageJ 1.40G計算劃痕區的面積,根據細胞遷移面積分析細胞的遷移速度。劃痕愈合率=(實驗開始時的劃痕面積-觀察時點的劃痕面積)/實驗開始時的劃痕面積×100%。實驗重復3次,每組3個復孔。
2.5 流式細胞術Annexin V/PI雙染色法檢測細胞凋亡 取適量vector組細胞及bcl-3 shRNA組細胞加入6孔培養板常規培養過夜后,2組細胞均經5 μmol/L終濃度順鉑處理24 h,收集經過處理的RKO細胞,預冷PBS洗滌2次。按照試劑盒說明書,用結合液按照約1×109/L密度進行重懸細胞,取100 μL含細胞的重懸液(約1×105個細胞)。加入5 μL Annexin V-FITC,輕輕混勻,室溫(20~25 ℃)避光孵育15 min;加入5 μL碘化丙啶染色液,輕輕混勻,冰浴避光放置。加入400 μL結合液。1 h內進行流式細胞術檢測。實驗重復3次,每組每次3個樣本。
3 統計學處理
采用SPSS 19.0軟件進行統計學分析。計量資料以均數±標準差(mean±SD)表示,均數間的比較采用獨立樣本t檢驗,以P<0.05為差異有統計學意義。
結 果
1 沉默bcl-3基因抑制RKO細胞的遷移能力
劃痕實驗表明,vector組細胞劃痕后12 h、24 h及36 h的劃痕愈合率分別為32.11%±7.01%、53.56%±14.06%及84.00%±13.01%。bcl-3 shRNA組細胞劃痕后12 h、24 h及36 h的劃痕愈合率分別為19.11%±3.33%、26.00%±3.61%及40.00%±7.73%。2組細胞在3個時點的劃痕愈合率差異均具有統計學意義(P<0.05),見圖1。

Figure 1.Migration ability of RKO cells was detected by wound healing assay. Mean±SD.n=9.*P<0.05vsvector group.
圖1 細胞劃痕試驗檢測RKO細胞遷移能力
2 沉默bcl-3基因促進RKO細胞對順鉑誘導的凋亡
細胞經Annexin V/PI染色后行流式細胞術分析,實驗結果顯示,vector組及bcl-3 shRNA組的細胞在5 μmol/L終濃度順鉑處理24 h后細胞凋亡率為59.67%±8.92%,而vector組的細胞凋亡率為12.89%±5.88%,2組凋亡率差異具有統計學意義(P<0.05),表明沉默bcl-3基因后RKO細胞對順鉑誘導的凋亡明顯增加,見圖2。

Figure 2.Apoptotic rate was analyzed by flow cytometry with Annexin V/PI staining after using cisplatin to induce the apoptosis of RKO cells. Mean±SD.n=9.*P<0.05vsvector group.
圖2 順鉑誘導RKO細胞凋亡后Annexin V/PI雙染色法檢測細胞凋亡率
3 沉默bcl-3基因對cyclin D1及凋亡相關蛋白表達的影響
Vector組細胞及bcl-3 shRNA組細胞中細胞周期蛋白cyclin D1的相對表達量分別為1.48±0.72及0.74±0.47 (P<0.05),促凋亡蛋白Bax的相對表達量分別為0.87±0.28及1.46±0.44 (P<0.05),抑凋亡蛋白Bcl-2的相對表達量分別為1.03±0.37及0.81±0.32 (P>0.05)。因此沉默bcl-3基因后cyclin D1表達顯著下降,Bax表達顯著升高,而Bcl-2蛋白表達無明顯變化,見圖3。
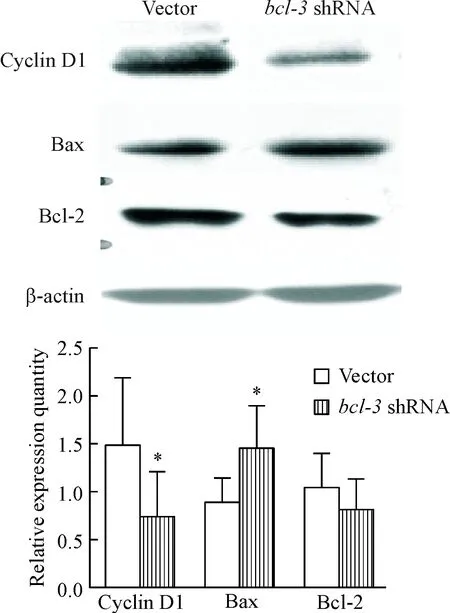
Figure 3.The relative expression levels of the proteins in the RKO cells were detected by Western blot. Mean±SD.n=9.*P<0.05vsvector group.
圖3 Western blot法檢測RKO細胞中蛋白的相對表達量
討 論
bcl-3基因最初在B細胞慢性淋巴細胞白血病亞型的t(14;19) 易位中被發現。此后的研究顯示,Bcl-3蛋白在多種實體腫瘤中均可見過度表達,并可對促進腫瘤形成的基因進行調控,發揮著促進腫瘤形成及生長的作用[1]。Bcl-3在胞核內通過與p50 及p52 形成異源復合物而擔任轉錄激活劑或轉錄抑制劑,激活或抑制靶基因的轉錄。Bcl-3蛋白的表達及激活可發現于膠質瘤、乳腺癌、鼻咽癌、肝癌、大腸癌、前列腺癌、黑色素瘤及多種皮膚腫瘤[1,9-10]。我們前期的研究表明,Bcl-3蛋白高表達于結腸癌RKO細胞中[8],沉默bcl-3基因表達后,RKO細胞增殖能力下降,并對奧沙利鉑的敏感性增強。細胞凋亡受抑是腫瘤發生的一個重要原因,會導致腫瘤的過度生長。本研究顯示沉默bcl-3基因的表達后,順鉑誘導的RKO細胞早期凋亡率及晚期凋亡率顯著增加,這表明Bcl-3可通過增加細胞凋亡而影響RKO細胞生長,這和我們前期的研究結果是一致的[8]。細胞凋亡的增加也有助于提高藥物敏感性,是潛在的治療途徑之一[11]。
Bcl-3對腫瘤轉移影響的研究顯示,ErbB2陽性乳腺癌的小鼠在敲除bcl-3基因表達后轉移灶的生長明顯減慢,但對腫瘤原發灶的生長無明顯影響,同樣bcl-3基因敲除后ErbB2陽性乳腺癌細胞的侵襲遷移能力下降61%[12]。針對結直腸癌的研究顯示,抑制Bcl-3表達后可阻滯大腸癌細胞周期的G1/S期轉變,并通過降低c-Myc蛋白的表達而抑制腫瘤生長[13]。結腸癌細胞核內Bcl-3的表達與患者生存顯著相關,高表達預示生存期短[7]。目前Bcl-3對結直腸癌的侵襲遷移能力未見相關研究,本研究的劃痕實驗顯示RKO細胞中沉默bcl-3基因后,RKO細胞的劃痕愈合率顯著降低,因此bcl-3基因影響結腸癌細胞的運動遷移能力,值得進一步探索其在體內是否有助于結直腸癌的浸潤及轉移。
Bcl-3蛋白可靶向多種基因,誘導基因的轉錄激活或抑制[14]。Westerheide等[15]在人類乳腺上皮細胞中發現Bcl-3通過促進cyclin D1的表達而增強G1期轉換,且Bcl-3使得Rb磷酸化程度增高。Park等[16]研究也表明,HBx上調Bcl-3后導致核內p52/Bcl-3復合物增高,進而導致cyclin D1上調表達,HBx這種cyclin D1上調方式可能在HBx介導的肝細胞肝癌形成及發展中發揮著重要作用。近期研究同樣顯示,肝癌細胞中Bcl-3通過影響cyclin D1的表達而影響細胞的增殖及細胞周期[17]。本研究在結腸癌RKO細胞中的Western blot 分析結果顯示,沉默bcl-3基因可通過上調凋亡促進蛋白Bax的表達而促進細胞凋亡。但沉默bcl-3基因后凋亡抑制蛋白Bcl-2的表達下降不明顯,因此Bcl-2蛋白可能對Bcl-3促進腫瘤形成的影響甚微。同樣我們觀察到沉默bcl-3基因表達后cyclin D1表達下降,cyclin D1為細胞周期蛋白而具有促進細胞由G期進入S期,在多種腫瘤中過表達并在其形成發展中發揮著重要的作用。因此,這些研究表明Bcl-3在多種腫瘤中通過調控cyclin D1的表達而影響腫瘤的生長發展。
綜上所述,結合前期研究及本課題組的研究表明bcl-3基因在結直腸癌中可能通過抑制凋亡、影響細胞周期而促進腫瘤的形成發展,機理上主要通過調控PI3K和mTOR信號途徑及影響c-Myc、AKT、Bax及cyclin D1等蛋白的表達。同樣bcl-3基因也影響著結腸癌細胞的侵襲遷移能力。盡管bcl-3基因在結直腸癌中得到較多的闡明,但由于腫瘤本身是個分子生物學基礎復雜的疾病并涉及多種信號途徑,Bcl-3在結直腸癌中與其它信號蛋白調控關系及在侵襲轉移中作用機理等仍有待于進一步研究,Bcl-3在結直腸癌中的臨床意義更值得進一步探索。
[1] Maldonado V,Melendez-Zajgla J.Role of Bcl-3 in solid tumors[J].Mol Cancer,2011, 10:152.
[2] Leyh B, Dittmer A, Lange T, et al. Stromal cells promote anti-estrogen resistance of breast cancer cells through an insulin-like growth factor binding protein 5 (IGFBP5)/B-cell leukemia/lymphoma 3 (Bcl-3) axis[J]. Oncotarget, 2015, 6(36):39307-39328.
[3] Tang W, Wang H, Ha HL, et al. The B-cell tumor promoter Bcl-3 suppresses inflammation-associated colon tumorigenesis in epithelial cells[J]. Oncogene, 2016, 35(48):6203-6211.
[4] Mansour NM, Bernal GM, Wu L, et al. Decoy receptor DcR1 is induced in a p50/Bcl3-dependent manner and attenuates the efficacy of temozolomide[J]. Cancer Res, 2015, 75(10):2039-2048.
[5] Schlette E, Rassidakis GZ, Canoz O, et al. Expression of Bcl-3 in chronic lymphocytic leukemia correlates with trisomy 12 and abnormalities of chromosome 19[J]. Am J Clin Pathol, 2005, 123(3):465-471.
[6] Urban BC, Collard TJ, Eagle CJ, et al. Bcl-3 expression promotes colorectal tumorigenesis through activation of AKT signalling[J]. Gut, 2016, 65(7):1151-1164.
[7] Puvvada SD, Funkhouser WK, Greene K, et al. NF-κB and Bcl-3 activation are prognostic in metastatic colorectal cancer[J]. Oncology, 2010, 78(3-4):181-188.
[8] 王少敏, 葉小磊, 倪曙民, 等.bcl-3基因沉默對Bcl-3高表達的人大腸癌RKO細胞增殖和藥物敏感性的影響[J]. 中國病理生理雜志, 2013, 29(8):1412-1416.
[9] Kuphal S, Shaw-Hallgren G, Eberl M, et al. GLI1-dependent transcriptional repression of CYLD in basal cell carcinomar[J]. Oncogene, 2011, 30(44): 4523-4530.
[10]Ahlqvist K, Saamarthy K, Syed Khaja AS, et al. Expression of Id proteins is regulated by the Bcl-3 proto-oncogene in prostate cancer[J]. Oncogene, 2013, 32(12):1601-1608.
[11]袁素娟, 喬田奎, 高彩霞, 等. TLR9激活后影響人非小細胞肺癌細胞對多西他賽化療敏感性的體外實驗[J]. 中國病理生理雜志, 2016, 32(10):1799-1806.
[12]Wakefield A, Soukupova J, Montagne A, et al. Bcl3 selectively promotes metastasis of ERBB2-driven mammary tumors[J]. Cancer Res, 2013, 73(2):745-755.
[13]Liu Z, Jiang Y, Hou Y, et al. The IκB family member Bcl-3 stabilizes c-Myc in colorectal cancer[J]. J Mol Cell Biol, 2013, 5(4):280-282.
[14]Schuster M, Annemann M, Plaza-Sirvent C, et al. Atypical IκB proteins: nuclear modulators of NF-κB signaling[J]. Cell Commun Signal, 2013, 11(1):23.
[15]Westerheide SD, Mayo MW, Anest V, et al. The putative oncoprotein Bcl-3 induces cyclin D1 to stimulate G1transition[J]. Mol Cell Biol, 2001, 21(24):8428-8436.
[16]Park SG, Chung C, Kang H, et al. Up-regulation of cyclinD1 by HBx is mediated by NF-κB2/BCL3 complex through κB site of cyclin D1 promoter[J]. J Biol Chem, 2006, 281(42):31770-31777.
[17]Tu K, Liu Z, Yao B, et al. BCL-3 promotes the tumor growth of hepatocellular carcinoma by regulating cell proli-feration and the cell cycle through cyclin D1[J]. Oncol Rep, 2016, 35(4):2382-2390.
(責任編輯: 林白霜, 羅 森)
Effects of bcl-3 gene silencing on apoptosis of human colon cancer cell line RKO
WANG Shao-min1, YE Meng1, NI Shu-min1, YE Xiao-lei2
(1DepartmentofMedicalOncology,AffiliatedHospitalofMedicalCollege,NingboUniversity,2NingboInstituteofMedicalSciences,Ningbo315020,China.E-mail: 13780009482@163.com)
AIM: To investigate the effects ofbcl-3 gene on the migration and apoptosis of human colon cancer cell line RKO, and the changes of cyclin D1 and apoptosis-related proteins. METHODS: After silencing ofbcl-3 gene expression in human colon cancer cell line RKO by lentiviral vector with RNA interference, the changes of RKO cell migration ability were investigated by wound healing assay. The changes of RKO cell apoptotic rate afterbcl-3 gene silencing were detected by flow cytometry with Annexin V/PI staining. The protein expression of cyclin D1 and apoptosis-related proteins in the RKO cells afterbcl-3 gene silencing was determined by Western blot.RESULTS: The wound healing rates of the RKO cells were 84.00% and 40.00% before and afterbcl-3 gene silencing, respectively, with statistically significant difference (P<0.05). Annexin V/PI staining showed that the cell apoptotic rates were 12.89% and 59.67% before and afterbcl-3 gene silencing, respectively, when RKO cells were treated with 5 μmol/L cisplatin for 24 h, with statistically significant difference (P<0.05). The expression of cyclin D1 decreased, while the expression of Bax increased afterbcl-3 gene silencing (P<0.05). CONCLUSION: Afterbcl-3 gene silencing, the migration ability of RKO cells decreases, and the apoptotic rate increases, accompanying with the changes of cyclin D1 and Bax.bcl-3 gene can affect the apoptosis of RKO cells by changing the expression of cyclin D1 and Bax.
bcl-3; Colorectal neoplasms; Apoptosis; Cell migration
1000- 4718(2017)05- 0939- 05
2016- 07- 18
2017- 03- 17
寧波市社會發展科研項目(No. 2011C50010)
R730.23
A
10.3969/j.issn.1000- 4718.2017.05.029
雜志網址: http://www.cjpp.net
△ 通訊作者Tel: 0574-87035808; E-mail: 13780009482@163.com

