葡萄籽原花青素聚合度分析方法的研究
高德艷,梁紅敏,任繼波,張晶瑩,胡文效
(山東省葡萄研究院,山東濟南250100)
葡萄籽原花青素聚合度分析方法的研究
高德艷,梁紅敏,任繼波,張晶瑩,胡文效*
(山東省葡萄研究院,山東濟南250100)
優化葡萄籽原花青素物質的量測定方法,確定比色條件,建立標準曲線。該方法線性范圍為0.055 μmol/mL~0.275 8 μmol/mL,檢出限為2.912×10-4μmol/mL,加標回收率在95%~100%,精密度RSD為0.757 1%;通過建立原花青素聚合度計算方法,測定不同原花青素聚合度進行驗證試驗,試驗結果證實該法靈敏度高、重現性良好,適用于不同原花青素聚合度的分析。
原花青素;聚合度;葡萄籽
隨著我國葡萄產業的迅速發展,葡萄籽作為葡萄產業的資源性副產物具有很高的利用價值。葡萄籽中含有豐富的原花青素,原花青素(Proanthocyanidins)是由兒茶素、表兒茶素及其沒食子酸酯類縮合而成的多酚類化合物,具有較強的抗氧化活性,在醫藥、食品、保健品及化妝品行業具有廣泛的應用前景。根據聚合度不同,原花青素分為低聚體原花青素(OPC,聚合度DP≤5)和高聚體原花青素(PPC,聚合度>5);由于單體組成及成鍵類型不同,同一聚合度原花青素有多種異構體,形成復雜混合物。不同聚合度原花青素抗氧化活性不同,大量研究證實隨著原花青素聚合度的增加,其抗氧化活性和對羥自由基和超氧陰離子自由基清除能力逐漸降低[1-2]。
文獻中原花青素聚合度的分析方法主要有硫解-HPLC法[3]、RP-HPLC-MS聯用法[4]、薄層層析法及凝膠滲透色譜法[5]。其中凝膠色譜法是利用不同分子量聚苯乙烯為標準品測定原花青素分子量,該法適用于大分子單一化合物分子量的測定,不適用于低分子量原花青素及混合原花青素聚合度的測定。Kennedy等[6]用RP-HPLC法分析酸催化裂解原花青素產物,得到原花青素平均聚合度,該法需要與質譜聯用,操作復雜,并且由于水解不完全導致與實際聚合度的偏差。前兩個方法操作較復雜,測定時間長,同時也受到標準品的限制,該法不易推廣。有研究表明:原花青素在乙酸體系中僅末端黃烷-3-醇參與香草醛反應,而在甲醇溶劑體系中各黃烷-3-醇均參與反應[3],根據此原理可建立測定原花青素物質的量的方法。
本研究在香草醛-硫酸(甲醇體系)測定原花青素質量的基礎上,研究原花青素物質的量測定方法,優化反應體系各反應條件,建立一種快速分析原花青素聚合度的方法,并對該方法進行評價及驗證性試驗。
1 材料與方法
1.1 試劑與儀器
兒茶素(純度>98%):美國sigma試劑公司;原花青素(純度>95%):天津尖峰天然產物研究開發有限公司、浙江森宇天然產物有限公司;原花青素B2(純度>98%):天津尖峰天然產物研究開發有限公司;香草醛、乙酸、甲醇、鹽酸(均為分析純):國藥集團化學試劑有限公司。
UV5200紫外可見分光光度計:上海美譜達儀器有限公司;電熱恒溫水浴鍋:廣東環凱儀器有限公司;WND-200型高速中藥粉碎機:浙江省蘭溪市偉能達電器有限公司;RE-52AA型旋轉蒸發器:上海亞榮生化儀器廠。
1.2 方法
1.2.1 原花青素物質的量濃度曲線建立及方法評估
采用香草醛比色法測定原花青素物質的量濃度。具體反應條件:配制0.016 g/L~0.080 g/L(+)-兒茶素-乙酸溶液、含4%(體積分數)鹽酸0.5 g/100 mL香草醛-乙酸溶液,避光反應一定時間后于400 nm~600 nm范圍內掃描,測定最大吸收波長。
考察不同反應條件(試劑體積比、反應溫度、反應時間)對吸光值的影響,確定最佳反應條件,繪制原花青素物質的量濃度-吸光值標準曲線,并對該標準曲線的線性范圍、檢出限及回收率進行計算與分析。
1.2.2 樣品聚合度的計算
通過對不同已知聚合度原花青素進行測定與分析,考察該方法的適用性。采用上述1.2.1方法測定原花青素的物質的量濃度,結合香草醛-硫酸法[8]測定原花青素質量可計算原花青素聚合度(DP),聚合度計算公式如下:
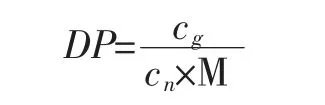
式中:cg為原花青素質量濃度,g/L;cn為原花青素物質的量濃度,moL/L;M為(+)-兒茶素摩爾質量,290 g/moL。
2 結果與討論
2.1 反應條件的選擇
原花青素與香草醛反應產物在光照條件下不穩定,因此反應和測定時需在避光條件下進行。
2.1.1 最大吸收波長
在1 mL兒茶素-乙酸溶液(濃度0.05 mol/L)加入5 mL香草醛-乙酸溶液,室溫避光下反應5 min后在400 nm~600 nm范圍內掃描,以最大吸收波長作為檢測波長見圖1。
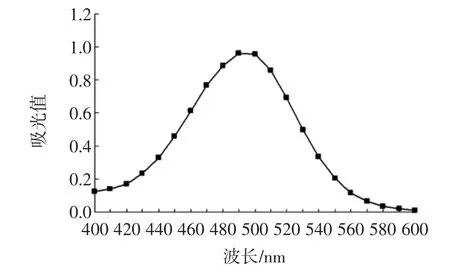
圖1 檢測波長-吸光值曲線Fig.1 Detection wavelength-absorbance curve
由圖1可知,以乙酸為溶劑時,產物的最大吸收波長為500 nm。確定檢測原花青素物質的量濃度波長為500 nm。
2.1.2 體積比的確定
為了確保試樣中原花青素與香草醛反應完全,對檢測過程中所需的香草醛溶液與待測樣品體積比對吸光值的影響進行研究,即在1 mL兒茶素溶液中分別按體積比1∶2、1∶4、1∶6、1∶8和1∶10加入香草醛-乙酸溶液,室溫下避光反應5 min,測定500 nm下的吸光值,并轉化為單位體積反應溶液的吸光度,結果如圖2所示。
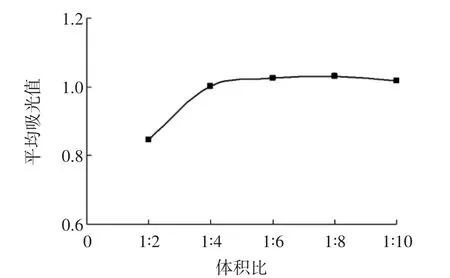
圖2 體積比-吸光值曲線Fig.2 Volume-absorbance value curve
由圖2可看出,香草醛與試樣體積比對反應吸光值影響較大,隨著香草醛體積的增加,吸光值增加,當在樣品與香草醛體積比為1∶5時,繼續增加香草醛吸光值不再增加,此時原花青素與香草醛反應基本完全。因此樣品溶液與香草醛試劑的最佳體積為1∶5。
2.1.3 反應溫度及反應時間的確定
考察不同反應溫度(20、25、30、35、40、50℃)及不同反應時間(1 min~20 min)對吸光值的影響,確定最佳反應溫度及反應時間,結果如圖3所示。

圖3 反應溫度與時間-吸光值曲線Fig.3 The reaction temperature and time-absorbance value curve
由上圖3可以看出,隨著反應溫度的升高,吸光值逐漸降低,并隨反應時間的延長有所降低。其中在20℃反應條件下,樣品吸光值在20 min內較穩定且反應較完全,因此選擇反應溫度為20℃。從時間曲線可看出在較短時間內(5 min~7 min)酚醛縮合反應較完全,之后吸光值有所降低。確定香草醛與試樣反應時間為6 min。
2.2 方法評價
2.2.1 標準曲線和檢測限
在2.1.1~2.1.3單因素試驗最佳條件下繪制原花青素物質的量濃度-吸光值標準曲線,結果見圖4。
從圖4可看出在500 nm處吸光度x與物質的量濃度呈良好的線性關系,其回歸方程y=0.172x+ 0.000 7,相關系數R2=0.999 6。其中,x為吸光度,y為物質的量濃度(μmol/mL),其線性范圍為0.055 μmol/mL~0.275 8 μmol/mL,計算的檢出限為LOD=3Σ/s=2.912× 10-4μmol/mL,說明該方法的靈敏度高。
2.2.2 精密度
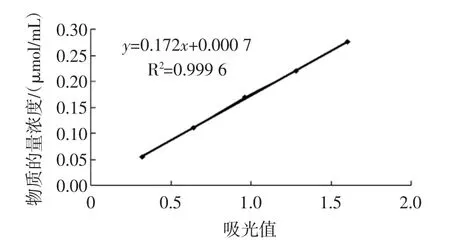
圖4 原花青素物質的量濃度-吸光值標準曲線Fig.4 The amount of substance concentration of proanthocyanidins-absorbance value of the standard curve
取兩種不同濃度的樣品溶液分別平行測定5次進行精密度試驗,結果見表1。不同濃度樣品的RSD(平均標準偏差)均小于1.0%,說明本法重現性好,符合測定要求。

表1 精密度試驗結果Table 1 Precision test results
2.2.3 回收率
取原花青素待測樣品溶液1 mL(物質的量為0.032 μmol)各5份,分別加入0.010、0.020、0.040、0.08 μmol的(+)-兒茶素標準品,測定物質的量以及計算回收率,回收率計算結果見表2。

表2 回收率試驗結果Table 2 Recovery test results
由表2可知,該法測定原花青素物質的量濃度線性范圍較寬,原花青素回收率(回收率/%=(加標試樣測定值-試樣測定值)/加標量×100)在95%~100%的理想范圍內,說明本法準確性高。
2.3 樣品聚合度
通過不同已知聚合度范圍原花青素為參考,測定其物質的量計算并計算出聚合度進行方法驗證,結果見表3。

表3 不同原花青素聚合度分析Table 3 Analysis of polymerization degree of different procyanidins
由表3可知,對不同原花青素(已知聚合度范圍)通過2.2.1方法膠進行聚合度測定,試驗結果表明該法重現性良好,適用于聚合度10以內的原花青素聚合度的測定與分析。
3 討論
本方法確定原花青素物質的量測定方法,結合原花青素質量測定方法分析其聚合度。通過已知聚合度范圍原花青素為參考依據驗證該方法的適用性,試驗結果顯示該法適用于不同聚合度(2~10)原花青素及原花青素混合物聚合度的分析;值得說明的是,對于原花青素混合物,該法分析得到的聚合度為原花青素平均聚合度;對于純度不高的原花青素,分析其聚合度為樣品中原花青素的平均聚合度,雜質對其無影響。綜上所述該法簡單易行、重現性良好,適用于不同原花青素聚合度的分析。
[1]孫蕓,谷文英.葡萄籽原花青素聚合度與功效關系的研究[D].無錫:江南大學,2004
[2] 趙丹,曾新安,徐中岳.不同聚合度葡萄皮原花青素的抗氧化活性[J].食品與發酵工業,2012,38(4):104-107
[3] Larry G Butler,Martin L Price,Jeffery E Brothertod.Vanillin Assay for Proanthocyanidins(Condensed Tannins):Modification of the Solvent for Estimation of the Degree of Polymerization[J].Agric Food Chem,1982,30:1087-1089
[4]任其龍,魏冠紅,金米聰,等.反相高效液相色譜-電噴霧質譜法鑒定葡萄籽低聚原花青素[J].食品與發酵工藝,2006,32(3):79-83
[5]張佰清,閆冬雪.薄層及凝膠色譜法測定樹莓籽原花青素的平均聚合度[J].食品工業科技,2013,34(11):317-319
[6] James A Kennedy,Graham P Jones.Analysis of proanthocyanidin cleavage products following acid-catalysis in the presence ofexcess phloroglucinol[J].J Agric Food Chem,2001,49(4):1740-1746
[7] 張晶瑩,胡文效,高德艷,等.葡萄籽原花青素檢測方法的比較[J].中外葡萄與葡萄酒,2013(6):18-20
Study on Analytical Methods of Grape Seed Proanthocyanidins Polymerization Degree
GAO De-yan,LIANG Hong-min,REN Ji-bo,ZHANG Jing-ying,HU Wen-xiao*
(Shandong Academy of Grape,Jinan 250100,Shandong,China)
This paper optimized the amount of substance concentration of grape seed proanthocyanidins measurement method to determine the colorimetric condition,a standard curve was established.The amount of substance concentration of proanthocyanidins measurement conditions,establish a standard curve,the standard curve range 0.055 μmol/mL-0.275 8 μmol/mL,the detection limit was 2.912×10-4μmol/mL,the recoveries of 95%-100%,precision of RSD was 0.757 1%;test verified by measuring different degree of polymerization of proanthocyanidins,the results confirmed that the method of high sensitivity and good reproducibility.The method was suitable for the analysis different DP of proanthocyanidins.
procyanidins;the degree of polymerization;grape seed
10.3969/j.issn.1005-6521.2017.10.029
2016-08-25
山東省農業重大應用技術創新項目
高德艷(1988—),女(漢),碩士,主要從事生物活性成分活性分離、活性評價等方向研究。
*通信作者:胡文效,男,研究員,研究方向:生物化工專業生物分離方向、食品科學與工程專業葡萄與葡萄酒方向。

