矮稈小粒水稻瀟湘矮的形態學與分子遺傳學分析
呂育松謝耘豐圣忠華鄔亞文唐紹清胡培松魏祥進,*
(1中國水稻研究所國家水稻改良中心/水稻生物學國家重點實驗室,杭州310006;2杭州師范大學生命與環境科學學院,杭州310036;#共同第一作者;*通訊聯系人,E-mail:weixiangjin@caas.cn)
矮稈小粒水稻瀟湘矮的形態學與分子遺傳學分析
呂育松1,#謝耘豐1,2,#圣忠華1鄔亞文1唐紹清1胡培松1魏祥進1,*
(1中國水稻研究所國家水稻改良中心/水稻生物學國家重點實驗室,杭州310006;2杭州師范大學生命與環境科學學院,杭州310036;#共同第一作者;*通訊聯系人,E-mail:weixiangjin@caas.cn)
【目的】研究揭示瀟湘矮矮稈小粒的遺傳機制,為瀟湘矮的育種利用提供理論基礎。【方法】利用水稻育種過程中自然突變而得到的穩定遺傳的矮稈小粒水稻材料瀟湘矮,對其進行農藝性狀考查、赤霉素(GA3)和油菜素內酯(BR)敏感性分析、遺傳學分析,并利用瀟湘矮與其近等基因系NIL(NIP)衍生的F2群體對控制矮稈小粒的基因xxa進行圖位克隆,最終利用轉基因互補試驗驗證候選基因。【結果】瀟湘矮除表現為矮稈小粒外,其穗長變短,穗型緊湊,千粒重極顯著下降。不同濃度梯度的赤霉素(GA3)和油菜素內酯(BR)處理,發現瀟湘矮對GA3部分敏感,而對BR不敏感。遺傳分析發現其符合孟德爾3∶1分離規律。圖位克隆將xxa基因定位于第5染色體InDel標記F81和F82之間約70 kb區間的物理距離內。該區間包含8個開放閱讀框(ORF)。其中,第5個ORF(LOC_Os05g26890)被注釋為水稻株高基因D1。序列分析發現,瀟湘矮的D1基因在第5和12外顯子分別有1個堿基的無義替換和3個堿基的缺失,其中第12外顯子3個堿基的缺失導致1個賴氨酸的缺失。轉基因互補顯示D1可以恢復瀟湘矮的表型。【結論】瀟湘矮控制株高的途徑可能與GA3代謝有關;瀟湘矮矮稈小粒表型符合單隱性核基因控制的遺傳規律;瀟湘矮矮稈小粒性狀是由D1基因突變所致。
水稻;矮稈小粒;圖位克隆;機械化制種
水稻矮稈突變體對于研究水稻株高的調控機制具有重要的意義。到目前為止已經有60多個的水稻矮稈突變體被鑒定[5]。很多矮稈突變體除了表現為矮稈之外,還表現出一些其他表型特征,如小粒、多分蘗、窄葉、卷葉等[5]。水稻矮稈、半矮稈基因主要與植物激素赤霉素(GA)、油菜素內酯(BR)、獨腳金內酯素(SLs)等的合成與信號傳導途徑有關[6-9]。其中,“綠色革命”中使用的半矮稈栽培品種,就是由于赤霉素的合成或信號傳導途徑基因改變,如sd1屬于赤霉素的生物合成途徑缺陷突變體,gid1、d1等屬于赤霉素信號傳導缺陷突變體[8-9]。SD1參與赤霉素的生物合成,該基因編碼赤霉素合成途徑中關鍵酶GA20氧化酶,該基因的突變導致水稻不同程度矮化[10-11]。GA代謝途徑中,受體蛋白GID1通過降解DELLA蛋白介導水稻中GA的信號傳導。gid1突變體表現株高嚴重矮化、不育等性狀[12]。Dwarf 1(D1)參與了依賴G蛋白的GA信號傳導,是水稻中第一個鑒定出的GTP結合蛋白(G蛋白)α亞基。d1突變體多表現為水稻株高矮化,莖稈增粗;葉片短且寬,谷粒小而圓,節間密集等。隨著研究的深入,功能也逐步清晰。異三聚體G蛋白存在于多種真核生物中,由G蛋白α亞基(D1)、β亞基和γ亞基3個亞基構成。在通常狀態下,這3個亞基結合在一起,直到一個配基被G蛋白偶聯受體(GPCR)檢測到,一起參與GA應答以及信號傳導[13-14]。此外,水稻矮稈突變體d2、d11、d61等被證實為BR生物合成或信號傳導相關基因發生突變所致[15-17];而d27、d10、d14、d3、d53則被證實為與SLs生物合成或信號傳導相關基因發生突變所致[9,18-19]。水稻株高除受一些主基因控制之外,也受大量微效數量基因控制,關于水稻株高相關的QTL定位也有大量研究報道[20-22]。因此,水稻株高調控具有極其復雜的遺傳機制,鑒定、解析新的矮稈、半矮稈資源仍然是分子生物學和遺傳育種學的關注熱點。
本研究以矮稈小粒水稻瀟湘矮為研究對象,從形態學、生理學等角度分析了其矮稈小粒特征,并對其矮稈小粒基因進行了圖位克隆和功能驗證,為瀟湘矮在水稻育種中的應用潛力提供理論依據。
1 材料與方法
1.1 試驗材料
矮稈小粒水稻瀟湘矮(Xiaoxiang’ai,XXA)為水稻育種中自然突變產生,具有穩定的矮化、小粒表型[23]。瀟湘矮與半矮稈品種日本晴、02428、熱研1號和Y01衍生的F1及F2群體用來對矮稈小粒基因進行遺傳分析。從日本晴與瀟湘矮的F2群體中選高稈單株連續與瀟湘矮回交3代并自交,選擇出株高類似日本晴的BC3F2單株為瀟湘矮的高稈近等基因系NIL(NIP)。矮稈小粒基因定位群體為瀟湘矮與NIL(NIP)雜交的F2群體。所有材料均于正季種植于中國水稻研究所杭州富陽試驗基地,種植與管理方法同大田生產。
1.2 外源赤霉素(GA3)和油菜素內酯(BR)處理
NIL(NIP)和瀟湘矮種子用1%次氯酸鈉消毒,浸種、催芽各24 h后,選取芽長一致的20粒種子
于含梯度濃度GA3(0、1×10-10、1×10-9、1×10-8、1×10-7、1×10-6、1×10-5、1×10-4mol/L)和BL(0、1×10-10、1×10-9、1×10-8、1×10-7、1×10-6mol/L)的50%MS固體培養基培養,30℃下持續光照培養1或2周(GA3為1周,BR處理2周)后,測量每株幼苗第2葉葉鞘長度。每個濃度梯度設置3個重復。
1.3 基因定位與候選基因分析
由《社會管理和公共服務綜合標準化試點細則(試行)》② 2013年7月,標準委、教育部等25部委印發《社會管理和公共服務綜合標準化試點細則(試行)》,細則中第二條對“社會管理和公共服務綜合標準化試點”的定義作了詳細解釋。引申得出,社會管理和公共服務綜合標準化是采用綜合標準化方法,開展以制定標準、組織實施標準、對標準實施進行監督為主要內容,以實現管理規范、服務質量良好、公眾滿意度高為目標,促進提高社會管理科學化水平、推動基本公共服務均等化、加強保障和改善民生的活動。
從瀟湘矮和NIL(NIP)衍生的F2群體中挑選出矮稈小粒的隱性單株,提取其DNA。首先分析瀟湘矮與NIL(NIP)之間的多態性SSR標記,之后利用22株F2矮稈小粒的隱性單株調查每個多態性標記與瀟湘矮矮稈小粒性狀之間的連鎖關系,對突變體基因進行初步定位。最后以786株F2矮稈小粒單株為材料,用新開發的6對SSR或InDel多態性標記對矮稈小粒基因進行精細定位(表1)。利用水稻基因組注釋數據庫(Rice Genome Annotation Project)對精細定位區間進行基因預測,并通過對候選基因進行序列分析,最終確定瀟湘矮矮稈小粒候選基因。
1.4 載體構建與轉基因
以PCR引物lv-1(序列:TTTGGATCC ATG GGCTCATCCTGTAGCAG,TTTGTCGACTCAAG TTCCTTCCCTGGAGC)從NIL(NIP)中擴增瀟湘矮矮稈小粒候選基因完整基因組序列,利用限制線內切酶BamHⅠ和SalⅠ將其克隆到雙元表達載體pCUbi1390載體上。利用農稈菌介導法將候選基因(啟動子為玉米Ubi啟動子)轉入瀟湘矮中。水稻愈傷組織誘導、分化,轉化、篩選等方法參見文獻[24]。

表1 本研究中基因定位所用引物Table 1.Primers for mapping in the study.
1.5 RNA提取與熒光定量PCR
分別以3周大小的瀟湘矮以及互補轉基因家系幼苗為材料,利用提取RNA試劑盒(北京鼎國昌盛生物技術有限公司)提取地上部分總RNA,用Primer premier 5設計D1定量PCR引物,前引物為ATTG ATGGCAGGTTGGATTA,后引物為GTTTCCTGA ATGGCTGGGTC;內參Ubquitin定量PCR引物,前引物為F(CTTGGTCGTGTCCCGT),后引物為R(TCCATGCTGCTCTACCAC)。實驗儀器為高通量實時熒光定量PCR系統LightCycler?480Ⅱ,通過特定的熒光定量PCR產物的溶解曲線的單峰來判定引物的特異性,適合進行定量PCR。
2 結果與分析
2.1 瀟湘矮表型以及形態學分析
瀟湘矮株高從苗期開始就明顯矮于其近等基因系,成熟后其株高約為NIL(NIP)的60%,同時穗長變短,穗型緊湊,粒型為小圓粒型(圖1-A~E)。另外,瀟湘矮的結實率、千粒重、粒長相比其近等基因系也顯著下降,其中千粒重約為NIL(NIP)的45%,而有效穗數、粒寬等與NIL(NIP)差異不明顯(圖1-F~J)。比較植株各節間長度發現,相對于近等基因系,XXA植株主莖的第1、2和3節間及穗長都顯著短于NIL(NIP)(圖2-A、B)。
2.2 瀟湘矮對GA3、BR敏感性分析
水稻株高的調控多與植物激素如赤霉素、油菜素內酯等的合成、代謝有關[5]。我們對瀟湘矮及其NIL(NIP)設置了GA3和BR的梯度濃度處理(圖3)。結果顯示,施加外源BR后,瀟湘矮與NIL(NIP)的第2葉葉鞘長度并沒有明顯改變(圖3-B),說明調控瀟湘矮株高的基因可能與BR合成無關。不同于BR處理,瀟湘矮和NIL(NIP)的株高對GA3具有敏感性,隨著GA3濃度的逐漸上升,它們第2葉葉鞘長度逐漸增加,雖然瀟湘矮第2葉葉鞘的長度始終短于NIL(NIP),但是它們對GA3的響應速率基本一致(圖3-A)。
2.3 瀟湘矮矮稈小粒的遺傳學分析及基因定位
我們將瀟湘矮與半矮稈表型的日本晴、熱研1號、0248、Y01雜交獲得F1組合,結果顯示所有F1組合植株都表現為半矮稈正常株型,其衍生的4個F2群體中正常半矮稈與類似瀟湘矮的矮稈小粒株型分離,比例符合3∶1(表2)。因此,我們推測相對于日本晴等半矮稈水稻品種,瀟湘矮發生了單基因突變,其矮稈小粒表型符合單隱性核基因控制的遺傳規律,并將該突變體基因暫命名為xxa。同時,通過連續回交及雜交,我們構建了株型表現為正常半矮稈植株的近等基因系NIL(NIP)。對從瀟湘矮和NIL(NIP)衍生的F2群體中挑選出的22株矮化小粒突變體單株進行連鎖分析,發現矮稈小粒性狀與第5染色體長臂上SSR標記RM182402、RM18457存在連鎖。利用從F2中選出的96株矮化小粒單株將突變體基因初步定位于RM18420和RM18450間約2 cM的區間內(圖4-A)。通過加密標記,并從F2中共挑選786株矮化小粒單株,突變體基因xxa最終被定位在第5染色體的InDel標記F81和F82間約70 kb區間的物理距離內(圖4-A)。利用國際水稻基因組注釋數據庫(Rice Genome Annotation Project)分析發現該區間包含8個開放閱讀框(ORF,圖4-A)。其中,第5個ORF被注釋為株高基因D1(LOC_Os05g26890)。D1編碼G蛋白的α亞基,參與依賴G蛋白的GA信號傳導,該基因突變后導致植株矮化粒型變小[13-14]。對瀟湘矮和NIL(NIP)的D1基因序列比對發現,在瀟湘矮中D1的第5和12外顯子分別有1個堿基的替換和3個
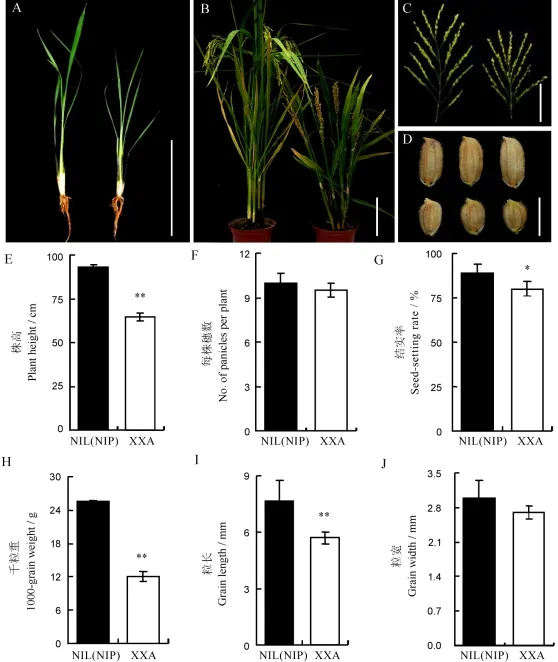
圖1 瀟湘矮(XXA)及其近等基因系NIL(NIP)的表型分析Fig.1.Phenotype analysis of XXA and NIL(NIP).
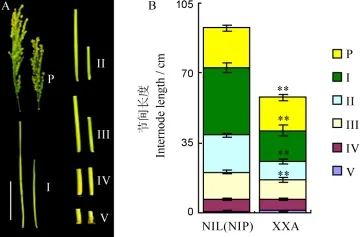
圖2 瀟湘矮與近等基因系NIL(NIP)主莖穗長、節間長度Fig.2.The internode and panicle length comparison in XXA and NIL(NIP).
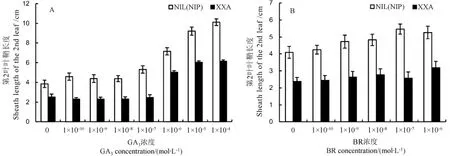
圖3 瀟湘矮與NIL(NIP)幼苗期第2葉葉鞘對外源赤霉素(A)和油菜素內酯(B)的響應Fig.3.Elongation of the second leaf sheath in response to gibberellin(A)and brassinolide(B)in NIL(NIP)and XXA plants.
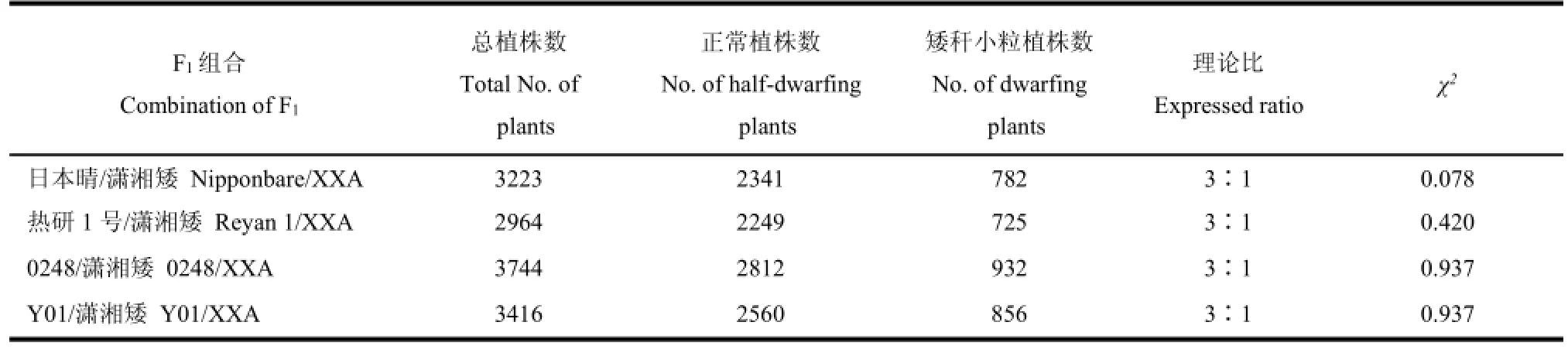
表2 日本晴、熱研1號、0248、Y01和瀟湘矮雜交組合F2株高的分離情況Table 2.Segregation of combination Nipponbare/XXA,Reyan 1/XXA,0248/XXA and Y01/XXA.
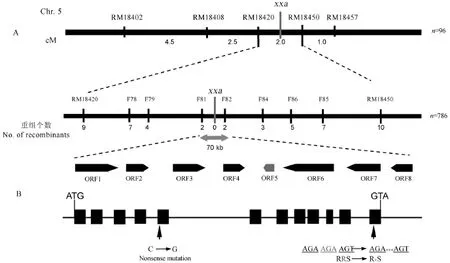
圖4 矮稈小粒基因的精細定位與候選基因分析Fig.4.Fine mapping and positional cloning of the candidate gene.
堿基的缺失,其中第5外顯子1個堿基的替換屬于無義突變,并沒有導致氨基酸的任何改變,而第12外顯子3個堿基的缺失導致1個賴氨酸的缺失(圖4-B)。因此,我們推測瀟湘矮矮稈小粒性狀是D1基因突變所致。
2.4 轉基因互補驗證
為了進一步驗證瀟湘矮矮稈小粒性狀是D1基因突變所致,我們擴增NIL(NIP)基因組中的D1基因序列,構建互補載體pCUbi1390-D1,通過農稈菌介導法導入瀟湘矮中,讓NIL(NIP)的D1基因在Ubi啟動子的驅動下在瀟湘矮中表達。對轉基因T0陽性家系(D1/XXA)中D1基因表達水平分析發現,D1轉基因和NIL(NIP)表達水平顯著高于瀟湘矮。表型分析發現,相對于瀟湘矮,轉基因陽性家系D1/XXA-1表現為株高變高,穗型變大,穗長及第Ⅰ、Ⅱ、Ⅲ節間長度顯著變長,粒長顯著增加,粒寬無明顯變化(圖5)。說明瀟湘矮矮稈小粒性狀是D1基因突變所致。
3 討論
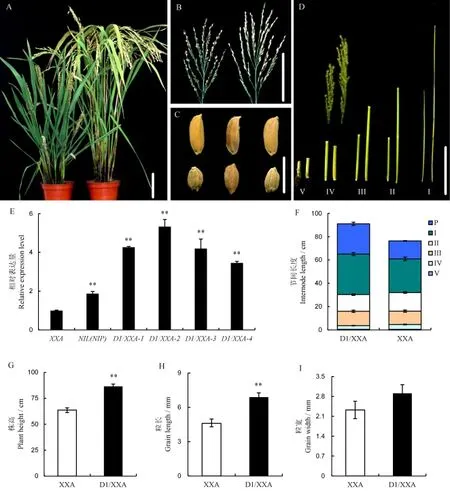
圖5 轉基因功能互補Fig.5.Phenotype analysis of complementary plants(D1/XXA).
本研究通過對育種過程中自然突變的矮稈小粒材料瀟湘矮進行了形態學以及遺傳學分析,發現了瀟湘矮矮稈小粒性狀符合單隱性基因控制的遺傳規律。通過構建近等基因系及定位群體,對矮稈小粒基因進行了圖位克隆。結果表明瀟湘矮矮稈小粒性狀是D1基因突變所致。水稻中最早報道的矮稈小粒突變體d1正是Dwarf 1(D1)基因突變所致。迄今,水稻報道的d1突變體有20多種,主要由大片段缺失、單堿基的突變、移碼突變導致翻譯提前終止等[5,25]。本研究中新發現的瀟湘矮為d1的新等位突變體(第12個外顯子處有3個堿基缺失導致一個1個賴氨酸的缺失)。生物信息學分析表明,瀟湘矮突變位點正好位于G蛋白α亞基(G_alpha)功能域,可能影響G蛋白偶聯受體的信號傳導,最終導致矮稈圓小粒表型。D1的功能喪失除了導致水稻的矮化外,還伴有其他性狀,如:莖稈增粗;葉片短且寬,葉色暗綠;穗形直立,著粒緊密,谷粒小而圓;節間密集,有時第2節間不伸長等[25-28]。我們發現瀟湘矮株高明顯矮于其近等基因系NIL(NIP),粒型小圓,穗型變小,且第2節間長度明顯短于NIL(NIP)(圖2)。前人研究表明d1矮稈突變體對外源赤霉素刺激不敏感,即外源赤霉素不能誘導其株高恢復正常[25]。本研究卻顯示瀟湘矮對GA3表現出一定程度的敏感性,施加外源GA3可以部分恢復瀟湘矮的株高(圖3),該結果表明除D1外,可能還存在其株高相關基因(如半矮稈基因等)共同在調控瀟湘矮的株高等表型。前人的研究推測控制瀟湘矮矮稈小粒性狀的可能有2對隱性基因,其中1對為已知的半矮稈基因sd1,且存在一個未知的半矮稈基因[23]。本研究中日本晴和瀟湘矮的背景親本均為半矮稈材料,它們均含有半矮稈基因sd1。因此,在半矮稈遺傳背景下得出結論瀟湘矮的矮稈性狀主要由d1控制。而前者提到的控制瀟湘矮矮稈小圓粒的未知基因很有可能就是d1。此外,最新研究發現D1可能參與水稻干旱脅迫調控途徑,D1新的等位突變體rga1對干旱脅迫的敏感性降低,干旱處理14 d后,葉片仍為暗綠色且直立,而野生型葉片黃化并萎蔫[29]。因此,D1的突變體rga1在培育抗旱水稻的分子育種中具有重要應用價值。
本研究中穩定遺傳矮稈小粒水稻瀟湘矮,其籽粒很小,千粒重只有12 g左右,因此,我們可以將其導入不育系中,雜交制種時小粒不育系與恢復系混播、混種、混收,最后通過機械篩選去除大粒恢復系種子留下小粒雜交種子,而小粒性狀為隱性核基因控制,雜種F1所結種子粒型正常,不影響產量。因此利用瀟湘矮的矮稈小粒基因可以實現水稻雜交制種全程機械化,具有重要的實踐意義。
[1]Khush G S.Green revolution:the way forward.Nat Rev Genet,2001,2(10):815-822.
[2]Hu C H.Evaluation of breeding semidwarf rice by induced mutation and hybridization.Euphytica,1973,22: 562-574.
[3]Sasaki A,Ashikari M,Ueguchi-Tanaka M,Itoh H, Nishimura A,Swapan D,Ishiyama K,Saito T,Kobayashi M,Khush G S,Kitano H,Matsuoka M.Green revolution: A mutant gibberellin-synthesis gene in rice.Nature,2002, 416:701-702.
[4]Peng J,Richards D E,Hartley N M,Murphy G P,Devos K M,Flintham J E,Beales J,Fish L J,Worland A J, Pelica F,Sudhakar D,Christou P,Snape J W,Gale M D, Harberd N P.“Green revolution”genes encode mutant gibberellin response modulators.Nature,1999,400: 256-261.
[5]張云輝,張所兵,林靜,汪迎節,方先文.水稻株高基因克隆及功能分析的研究進展.中國農學通報,2014, 30:1-7. Zhang Y H,Zhang S B,Fang X W,Lin J,Wang Y J, Fang X W.Research progress on cloning and functional analysis of plant height genes in rice(Oryza sativa L.). Chin Agric Sci Bull,2014,30:1-7.(in Chinese with English abstract)
[6]Fujioka S,Yokota T.Biosynthesis and metabolism of brassinosteroids.Annu Rev Plant Biol,2003,54:137-164.
[7]ItohH,Ueguchi-TanakaM,Sato Y,AshikariM, Matsuoka M.The gibberellin signaling pathway is regulatedbytheappearanceanddisappearanceof SLENDER RICE1 in nuclei.Plant Cell,2002,14:57-70.
[8]Hirano K1,Asano K,Tsuji H,Kawamura M,Mori H, KitanoH,Ueguchi-TanakaM,MatsuokaM. Characterization of the molecular mechanism underlying gibberellin perception complex formation in rice.Plant Cell,2010,22:2680-2696.
[9]Smith S M,Waters M T.Strigolactones:Destructiondependent perception?Curr Biol,2012,22:924-927.
[10]Monna L1,Kitazawa N,Yoshino R,Suzuki J,Masuda H, Maehara Y,Tanji M,Sato M,Nasu S,Minobe Y. Positional cloning of rice semidwarfing gene,sd-1:Rice“green revolution gene”encodes a mutant enzyme involved in gibberellin synthesis.DNA Res,2002,9: 11-17.
[11]SpielmeyerW,EllisMH,ChandlerPM. Semidwarf(sd-1),“green revolution”rice,contains a defective gibberellin 20-oxidase gene.Proc Natl Acad Sci USA,2002,99:9043-9048.
[12]Ueguchi-Tanaka M,Ashikari M,Nakajima M,Itoh H, Katoh E,Kobayashi M,Chow T Y,Hsing Y I,Kitano H, YamaguchiI,MatsuokaM.GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellin.Nature,2005,437:693-698.
[13]Izawa Y,Takayanagi Y,Inaba N,Abe Y,Minami M, Fujisawa Y,Kato H,Ohki S,Kitano H,Iwasaki Y. Function and expression pattern of the alpha subunit of the heterotrimeric G protein in rice.Plant Cell Physiol, 2010,51:271-281.
[14]Kamei T,Matozaki T,Sakisaka T.Coendocytosis of cadherin and c-Met coupled to disruption of cell-cell adhesion in MDCK cells-regulation by Rho,Rac and Rab small G proteins.Oncogene,1999,18:6776-6784.
[15]Wu Y,Fu Y,Zhao S,Gu P,Zhu Z,Sun C,Tan L. CLUSTERED PRIMARY BRANCH 1,a new allele of DWARF11,controls panicle architecture and seed size in rice.Plant Biotechnol J,2016,14:377-386.
[16]Tong H,Liu L,Jin Y,Du L,Yin Y,Qian Q,Zhu L,Chu C.DWARF AND LOW-TILLERING acts as a direct downstream target of a GSK3/SHAGGY-like kinase to mediate brassinosteroid responses in rice.Plant Cell, 2012,24:2562-2577.
[17]Shi Z.Characterization and cloning of SMALL GRAIN 4, a novel DWARF11 allele that affects brassinosteroid biosynthesis in rice.Chin Sci Bull,2015,60:905-915.
[18]Zhou F,Lin Q,Zhu L,Ren Y,Zhou K,Shabek N,Wu F, Mao H,Dong W,Gan L,Ma W,Gao H,Chen J,Yang C, Wang D,Tan J,Zhang X,Guo X,Wang J,Jiang L,Liu X, Chen W,Chu J,Yan C,Ueno K,Ito S,Asami T,Cheng Z, Wang J,Lei C,Zhai H,Wu C,Wang H,Zheng N,Wan J. D14-SCF(D3)-dependent degradation of D53 regulates strigolactonesignalling.Nature,2013,504(7480): 406-410.
[19]Jiang L,Liu X,Xiong G,Liu H,Chen F,Wang L,Meng X,Liu G,Yu H,Yuan Y,Yi W,Zhao L,Ma H,He Y, Wu Z,Melcher K,Qian Q,Xu H E,Wang Y,Li J. DWARF 53 acts as a repressor of strigolactone signalling in rice.Nature,2013,504:401-405.
[20]Huang N,Courtois B,Khush G S.Association of quantitative trait loci for plant height with major dwarfing genes in rice.Heredity,1996,77:130-137.
[21]Moncada P,Martínez C P,Borrero J.Quantitative trait loci for yield and yield components in an Oryza sativa× Oryza rufipogon BC2F2population evaluated in an upland environment.Theor Appl Genet,2002,102:41-52.
[22]羅炬,邵高能,魏祥進,陳明亮,唐紹清,焦桂愛,謝黎虹,胡培松.一個控制水稻株高QTL qPH3的遺傳分析.中國水稻科學,2012,26(4):417-422. Luo J,Shao G N,Wei X J,Chen M L,Tang S Q,Jiao Q A,Xie L H,Hu P S.Genetic analysis of a QTL qPH3 for plant height in rice.Chin J Rice Sci,2012,26(4):417-422. (in Chinese with English abstract)
[23]余應弘,吳云天,曾翔,袁隆平.水稻矮稈小粒突變體瀟湘矮的特征特性及其遺傳鑒定.雜交水稻,2007, 22(6):67-70. Yu Y H,Wu Y T,Zeng X,Yuan L P.Characterization and genetic studies on dwarf rice mutant Xiaoxiangai with small grains.Hybrid Rice,2007,22(6):67-70.(in Chinese with English abstract)
[24]鄭貴朝,胡事君.提高水稻愈傷組織植株再生能力幾種方法的評價.雜交水稻,2005,20(2):54-57. Zheng C G,Hu S J.Evaluation of some culture methods for enhancing plant regeneration ability of rice callus. Hybrid Rice,2005,20(2):54-57.(in Chinese with English abstract)
[25]Ashikari M,Wu J,Yano M,Sasaki T,Yoshimura A.Rice gibberellin-insensitivedwarfmutantgeneDwarf1 encodes the alpha-subunit of GTP-binding protein.Proc Natl Acad Sci USA,1999,96:10284-10289.
[26]Ueguchi-Tanaka M,Fujisawa Y,Kobayashi M.Rice dwarf mutant d1,which is defective in the alpha subunit of the heterotrimeric G protein,affects gibberellin signal transduction.Proc Natl Acad Sci USA,2000,97: 11638-11643.
[27]Hartweck L M,Olszewski N E.Rice GIBBERELLIN INSENSITIVE DWARF1 is a gibberellin receptor that illuminates and raises questions about GA signaling. Plant Cell,2006,18:278-282.
[28]Choe S,Dilkes B P,Gregory B D,Ross A S,Yuan H, Noguchi T,Fujioka S,Takatsuto S,Tanaka A,Yoshida S, Tax F E,Feldmann K A.The Arabidopsis dwarf 1 mutant is defective in the conversion of 24-methylenecholesterol to campesterol in brassinosteroid biosynthesis.Plant Physiol,1999,119:897-907.
[29]Ferrero-Serrano A,Assmann S M.The alpha-subunit of the rice heterotrimericG protein,RGA1,regulates drought tolerance during the vegetative phase in the dwarfricemutantd1.JExpBot,2016,67(11): 3433-3443.
Morphological and Molecular Genetic Analysis of a Dwarf and Small Grain Rice Variety Xiaoxiang’ai
Lü Yusong1,#,XIE Yunfeng1,2,#,SHENG Zhonghua1,WU Yawen1,TANG Shaoqing1,HU Peisong1, WEI Xiangjin1,*
(1State Key Laboratory of Rice Biology/Key Laboratory of Rice Biology and Breeding of Ministry of Agriculture,China National Rice Research Institute, Hangzhou 310006,China;2College of Life and Environmental Sciences,Hangzhou Normal University,Hangzhou 310036,China;#These authors contributed equally to this work;*Corresponding author,E-mail:weixiangjin@caas.cn)
【Objective】To uncover the genetic mechanism of a dwarf and small grain variety Xiaoxiang’ai(XXA),and lay an important theoretical foundation in rice dwarfing breeding.【Method】Rice variety XXA characterized as a dwarf and small grain phenotype was derived from natural mutation under breeding process.The agronomic traits of XXA were investigated.Its sensibility to phytohormone was analyzed under GA3and BR treatments at various concentrations. Genetic analysis of XXA with different varieties and fine mapping of xxa gene from the F2population derived from the cross between near-isogenic lines NIL(NIP)and XXA were done.Furthermore,complementary assay was performed to confirm the candidate gene.【Result】The XXA shows short spikes and compact panicles,with significant decrease in 1000-grain weight under GA3and BR treatments,we found that XXA is partially sensitive to GA3,whereas insensitive to BR.The segregation behavior in each of the derived F2populations between XXA and either varieties was consistent with the Mendelian monogenic ratio of 3∶1.The xxa gene was finally narrowed down to a 70 kb physical region between the InDel markers F81 and F82 on chromosome 5.Within this region,eight open reading frames(ORFs)were predicted, of which,ORF5(LOC_Os05g26890)has been annotated as a Dwarf1 gene(D1).Furthermore,sequence analysis of all the region revealed that there are only two mutation sites including one 1-bp nonsense mutation in the 5th exon and a 3-bp deletion that resulted in a lysine deletion in the 12th exon of D1.The complementary assay showed that the abnormal phenotype of XXA can be recovered.【Conclusion】The dwarf and small grain phenotype is probably associated with GA3metabolism.The abnormal phenotype is mainly controlled by a single recessive gene.The D1 indisputably corresponds to mutation phenotype of XXA.
rice;dwarf and small grain;gene mapping;mechanized propagation
S511.024獻標識碼:A
:1001-7216(2017)03-0238-09
2016-11-24;修改稿收到日期:2017-02-06。
國家自然科學基金資助項目(31471472);國家重點研發計劃資助項目(2016YFD0101801);浙江省自然科學基金資助項目(LY14C30009)。

