病毒-植物互作對介體昆蟲生物學特性的影響
關桂靜 趙恒燕 王洪蘇 劉金香
(西南大學柑桔研究所,重慶 400712)
病毒-植物互作對介體昆蟲生物學特性的影響
關桂靜 趙恒燕 王洪蘇 劉金香
(西南大學柑桔研究所,重慶 400712)
大部分植物病毒需要介體來傳播,而昆蟲則是其最重要的介體類別。植物-病毒-介體昆蟲的互作關系既復雜又特異,而病毒由于其繁殖迅速、變異快而成為三者協同進化的推動者,以有利于病毒的有效傳播。病毒對介體昆蟲的影響分直接影響和間接影響兩個方面,間接影響即是病毒侵染寄主植物后會引起植物的光合作用、次生代謝、營養成分、信號途徑等發生變化,繼而影響介體昆蟲的寄主選擇行為、生長發育、繁殖力等生物學特性,最終會影響介體對于病毒的傳播。綜述了病毒侵染寄主植物對刺吸式昆蟲生物學特性的影響,以期為防治植物病毒性病害提供依據。
植物病毒;寄主植物;刺吸式昆蟲;生物學特性
植物病毒是農林生產最嚴重的威脅,目前尚無有效的治理措施。由于病毒無法突破植物的細胞壁障礙,大多數植物病毒的傳播需要介體來完成,刺吸式口器昆蟲因其特殊的口器類型和特異性的取食方式而成為植物病毒最重要的介體類群。刺吸式昆蟲中的飛虱、蚜蟲、粉虱和葉蟬等是植物病毒介體中最重要的類群,它們傳播病毒的方式各不相同,如飛虱一般以持久方式傳播病毒;蚜蟲多以非持久性或半持久性方式進行傳播;粉虱中的煙粉虱是雙生病毒的主要傳播媒介,以持久性方式進行傳播。病毒傳播方式是影響病毒與媒介昆蟲相互作用的重要因素,緊密調控著病原體的媒介傳播[1,2]。植物-病毒-介體昆蟲的互作關系是復雜而特異的,其間的協同進化關系是生態學、進化生物學等理論學科的重要研究內容,同時也是病毒防控措施制定的理論基礎。病毒因其繁殖迅速、變異快而成為三者互作及進化的推動者和主動因素,其結果是有利于病毒的傳播[2,3]。病毒對介體的影響分為直接和間接兩個方面,直接影響即是病毒病毒在媒介昆蟲體內滯留,可直接影響昆蟲的存活率、產卵量、發育歷期、取食行為及寄主選擇行為等生物學特性[4,5];而間接影響是指病毒的侵染可觸發寄主植物的應激反應,進而在一定程度上影響介體昆蟲,以此改變介體昆蟲的生態適應性。
病毒誘導的植物對刺吸式媒介昆蟲的間接互作涉及生理、行為、進化層面的拮抗或協同關系。通過對這些關系的系統性研究,可為研究病毒-寄主植物-介體昆蟲三者互作奠定基礎,將有利于人們研究新的應對媒介傳播的植物病毒病的防控機制,并為害蟲防治和抗蟲植物培育提供新的思路。本文主要綜述了病毒侵染誘導植物的次生代謝、信號通路、初生代謝及物理結構等的變化對介體昆蟲所造成的間接影響,以期為防治植物病毒性病害提供依據。
1 病毒誘導植物次生代謝的變化
病毒通過侵染寄主植物使其產生一系列次生代謝產物,主要包括植物揮發性物質(volatile organic compound,VOC)、抗氧化物酶、病程相關蛋白(pathogenesis-related protein,PR)等。一些次生代謝產物可與游離氨基酸發生反應,以此改變植物的營養價值。這些變化可能會對媒介昆蟲產生有利、不利或無顯著影響[1,6,7],這種差異與物種特異性、寄主抗性等相關[8]。
1.1 植物揮發性物質
大量研究發現,植物感染病毒后,其揮發性化學物質發生了很大變化,對介體昆蟲的寄主選擇行為造成影響。與病害相關的植物揮發物大致分為綠葉性氣味、芳香族化合物、萜類化合物,也包含一些含氮及含硫的化合物等[9]。Mauck等[1,2]發現蚜蟲可能會因嗅覺感知而優先選擇病毒侵染過的植株;Luan等[10]采用氣相色譜-串聯質譜(GC-MS)對感染番茄黃化曲葉病毒(tomato yellow leaf curl virus,TYLCV)的煙草進行分析發現,植株的萜類化合物質合成受到抑制;通過基因沉默技術發現,這種抑制現象增加了植株對煙粉虱的吸引力。據此認為,這些揮發性物質可能會對介體產生一定影響。這也與Howe等[11]在另一個研究中發現萜類物質可作為驅蟲劑或毒素進而影響昆蟲的習性的結論相一致。
不同的生物或非生物因子可誘導同種植物釋放不同的揮發物,因此可通過監測VOC的變化研制開發監控植物健康狀況的探測系統,以便能在植物病蟲害初期做出預報。Cheung等[12]利用TwisterTM吸附系統,檢測到月桂烯、蒈烯、羅勒烯、布藜烯等柑橘衰退病(citrus tristeza virus,CTV)的生物標志物發生顯著變化,據此發現VOC的潛在應用價值,即用于一些植物病害的監測和評估分析。
1.2 抗氧化物酶
病毒侵染寄主植物后能夠在不同程度上誘導一些抗氧化物酶活性產生變化,且這種變化具有物種差異性。趙榮樂[13]發現黃瓜花葉病毒(cucumber mosaic virus,CMV)感染甜瓜后,植株中苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性顯著增高;TYLCV侵染番茄后,過氧化物酶(peroxidase,POD)活性顯著提高[14];Nair[15]發現斯里蘭卡木薯花葉病毒(srilankan cassava mosaic virus,SLCMV)侵染植物后,POD、PAL和多酚氧化酶(polyphenol oxidase,PPO)酶活性均顯著增加。而PPO為“營養限制酶”,可降低植物營養價值;POD可產生調節與防御有關的信號傳導途徑的氧化物質,這些氧化物質可增強木質化和交聯作用加固細胞壁來限制昆蟲取食[16],也可直接減弱其消化能力[17]。這些抗氧化物酶活性改變會對媒介昆蟲生物學特性產生一定影響,進而影響病毒的傳播。
1.3 病程相關蛋白
病程相關蛋白參與病毒侵染誘導的植物防御反應,主要包括幾丁質酶、葡聚糖酶、類甜蛋白以及一些功能未知的蛋白,這些蛋白在植物防御過程中起著重要作用[18,19]。很多研究表明植物受病毒侵染后,能誘導幾丁質酶、β-1,3-半乳糖苷酶等多種抗性酶的高水平表達[20-22];而幾丁質酶能通過水解幾丁質和抑制α淀粉酶活性來干擾媒介昆蟲的消化[23]。
2 病毒誘導植物的信號途徑變化
植物進化出不同的機制來應對多種生物及非生物因素的脅迫,水楊酸(salicylic acid,SA)、茉莉酸(jasmine acid,JA)和乙烯(ethylene,ET)是目前已知的參與高等植物防御反應的重要植物激素。JA和ET信號轉導途徑在應對植食性害蟲和腐生營養型病原微生物中發揮重要作用,而SA途徑主要參與植物對活體營養型病原物微生物的防御反應。其中,SA途徑的激活可誘導系統獲得性抗性(systemic acquired resistance,SAR)、病程相關蛋白等抗性基因的表達,JA信號途徑可誘導多種防御基因和防御相關蛋白(如多酚氧化酶、蛋白酶抑制劑等)的表達。這些激素信號途徑之間的交叉互作可對昆蟲產生相應的影響。
2.1 水楊酸信號途徑
病毒侵染可誘導SA信號途徑上的相關基因表達發生變化。Shi等[24]發現TYLCV侵染顯著增加番茄葉片內SA水平;Mauck等[25]也證明CMV侵染改變了寄主的SA代謝途徑;Abe[20]通過表達譜測序等技術證明番茄斑萎病毒(tomato spotted wilt virus,TSWV)侵染誘導了SA相關基因表達,且西花薊馬(Frankliniella occidentalis)會優先選擇感病的擬南芥,并且其存活力、增殖力也有所提高,實驗表明植物體內SA信號的積累能增強昆蟲的適應性。這些結果與Zarate等[26]提出的SA信號途徑可抑制約束昆蟲發育的防御反應的結論相符合。
2.2 茉莉酸信號途徑
對植株施用外源JA能降低昆蟲的行為表現、存活率和繁殖力[20,27,28],擬南芥JA突變體coi1-1更加吸引西花薊馬取食[28],表明由JA調控的防御反應可有效調節媒介昆蟲生活力。中國番茄黃化曲葉病毒(tomato yellow leaf curl China virus,TYLCCNV)的致病因子DNAβ上βC1[29]和CMV上的2b蛋白[30]可抑制JA代謝途徑,從而有利于MEAM1煙粉虱和蚜蟲的存活力和生殖力,促成了通過寄主植物介導的媒介昆蟲-病毒之間的互惠關系。
2.3 乙烯信號途徑
寄主植物受病毒侵染后可改變其乙烯代謝途徑[25,31,32]。最近研究表明,擬南芥ein2和etr1乙烯突變體可以提高植株對煙草花葉病毒(tobacco mosaic virus,TMV)和花椰菜花葉病毒(cauliflower mosaic virus,CaMV)的 抗性[31,33]。Casteel等[34]發現蕪菁花葉病毒(turnip mosaic virus,TuMV)侵染可以誘導寄主植物的ET代謝途徑來增加其敏感性,這種調節可以增加蚜蟲的適應性。ET經常和JA協同作用,介導由植食性害蟲或腐生營養性病原微生物引起的防御反應。在擬南芥JA和ET組成型激活突變體cev1上,桃蚜和B型煙粉虱的種群增長速率明顯降低[26]。以上結果表明病毒可以通過誘導寄主防御信號的開啟進而調節媒介昆蟲的繁殖力、存活率等(表1)。
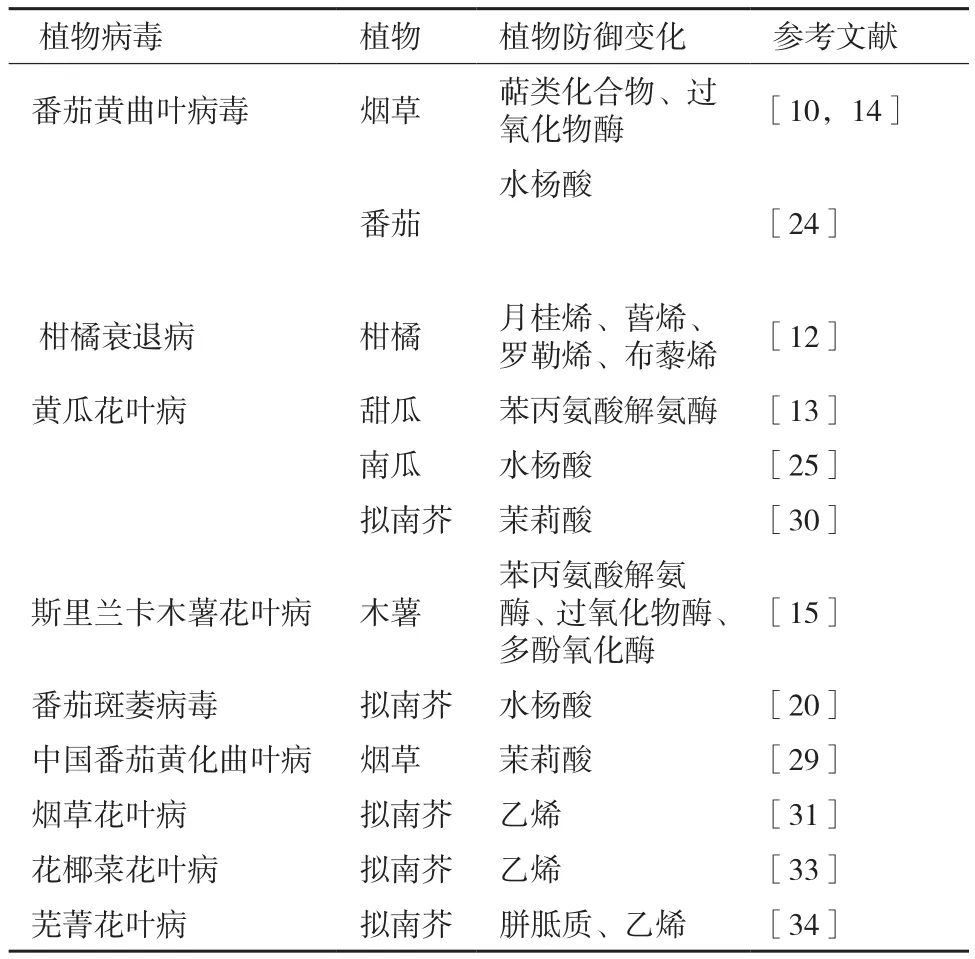
表1 病毒誘導的植物防御物質變化
3 病毒誘導植物的其他應激反應
病毒感染改變了寄主植物的性狀,如初生代謝、光合作用的強弱、生長狀況以及葉片顏色、篩管成分中胼胝質含量等,這些性狀變化會使媒介昆蟲在病株上刺探取食時表現出一些異常。
3.1 初生代謝
病毒侵染能夠改變植物組織中的碳水化合物、氨基酸、水等營養物質及植物光合作用的強弱,這些變化既可導致信號轉導通路的激活,也可改變營養物質的運輸。Su等[14]利用高效液相色譜(high performance liquid chromatography,HPLC)測定感染TYLCV及對照植株的營養組成發現,感病植株葉肉、表皮細胞中自由氨基酸濃度顯著下降了55%,而碳氮化合物比例卻有所增加;Mauck等[25]發現CMV侵染后的植株葉片、韌皮部組織中碳氮化合物比例顯著降低。他們認為碳氮化合物比例的增加可以促進昆蟲的同化吸收能力。因此,煙粉虱更偏向于在感染持久性傳播的TYLCV植株上取食,而蚜蟲在以非持久性傳播的CMV侵染的植株上短暫取食后轉移到健康植株上,從而加速了病毒的傳播,這與Mauck等[1,2]的病毒傳播方式調控病原傳播的研究結果一致。
3.2 植物生長結構
病原可誘導植物生長、形態學性狀等發生變化,如葉片黃化、卷曲、褶皺以及腺毛密度、胼胝質沉積、葉片厚度等,這些特征的變化可能會影響媒介昆蟲在植株上的取食和移動[35,36]。Casteel等[34]發現TuMV抑制了煙草中胼胝質沉積;胼胝質沉積是蚜蟲取食引起的一種寄主防衛反應,可提高蚜蟲的繁殖力。多數病毒都能引起寄主植物產生黃化或淺綠癥狀[37],而蚜蟲、粉虱偏向于選擇黃色或淺綠的植物組織[38,39],介體對黃色(或黃化植物)表現一定的趨性,可能是三者長期進化過程中形成的。
3.3 其他
病毒-植物的應激反應還可以對媒介昆蟲的刺探產生一定影響。刺吸電位圖譜(electrical penetration graph,EPG)可以將昆蟲的探索和取食行為可視化[40,41]。何應琴等[42]通過EPG監測發現褐色橘蚜(Toxoptera citricida)在感病植株上C波的總持續時間顯著少于健康植株,而E波增多,有利于褐色橘蚜取食及CTV的傳播;Liu等[43]發現B型和Q型煙粉虱在取食感染TYLCV的番茄時口針刺探次數更頻繁,取食和分泌唾液的時間更長;感染馬鈴薯Y病毒(potato virus Y,PVY)的植物能夠顯著增加桃蚜的韌皮部取食時間[44]。這些跡象表明,昆蟲口針在感病植株葉片組織內移動的束縛力減弱,病毒的感染減弱了植物對刺吸式昆蟲取食的抵抗性。這種由寄主植物介導的媒介昆蟲與病原物之間的互作可能是決定植物病毒病流行和昆蟲種群增長的主要因子之一。
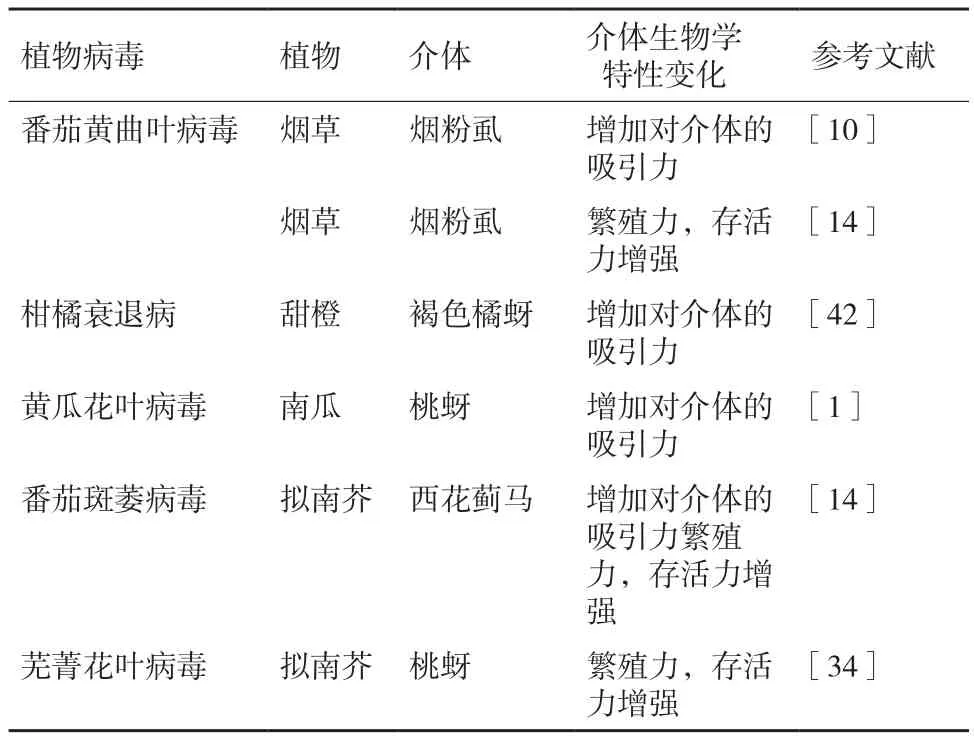
表2 病毒-植物互作對介體的生物學特性的影響
4 綜合互作
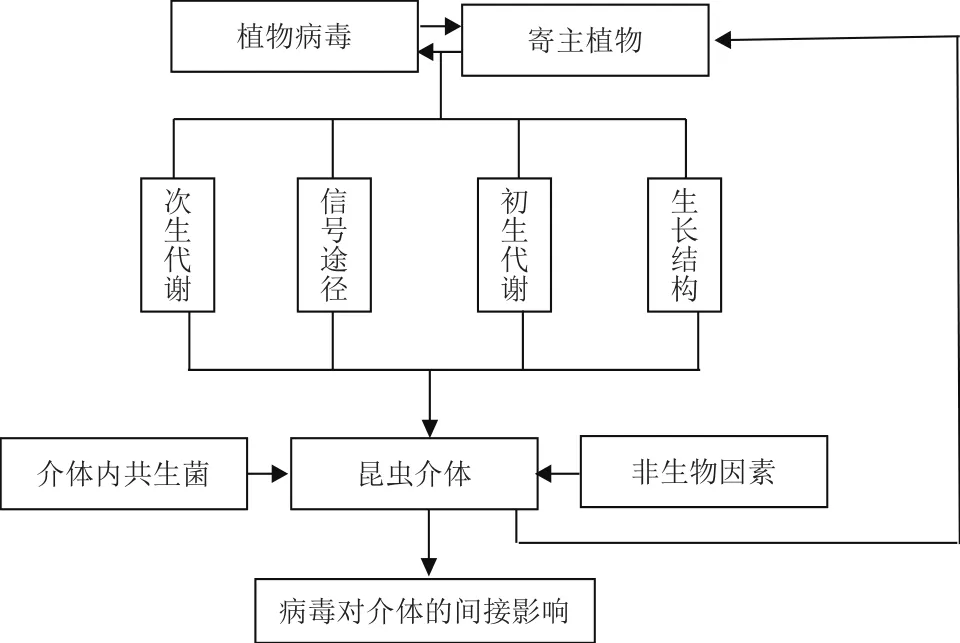
圖1 綜合互作
病毒感染寄主植物可削弱或破壞植物的防御機制,并改變植物的營養組成或形態學性狀進而對介體產生一定影響。同時這些變化可能也會對自然界中的其他病原微生物,植食性昆蟲及介體天敵等產生影響[45]。此外,介體昆蟲體內的內共生菌[46]、一些非生物因素(如溫度、濕度、肥料和土壤類型等)等[47]在植物-病毒-介體互作中可能發揮重要作用。介體昆蟲體內的內共生菌,如立氏立克次體(Rickettsia rickettsii),Rickettsia通過介體轉移到植株體內并對植株防御反應進行調節[48,49];Douglas等[46]發現煙粉虱體內的共生體組分發生變化可能會影響介體、植物病毒、寄主植物之間的相互關系。因此,開展綜合互作的相關研究可為病蟲害綜合治理提供不可多得的借鑒。
5 展望
利用多種技術進一步揭示植物-病毒-介體互作的復雜關系是十分必要的。植物介導的病毒與刺吸式媒介昆蟲相互作用的復雜性,使得確定植物的結構特點、代謝產物及信號途徑是如何影響媒介昆蟲的生物學特性變得困難。因此要明確病毒侵染對媒介昆蟲與寄主植物的相互影響,通過基因組、轉錄組、蛋白組及代謝組多組學聯合分析并與EPG、種群生物學等經典研究技術相結合顯得尤為重要。
植物病毒的快速繁殖及害蟲的大爆發對農業生產、食品安全帶來了嚴重性威脅。植物病毒的有效防控需要通過控制介體來實現[50]。化學防治雖能在一定程度上減少植物病毒的傳播,但不同殺蟲劑對媒介的防治效果差異很大;而介體昆蟲一般均是繁殖力強、生活史短的r-對策者,容易產生抗藥性;而且殺蟲劑會對環境造成污染、農藥殘留等,故害蟲的生態調控研究成為生態學研究的熱點之一。在害蟲綜合治理策略中,植物抗性是最經濟、最環保、最有效的措施[51]。因此,開展病毒-植物互作影響媒介昆蟲生物學特性的機制研究,不僅可為其有效防控提供新的思路與途徑,也可為病蟲害綜合治理和持續控制的問題提供一定的借鑒。
[1] Mauck KE, De Moraes CM, Mescher MC. Deceptive chemical signals induced by a plant virus attract insect vectors to inferior hosts[J]. Proceedings of the National Academy of Sciences, 2010, 107(8):3600-3605.
[2] Mauck K, Bosque-Perez NA, Eigenbrode SD, et al. Transmission mechanisms shape pathogen effects on host-vector interactions:evidence from plant viruses[J]. Functional Ecology, 2012, 26(5):1162-1175.
[3]Blanc S, Michalakis Y. Manipulation of hosts and vectors by plant viruses and impact of the environment[J]. Current Opinion in Insect Science, 2016, 16:36-43.
[4] Schliephake E, Habekuss A, Scholz M, et al. Barley yellow dwarf virus transmission and feeding behaviour of rhopalosiphum padi on hordeum bulbosum clones[J]. Entomologia Experimentalis Et Applicata, 2013, 146(3):347-356.
[5] Li S, Wang SJ, Wang X, et al. Rice stripe virus affects the viability of its vector offspring by changing developmental gene expression in embryos[J]. Scientific Reports, 2015, 5(5):417-446.
[6] Bosque-Pérez NA, Eigenbrode SD. The influence of virus-induced changes in plants on aphid vectors:Insights from luteovirus pathosystems[J]. Virus Research, 2011, 159(2):201-205.
[7] Shapiro L, De Moraes CM, Stephenson AG, et al. Pathogen effects on vegetative and floral odours mediate vector attraction and host exposure in a complex pathosystem[J]. Ecology Letters, 2012, 15(12):1430-1438.
[8] Nogia VK, Singh V, Meghwal RR. Effect of cotton leaf curl virus infected plants on the biology of the whitefly, Bemisia tabaci(Hemiptera:Aleyrodidae):Vector-virus mutualism[J]. Phytoparasitica, 2014, 42(5):619-625.
[9] 劉守安, 王夢馨, 韓寶瑜. 植物揮發性物質在茶樹病害監測和防御中的作用研究現狀[J]. 中國茶葉, 2010, 32(1):12-14.
[10] Luan JB, Yao DM, Zhang T, et al. Suppression of terpenoid synthesis in plants by a virus promotes its mutualism with vectors[J]. Ecology Letters, 2013, 16(3):390-398.
[11] Howe GA, Jander G. Plant immunity to insect herbivores[J]. Annual Review of Plant Biology, 2008, 59(59):41-66.
[12] Cheung WHK, Pasamontes A, Peirano DJ, et al. Volatile organic compound(VOC)profiling of citrus tristeza virus infection in sweet orange citrus varietals using thermal desorption gas chromatography time of flight mass spectrometry(TD-GC/TOFMS)[J]. Metabolomics, 2015, 11(6):1514-1525.
[13] 趙榮樂. 黃瓜花葉病毒感染引起甜瓜植株苯丙氨酸解氨酶和葉綠素的變化[J]. 吉首大學學報:自然科學版, 2006, 27(3):78-81.
[14] Su Q, Preisser EL, Zhou XM, et al. Manipulation of host quality and defense by a plant virus improves performance of whitefly vectors[J]. Journal of Economic Entomology, 2015, 108(1):11-19.
[15] Nair, AB, Umamaheswaran, K. Enzymatic Responses to Srilankan cassava mosaic virus infection in cassava plants after grafting[J]. International Journal of Applied and Pure Science and Agriculture,2016, 2(3):165-170.
[16] Ralph J, Bunzel M, Marita JM, et al. Peroxidase-dependent crosslinking reactions of p-hydroxycinnamates in plant cell walls[J]. Phytochemistry Reviews, 2003, 3(1):79-96.
[17] Duffey SS, Stout MJ. Antinutritive and toxic components of plant defense against insects[J]. Archives of Insect Biochemistry & Physiology, 1996, 32(1):3-37.
[18]Singh A, SubudhiE. Expression of a chitinase family protein at4g01700 from Arabidopsis thaliana[J]. Austin Journal of Computational Biology & Bioinformatics, 2014, 1(4):23-30.
[19] Eboigbe L, Tzima AK, Paplomatas EJ, et al. The role of the β-1, 6-endoglucanase gene vegB in physiology and virulence of Verticillium dahliae[J]. Phytopathologia Mediterranea, 2014, 53(1):94-107.
[20] Abe H, Tomitaka Y, Shimoda T, et al. Antagonistic plant defense system regulated by phytohormones assists interactions among vector insect, thrips and a tospovirus[J]. Plant & Cell Physiology, 2012, 53(1):204-212.
[21] El-Morsi Adel, Abdelkhalek A, E-Shehaby O, et al. Pathogenesisrelated genes as tools for discovering the response of onion defence system against Iris yellow spot virus infection[J]. Botanybotanique, 2015, 93(11):735-744.
[22] R?hring C. Induction of Pathogenesis-related proteins of group 1 by systemic virus infections of Nicotiana tabacum L.[J]. Beitr?ge Zur Tabakforschung International Contributions to Tobacco Research, 2015, 18(2):63-70.
[23] Ary MB, Richardson M, Shewry PR. Purification and characterization of an insect α-amylase inhibitor/endochitinase from seeds of job’s tears(Coix lachryma-jobi)[J]. Biochimica Et Biophysica Acta, 1989, 999(3):260-266.
[24] Shi XB, Pan HP, Xie W, et al. Plant virus differentially alters the plant’s defense response to its closely related vectors[J]. PLoS One, 2013, 8(12):e83520-e83520.
[25] Mauck KE, De Moraes CM, Mescher MC. Biochemical and physiological mechanisms underlying effects of cucumber mosaic virus on host-plant traits that mediate transmission by aphid vectors[J]. Plant Cell and Environment, 2014, 37(6):1427-1439.
[26] Zarate SI, Kempema LA, Walling LL. Silverleaf whitefly induces salicylic acid defenses and suppresses effectual jasmonic acid defenses[J]. Plant Physiology, 2007, 143(2):866-875.
[27] Rodriguez-Enfedaque A, Delmas E, Guillaume A, et al. zVAD-fmk upregulates caspase-9 cleavage and activity in etoposide-induced cell death of mouse embryonic fibroblasts[J]. Biochimica Et Biophysica Acta-Molecular Cell Research, 2012, 1823(8):1343-1352.
[28] Abe H, Narusaka M, Shimoda T, et al. Analyses of plant resistance to thrips attack using Arabidopsis and chinese cabbage[J]. Plant Biology(Rockville), 2009, 2009(Suppl.):318-318.
[29] Zhang T, Luan JB, Qi JF, et al. Begomovirus-whitefly mutualism is achieved through repression of plant defences by a virus pathogenicity factor[J]. Molecular Ecology, 2012, 21(5):1294-1304.
[30] Lewsey MG, Murphy AM, Maclean D, et al. Disruption of two defensive signaling pathways by a viral RNA silencing suppressor[J]. Molecular Plant-Microbe Interactions, 2010, 23(7):835-845.
[31] Chen L, Zhang L, Li D, et al. WRKY8 transcription factor functions in the TMV-cg defense response by mediating both abscisic acid and ethylene signaling in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(21):1963-1971.
[32] Mandadi KK, Pyle JD, Scholthof KB. Comparative analysis of antiviral responses in Brachypodium distachyon and Setaria viridis reveals conserved and unique outcomes among C3and C4plant defenses[J]. Molecular Plant-Microbe Interactions, 2014, 27(11):1277-1290.
[33] Love AJ, Laval VGC, Laird J, et al. Components of arabidopsis defense- and ethylene-signaling pathways regulate susceptibility to cauliflower mosaic virus by restricting long-distance movement[J]. Molecular Plant-Microbe Interactions, 2007, 20(6):659-670.
[34] Casteel CL, De AM, Bak A, , et al. Disruption of ethylene responses by turnip mosaic virus mediates suppression of plant defense against the green peach aphid vector[J]. Plant Physiology, 2015, 169(1):209-218.
[35] Moreno-Delafuente A, Garzo E, Moreno A, et al. A plant virus manipulates the behavior of its whitefly vector to enhance its transmission efficiency and spread[J]. PLoS One, 2013, 8(4):e61543-e61543.
[36] Sade D, Shriki Oz, Cuadros-Inostroza Alvar, et al. Comparative metabolomics and transcriptomics of plant response to Tomato yellow leaf curl virus infection in resistant and susceptible tomato cultivars[J]. Metabolomics, 2015, 11(1):81-97
[37] Li Y, Cui H, Cui X, et al. The altered photosynthetic machinery during compatible virus infection[J]. Current Opinion in Virology, 2016, 17(4):19-24.
[38]Hodge S, Powell Glen. Do plant viruses facilitate their aphid vectors by inducing symptoms that alter behavior and performance?[J]. Environmental Entomology, 2015, 37(6):1573-1581.
[39]Isaacs R, Willis MA, Byrne DN. Modulation of whitefly takeoff and flight orientation by wind speed and visual cues[J]. Physiological Entomology, 2002, 24(4):311-318.
[40] Fred Tjallingii W, Garzo E, Fereres A. New structure in cell puncture activities by aphid stylets:a dual-mode EPG study[J]. Entomologia Experimentalis Et Applicata, 2010, 135(2):193-207.
[41] Mclean DL, Kinsey MG. A technique for electronically recording aphid feeding and salivation[J]. Nature, 1964, 202(4939):1358-1359.
[42] 何應琴, 陳文龍, 魯卓越, 等. 褐色橘蚜在健康與CTV植株上的EPG比較[J]. 山地農業生物學報, 2014, 33(2):36-39.
[43] Liu BM, Preisser EL, Chu D, et al. Multiple forms of vector manipulation by a plant-infecting virus:Bemisia tabaci and Tomato Yellow Leaf curl Virus[J]. Journal of Virology, 2013, 87(9):4929-4937.
[44] Boquel S, Delayen C, Couty, et al. Modulation of aphid vector activity by potato virus Y on in vitro potato plants[J]. Plant Disease, 2011, 96(1):82-86.
[45]Inbar M, Dan G. Plant-mediated interactions between whiteflies, herbivores, and natural enemies[J]. Annual Review of Entomology, 2008, 53(1):431-448.
[46]Douglas AE. The microbial dimension in insect nutritional ecology[J]. Functional Ecology, 2009, 23(1):38-47.
[47]Rodelo-Urrego M, Pagán I, González-Jara P, et al. Landscape heterogeneity shapes host-parasite interactions and results in apparent plant-virus codivergence[J]. Molecular Ecology, 2013, 22(8):2325-2340.
[48] Casteel CL, Hansen AK, Walling LL, et al. Manipulation of plant defense responses by the tomato psyllid(Bactericerca cockerelli)and its associated endosymbiont Candidatus liberibacter psyllaurous[J]. PLoS One, 2012, 7(4):1-10.
[49] Frago E, Dicke M, Godfray CJH. Insect symbionts as hidden players in insect-plant interactions[J]. Trends in Ecology & Evolution, 2012, 27(12):705-711.
[50] Hohn T. Plant virus transmission from the insect point of view[J]. Proceedings of the National Academy of Sciences, 2007, 104(46):17905-17906.
[51] 閆鳳鳴. 煙粉虱的有效治理有賴于基礎研究[J]. 中國農業科學, 2016, 49(13):2511-251.
(責任編輯 狄艷紅)
Effects of Virus-Plant Interaction on Biological Characteristics of Insects as Vectors
GUAN Gui-jing ZHAO Heng-yan WANG Hong-su LIU Jin-xiang
(Citrus Research Institute,Southwest University,Chongqing 400712)
Most plant viruses are transmitted by vectors,among which insect is the most important category. The tripartite interaction of plant-virus-vector is complex and specific. So far,virus has become a powerful booster for co-evolution of plant-virus-vector due to its rapid reproduction and fast variation,which then is conducive for its effective transmission. The effects of virus on vector insects can be direct and indirect. The indirect effect refers to such process,i.e.,virus infection to host plants results in the changes on the photosynthesis,secondary metabolism,nutrition components,and signal pathways of plants,which thus affects insects’ biological properties,such as their behavior of host selection,growth and development,fertility and so on,and finally influences virus’ transmission efficiency. The biological impacts of virus-infected host plants on piercing-sucking insects are reviewed here,aiming at providing evidences for the prevention and control of plant virus diseases.
plant virus;host plant;piercing-sucking insects;biological characteristic
10.13560/j.cnki.biotech.bull.1985.2017.04.006
2016-09-05
重慶市基礎與前沿研究計劃項目(cstc2015jcyjBX0043),中央高校基本科研業務費專項(XDJK2014C131)
關桂靜,女,碩士研究生,研究方向:分子微生物學;E-mail:guanshero@163.com
劉金香,女,副研究員,研究方向:分子植物病理學;E-mail:Ljinxiang@126.com

