一株具有褐藻膠降解能力的海洋細菌的篩選鑒定及其多糖利用能力研究
許超熊亞茹盧明倩廖威張云開黃庶識
(1. 廣西大學生命科學與技術學院,南寧 530003;2. 廣西科學院生物物理實驗室,南寧 530007;3. 廣西職業技術學院,南寧 530226)
一株具有褐藻膠降解能力的海洋細菌的篩選鑒定及其多糖利用能力研究
許超1熊亞茹1盧明倩2廖威3張云開1黃庶識2
(1. 廣西大學生命科學與技術學院,南寧 530003;2. 廣西科學院生物物理實驗室,南寧 530007;3. 廣西職業技術學院,南寧 530226)
旨在得到一株具有褐藻膠降解能力的菌株。利用海藻酸鈉作為唯一碳源,從腐爛馬尾藻中篩選純化得到一株降解褐藻膠能力較強的海洋細菌,編號X511。根據形態觀察和理化指標,結合分子生物學技術鑒定該菌株為弧菌,命名Vibrio sp. X511。X511菌株的指數生長期5-16 h,適宜生長的鹽濃度為2%-6%(W/V)。能在以葡萄糖、甘露醇、淀粉等為唯一碳源的培養基中生長。4%-6%(W/V)的鹽濃度、海帶粉、昆布多糖能延長該菌株的生長穩定期。該菌株在篩選培養基中發酵培養24 h胞內褐藻膠裂解酶粗酶活力達到12.68±0.13 U/mL;提取X511的褐藻膠裂解酶粗酶,分別對海藻酸鈉、聚甘露糖醛酸和聚古羅糖醛酸三種多糖的酶解能力依次為:海藻酸鈉>聚甘露糖醛酸>聚古羅糖醛酸。薄層層析(TLC)結果顯示,該菌株胞內酶降解海藻酸鈉的產物為三糖。結果表明,X511是一株鹽耐受性較強、生長周期較短且能同時以海藻酸鈉、聚甘露糖醛酸和聚古羅糖醛酸為碳源生長的海洋細菌。
褐藻膠;篩選;鑒定;鹽耐受性;多糖利用
從第一次工業革命開始,支撐著世界經濟發展和進步的主要能源是石油和煤炭等化石燃料資源。隨著經濟規模變大,全球對于能源的需求量也在不斷增加,化石燃料枯竭的問題日益凸顯。按照已發現的礦產儲量計算,如若保持當今的開采量,煤炭將在約100-150年、天然氣在50-60年、石油在30-40年消耗完[1]。
“可持續發展”是世界經濟發展的主題,大力發展可再生能源是達成這一目標的主要保障。以乙醇為代表的可再生生物質能源能有效緩解能源危機,具有較好的應用前景。近年來,以豐富的海洋藻類資源作為原材料迅速發展的第三代生物乙醇技術,引起了能源領域的廣泛關注[2]。據理論推測,僅需利用我國海洋面積的1%種植大型海藻就能生產1.3億t乙醇,能代替市場20%的石油需求,二氧化碳排放量可降低5.5%[3]。我國生物質能源的開發政策是“不與人爭糧,不與糧爭地”[4],利用大型藻類發展生物質能源,符合我國國情,應用潛力大,可以較好地滿足我國能源可持續發展的需求。
在地球上的大分子多糖中,褐藻膠的總量僅次于纖維素,是海藻最主要的組成成分。褐藻膠是一種高分子聚合物,通過1-4糖苷鍵連接β-D甘露糖醛酸(β-D-mannuronic)和α-L古羅糖醛酸(α-L-guluronic)單體而成,褐藻細胞壁是其主要存在部位[5]。利用褐藻膠裂解酶處理海藻酸可得到單糖,通過特定微生物進行發酵可將單糖轉化為生物乙醇。因此,利用微生物技術高效地將海藻酸轉化為燃料乙醇,是得到生物質能源的一條重要途徑,而如何獲得高活性褐藻膠裂解酶,將海藻酸高效轉化為燃料乙醇是該途徑的關鍵[2]。褐藻膠裂解酶的主要海洋或者陸地微生物來源包括假交替單胞(Pseudoalteromonas)[6]、弧菌(Vibrio)[7]、黃桿菌(Flavobacterium)[8]、芽胞桿菌(Bacillus)[9]、鏈霉菌(Streptomyces)[10]等。
本研究利用海藻酸鈉作為篩選培養基的唯一碳源,經過多次富集和純化,從腐爛的馬尾藻中篩選得到一株高產褐藻膠裂解酶的菌株X511,通過形態觀察、生理生化指標考察和16S rDNA基因序列分析對菌種進行鑒定,并研究其生長特性、鹽耐受性及底物特異,旨為豐富對褐藻膠裂解酶產生菌菌株的研究提供借鑒。
1 材料與方法
1.1 材料
1.1.1 樣品采集 分離菌種的樣本采自廣西北海潿洲島周邊海域生長的馬尾藻。
1.1.2 主要試劑及儀器 臺式冷凍離心機購自德國Hitachi科學儀器公司;雙光束紫外可見分光光度儀(TU-1901)購自北京普析通用儀器有限公司;PCR儀購自德國Biometra公司;超聲波細胞粉碎機購自寧波新芝生物科技股份有限公司;細菌總DNA提取試劑盒購自杭州博日科技有限公司;Silica gel 60 TLC鋁板購自德國merk集團;海藻酸鈉購自阿拉丁試劑公司;硫酸鎂、甘露糖等購自天津博迪化工股份有限公司;氯代十六烷基吡啶購自天津光復精細化工研究所;聚甘露糖醛酸、聚古羅糖醛酸等由國家海洋藥物工程技術研究中心贈送。
1.1.3 培養基 富集和篩選培養基:海藻酸鈉6 g,NaCl 15 g,硫酸銨5 g,磷酸氫二鉀1 g,硫酸鎂1 g,硫酸亞鐵0.001 g,加水定容到1 L,pH7.5,121℃滅菌20 min。
鹽耐受性培養基:在篩選培養基中加入終濃度為0%、1%、2%、3%、4%、5%、6%、7%、8%和9%,10% NaCl(W/V)配制,pH 7.5,121℃滅菌20 min。
固體平板篩選培養基在富集和篩選培養基的基礎上加1.5%瓊脂,發酵培養基與篩選培養基相同。
1.2 方法
1.2.1 菌株篩選與純化 將馬尾藻樣品與2%(W/V)的NaCl水溶液混合均勻,室溫(20℃左右)放置至樣品發生腐爛。取10 mL腐爛樣品上清于90 mL 2%(W/V)的NaCl溶液中混勻,吸2 mL接種于富集培養基中,30℃搖瓶富集培養3 d,搖床轉速200 r/min。將富集的菌液梯度稀釋涂平板,30℃恒溫培養2 d,觀察平板上的菌落形態,挑取生長狀況較好的單菌落平板劃線,進一步純化,利用10%(W/V)氯代十六烷基吡啶對已純化的菌落染色,挑取水解圈與菌落直徑比最大的菌株,低溫保存備用。
1.2.2 菌株生長曲線和酶活力測定 生長曲線的繪制:用接種環挑取一環菌種接至培養基中過夜活化后轉至50 mL/250 mL富集培養基,30℃條件下搖瓶培養,搖床轉速200 r/min,每隔4 h取樣一次,稀釋至合適濃度,測600 nm光吸收值,作生長曲線;8 000 r/min離心30 min,收集菌體,破胞,測定胞內酶酶活力曲線。 酶活測定:胞內酶粗酶。根據產酶曲線,取5 mL培養24 h的菌液,8 000 r/min 離心 30 min,收集菌體,加入10 mL 0.02 mol/L的PBS緩沖液重懸浮,8 000 r/min 離心 15 min,重復3次洗凈培養基,超聲細胞粉碎機破胞20 min,將破胞液8 000 r/min 離心 20 min,取上清,用于胞內酶活測定,上述操作均在4℃條件下進行。相對酶活力測定:參照 Preiss法[11],取0.5 mL胞內粗酶加入到1.5 mL 0.2%(W/V)海藻酸鈉底物中,30℃水浴酶解30 min,沸水浴5 min終止反應,冷卻至室溫,測定235 nm光吸收值。定義光吸收值每分鐘增加0.01為1個酶活力單位(U)。
1.2.3 菌株鑒定 菌株X511的菌落形態觀察。將已純化的菌株劃線至篩選培養基,恒溫(30℃)培養48 h,觀察單菌落的形態特征,采用革蘭氏法染色,在光學顯微鏡下觀察單個菌體細胞形態并拍照。
生理生化相關、糖類發酵指標以及產酶能力指標送科標技術(青島)研發中心測試。
耐鹽性生長特性測定。按2%(V/V)的接種量將培養至對數期的種子液接種至不同濃度的鹽耐受性培養基中,30℃,200 r/min條件下震蕩培養24 h,測定生物量和酶活性。
菌株的16S rDNA基因鑒定。挑取純化的菌株培養至對數期,使用細菌基因組DNA 提取試劑盒提取基因組 DNA。16S rDNA引物為27 f(5'-AGAGTTTGATCMTGGCTCAG-3') 和 1 492r(5'-GGTTAC-CTTGTTACGACTT-3')。回收PCR產物,將擴增片段送至北京奧科鼎盛生物科技有限公司測序。測序結果的16S rDNA基因序列輸入美國國立生物技術信息中心(NCBI)核酸數據庫進行BLAST在線分析,下載同屬代表種的16S rDNA序列,將結果輸入MEGA6.0軟件中,進行完全序列比對切割后,以Neighbor-Joining方法構建系統發育樹。
1.2.4 菌株X511胞內酶底物特異性分析 底物專一性。分別取0.5 mL胞內粗酶至1.5 mL 1%海藻酸鈉、1.5 mL 1%聚甘露糖醛酸和1.5 mL 1%聚古羅糖醛酸溶液中,30℃水浴酶解0.5 h,沸水浴5 min終止反應,測定235 nm光吸收值。薄層層析法(TLC)分析胞內酶酶解產物。用pH為7.5的Tris-HCl緩沖液配制10 mg/mL海藻酸鈉底物溶液,取0.5 mL胞內酶粗酶加至1.5 mL的海藻酸鈉底物溶液中,30℃水浴1 h,沸水浴5 min終止反應,冷卻至室溫,12 000 r/min離心5 min后取3 μL上清,作為酶解上樣液,分兩次點樣于TLC鋁板上,80℃烘干后,在4℃條件下進行Silica gel 60 TLC分析。展開劑各成分的比例為正丁醇∶乙酸∶水= 3∶2∶2;取10 mL濃硫酸加入到90 mL無水乙醇中,混勻,作為顯色劑。待樣品展開后,晾干硅膠鋁板,用顯色劑噴霧染色,110℃烘10 min顯色。
1.2.5 菌株X511的多糖利用能力 按2%(V/V)的接種量將培養至對數期的種子液分別接至50 mL以海藻酸鈉、海帶粉、可溶性淀粉、D-木糖、褐藻膠、昆布多糖等多糖為唯一碳源的液體培養基中震蕩培養(4℃,200 r/min),每隔1 d取樣,測OD600值。
2 結果
2.1 褐藻膠裂解酶產生菌的篩選
經富集培養、篩選和純化,自腐爛的馬尾藻中共篩選得到15株具有褐藻膠降解能力且能在平板上形成水解圈的菌株。將篩選到的菌株進行平板復篩,用10%(W/V)的氯代十六烷基吡啶染色。結果表明,菌株X511周圍出現大于菌落自身直徑3倍的水解圈。經過5代遺傳穩定性培養,選擇產酶能力穩定的菌株作為出發菌株進一步研究。菌株X511能同時產生胞內酶和胞外酶,其中胞外酶活力為5.037±0.15 U/mL,胞內酶活力為12.68±0.13 U/mL,故選用該菌株所產生的胞內酶作進一步研究。菌株X511在以海藻酸鈉為唯一碳源的液體培養基中的生長曲線和產胞內酶曲線,如圖1。該菌株生長具有明顯的3個時期,即延緩期(0-4 h),對數期(5-16 h),穩定期(16-100 h),在接種至新鮮培養基的前24 h,其胞內酶活隨著時間的增加而上升,在培養至24 h時,該菌株的胞內酶活達到最大,隨后發生較明顯的下降,推測與培養基營養成分的消耗和菌株自身的老化有關。
2.2 菌株鑒定
2.2.1 形態觀察 菌株X511菌落形態以及細胞形態特征如圖2-A所示,菌株在固體篩選平板上能形成規則的圓形菌落,生長時間超過48 h后,菌落由乳白色變為淡黃色,中間凸起,表面光滑濕潤,邊緣整齊,易挑取。菌株經革蘭氏染色后光學顯微鏡觀察,該菌株為革蘭氏陰性菌,菌體呈弧形,未發現芽孢存在(圖2-B)。
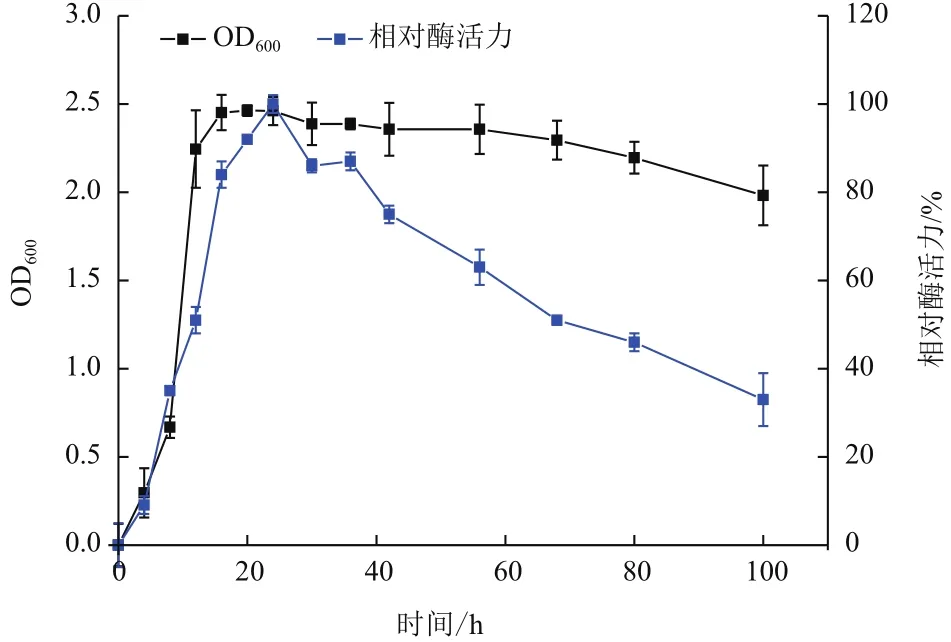
圖1 菌株X511在液體發酵培養基中的生長曲線和產胞內酶曲線
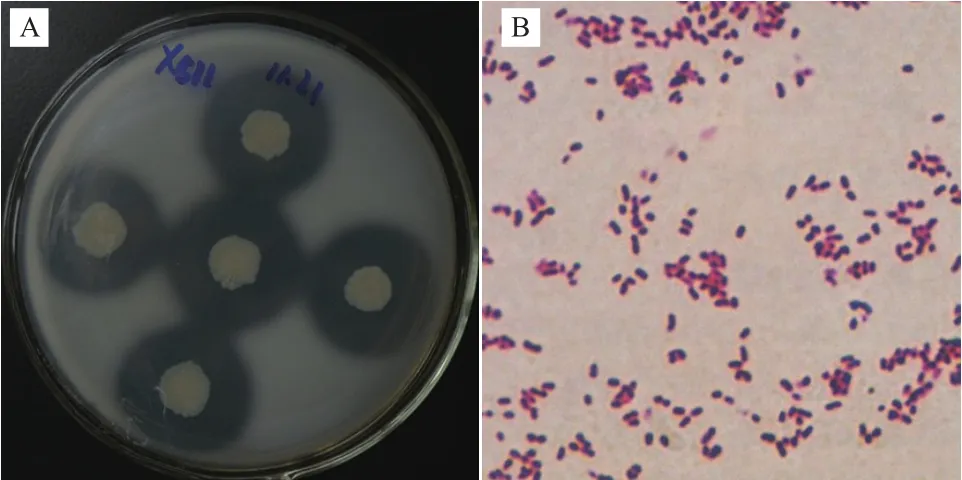
圖2 菌株X511的菌落及菌體形態觀察和革蘭氏染色結果
2.2.2 生理生化及不同鹽濃度生長特性 菌株X511能利用蔗糖、D-海藻糖、D-葡萄糖、D-甘露醇、甘露糖,葡萄糖作為碳源生長,不能利用D-塔格糖、古老糖、D-纖維二糖、D-山梨醇和側金盞花醇、L-阿拉伯醇和5-酮-葡萄糖苷(表1)。在菌株的生長過程中,能檢出β-N-乙酰葡萄糖苷酶、氨基乙酸芳胺酶、L-脯氨酸芳胺酶、吡咯烷基芳胺酶和酪氨酸芳胺酶等5種酶的活性(表2)。

表1 菌株X511對不同碳源的利用情況

表2 菌株X511產酶情況
耐鹽性結果(圖3)顯示,菌株X511無法在不含NaCl的培養基中生長;當培養液中的NaCl濃度為2%(W/V)和4%(W/V)時,菌株在不到1 h內達到最大生物量;當培養基中的NaCl濃度為6%(W/V)和8%(W/V)時,菌株生長達到穩定期的時間延后,生物量積累速度相對緩慢,隨著NaCl濃度加大,菌株達到穩定期時間越長,總生物量越低;當培養液中的NaCl濃度為10%(W/V)時,菌株基本不能生長。
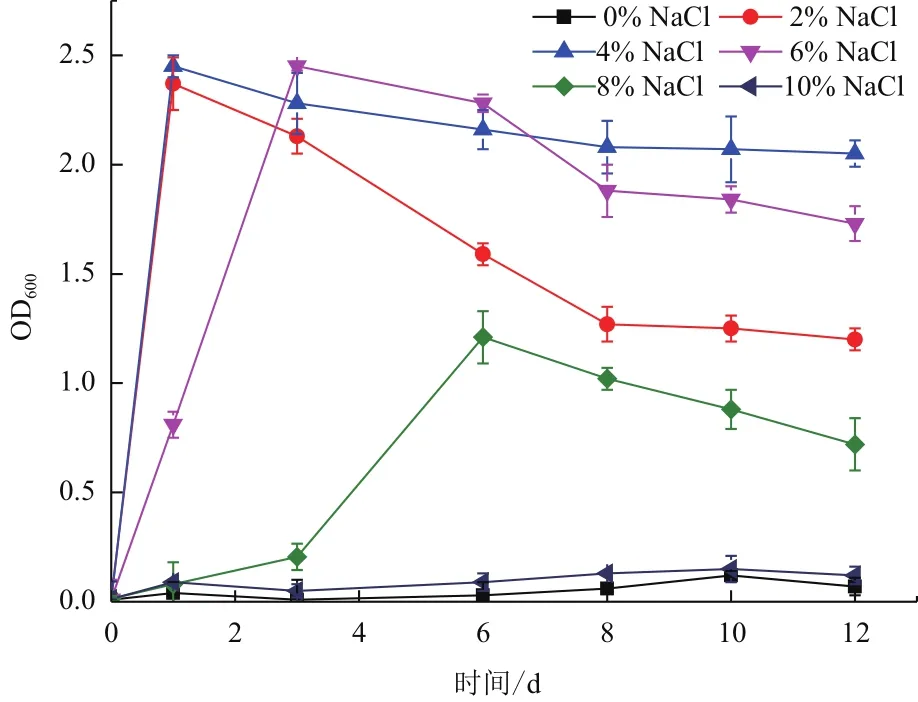
圖3 NaCl濃度對菌株X511生長的影響
2.2.3 16S rDNA測序分析 利用16S rDNA通用引物對菌株X511擴增,得到的目的片段長度為1 570 bp,其中(G+C)含量為56%。利用NCBI上的BLAST程序進行序列同源性比對,菌株X511與弧菌屬的多種菌株相似性為99%,同時結合菌株的形態特征和生理生化特征,鑒定其為弧菌屬菌株,并命名為Vibrio sp. X511,系統發育樹,見圖4。
2.2.4 菌株X511胞內酶底物特異性分析 菌株X511胞內酶粗酶分別降解海藻酸鈉、聚甘露糖醛酸和聚古羅糖醛酸,其對不同底物的利用能力如圖5所示。菌株X511中的胞內酶粗酶液能同時降解海藻酸鈉、聚甘露糖醛酸和聚古羅糖醛酸,其中,該菌株利用海藻酸鈉的能力最強,利用聚甘露糖醛酸能力次之,而利用聚古羅糖醛酸能力最弱。
菌株X511胞內酶粗酶降解海藻酸鈉,離心,取上清進行薄層層析(TLC),結果如圖6所示,該菌株胞內酶降解海藻酸鈉后能得較高濃度的褐藻三糖產物。
2.2.5 菌株X511的多糖利用能力 菌株X511在不同多糖培養液中的菌體濃度,如圖7所示。菌株在以海藻酸鈉、海帶粉和昆布多糖為唯一碳源時,其生物量最高,可溶性淀粉次之。此外,菌株還能利用L-巖藻糖、褐藻膠、褐藻糖膠和海帶多糖,以羧甲基纖維素鈉和D-木糖為唯一碳源時,菌株不能生長。
3 討論
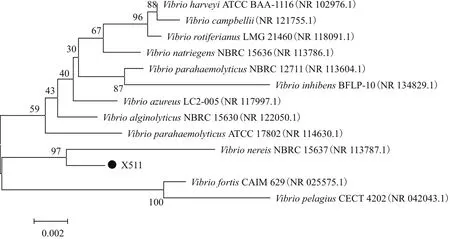
圖4 基于16S rDNA基因序列用Neighbor-Joining方法構建的菌株X511與相關菌種的系統發育樹
近年來,對海洋環境來源的產褐藻膠裂解酶微生物的篩選屢有報道,篩選材料多為腐爛海帶,海泥,海水以及海洋魚類的內臟[12-15]等,本研究從腐爛的馬尾藻中篩選得到了一株產褐。藻膠裂解酶菌株,其對數生長期為5-16 h,在培養24 h時相對酶活力達到最大;繼續培養后菌株的生物總量沒有明顯變化,但隨著菌株的老化以及培養基的消耗,酶活力下降趨勢明顯,菌株的總生物量未發生明顯下降;該菌株的最大產褐藻膠裂解酶時間相對于達到最大生物量時間有一定的延遲,老化能迅速降低該菌株的產褐藻膠裂解酶能力。本研究從腐爛的馬尾藻中篩選得到了一株產褐藻膠裂解酶的海洋弧菌X511。菌株X511的對數生長期為5-16 h,在培養24 h時相對酶活力達到最大,與已報道的菌株相比[16,17],該菌株的生長速度快,達到酶活最大所需時間短。在耐鹽性試驗中,菌株X511在無氯化鈉的培養液中不能生長,一定的鹽濃度(2%-6%)能促進該菌株的生長,并能延長其穩定期;6%(W/V)的鹽濃度能減緩該菌株的生長速度,但并不影響其最大生物量;當鹽濃度大于6%(W/V)時,菌株的生長速度和最大生物量均明顯降低;10%(W/V)的NaCl濃度能抑制該菌株的生長。與其他同類型產褐藻膠裂解酶的嗜鹽菌株相比[15],該菌株的鹽耐受性較強。
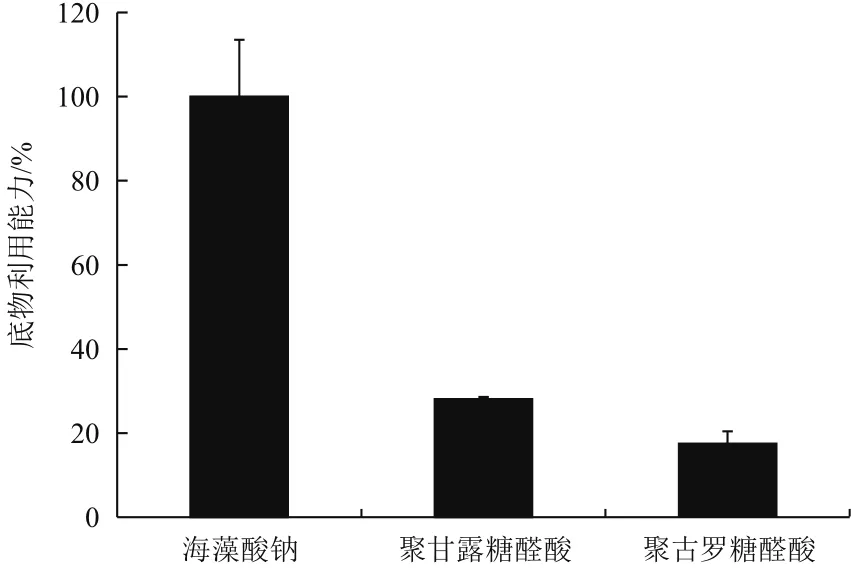
圖5 菌株X511胞內粗酶對海藻酸鈉、聚甘露糖醛酸和聚古羅糖醛酸利用能力

圖6 TLC分析菌株X511降解海藻酸鈉產物
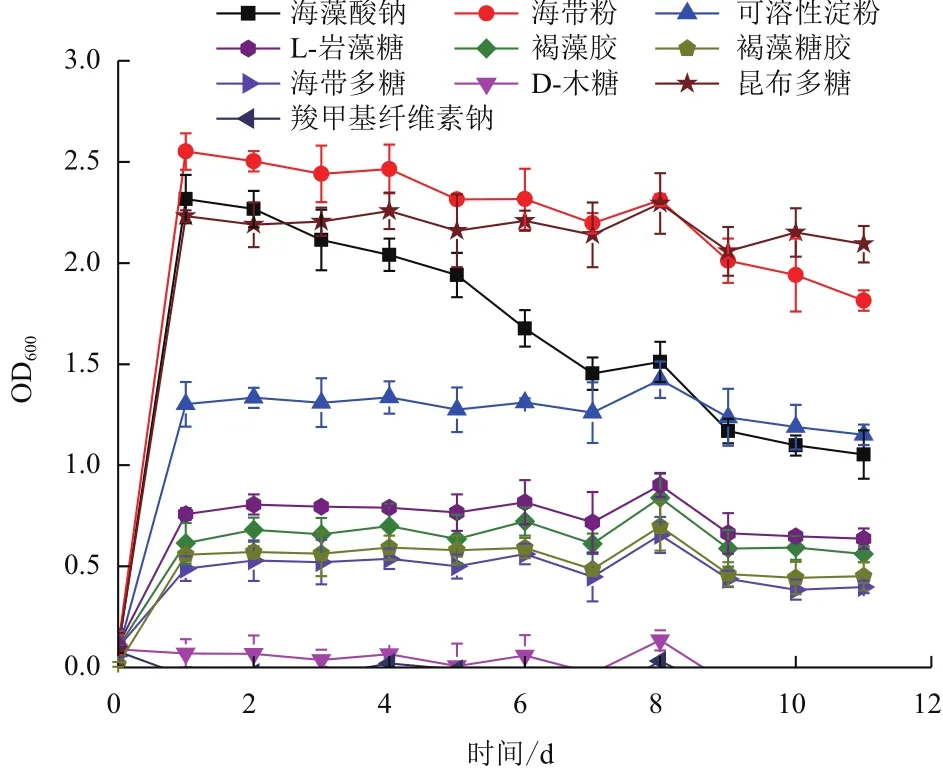
圖7 菌株X511在不同多糖培養基中的菌體濃度
菌株X511能同時降解海藻酸鈉、聚甘露糖醛酸和聚古羅糖醛酸,推測該菌株可能產生了能分別降解不同的底物多種酶,也可能產生了一種雙功能酶,有待進一步研究。目前研究的大多數酶對聚甘露糖醛酸片段有偏好性,只有少數對聚古羅糖醛酸片段有偏好性[18]。薄層層析分析該菌株胞內酶水解海藻酸鈉后的產物,發現其水解產物主要的為褐藻膠三糖。李恒等[13]篩選得到一株鹽單胞菌halomonas sp.WF6,酶水解海藻酸鈉后的薄層層析產物主要為聚合度為二和三的寡糖。Wang等[19]篩選的希瓦氏菌屬Shewanella sp.Kz7能同時水解聚甘露糖醛酸和聚古羅糖醛酸得到單糖。據相關報道,以褐藻膠三糖為主要成分的褐藻膠寡糖能促進大鼠腸道內益生菌的增殖和抑制有害菌的生長,而且低分子量的褐藻膠寡糖具有很強的抗氧化活性,有望開發成一種新的食品添加劑和飼料添加劑[20]。
在多糖利用實驗中,菌株X511能利用褐藻膠、海藻酸鈉、昆布多糖、海帶粉、可溶性淀粉、海帶多糖、褐藻糖膠和L-巖藻糖,不能利用羧甲基纖維素鈉和D-木糖。海帶的主要多糖成分褐藻膠和昆布多糖[21],該菌株能分別利用這兩種多糖,為海帶的生物酶解提供了思路。此外,海帶粉和昆布多糖還能延長該菌株的穩定期。
4 結論
自廣西潿洲島海域馬尾藻樣本中分離純化得到一株具有較強海藻酸鈉降解能力的海洋細菌,屬于革蘭氏陰性菌,鑒定為弧菌屬,編號X511。
菌株X511的生長速度快,16 h達到穩定期,液體發酵24 h酶活達到最大,能利用的單糖有葡萄糖、D-海藻糖、D-葡萄糖、D-甘露醇、甘露糖和蔗糖,還能以多種多糖為唯一碳源,如褐藻膠、海藻酸鈉、昆布多糖、海帶粉、可溶性淀粉、海帶多糖、褐藻糖膠和L-巖藻糖,其中包括多種褐藻的多糖成分,對褐藻資源的開發和利用具有較高的價值。
菌株X511在無NaCl以及NaCl濃度大于10%(W/V)的培養液中不能生長,其適宜生長的鹽濃度為2%-6%(W/V),且一定濃度的NaCl、海帶粉和L-巖藻糖能延長該菌的平穩期,屬于典型的海洋細菌。
菌株X511產生的酶同時對海藻酸鈉、聚甘露糖醛酸和聚古羅糖醛酸有酶解活性,其海藻酸鈉的酶降解產物主要為褐藻膠三糖。
[1]Campbell CJ, Laherrere JH. Preventing the next oil crunch-the end of cheap oil[J]. Scientific American, 1998, 278(3):77-83.
[2]錢龍, 唐麗薇, 黃庶識, 伊日布斯. 海藻酸轉化生物乙醇研究進展[J]中國生物工程雜志, 2013, 33(1):122-127.
[3]任小波, 吳園濤, 向文洲, 秦松. 海洋生物質能研究進展及其發展戰略思考[J]. 地球科學進展, 2009, 24(4):403-410.
[4]于敏, 關春江, 那杰. 大型海藻發酵制取乙醇研究淺析[J].水產學雜志, 2014, 27(1):55-59.
[5]Panikkar R, Brasch DJ. Composition and block structure of alginates from New Zealand brown seaweeds[J]. Carbohydrate Research, 1996, 293(1):119-132.
[6]Ma LY, Chi ZM, Li J, Wu LF. Overexpression of alginate lyase of Pseudoaltetmonas elyakovii in Escherichia coli, purification, and characterization of the recombinant alginate lyase[J]. World J Microbiol Biotechnol, 2008, 24(1):89-96.
[7]Kawamoto H, Horibe A, Miki Y, et al. Cloning and sequencing analysis of alginate lyase genes from the marine bacterium Vibrio sp. O2[J]Mar Biotechnol, 2006, 8(5):481-490.
[8]An QD, Zhang GL, Wu HT, et al. Alginate-deriving oligosaccharide production by alginase from newly isolated Flavobacterium sp. LXA and its potential application in protection against pathogens[J]. J Appl Microbiol, 2009, 106(1):161-170.
[9]Nakagawa A, Ozaki T, Chubachi K, et al. An effective method for isolating alginate lyase-producing Bacillus sp. ATB-1015 strain and purification and characterization of the lyase[J]. J Appl Microbiol, 1998, 84(3):328-335.
[10]Cao L, Xie L, Xue X, et al. Purification and characterization of alginate lyase from Streptomyces species strain A5 isolated from banana rhizosphere[J]. J Agric Food Chem, 2007, 55(13):5113-5117.
[11]Preiss J, Ashwell G. Alginic acid metabolism in bacteria. I. enzymatic formation of unsaturated oligosac-charides and 4-deoxy-L-erythro-5-hexoseulose uronic acid[J]. The Journal of Biological Chemistry, 1962, 237:309-316.
[12]陳朋, 朱玥明, 韓文佳, 等. 產褐藻膠裂解酶菌種的篩選、鑒定及發酵條件優化[J]. 食品科學, 2015, 36(15):105-111.
[13]李恒, 朱思婷, 劉旭梅, 等. 褐藻膠裂解酶產生菌的分離鑒定及產酶發酵優化[J]. 中國生物工程雜志, 2014, 34(9):94-101.
[14]嚴芬, 連燕萍, 楊光, 等. 高產褐藻膠裂解酶菌株的篩選及發酵條件優化[J]. 食品工業科技, 2015, 36(22):287-292.
[15]郭恩文, 王亞, 于文功, 韓峰. 產雙功能褐藻膠裂解酶菌株的篩選與初步研究[J]. 現代生物醫學進展, 2013, 13(29):5606-5609.
[16]侯士昌, 溫少紅, 唐志紅, 等. 一株高效褐藻酸降解菌的篩選、鑒定及其發酵條件的優化[J]. 海洋科學, 2014, 7:20-26.
[17]李永幸, 楊帆, 姜澤東, 等. 響應面優化微泡菌ALW1產褐藻膠裂解酶的發酵條件[J]. 發酵科技通訊, 2016, 2:75-80.
[18]林清菁, 潘崇良, 蔣霞敏, 等. 一株海藻多糖降解菌的分離與鑒定[J]. 微生物學通報, 2014, 41(11):2208-2215.
[19]Wang L, Li S, Yu W, Gong Q. Cloning, overexpression and characterization of a new oligoalginate lyase from a marine bacterium, Shewanella sp. [J]. Biotechnol Lett, 2015, 37(3):665-671.
[20]孫麗萍, 薛長湖, 許家超, 等. 褐藻膠寡糖體外清除自由基活性的研究[J]. 中國海洋大學學報, 2005, 35(5):811-814.
[21]仇哲, 孫躍春, 吳海歌. 酶解海帶產物的營養成分分析[J].黑龍江八一農墾大學學報, 2016, 28(2):60-63.
(責任編輯 狄艷紅)
Screening and Identification of a Marine Alginate-degrading Bacterium and the Utilization Capacity of Polysaccharide
XU Chao1XIONG Ya-ru1LU Ming-qian2LIAO Wei3ZHANG Yun-kai1HUANG Shu-shi2
(1. College of Life Science and Technology,Guangxi University,Nanning 530003;2. Biophysics Laboratory of Guangxi Academy,Nanning 530007;3. Guangxi Vocational and Technical College,Nanning 530226)
The purpose of this work is to obtain a strain with an ability to degrade alginate. With sodium alginate as a sole carbon source,a strain of marine bacterium with the solid ability to degrade alginate was screened and purified from the cankered gulfweed,coded as X511. According to the morphological observation,physicochemical indexes and the techniques of molecular biology,the strain was identified as Vibrio,designated as Vibrio sp. X511. The exponential phase of strain X511 was about 5-16 h,and the suitable salinity for its growth was around 2%-6%(W/V). It was capable to grow in the culture medium with a sole carbon source like glucose,mannitol,or starch,et al. Also,4%-6%(W/V)of the salinity,the kelp powder,and the laminarin extended its stationary phase. The activity of intracellular crude alginate lyase reached 12.68 ± 0.13 U/mL when the X511 fermented in the screening medium for 24 h. The intracellular crude alginate lyase was extracted,and its ability to digest alginate sodium,poly mannurono acid,and poly guluronic acid was measured as such order:alginate sodium > poly mannurono acid > poly guluronic acid. The results of the Thin Layer Chromatography(TLC)showed that the enzymatic degradation product of alginate sodium was trisaccharide. The above results indicate that the X511 is a marine strain with strong salt tolerance,short growth cycle,and it simultaneously utilizes the sodium alginate,poly mannurono acid,and poly-guluronic acid as its growing carbon resource.
alginate;screening;identification;salt tolerance;polysaccharides use
10.13560/j.cnki.biotech.bull.1985.2017.04.026
2016-09-14
國家自然科學基金項目(31560017),廣西自然科學基金重點項目(2014GXNSFDA118012)
許超,男,碩士研究生,研究方向:海洋微生物;E-mail:18174662721@163.com
黃庶識,男,研究員,研究方向:海洋微生物;E-mail:hshushi@gxas.cn

