人白細胞介素10受體α基因真核表達及與JAK1蛋白的相互作用的檢測
郭欣欣 王剛 鄧巧亭 吳涵韜 李坤 吳英松 劉天才
(南方醫科大學檢驗與生物技術學院抗體工程研究所,廣州 510515)
人白細胞介素10受體α基因真核表達及與JAK1蛋白的相互作用的檢測
郭欣欣 王剛 鄧巧亭 吳涵韜 李坤 吳英松 劉天才
(南方醫科大學檢驗與生物技術學院抗體工程研究所,廣州 510515)
構建含人白介素10受體α(IL-10RA)基因的真核表達質粒pENTER-IL-10RA-His,并在HEK293中進行真核表達,并用免疫共沉淀檢測JAK1與IL10RA在細胞內的相互作用。在HeLa細胞中提取人總RNA,通過RT-PCR獲得人IL10RA的基因全長,并將其克隆至真核表達載體pENTER-His中。經PCR擴增、雙酶切、測序鑒定后,將重組質粒pENTER-IL-10RA-His轉染至HEK293細胞中。免疫印跡法檢測IL-10RA蛋白在HEK293細胞中的表達。結果顯示,經PCR擴增和雙酶切,測序鑒定質粒克隆正確。免疫印跡可見63 kD的目的蛋白。共同轉染JAK1和IL-10RA的質粒,免疫印跡可見分別為133 kD和63 kD的目的條帶,免疫共沉淀鑒定了JAK1和IL-10RA的相互作用。IL-10RA基因成功構建在pENTER-His中,并在HEK293細胞中成功表達,并成功共轉染JAK1和IL-10RA質粒,免疫共沉淀檢測兩者的相互作用。這為JAK1和IL-10RA相互作用的機制研究奠定基礎。
白介素10受體α(IL-10RA);真核表達;免疫共沉淀;蛋白相互作用
人白介素10(Interleukin-10,IL-10)是一種通過跨膜受體介導的重要的免疫細胞調節因子,是重要的抗炎細胞因子之一。普遍認為,IL-10可以抑制炎癥反應和各種腫瘤,增強體液免疫應答[1-5]。IL-10是由多種細胞釋放的,對T細胞、B細胞和骨髓瘤細胞有不同的影響[6],它可以下調Th1細胞因子的表達,促進B細胞的增值、生存。IL-10受體(IL-10R)由兩條鏈組成,IL-10RA和IL-10RB,IL-10RA可以調節IL-10的免疫抑制信號,從而抑制促炎因子的合成[7,8]。IL-10RA可參與PEDF通路、EGF-β通路、AKT信號通路、JAK-STAT信號通路。IL-10RA的激活可導致非受體型酪氨酸激酶JAK1的激活,引發下游信號轉導通路的激活,產生一系列的反應。JAK1是非受體型酪氨酸蛋白激酶的家族成員之一,JAK1的突變或者過度表達可以引發多種疾病,如子宮內膜癌、胃癌等[9,10]。因此,研究JAK1與IL-10RA之間的蛋白相互作用極具意義。
目前對于IL-10RA蛋白的研究主要是對下游的信號通路的激活等,IL-10RA與JAK1的相互作用的研究報道并不多。結合前期的工作,本實驗室已成功構建并表達JAK1蛋白,接下來構建IL-10RA的真核表達質粒,并表達IL-10RA蛋白。共轉染pENTER-IL-10RA-His和pENTER-JAK1-His重組質粒,用免疫印跡檢測兩者的表達,免疫共沉淀檢測兩者的相互作用,旨在為研究兩者蛋白相互作用的機制奠定基礎。
1 材料與方法
1.1 材料
1.1.1 實驗材料 DH5α感受態細胞購自天根生化科技(北京)有限公司;pENTER-JAK1-His質粒、Hela細胞和HEK293細胞由南方醫科大學抗體工程研究所保存。
1.1.2 試劑 胎牛血清、1640培養基和DMEM培養基購自Hyclone公司;Total RNA小提試劑盒、和質粒提取試劑盒購自OMEGA公司;SuperScriptTMⅡReverse Transcriptase試劑盒和Lipofectamine? 2000轉染試劑購自Invitrogen公司;PrimeStar Max DNA聚合酶和DNA 2000核酸Marker購自TaKaRa公司;限制性內切酶AsiS I和MIu I購自BioLabs公司;一步法克隆試劑盒購自biotool公司。引物合成和質粒測序由華大基因完成。蛋白Marker購自ThermoFisher;PVDF膜購自Bio-RAD公司。鼠源抗GAPDH抗體、鼠源抗His抗體、山羊抗鼠IgGHRP、山羊抗兔IgG-HRP購自Bioworld公司;兔源抗JAK1抗體購自Cell Signaling Technology公司,抗IL-10RA抗體(鼠源)由羅樹紅教授贈與。Protein G Agrose beads 購自Millipore公司。
1.1.3 儀器設備 PCR擴增儀購自Life Technologies公司;蛋白電泳儀及轉移裝置購自BioRad公司;核酸電泳儀購自JUNYI。
1.2 方法
1.2.1 引物設計與合成 在GenBank中獲取IL-10RA基因序列(NM_001558),根據mRNA編碼區,用Primier5.0軟件進行引物設計,并在5' 端加入保護堿基和酶切位點,上游引物:5'-GCCGCGAT CGCCATGCTGCCGTGCCTCGTAGTGCTGC-3'(下劃線為AsiS I酶切位點),下游引物:5'-GCATGCGCA TCACTCACTTGACTGCAGGCTAGAG-3'(下劃線為MIu I酶切位點)。擴增的IL10RA基因片段大小為1 756 bp。
1.2.2 IL-10RA基因的擴增 用含10%胎牛血清的1640培養基培養HeLa細胞,按照Total RNA小提試劑盒的步驟提取人Hela細胞的總RNA,用1%的瓊脂糖凝膠電泳鑒定。按照SuperScriptTMⅡ Reverse Transcriptase試劑盒說明書將提取的RNA逆轉錄成cDNA。PCR體 系:PrimeStar Max 25 μL,cDNA模板5 μL,上游引物2 μL,下游引物2 μL,總體積為50 μL。PCR擴增反應條件:95℃ 10 min,95℃ 10 s,56℃ 5 s,72℃ 2 min,35個循環,72℃ 10 min,4℃保存。用1%的瓊脂糖凝膠電泳鑒定擴增產物。
1.2.3 真核表達質粒pENTER-IL-10RA-His的構建 將pENTER-His質粒進行AsiS I和MIu I雙酶切3 h,IL-10RA的PCR克隆產物和pENTER-His質粒用膠回收試劑盒回收產物。用一步法克隆試劑盒連接IL-10RA回收產物和回收的pENTER-His產物(IL-10RA和pENTER-His的摩爾比為5:1),16℃,20 h。連接產物轉化DH5α感受態細胞,次日挑取單克隆于5 mL 含Kana的LB培養基中,37℃搖床培養10 h,按照質粒提取試劑盒說明書提取質粒。質粒經PCR擴增和雙酶切鑒定為陽性克隆后,送至華大基因科技有限公司測序鑒定。
1.2.4 HEK293細胞培養及IL-10RA質粒轉染 用含10%胎牛血清的DMEM培養HEK293細胞。轉染前1 d將細胞以4×105細胞/孔接種于6孔板培養。次日待細胞生長至60%,按照Lipofectamine? 2000轉染試劑說明書轉染,質粒(μg):轉染試劑(μL)為1∶3的比例將空質粒、重組質粒pENTERIL-10RA-His各2 μg轉染至HEK293細胞,轉染6 h后HEK293細胞換液,轉染48 h后收細胞進行蛋白水平鑒定。
1.2.5 JAK1與IL10RA質粒共轉染 轉染前1 d將細胞以6×106細胞/皿接種于10 cm培養皿中。用同樣的方法將7 μg的pENTER-JAK1-His和3 μg的pENTER-IL-10RA-His重組質粒和30 μL轉染試劑轉染至HEK293細胞中,7 μg的pENTER-JAK1-His和3 μg的pENTER-IL-10RA-His分別轉染作為對照組。48 h后收細胞進行蛋白水平鑒定。
1.2.6 免疫印跡檢測蛋白的表達 將收集的蛋白樣品加入等體積的SDS-loading buffer(2×),沸水煮15 min使蛋白變性,后14 000 r/min,室溫離心15 min。經10% SDS-PAGE進行蛋白電泳。PVDF膜用甲醇浸泡5 min后進行電轉移。PVDF膜用5%脫脂奶粉室溫封閉2h,分別加入1∶10 000用封閉液稀釋的抗His標簽的鼠抗和抗GAPDH抗體為一抗,室溫孵育1 h。TBST工作液洗滌4次,每次8 min。加入山羊抗鼠IgG-HRP為二抗(1∶10 000稀釋),室溫孵育1 h。TBST工作液洗滌6次,每次8 min。ECL顯影。
1.2.7 免疫共沉淀鑒定IL-10RA和JAK1的相互作用 將共轉染表達的JAK1和IL-10RA的細胞用細胞裂解液收集,充分裂解。制備的裂解液中加入2 μg的抗IL-10RA的抗體,以HEK293細胞為對照,4℃結合過夜。40 μL/管 Protein G Agrose beads 5 000 r/min離心1 min,棄上清,用40 μL細胞裂解液重懸,加入到過夜反應的混合液中,4℃結合1 h。5 000 r/min離心1 min棄上清,重復4次,加入40 μL SDS-loading buffer(2×)準備蛋白電泳樣品,免疫印跡法檢測,這里抗IL-10RA的抗體和抗JAK1的抗體為一抗分別孵育相應位置的條帶,相對應的山羊抗鼠IgG-HRP和山羊抗兔IgG-HRP為二抗。
2 結果
2.1 人Hela細胞總RNA鑒定
提取的Hela的總RNA經1%瓊脂糖凝膠電泳,結果(圖1)顯示,有明顯的28S和32S兩條條帶,OD260/280約為1.98,說明此次提取的總RNA可用于逆轉錄cDNA。
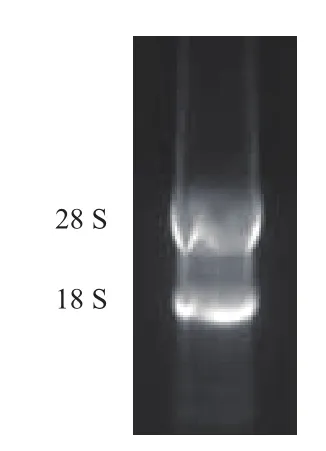
圖1 人Hela細胞的總RNA
2.2 IL-10RA擴增產物的鑒定
合成的引物以cDNA為模板經PCR擴增目的片段,產物進行1%瓊脂糖凝膠電泳。結果(圖2)顯示約1 756 bp可見特異性目的條帶,與IL-10RA大小一致。
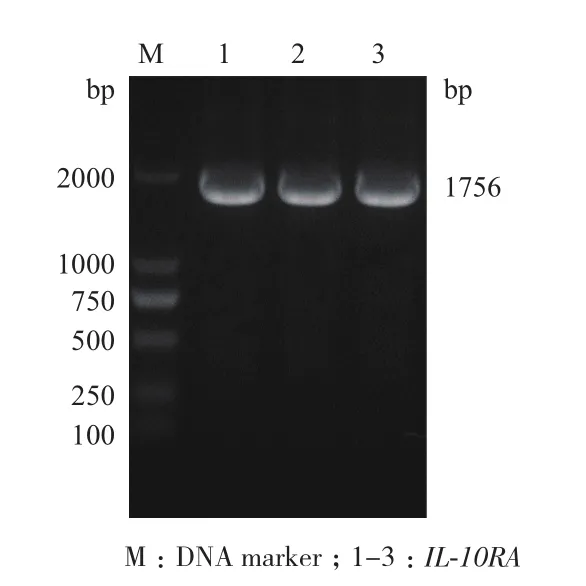
圖2 IL-10RA基因PCR產物電泳圖
2.3 重組質粒的PCR鑒定
提取質粒并進行重組質粒的PCR鑒定。1%瓊脂糖凝膠結果(圖3)在約1 756 bp可見特異性目的條帶,與IL-10RA大小一致,說明重組質粒含有IL-10RA基因片段。
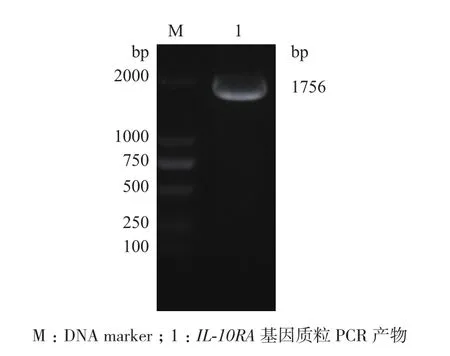
圖3 重組質粒pENTER-IL-10RA-His的質粒PCR
2.4 重組質粒的雙酶切鑒定
分別用限制性內切酶AsiSⅠ和MIuⅠ對重組質粒進行雙酶切鑒定,產物進行1%瓊脂糖凝膠電泳(圖4),在約1 756 bp和7 472 bp處可見IL-10RA基因和pENTER-His質粒的條帶,說明重組質粒構建成功。
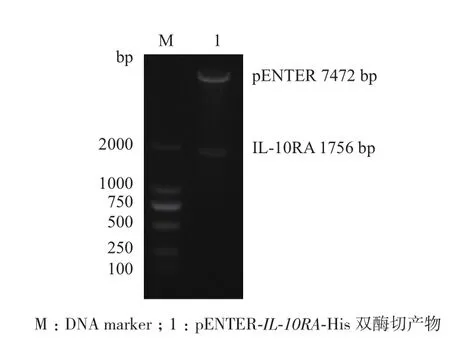
圖4 重組質粒pENTER-IL-10RA-His的雙酶切鑒定
2.5 免疫印跡法鑒定重組質粒pENTER-IL-10RAHis在HEK293細胞的表達
收 集 轉 染48 h的HEK293細 胞,Western blotting鑒定IL-10RA蛋白表達量(圖5),以未處理的HEK293細胞作為對照組。實驗組HEK293細胞中轉染pENTER-IL-10RA-His質粒,Western Blotting鑒定可見約63 kD的IL-10RA蛋白條帶。

圖5 IL-10RA蛋白表達的western blotting分析結果
2.6 免疫印跡法鑒定共轉染質粒pENTER-IL-10RA-His和pENTER-JAK1-His在HEK293的表達
收集共轉染重組質粒pENTER-IL-10RA-His和pENTER-JAK1-His的HEK293細胞,檢測其蛋白表達量,以未處理的HEK293細胞、單轉質粒pENTER-IL-10RA-His、質粒pENTER-JAK1-His為對照組,Western Blotting鑒定。由圖6可知,實驗組出現兩條條帶,位置在約63 kD和133 kD處;未處理的HEK293細胞未出現特異性條帶;單轉染的質粒pENTER-IL-10RA-His在約63 kD有條帶出現;單轉染的質粒pENTER-JAK1-His在133 kD處出現條帶,這與共轉染的結果相符,說明共轉染質粒成功表達IL-10RA和JAK1蛋白。
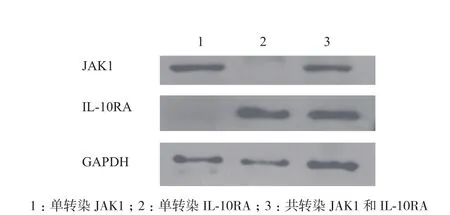
圖6 JAK1和IL-10RA共轉染結果分析
2.7 免疫共沉淀檢測IL-10RA和JAK1蛋白的相互作用
共轉染JAK1和IL-10RA質粒的細胞裂解液用抗IL-10RA的抗體捕獲裂解液中的IL-10RA,同時捕獲的還有可以與之相互作用的JAK1蛋白。Protein G Agrose beads可特異性結合抗IL-10RA的抗體。加入Protein G Agrose beads后, 抗IL-10RA的 抗 體和IL-10RA及與之相互作用的蛋白JAK1均結合在Protein G Agrose beads上,通過低速離心,使得與裂解液中的其他蛋白分離,Western Blotting鑒定(圖7)。HEK293細胞對照組只出現抗體的重鏈和輕鏈,而實驗組除了抗體的重鏈和輕鏈,還有目的條帶JAK1和IL-10RA的條帶,這說明兩個蛋白在HEK293細胞中存在相互作用,并且可以用免疫共沉淀檢測。
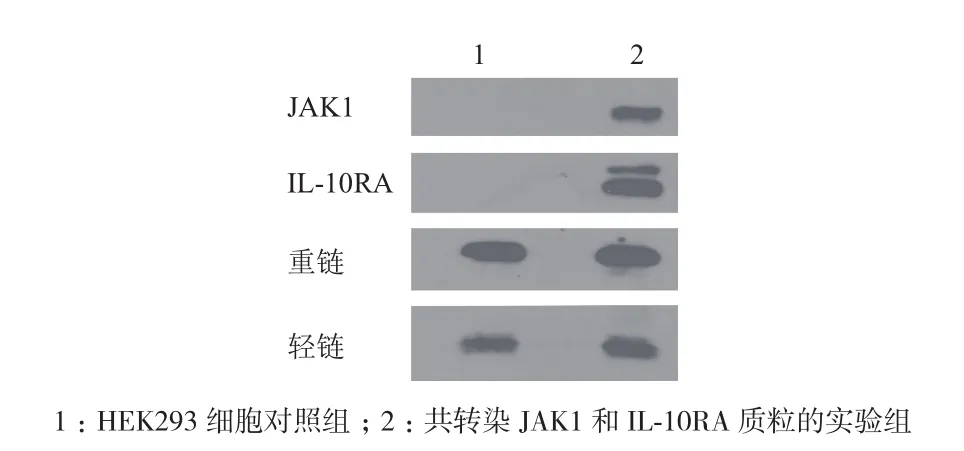
圖7 檢測JAK1蛋白和IL-10RA蛋白相互左右的免疫共沉淀分析
3 討論
自90年代開始,人類開始實施基因組計劃,至2003年經過世界各國科學家的努力,提前完成了人全基因組測定。但是,大多數疾病并非僅僅因為基因改變造成,隨后又提出后基因組計劃,蛋白質組的研究占據及其重要的部分,但是對于蛋白質功能及其相互作用方面的研究仍相對缺乏。目前研究蛋白質相互作用技術方法很多,如噬菌體展示技術、串聯親和純化技術、pull down,免疫共沉淀等[11-17]。研究發現,IL-10可以調節相關細胞的神經炎癥反應,而且也存在抗凋亡作用。IL-10通過與神經元上的IL-10RA相互作用,導致JAK1-STAT3通路的激活,抑制神經元凋亡和神經炎癥[18]。Wagner等[19]發現JAK1激活程度不同可引起下游不同的信號轉導通路,JAK1的抑制可某種程度上減輕自身免疫病及炎癥,這提示未來JAK1的抑制劑可能可以應用于自身免疫性疾病的治療。但是,目前對于IL-10RA蛋白的研究主要致力對下游信號通路的激活等,IL-10RA與JAK1的相互作用的研究報道并不多。因此,本研究嘗試用免疫共沉淀的方法檢測IL-10RA與JAK1的蛋白相互作用。而IL-10RA參與多條信號通路,因此與其存在相互作用的蛋白必然很多,現今用經典的免疫共沉淀的方法對這些相互作用蛋白尚并不能定量,而且檢測過程繁瑣而復雜。因此,嘗試用免疫分析的方法如ELISA、時間分辨免疫分析、化學發光免疫分析等,以期對已知存在相互作用的蛋白進行簡便快速的檢測,同時也可為其他研究者尋找未報道的存在相互作用的蛋白提供便利,這將是未來的一個研究方向。
4 結論
本實驗從Hela細胞中提取人總RNA,并通過逆轉錄PCR獲得IL-10RA基因全長,以pENTERHis為載體構建重組真核表達質粒轉染至HEK293細胞表達蛋白,Western blot可檢測到與人IL-10RA大小一致的蛋白條帶。共轉染及免疫共沉淀均可檢測到IL-10RA和JAK1。真核表達蛋白特異性較強,具有生物學活性,其結構更接近天然蛋白。
[1]Mocellin S, Marincola FM, Young HA. Interleukin-10 and the immune response against cancer:a counterpoint[J]. Journal of Leukocyte Biology, 2005, 78(5):1043-1051.
[2]von Lanzenauer SH, Wolk K, Kunz S, et al. Interleukin-10 receptor-1 expression in monocyte-derived antigen-presenting cell populations:dendritic cells partially escape from IL-10’s inhibitory mechanisms[J]. Genes & Immunity, 2015, 16(1):8-14.
[3]Trifunovi? J, Miller L, Debeljak Z, et al. Pathologic patterns of interleukin 10 expression--a review[J]. Biochemia Medica, 2015, 25(1):36-48.
[4]Kim R, Emi M, Tanabe K, et al. Tumor-driven evolution of immunosuppressive networks during malignant progression[J]. Cancer Research, 2006, 66(11):5527-5536.
[5]Darnell JJ, Kerr IM, Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins[J]. Science, 1994, 264(5164):1415-1421.
[6]Beser OF, Conde CD, Serwas NK, et al. Clinical features of interleukin 10 receptor gene mutations in children with very earlyonset inflammatory bowel disease[J]. Journal of Pediatric Gastroenterology & Nutrition, 2014, 60(3):332-338.
[7]Pestka S, Krause CD, Sarkar D, et al. Interleukin-10 and related cytokines and receptors[J]. Annual Review of Immunology, 2004, 22:929-979.
[8]Commins S, Steinke JW, Borish L. The extended IL-10 superfamily:IL-10, IL-19, IL-20, IL-22, IL-24, IL-26, IL-28, and IL-29[J]. Journal of Allergy & Clinical Immunology, 2008, 121(5):1108-1111.
[9]Stelloo E, Versluis MA, Nijman HW, et al. Microsatellite instability derived JAK1 frameshift mutations are associated with tumor immune evasion in endometrioid endometrial cancer[J]. Oncotarget, 2016,7(26):39885-39893.
[10]Song B, Zhan H, Bian Q, et al. Piperlongumine inhibits gastric cancer cells via suppression of the JAK1, 2/STAT3 signaling pathway[J]. Molecular Medicine Reports, 2016, 13(5):4475-4480.
[11]Li Q, Gu S, Li N, et al. Protein interaction network construction and biological pathway analysis related to atherosclerosis][J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2015, 32(6):1255-1260.
[12]Verhelst J, De Vlieger D, Saelens X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein[J]. J Vis Exp, 2015(98):e52871.
[13]Duan JW, Lu Z, Jiang B, et al. Discovery of pyrrolo[1, 2-b]pyridazine-3-carboxamides as Janus kinase(JAK)inhibitors[J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(24):5721-5726.
[14]Einarson MB, Pugacheva EN, Orlinick JR. GST Pull-down[J]. CSH Protoc, 2007(2007):t4757.
[15]Valero ML, Sendra R, Pamblanco M. Tandem affinity purification of histones, coupled to mass spectrometry, identifies associated proteins and new sites of post-translational modification in Saccharomyces cerevisiae[J]. J Proteomics, 2016, 136:183-192.
[16]Saito Y, Nakagawa T, Kakihana A, et al. Yeast Two-Hybrid and One-Hybrid screenings identify regulators of hsp70 gene expression[J]. J Cell Biochem, 2016, 117(9):2109-2117.
[17]Yu Y, Li Y, Zhang Y. Yeast Two-Hybrid screening for proteins that interact with the extracellular domain of amyloid precursor protein[J]. Neurosci Bull, 2016, 32(2):171-176.
[18]Zhu Y, Chen X, Liu Z, et al. Interleukin-10 protection against lipopolysaccharide-induced neuro-inflammation and neurotoxicity in ventral mesencephalic cultures[J]. International Journal of Molecular Sciences, 2016, 17(1).
[19]Wagner AH, Conzelmann M, Fitzer F, et al. JAK1/STAT3 activation directly inhibits IL-12 production in dendritic cells by preventing CDK9/P-TEFb recruitment to the p35 promoter[J]. Biochem Pharmacol, 2015, 96(1):52-64.
(責任編輯 李楠)
Eukaryotic Expression of Human Interleukin 10 Receptor α and Detection of Interactions in Protein JAK1s
GUO Xin-xin WANG Gang DENG Qiao-ting WU Han-tao LI Kun WU Ying-song LIU Tian-cai
(Institute of Antibody Engineering,School of Laboratory Medicine and Biotechnology,Southern Medical University,Guangzhou 510515)
This work is to construct a eukaryotic express vector pENTER-IL-10RA-His that expresses human interleukin 10 receptor α(IL-10RA)in HEK293 cells,and then to detect the intracellular interaction between JAK1 and IL-10RA by co-immunoprecipitation. Human total RNA was extracted from Hela cells,then IL-10RA gene was amplified by RT-PCR and inserted into eukaryotic vector pENTER-His. After validation by PCR,enzymatic digestion,and sequencing,the HEK293 cells were transfected with the recombined plasmid pENTER-IL-10RA-His. The expression level of IL-10RA at 48 h was determined by Western blotting. The results revealed that plasmid was cloned correctly,and the target protein of 63 kD was observed. When HEK293 cells were simultaneously transfected with the plasmid of both JAK1 and IL-10RA,the target protein band in 133 kD and 63 kD were identified. Co-immunoprecipitation validated the interaction between JAK1 and IL-10RA. In conclusion,IL-10RA gene was successfully constructed in recombined plasmid pENTER-His and expressed effectively in HEK293 cells. The interaction between JAK1 and IL-10RA was validated co-immunoprecipitation,which lays a foundation for further understanding the mechanism of interaction between JAK1 and IL-10RA.
interleukin 10 receptor α(IL-10RA),eukaryotic expression,co-immunoprecipitation,protein - protein interaction
10.13560/j.cnki.biotech.bull.1985.2016-0985
2016-10-28
國家高技術研究發展計劃(“863”計劃)項目(2014AA020904),國家自然科學基金項目(21575058、81271931)
郭欣欣,女,碩士研究生,研究方向:免疫學,蛋白質相互作用;E-mail:347315578@qq.com
劉天才,男,研究員,研究方向:免疫學;E-mail:liutc@smu.edu.com

