兩種瞬時表達體系研究擬南芥Profilin-1的亞細胞定
張曉慧 韓榕
(山西師范大學生命科學學院 植物分子與環境脅迫響應山西省高等學校重點實驗室,臨汾 041000)
兩種瞬時表達體系研究擬南芥Profilin-1的亞細胞定
張曉慧 韓榕
(山西師范大學生命科學學院 植物分子與環境脅迫響應山西省高等學校重點實驗室,臨汾 041000)
使用兩種瞬時表達方法研究Profilin-1(PRF1)的亞細胞定位,并比較了2種瞬時表達體系在亞細胞定位研究中的優缺點。利用擬南芥幼葉作為材料,提取葉片的RNA,采用特異性引物RT-PCR的方法克隆PRF1基因,連接到pCAMBIA1300-GFP的改造載體上,成功的構建pCAMBIA1300-GFP-PRF1的表達載體。然后分別利用PEG轉化擬南芥原生質體、農桿菌浸染煙草葉片兩種技術進行了瞬時表達,并在激光共聚焦顯微鏡下觀察綠色熒光蛋白(GFP)融合蛋白的表達。研究結果表明,將PRF1基因導入擬南芥的原生質體和煙草表皮細胞后,融合蛋白綠色熒光均能被觀察到,PRF1基因與GFP融合蛋白的產物在煙草表皮細胞中主要定位在細胞質和外周細胞器中,在擬南芥的原生質體中的細胞核和細胞質中都有定位。兩種不同的瞬時表達體系中PRF1蛋白的定位出現了不同,這可能與同源或異源表達的植物的特性相關。
擬南芥;PRF1;瞬時表達;原生質體;GFP
轉基因是一種非常重要的手段去研究植物的分子生物學,并且它可以被用來研究植物中基因的功能和遺傳學上的進展[1]。然而,在轉基因株系中穩定的基因的表達是相對昂貴和費時的,并且對大規模的植物基因的分析是有限制的。瞬時表達研究變得越來越便捷,簡單,安全和有效,并且與長期穩定表達的系統相比瞬時表達有很高的表達水平[2]。如今瞬時基因表達已經被廣泛的用于蛋白質功能的研究,如蛋白質的亞細胞定位和運輸、蛋白與蛋白之間的相互作用、蛋白的穩定和降解以及蛋白的活力。普通的瞬時轉染系統的方法包括基因槍轟擊法,根癌農桿菌介導法(農桿菌滲入法),聚乙二醇(聚乙二醇)介導的原生質體轉化。雖然,離子轟擊的方法可以被用于大部分的植物物種中[3],但是它是具有挑戰性的,使用這種方法會改變許多類型的葉綠體靶向蛋白[4]。農桿菌介導的瞬時表達具有操作簡單、價格低,易操作的特點[5]。使用各種不同的轉染技術將重組質粒的DNA分子轉染到原生質體中有很多方法,如PEG介導法、電穿孔法和顯微注射法。而PEG介導的原生質體的轉染表達有很高的轉染效率,可以直接作用于單個細胞,從而可以更直接地研究外源基因在細胞內的瞬時表達,所以它被很廣泛的應用于植物分子生物學研究中[6,7]。
前纖維蛋白(Profilin)是一個分子量為12-15 kD的肌動蛋白結合蛋白,它在動植物中廣泛存在[8,9]。1997年,Profilin主要在動物細胞的提取液中作為抑制微絲體外聚合的組分被提取出來,植物中Profilin是在1991年作為赤楊花粉中的致敏源而被發現的[10],經過多年的研究,人們已經發現了多種Profilin的異構體。如玉米中已確定的Profilin的異構體有6種[11],在模式生物擬南芥中至少有5種Profilin的異構體[12],在這些Profilin異構體中,其中Profilin-1在調控植物細胞的生長中扮演著重要的作用,如頂端生長的細胞-根毛和彌散生長的細胞-下胚軸表,當缺失Profilin-1時,就會導致根毛變短和下胚軸變短。相反的,當過表達Profilin-1時,就會導致根毛和下胚軸變長[13]。為了對Profilin-1的分布進行研究,我們利用了綠色熒光蛋白的方法,去觀察Profilin-1的分布。熒光蛋白是在發光的水母(Aequorea victoria)中發現的小分子蛋白,當使用UV光去激發GFP蛋白是就表現出了熒光特性[14]。GFP的最大激發波長為395 nm,發射光波長為509 nm,采用帶有濾波器的熒光顯微鏡可以很容易的被觀察到[15]。GFP能夠一直的維持熒光亮度。它是一種很好的熒光標簽去檢測蛋白與蛋白之間的相互作用,蛋白的跨膜和亞細胞定位。然而,直到現在還沒有報道使用帶有GFP報告基因的瞬時表達去研究Profilin-1的定位。在本實驗中,我們構建了GFP∶PRF1融合基因,利用瞬時表達的方法將融合基因分別導入到擬南芥原生質體和煙草的表皮細胞中,使用激光共聚焦顯微鏡觀察PRF1在細胞中的定位,旨在為后期瞬時表達體系的建立和其它功能基因的導入奠定基礎。
1 材料與方法
1.1 材料
1.1.1 植物材料 擬南芥哥倫比亞生態型被用于本次實驗的研究,使用1%的次氯酸鈉消毒后用蒸餾水沖洗種子,然后用0.1%的瓊脂粉懸浮種子點種在MS培養基上,4℃冰箱放置72 h后轉移至生長室中,生長室的條件如下:溫度,22±1℃;光照強度,50-55 mmol photons m-2s-1;光周期,16∶8 h(光∶黑暗);相對濕度,70%。
本氏煙草用于此次研究中,并且所選用的植物是4-5周的植物,光周期為14∶10 h(光∶黑暗)。
1.1.2 菌株、質粒及試劑 農桿菌GV3101、大腸桿菌DH5α均為本實驗室所有,質粒小提試劑盒,DNA回收試劑盒,T4 DNA連接酶和DNA marker均來購自TaKaRa(Japan)公司,限制性內切酶和Q5高保證酶均購自NEB(Beijing)有限公司,纖維素酶和果膠酶均購自日本Yakult公司。
1.1.3 儀器 激光共聚焦掃描顯微鏡(OLYMPUS CONFOCAL FV1000)。
1.2 方法
1.2.1 RNA的提取 選取葉片完全伸展的2周的擬南芥葉片作為實驗材料,然后將幼苗轉移到液氮中,用預冷的研磨棒將葉片研磨成粉狀,使用Trizol試劑來提取RNA后,用1%的瓊脂糖凝膠電泳檢測,RNA質量合格后,使用PrimeScipt?RTReagent Kit(TaKaRa,Japan)將RNA反轉錄為cDNA,最后將cDNA儲存在 -80℃的冰箱中,以便用于后續的實驗。
1.2.2 PRF1基因的克隆和表達載體的構建 根據擬南芥微絲結合蛋白PRF1的全長進行引物設計,設計引物如下:上游引物:5'-CGCGGATCCATGTCTTGGCAATCATACG-3';下游引物:5'-CGGGGTACCGAG TTCAGACTCGATAAGG-3'。以上引物的劃線部分分別為BamH I和Kpn I兩個內切酶的酶切識別位點,前面斜體為保護堿基。然后使用此引物擴增得到目的基因profilin-1,使用1.5%的瓊脂糖凝膠進行檢測并回收目的片段。將回收后的片段連接到表達載體上,然后轉染到大腸桿菌感受態中,選擇陽性單克隆菌株,搖菌,提質粒,酶切鑒定,送往北京華大公司測序。
1.2.3 原生質體的分離和轉染 選取3周齡的擬南芥葉片用于提取原生質體,原生質體的提取方法如下[16],略有改動。酶溶液的制備含有1%的纖維素酶R-10,0.25%的離析酶R-10,20 mmol/L MES、0.4 mol/L甘露醇和20 mmol/L KCl,酶溶液放置在水浴鍋中55℃ 10 min。然后移到室溫環境中放涼,然后添加0.1% BSA、10 mmol/LCaCl2和5 mmol/L β-ME(β-巰基乙醇),使用0.45 μm的過濾器過濾,儲存,為后續的使用,使用雙面刀片按與主莖面垂直的方向切成1 mm的細條狀。這些細條被快速的放在酶解液中(0.4-0.5 g/10 mL),然后在25℃暗處酶溶液中孵育3 h。在消化后,用W5(20 mmol/L MES,154 mmol/L NaCl,125 mmol/L CaCl2,5 mmol/L KCl,pH5.8)把酶解液稀釋成同等的體積。并且均勻的混合在一起,然后使用200目的尼龍網過濾。離心1 000 r/min 2 min,上清液去除,把原生質體重懸在W5溶液中,接下來取靜置10 h后的原生質體以終濃度為25 mol/L的熒光素二乙酸酯(Fluoresceindiacetate,FDA)室溫處理10 min,在熒光顯微鏡下鏡檢,鑒定原生質體的活力。
接下來,進行擬南芥原生質體的轉化,向原生質體中加入MMg溶液[0.4 mol/L甘露醇、15 mmol/L MgCl2和4 mmol/L MES(pH5.7)],重懸原生質體,接下來在1.5 mL離心管中加入100 μL的重懸的原生質體和25 μL的重組載體,再加入125 μL的PEG溶液(40% PEG-4000,0.2 mol/L甘露醇和0.1 mol/L CaCl2),輕輕搖勻,在23℃培養箱中,避光靜置30 min。接下來加入4倍體積的W5溶液混勻,室溫100×g離心1 min,移除PEG,在加入100 μL的W5溶液重懸原生質體,將轉化后的原生質體放在22℃培養箱中培養12-18 h,用熒光顯微鏡下觀察鑒定。
1.2.4 PRF1在煙草細胞中的表達 將GFP:PRF1載體轉入農桿菌菌株GV3101的感受態細胞中,涂板,放在28℃的培養箱中培養,16 h后挑取單克隆菌株于YEB液體培養基中,于搖床中 28℃ 200 r/min 過夜搖培24-36 h,測OD600的值為0.8-1時,結束培養,5 000×g,離心5 min,倒掉上清液,使用重懸液(1 mol MgCl2,0.5 mol MES,100 mol/L AS(乙酰丁香酮)懸菌,使其終濃度達到0.4,室溫靜置3 h后,使用沒有針頭的1 mL的注射器吸取菌液,注射3-4周長勢較好煙草。接種2 d后,使用激光共聚焦對煙草葉片表面接種部位進行觀察拍照。
2 結果
2.1 PRF1的擴增和DNA的構建
對擬南芥葉片進行總RNA的提取,通過1%的瓊脂糖凝膠進行檢測,然后以此RNA為模板,通過RT-PCR擴增得到一條長約396 bp的片段(圖1-A),可以進行到下一步的連接實驗。然后,將目的基因片段PRF1與帶GFP標簽的表達載體連接,轉化到大腸桿菌中,提質粒進行酶切驗證,酶切3 h后,使用1%的瓊脂糖進行驗證,驗證結果如圖1-B所示。接下來將質粒送往北京華大進行測序,測序正確,這個構建好質粒可以被用于接下來的瞬時表達實驗。
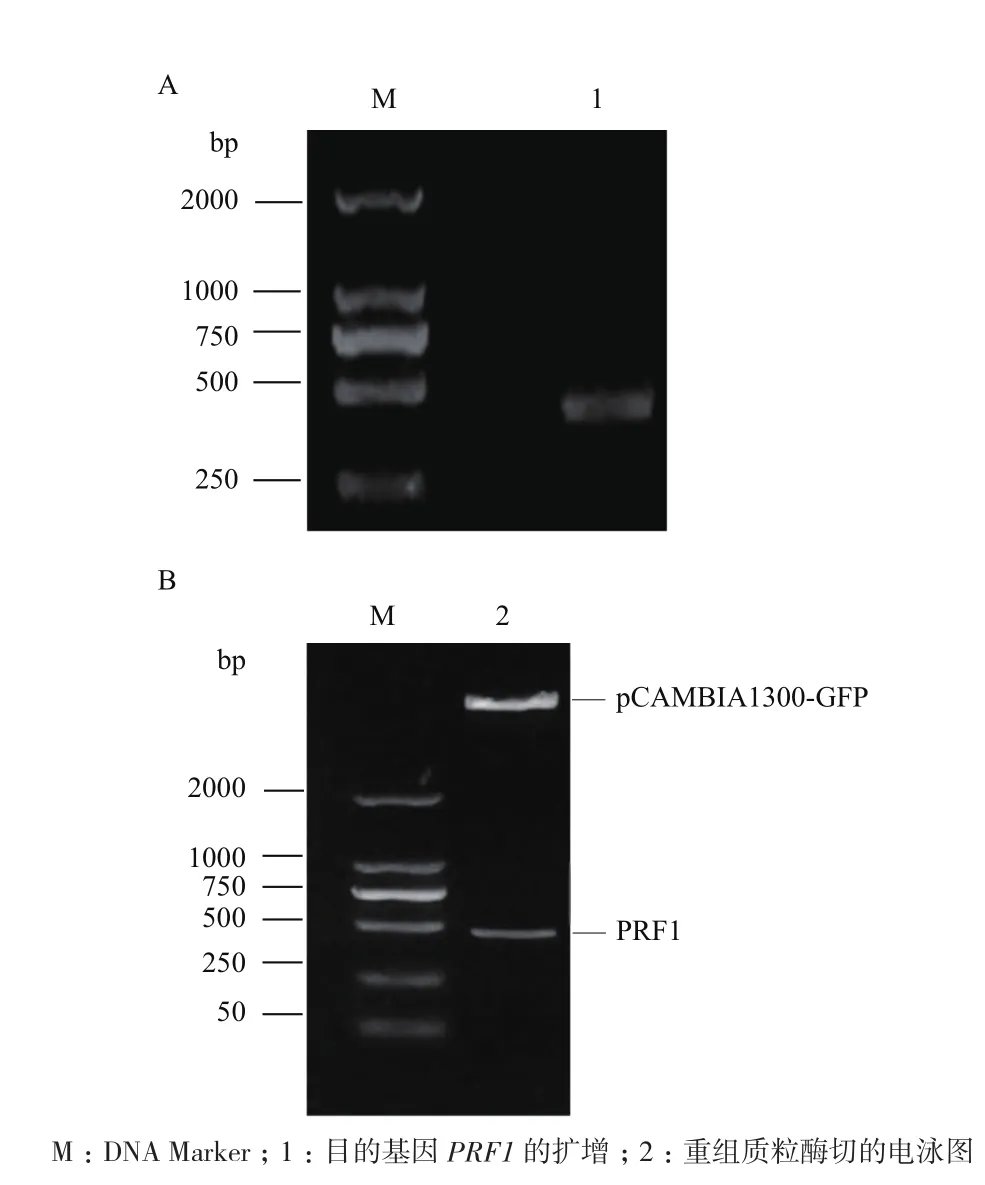
圖1 PRF1的擴增(A)和重組質粒雙酶切(B)結果
2.2 原生質體活力的檢測和PRF1在原生質體中的瞬時表達
高質量的原生質體對于隨后的研究和分析十分重要,尤其是原生質體的轉化。首先,用3周齡的擬南芥幼苗葉片作為材料進行原生質體的提取,擬南芥葉肉原生質體為表面十分光滑的球狀體(圖2-B)。其次,開花前的幼苗比整株幼苗更可以提取到比較好的原生質體(圖2-A)。對原生質體活力的鑒定采用熒光指示劑FDA標記法,研究結果發現,在488 nm激發下,大部分原生質體仍顯示綠色熒光,表明原生質體始終保持很高的活性,可以用于接下來的原生質體的轉染實驗(圖2-C)。
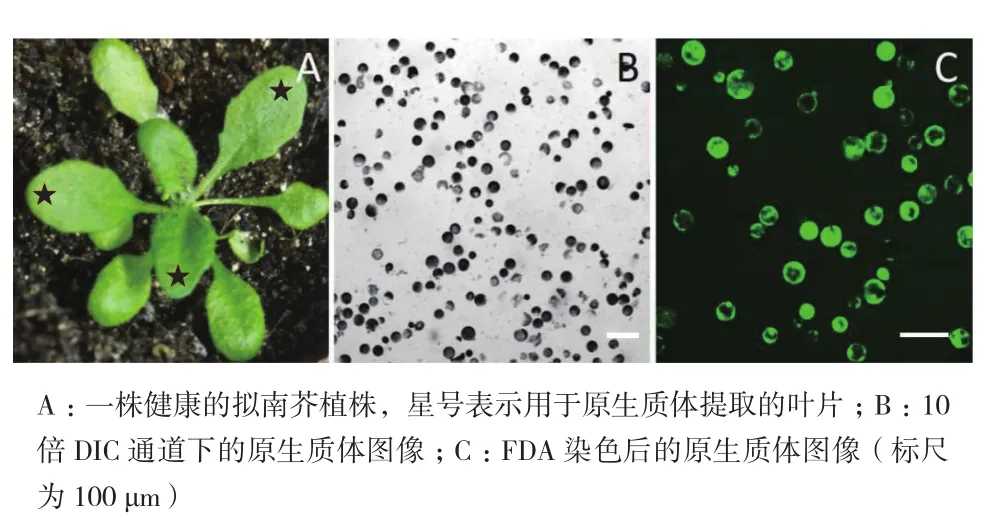
圖2 原生質體的提取
為了可以形象直觀的看到PRF1蛋白的亞細胞定位,我們構建了帶有GFP標簽的融合表達載體,通過PEG轉化法將融合表達載體轉化到擬南芥原生質體中,融合蛋白在原生質體中的胞質和質體的定位,且較清晰(圖3A-C)。
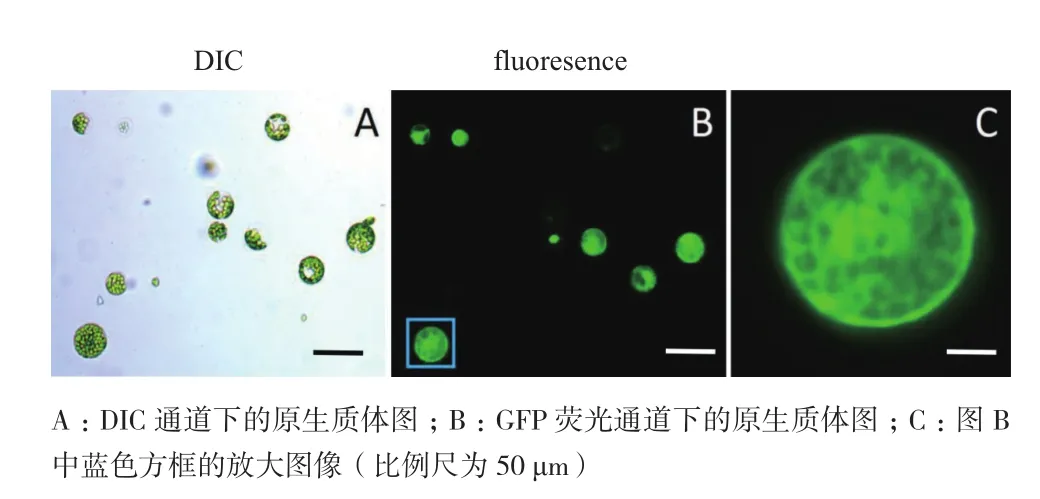
圖3 為轉化表達載體后的擬南芥原生質體
2.3 PRF1在煙草葉片中的定位
使用健康的至少有兩個大葉的煙草植株作為實驗材料,因為小葉子很難滲透并且明顯的降低了轉化效率。利用農桿菌GV3101,將pCAMBIA1300-GFP載體與PRF1基因的融合表達載體(pCAMBIA1300-GFP-PRF1)轉入到煙草葉片中,獲得了高效瞬時的表達,在475 nm藍光的激發下綠色熒光蛋白產生了509 nm的綠色熒光。本實驗結果表明,PRF1和GFP的融合蛋白在胞質中產生綠色熒光(圖4-A),并且也聚集在顆粒狀細胞器外周,在對照組中,GFP則可進入核孔復合物中擴散進入細胞核,從而我們在細胞核中觀察到了GFP的綠色熒光信號(圖4-B)。
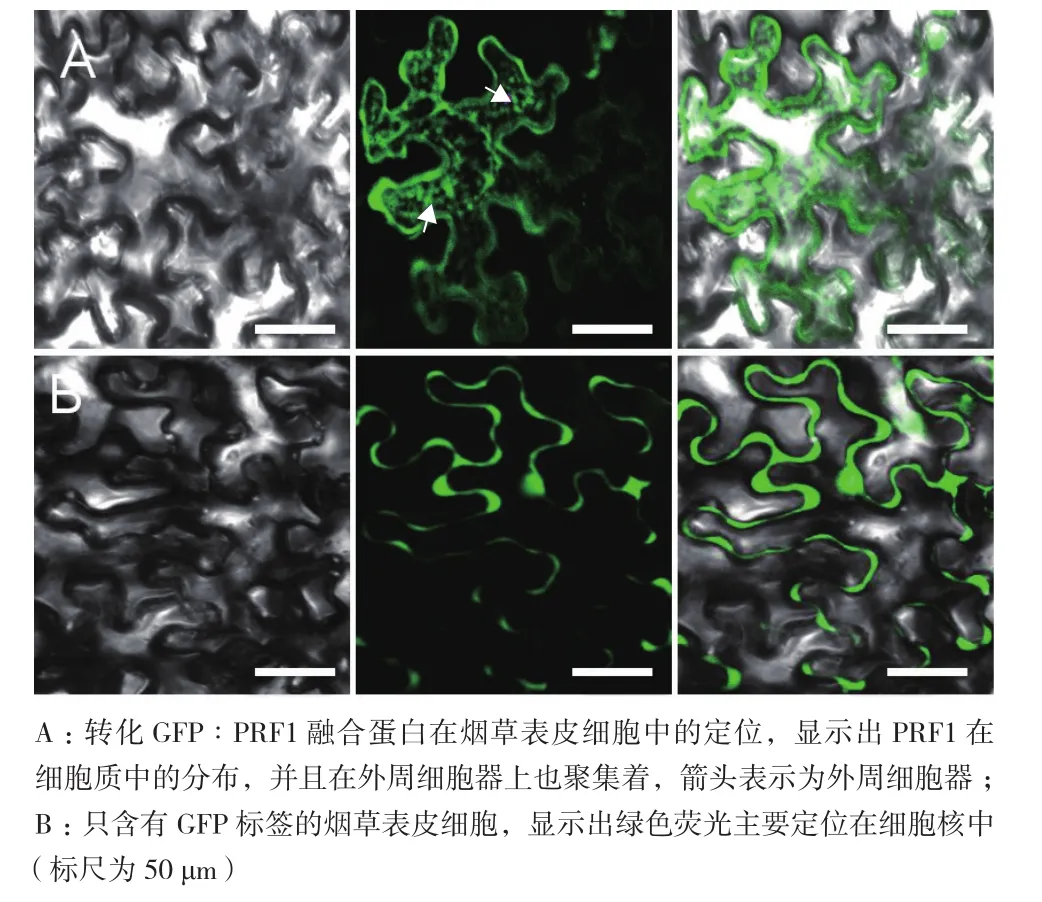
圖4 PRF1在煙草葉片中的亞細胞定位
3 討論
前纖維蛋白(Profilin)是一種幾乎存在于所有的真核細胞的一種蛋白,可以與細胞內其它大分子如磷脂酰肌醇二磷酸,富含脯氨酸的蛋白質等共同作用。經過多年的研究發現Profilin在生命活動過程有非常重要的作用,如參與了細胞內的信號轉導、真核細胞中亞細胞結構的運動等過程。除此之外,在擬南芥中發現了profilin基因在細胞伸長、細胞形態的維持、根毛的極性生長、開花時間等方面起著重要的作用[18]。同時,在本實驗室前期的研究中也發現,使用UV-B輻射小麥時,小麥根尖的體細胞中的染色體發生了異常的分裂[19],為了研究這種機制,我們使用Profilin抗體進行標記發現,在染色體異常分裂的同時還伴隨著Profilin的異常的分布,從而推測Profilin可能參與了染色體的分裂過程。而不同的Profilin的異構體在細胞中分別執行著各自不同的功能,其中PRF1在調控植物細胞的生長中扮演著重要的角色,所以Profilin-1在細胞內的分布以及動態值得研究。在本實驗中,運用擬南芥瞬時表達的實驗證實PRF1定位在擬南芥原生質體的細胞質和細胞核中,這與Wang[20]使用穩定表達體系獲得PRF1定位的結果相一致,說明這個瞬時表達系統適合于定位信號的研究。
近幾年來,瞬時表達已經陸續地被運用到生物學研究中,如利用該系統進行基因功能的鑒定分析、蛋白質互作、亞細胞定位等。在本實驗中,我們使用了PEG介導的原生質體的轉染和農桿菌介導的方法來研究PRF1的亞細胞定位,從結果中可以看出PRF1在煙草表皮細胞中主要定位在細胞質中,在擬南芥原生質體中主要定位在細胞質和細胞核中。對兩種體系所獲得的不同結果表明,應用不同體系研究蛋白質的亞細胞定位可能出現不同的結果,這可能是異源的細胞產生偏差的結果。從兩種體系操作過程中發現,煙草生長周期短,轉基因技術成熟,易操作,不需要酶解細胞壁等優點,因此農桿菌注射煙草葉片的瞬時轉化效率比較高,能夠獲得大片的陽性細胞,且能夠比較清楚的看到PRF1在葉表皮的定位。但是由于受到物種和農桿菌親和性的原因,農桿菌注射的方法更適用于細胞中生物分子相互作用的研究。而擬南芥原生質體瞬時表達體系周期短,易獲得活力強的原生質體細胞,通過PEG轉化原生質體的方法能夠清晰的看到瞬時表達目標蛋白的亞細胞定位。
4 結論
在本研究中,我們通過使用兩種不同的瞬時表達的方法,研究了PRF1的定位,結果表明將PRF1基因導入擬南芥的原生質體和煙草表皮細胞后,融合蛋白綠色熒光均能被觀察到,PRF1基因與GFP融合蛋白的產物在煙草表皮細胞中主要定位在細胞質和外周細胞器中,在擬南芥的原生質體中主要定位在細胞核和細胞質中。在本實驗中所使用的兩種瞬時表達體系,均得到了一定的結果,但是相對于煙草的瞬時表達體系,擬南芥原生質體瞬時表達能夠很好的研究蛋白質的亞細胞定位。
[1]Huang H, Wang Z, Cheng J, et al. An efficient cucumber(Cucumis sativus L.)protoplast isolation and transient expression system[J]. Scientia Horticulturae, 2013, 150(2):206-212.
[2]Chen SB, Tao LZ, Zeng LR, et al. A highly efficient transient protoplast system for analyzing defence gene expression and proteinprotein interactions in rice[J]. Mol Plant Pathol, 2006, 7(5):417-427.
[3]Taylor NJ, Fauquet CM. Microparticle bombardment as a tool in plant science and agricultural biotechnology[J]. Dna & Cell Biology, 2002, 21(12):963-977.
[4]Jaedicke K, R?sler J, Gans T, et al. Bellis perennis:a useful tool for protein localization studies[J]. Planta, 2011, 234(4):759-768.
[5]Ueki S, Lacroix B, Krichevsky A, et al. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment[J]. Nature Protocols, 2008, 4(1):71-77.
[6]Sheen J. Signal transduction in maize and Arabidopsis mesophyll protoplasts[J]. Plant Physiology, 2001, 127(4):1466-1475.
[7]Walter M, Chaban C, Schütze K, et al. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation[J]. Plant Journal, 2004, 40(3):428-438.
[8]Carlsson L, Nystr?m LE, Sundkvist I, et al. Actin polymerizability is influenced by profilin, a low molecular weight protein in non-muscle cells[J]. Journal of Molecular Biology, 1977, 115(3):465-483.
[9]Machesky LM, Poland TD. Profilin as a potential mediator of membrane-cytoskeleton communication[J]. Trends in Cell Biology, 1993, 3(11):381-385.
[10]Valenta R, Duchêne M, Pettenburger K, et al. Identification of profilin as a novel pollen allergen;IgE autoreactivity in sensitized individuals[J]. Science, 1991, 253(5019):557-560.
[11]Staiger CJ, Goodbody KC, Hussey PJ, et al. The profilin multi gene family of maize:differential expression of three isoforms[J]. The Plant Journal, 1993, 4(4):631-641.
[12]Huang S, Meagher RB. The Arabidopsis profilin gene family.Evidence for an ancient split between constitutive and pollenspecific profilin genes[J]. Plant Physiology, 1996, 111(1):115-126.
[13]Ramachandran S, Christensen HEM, Ishimaru Y, et al. Profilin plays a role in cell elongation, cell shape maintenance, and flowering in Arabidopsis[J]. Plant Physiology, 2000, 124(4):1637-1647.
[14]Chalfie M, Tu Y, Euskirchen G, et al. Green fluorescent protein as a marker for gene expression[J]. Science, 1994, 263(5148):151.
[15]Zhang S, Zhao B, Liu X, et al. Construction of a new GFP vector and its use for Fusaruim oxysporum, transformation[J]. Saudi Journal of Biological Sciences, 2013, 20(1):23-27.
[16]廖嘉明, 王伯初, 王益川, 等. 擬南芥葉肉原生質體分離條件的優化研究[J]. 西北植物學報, 2010, 30(6):1271-1276.
[17]Yoo SD, Cho YH, Sheen J. Arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis[J]. Nature Protocols, 2007, 2(7):1565-1572.
[18]Ramachandran S. Profilin plays a role in cell elongation, cell shape maintenance, and flowering in Arabidopsis[J]. Plant Physiologists, 2000, 124(2000):1637-1647.
[19]韓榕, 王勛陵, 岳明, 等. 增強UV-B輻射對小麥體細胞分裂的影響[J]. 遺傳學報, 2002, 29(6):537-541.
[20]王鳳. GFP:Actin結合蛋白融合基因的構建及其在擬南芥中的表達[D]. 北京:中國農業大學, 2002.
(責任編輯 馬鑫)
Subcellular Localization of Profilin-1 from Arabidopsis Utilizing Two Transient Expression Systems
ZHANG Xiao-hui HAN Rong
(Higher Education Key Laboratory of Plant Molecular and Environmental Stress Response,College of Life Science,Shanxi Normal University,Linfen 041000)
Here we study the subcellular localization of profilin-1(PRF1)using two transient expression methods and compare the advantages and disadvantages of two transient expression methods in the subcellular localization. Using the leaves of Arabidopsis thaliana as material,the total RNA from the leaves was extracted,and PRF1 gene was cloned using specific primers by RT-PCR and then ligated to pCAMBIA1300-GFP vectors,finally one plant expression vector pCAMBIA1300- GFP-PRF1 was constructed successfully. Two transient expression systems,agroinfiltration of tobacco leaves,and PEG transformation of protoplasts isolated from the leaves of Arabidopsis thaliana were adopted. The expression of the fusion proteins was observed by a confocal laser scanning microscopy. The results showed that the green fluorescence of the fusion protein was observed when the PRF1 gene was introduced into the protoplasts of A. thaliana and tobacco epidermal cells,the product of PRF1 gene and GFP fusion protein was mainly localized in the cytoplasm of tobacco epidermal cells,and there was also an expression in the nuclear cell organelle. PRF1 was localized in the nucleus and cytoplasm of Arabidopsis thaliana. The localization of PRF1 protein was different in two different transient expression systems,which may be related to the characteristics of the plants that are homologous or heterologous expression.
Arabidopsis thaliana;PRF1;transient expression;protoplasts;GFP
10.13560/j.cnki.biotech.bull.1985.2017.05.008
2016-11-30
國家自然科學基金項目(30671061),山西省自然科學基金項目(20041101,2008011059-1)
張曉慧,女,碩士研究生,研究方向:植物細胞學;E-mail:zhangxiaohuifig@163.com
韓榕,男,博士,教授,研究方向:環境植物學;E-mail:hhwrsl@163.com

