游離態氨基酸對羊角月牙藻的生物有效性
翟天恩,霍守亮,張靖天,席北斗,肖喆
中國環境科學研究院地下水與環境系統創新基地,北京 100012
?
游離態氨基酸對羊角月牙藻的生物有效性
翟天恩,霍守亮*,張靖天,席北斗,肖喆
中國環境科學研究院地下水與環境系統創新基地,北京 100012
采用實驗室模擬培養試驗,以6種個體氨基酸——絲氨酸、天冬氨酸、谷氨酸、甘氨酸、丙氨酸和精氨酸為唯一氮源,采用一次性培養的方法,在無菌條件下,研究羊角月牙藻對不同種類個體氨基酸和不同濃度混合氨基酸的利用潛能。結果表明:藻細胞在生長過程中會釋放氨基酸增加水體中氨基酸濃度,同時,藻類可迅速并直接利用多種游離態氨基酸快速生長。氨基酸濃度在培養周期的前2天減少90%以上,藻細胞數在第6~8天達到最大,說明藻細胞的生長滯后于游離氨基酸濃度的下降;在個體氨基酸試驗中,藻細胞對氨基酸的利用程度為精氨酸>丙氨酸>谷氨酸>天門冬氨酸>絲氨酸>甘氨酸;在混合氨基酸試驗中,藻細胞的比增殖速率明顯高于個體氨基酸試驗組,且隨混合氨基酸濃度的增加,最大藻細胞生物量增加;羊角月牙藻在利用個體氨基酸的同時也會釋放其他種類的氨基酸,其中,天冬氨酸和甘氨酸的釋放濃度最大。羊角月牙藻在無機氮缺乏情況下,能迅速利用氨基酸。
游離態氨基酸;溶解性有機氮;羊角月牙藻;生物有效性
氮是水生態系統中重要的營養元素之一,參與浮游生物的新陳代謝活動,對浮游生物生長具有重要的作用。研究表明,細菌和藻類可直接利用無機氮,并且細菌可將一些有機氮轉化為無機氮形式作為碳源和氮源供給生命體的新陳代謝活動[1]。近期研究發現,一些浮游植物也可以直接利用有機氮[1-3],并且在溶解性無機氮(DIN)濃度較低時,高濃度的溶解性有機氮(DON)會促進浮游植物的增殖[1,3]。氨基酸作為DON庫中活躍的組分,廣泛存在于自然水體、沉積物、大氣中,包括游離態氨基酸(DFAA)和結合態氨基酸(DCAA)。湖泊水體中28%~46%的DON為氨基酸類有機氮[4]。近海表層沉積物氨基酸組成中[5],含量較高的氨基酸有天冬氨酸、谷氨酸、丙氨酸和賴氨酸,其平均摩爾分數均在80%以上。大氣PM2.5樣品中也檢測到DFAA,主要以鳥氨酸、蘇氨酸、甘氨酸、絲氨酸、甲胺和丙氨酸為主,占DFAA總量的81.1%[6]。在北太平洋西部氣溶膠中發現的氨基酸主要以甘氨酸、絲氨酸、天冬氨酸和精氨酸為主,占DFAA總量的72%[7]。污水處理廠出水中也發現15%~35%的有機氮為氨基酸類物質[8],主要包括谷氨酸、絲氨酸、天冬氨酸和甘氨酸,以及少量的鳥氨酸、組氨酸、賴氨酸和半膀氨酸。
國內外學者對DON的生物有效性已開展多項研究:如Pehlivanoglu等[9]研究發現,在有菌條件下56%的DON可以被藻類所利用,同時發現接近30%的DON是小分子類含氮化合物(<1 kDa),但在無菌條件下,DON幾乎不能被藻類所利用;Urgun-Demirtas等[10]研究發現,在有菌和無菌條件下,有18%~61%的DON能被藻類所利用;Liu等[11-12]將DON分為親水、疏水組分,發現親水組分可刺激藻類生長;Su等[13]進一步研究了細菌對DON不同極性組分的利用特性,發現細菌能夠利用親水、疏水組分中的氨基酸,并且在后期可通過水解作用將溶解性蛋白質物質分解為縮氨酸和自由態氨基酸,導致氨基酸濃度緩慢增長。
DFAA是重要的小分子有機氮,具有很強的活性,不僅能作為細菌生長的碳源和氮源,而且在DIN濃度較低時,可被浮游植物通過直接吸收或胞外酶分解間接利用[14]。依據氨基酸分子中所含氨基和羧基數目的不同,可將DFAA分為酸性氨基酸(天冬氨酸、谷氨酸)、堿性氨基酸(組氨酸、精氨酸)和中性氨基酸。目前,對藻類吸收利用氨基酸已開展了研究。徐寧等[15]對比研究了不同條件下4種海洋微藻對DFAA(試驗濃度為100 μmolL)的利用特性,結果表明,海洋微藻對游離態氨基酸的利用存在顯著的種間差異,東海原甲藻和球形棕囊藻可在無菌條件下以氨基酸為唯一氮源快速生長,而米氏凱倫藻和中肋骨條藻必須依賴細菌才能利用氨基酸維持生長。Zhang等[2]研究蛋白核小球藻(Chlorellapyrenoidosa)對18種個體氨基酸在高濃度(0.05和0.5 gL)條件下的利用潛能發現,有10種氨基酸均能促進小球藻的生長,特別是天冬氨酸、精氨酸和甘氨酸更能促進藻細胞的生長。John等[16]研究發現,豐迪亞歷山大藻(Alexandriumfundyense)在低濃度(50 μmolL)條件下可以利用多種不同個體氨基酸并能在數小時內將氨基酸濃度降低50%左右。Dai等[17]研究發現,在無菌條件下,銅綠微囊藻(Microcystisaeruginosa)對100 μmolL濃度下不同種類氨基酸的利用程度存在明顯差異,精氨酸、丙氨酸和亮氨酸可被藻細胞迅速利用并促進細胞增殖,而谷氨酸、天冬氨酸和賴氨酸盡管可以通過細胞膜進入胞內,但不能促進藻細胞的生長。Yan等[18]運用15N同位素示蹤技術研究發現,銅綠微囊藻在精氨酸中的生長狀況優于氨氮。
羊角月牙藻(Selenastrumcapricornutum)作為自然水體中常見的藻類,因其細胞特征明顯,易于培養,且試驗結果重現性較好,已廣泛應用于DON的生物有效性研究上[9-12]。近年來以羊角月牙藻為測試藻種,從DON不同分子量分布以及親疏水極性開展大量研究,但多從菌藻共存條件下出發,且對于DON中的已知組分(如氨基酸、尿素等)的生物有效性報道較少。同時,關于藻類利用游離態氨基酸的研究側重于個體氨基酸作為氮源,所研究的氨基酸濃度大多大于50 μmolL,高于自然水體中的濃度,多為海洋微藻[15,19-20]或有毒藻種[17-18],不同藻種的生物利用特性存在一定差異,因而有必要展開羊角月牙藻對氨基酸的生物有效性研究。筆者擬選擇環境中存在的6種典型個體氨基酸作為氮源,包括酸性、堿性和中性氨基酸,以淡水藻種羊角月牙藻作為試驗藻種,研究在低濃度環境和無菌條件下,藻類對游離態氨基酸的利用特性,以期為藻類對DON的生物有效性研究提供理論依據。
1 材料與方法
1.1 試驗藻種及培養
試驗藻種為羊角月牙藻,由中國科學院水生生物研究所提供。試驗前,選用BG11培養基,在藻細胞處于對數生長期反復接種3~4次,使細胞達到同步增長。接種前,培養基通過 121 ℃高溫滅菌15 min后,移至超凈臺中操作。所有容器及試驗耗材均經過高溫滅菌后使用。藻細胞生長溫度為(25±1)℃,光照強度為2 000~3 000 lx,光照周期為12 h∶12 h,在恒溫光照培養箱中進行培養試驗。
無氮培養:將處于對數生長期的藻細胞離心,用超純水清洗2~3次,接種至無氮BG11培養基(即培養基中不添加NaNO3組分)中培養,每天按時測定藻細胞生物量,培養1周左右藻細胞生物量處于穩定狀態,認為此時藻細胞體內貯存的氮消耗殆盡。
1.2 試驗設計
1.2.1 個體氨基酸的生物有效性
選擇絲氨酸(Ser)、天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)和精氨酸(Arg)為研究對象,以無氮培養液做空白對照組,在實驗室條件下開展藻類培養試驗,評估個體氨基酸對羊角月牙藻的生物有效性,即培養過程中羊角月牙藻所能利用的個體氨基酸濃度占初始個體氨基酸濃度的比例。
1.2.2 混合氨基酸的生物有效性
以6種個體氨基酸的混合液作為藻類生長的氮源,以無氮培養液為參照組,評估不同濃度梯度混合氨基酸對藻類的生物有效性,即培養過程中羊角月牙藻所能利用的混合氨基酸濃度占初始混合氨基酸濃度的比例。
采用實驗室一次性培養的方法,試驗共設置12組,其中包括1組空白組,6組個體氨基酸試驗組和5組混合氨基酸試驗組,每組2個平行試驗,試驗周期為15 d,藻細胞初始接種密度為3.75×104cellsmL。試驗設計如表1所示。
將上述配置好的不同試驗組培養基置于121 ℃高溫滅菌鍋中滅菌30 min,冷卻至室溫后移至無菌超凈臺,接種無氮培養后的藻細胞并取水樣作為初始培養基濃度,后期取樣均在無菌操作臺中進行,光照培養箱在放入試驗組前用儀器自帶紫外燈滅菌。
1.3 藻細胞生物量測定
每天對藻細胞生物量進行測定,用顯微鏡(NIKON,日本尼康株式會社)觀察藻細胞培養是否出現細菌污染,并記錄藻細胞生物量。比生長速率(μ)的計算公式如下:
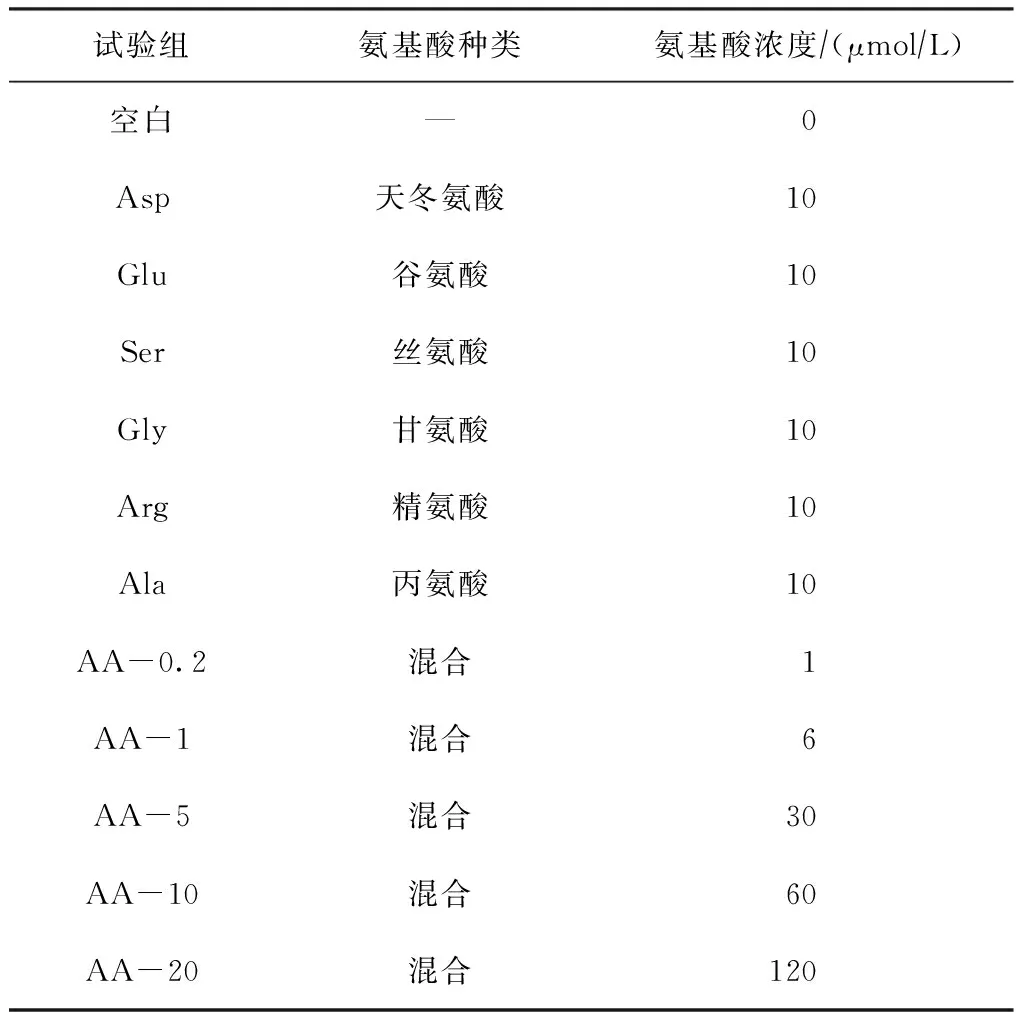
表1 各試驗組培養基中的氨基酸種類及濃度
注:混合為天冬氨酸、谷氨酸、絲氨酸、甘氨酸、精氨酸和丙氨酸6種個體氨基酸混合液。
μ=(lnN1-lnN0)(T1-T0)
式中N1和N0分別為第T1天和T0天時的細胞數。
1.4 氨基酸的測定
1.4.1 試驗儀器和試劑
試驗儀器采用Agilent-1200液相色譜儀,配有在線脫氣機、四元梯度泵、標準自動進樣器(20 μL)、熒光檢測器(fluorescence detector,FLD)及Agilent化學工作站。
氨基酸混合標準溶液包括天冬氨酸、絲氨酸、色氨酸(Trp)、谷氨酸、甘氨酸、組氨酸(His)、精氨酸、蘇氨酸(Thr)、丙氨酸、脯氨酸(Pro)、胱氨酸(Cys)、酪氨酸(Tyr)、纈氨酸(Val)、蛋氨酸(Met)、異亮氨酸(Ile)、亮氨酸(Leu)及苯丙氨酸(Phe);個體氨基酸試劑包括天冬氨酸、谷氨酸、絲氨酸、甘氨酸、精氨酸和丙氨酸,試驗中所使用的氨基酸以及衍生化試劑鄰苯二甲醛(OPA,HPLC)和3-巰基丙酸(3-MPA,HPLC)均為Sigma (St Louis, MO, USA)生產;甲醇、乙腈和四氫呋喃(THF)為HPLC級試劑;試驗用水是Mill-Q水(Millipore, USA);其他試劑均為優級純。
色譜柱為Agilent Eclipse XDB C18柱(5 μm,4.6 mm×250 mm)。
1.4.2 試劑配制
氨基酸混合標準溶液不同濃度梯度配制:準確吸取一定量的氨基酸混合標準溶液,用Mill-Q水配置成0.005、0.010、0.025、0.050、0.100、0.250、0.500、1.000、2.000、5.000和10.000 μmolL不同濃度梯度溶液,冷藏備用。
OPA衍生化試劑配制:將13.4 mg OPA溶解于25 mL甲醇中;取出5 mL加入20 μL 3-巰基丙酸;用pH為9.9±0.05的硼酸鈉緩沖溶液定容到25 mL,最終pH為9.3±0.05;該溶液避光陳化90 min以上,以降低試劑空白;保存在4 ℃冰箱中,最長使用9 d。
1.4.3 衍生化反應
將200 μL衍生化試劑添加到0.5 mL氨基酸混合標準溶液或試驗樣品中反應10 min后,以微量進樣器吸取20 μL進樣。
1.4.4 色譜條件的選擇與設定
根據Confer等[21]研究設置以下試驗條件:1)柱溫為35 ℃;2)流動相的pH為7.2,流動相中THF的濃度為1.5%;3)將反應時間控制在10~15 min;4)梯度洗脫條件如表2所示;5)熒光掃描樣品時間為31 min,并保持液相色譜后運行10 min使壓力恢復到正常水平(即只進流動相的壓力),檢測波長Ex為337 nm,Em為454 nm。

表2 流動相梯度洗脫
2 結果與討論
2.1 氨基酸標準曲線的建立
利用個體氨基酸標準溶液的保留時間定性,外標法定量,利用不同濃度混合標準溶液建立的各氨基酸標準曲線相關系數均在0.996以上,大部分在0.999以上。
用保留時間法對樣品中氨基酸定性,即在相同的色譜分析條件下,樣品中氨基酸的色譜峰與氨基酸標準的色譜峰保留時間相同或相近,則認為樣品中含有此氨基酸。采用峰面積法對水樣中游離態氨基酸的濃度進行定量分析。氨基酸標準的液相色譜如圖1所示。該分析方法進行一次氨基酸分析需要30 min,除了半胱氨酸在FLD下無信號,脯氨酸不能與OPA生成衍生物,Phe和Ile分離不太好外,其他氨基酸都得到較為滿意的分離。
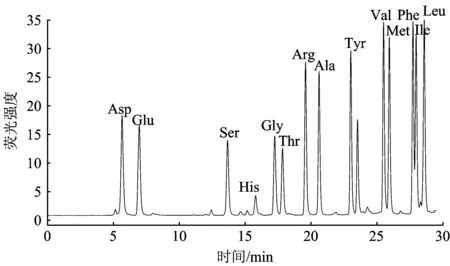
注:每個峰代表1.0 μmolL的氨基酸。圖1 氨基酸標準液相色譜Fig.1 Chromatogram of the amino acid standards
在上述最佳試驗條件下,所測得各氨基酸標準樣品的保留時間、回歸方程和相關系數見表3。從表3可以看出,在一定濃度范圍內,氨基酸組分峰面積與濃度呈良好的線性關系。
2.2 試驗結果
2.2.1 個體氨基酸對藻類的生物有效性
圖2為個體氨基酸試驗組培養過程中藻細胞生物量的變化和培養中游離態氨基酸濃度的變化。從圖2可以看出,以個體氨基酸為唯一氮源時,羊角月牙藻均呈現快速生長態勢。在培養的第2天,藻細胞增長速率達到最大,為3×104~8×104cells(mL·d);第2~8天,藻細胞處于穩定期,之后藻細胞生物量出現明顯的下降趨勢。從最大細胞生物量來看,藻細胞對氨基酸的生物可利用程度為精氨酸>丙氨酸>谷氨酸>天冬氨酸>絲氨酸>甘氨酸。以精氨酸為唯一氮源時,細胞生物量達到最大,為58×104cellsmL。精氨酸屬于堿性氨基酸,其分子組成中氨基數目大于羧基數目,1個精氨酸分子中含有4個氮原子,是15種氨基酸中含氮原子數量最多的氨基酸之一,相同濃度的個體氨基酸中,精氨
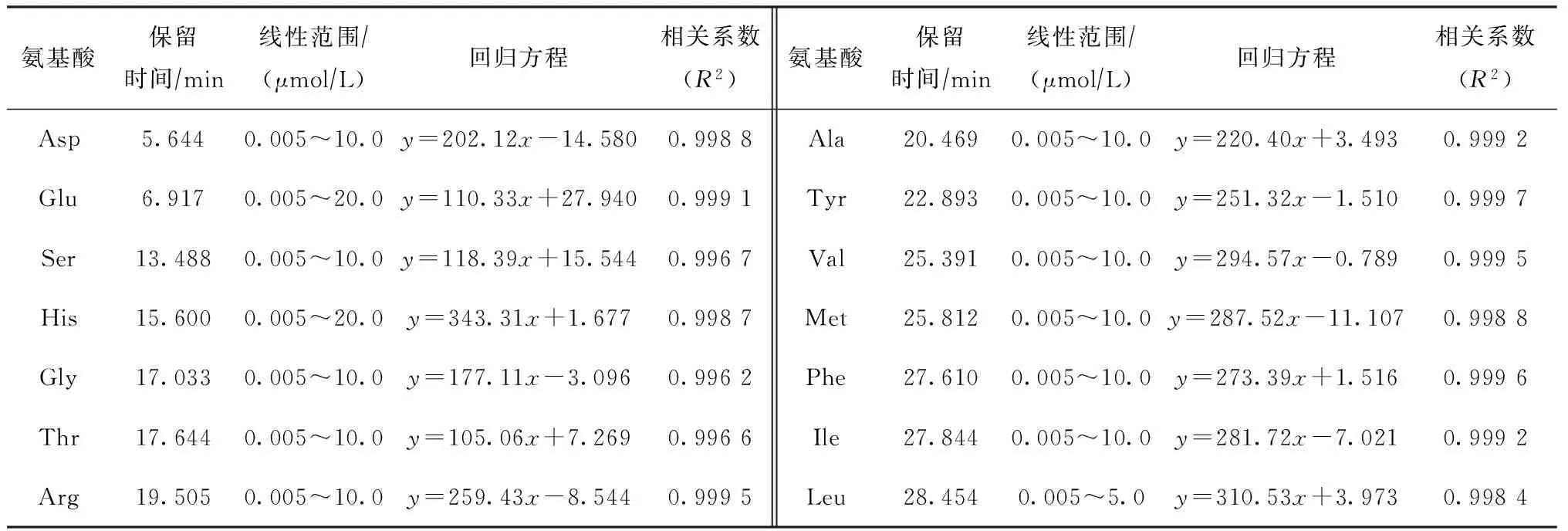
表3 各氨基酸標準樣品的保留時間、線性范圍、回歸方程和相關系數
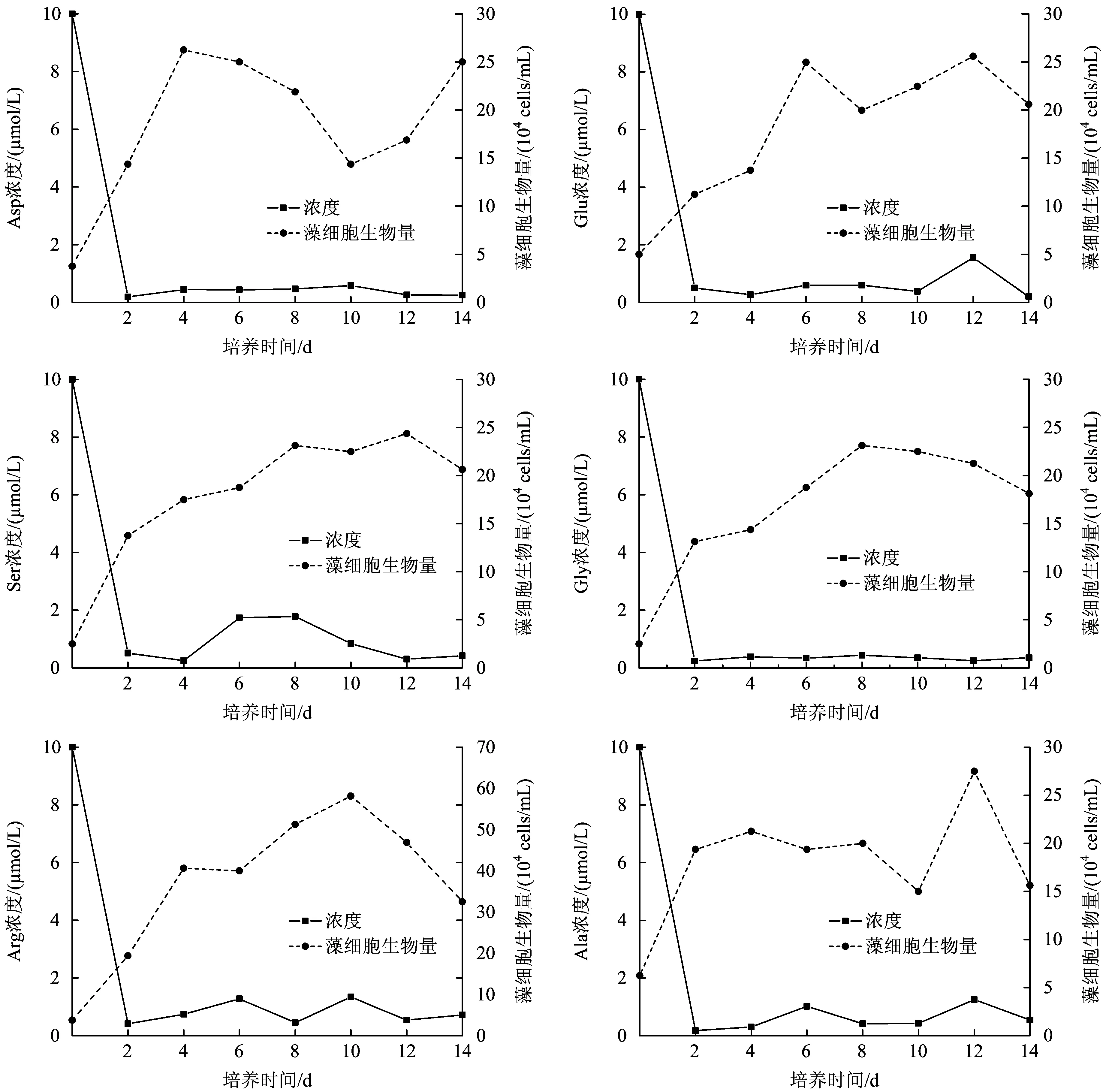
注:氨基酸濃度為培養液中總濃度。圖2 個體氨基酸對羊角月牙藻細胞生物量的影響Fig.2 Growth curve of Selenastrum capricornutum and concentration change of amino acid in different individual amino acids situation
酸的氮含量最大,藻細胞生物量增長最多。最大比生長速率可表示藻細胞瞬間最大的生長潛力。以絲氨酸、甘氨酸和精氨酸為唯一氮源時,藻細胞的最大比生長速率分別為0.85、0.82、0.82 d-1;以谷氨酸為唯一氮源時,藻細胞的最大比生長速率為0.41 d-1。谷氨酸屬酸性氨基酸,一般認為藻類對中性脂肪族氨基酸利用率較高,而對酸性氨基酸利用率較低,本試驗結果進一步印證了該觀點。
2.2.2 混合氨基酸對藻類的生物有效性
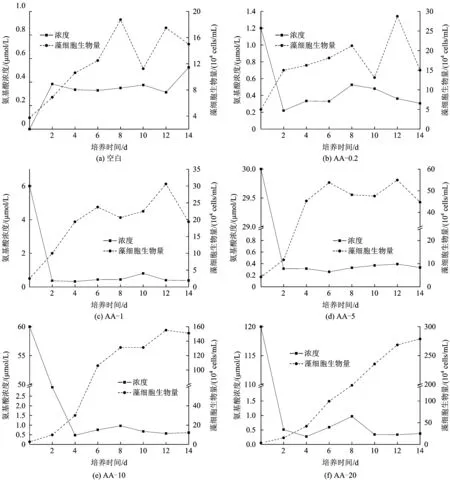
圖3 不同濃度混合氨基酸對羊角月牙藻細胞生物量的影響Fig.3 Growth curve of Selenastrum capricornutum and concentration change of total amino acids in different concentrations situation
圖3為不同濃度混合氨基酸對藻細胞生物量的影響。從圖3可以看出,藻細胞生物量隨培養基中氨基酸總濃度的增大而增加。藻細胞最大比生長速率基本出現在前2 d的培養過程中,AA-0.2、AA-1、AA-5、AA-10和AA-20試驗組藻細胞最大比生長速率分別為0.55、0.69、0.58、0.65和0.75 d-1。除AA-20試驗組外,其他4組試驗,藻細胞生物量在第12天均出現不同程度的下降,說明藻細胞進入衰亡期;在AA-20試驗組,試驗培養的第14天,藻細胞還處于增長過程,說明培養液中還有供給藻細胞增殖的氮源存在。AA-0.2、AA-1、AA-5、AA-10和AA-20試驗組的最大藻細胞生物量分別是接種初期的5.75、12.25、15.50、44.00和71.70倍;在個體氨基酸試驗中,除精氨酸試驗組外,天冬氨酸、谷氨酸、絲氨酸、甘氨酸和丙氨酸5個試驗組最大藻細胞生物量分別是接種初期的7.00、5.13、9.75、9.25、15.50和4.40倍:說明混合氨基酸更能促進藻細胞的生長。John等[16]研究了豐迪亞歷山大藻在無機氮和氨基酸不同氮源條件下的藻細胞生長情況,結果表明,氨基酸為氮源的環境下最大藻細胞生物量僅達到無機氮環境下的23;而Yan等[18]對銅綠微囊藻在氨氮和丙氨酸不同氮源條件下的研究發現,藻細胞在丙氨酸環境下增加的生物量約是氨氮環境下的3.5倍,其結果與Dai等[17]的基本一致。其差異性的原因首先是藻種類不同[15],其利用氮源的能力存在一定的差異;其次是藻對于不同氮源采用不同的攝入形式,并且對不同氮源的利用程度存在一定的差異[19-20,22]。
2.2.3 藻類生長過程中不同氨基酸變化
在藻類培養過程中,藻細胞會通過自身裂解或死亡產生碳水化合物、多肽、氨基酸等物質[12,17]。表4為羊角月牙藻在無氮培養基內生長過程中水體氨基酸的濃度變化。從表4可以看出,在無外源氨基酸引入的情況下,藻細胞在生長過程中也會釋放各種氨基酸。第2天,藻細胞釋放了較多的天冬氨酸和甘氨酸,而其他氨基酸的釋放量較少。在培養過程中,谷氨酸、組氨酸、蘇氨酸、亮氨酸和苯丙氨酸等氨基酸濃度較低,甚至檢測不出;天冬氨酸和甘氨酸濃度相對較高,是羊角月牙藻釋放的主要氨基酸組成組分。于茜等[23]研究了銅綠微囊藻在培養過程中氨基酸的釋放特性,結果表明,藻細胞釋放的氨基酸濃度整體呈增加趨勢,與本試驗結果相似。
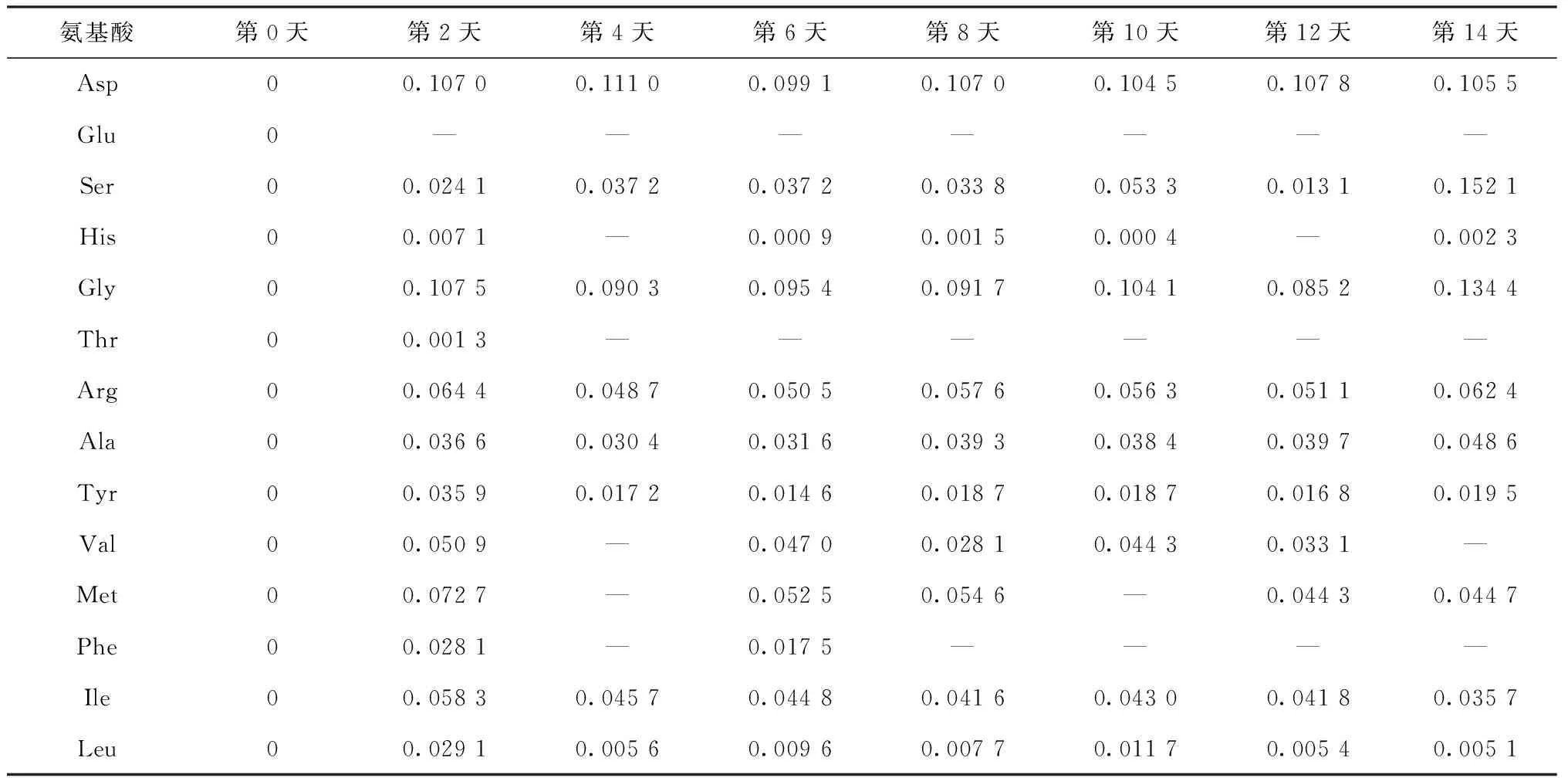
表4 羊角月牙藻無氮生長過程中水體氨基酸濃度變化
注:“—”表示氨基酸濃度低于儀器檢測限。
表5給出了不同試驗組羊角月牙藻生長過程中氨基酸的濃度變化。個體氨基酸試驗組中,第2天因子氨基酸的濃度均發生明顯下降,比初始(第0天)下降了99.0%~100%;從第2天開始,因子氨基酸的濃度基本保持不變。混合氨基酸試驗組中,第2天因子氨基酸濃度下降了82.5%~99.6%。John等研究[16-18]發現,藻細胞內可能存在儲存庫和代謝庫2個氨基酸庫,吸收的氨基酸首先進入儲存庫,在短時間內可能不會影響代謝庫的氨基酸量;隨著藻細胞對代謝庫中氨基酸的利用,儲存庫中氨基酸開始向代謝庫中轉移,這一過程對胞外因子氨基酸的濃度變化影響較小;之后藻細胞通過酶作用將攝取的氨基酸轉化為生長所需的能量以及合成新的蛋白質等[24],因而藻細胞增長出現明顯的滯后現象。Dai等[17]研究發現,銅綠微囊藻在12 h內可迅速降低培養基中天冬氨酸和谷氨酸的濃度,而對丙氨酸和亮氨酸的吸收速度較慢;培養24 h,天冬氨酸、精氨酸和谷氨酸基本耗盡;同時,不同試驗組均檢測到其他氨基酸的生成,且濃度變化不大。同樣的,本研究發現,不同培養周期內,不同試驗組中也檢測到除添加的因子氨基酸外的其他氨基酸,且氨基酸種類和濃度與空白試驗組基本相同。試驗最初添加的藻細胞取自同一瓶藻液,且接種的生物量基本相同,這說明藻細胞釋放的氨基酸種類和濃度與因子氨基酸濃度和藻細胞生物量關系不大,可能的原因是氨基酸的釋放主要來自培養初期,因而培養過程中氨基酸的釋放差別不大。

表5 藻類生長過程中水體因子氨基酸濃度變化
3 結論
(1)羊角月牙藻對多種個體氨基酸具有較強的利用能力,氨基酸的利用率達99.0%~100%,藻細胞對氨基酸的生物可利用程度為精氨酸>丙氨酸>谷氨酸>天門冬氨酸>絲氨酸>甘氨酸。
(2)羊角月牙藻在混合氨基酸中的生長狀況優于個體氨基酸,且在低濃度(<120 μmolL)條件下,隨著氨基酸濃度的增加,其細胞生物量也增加;藻細胞藻培養的前2天,氨基酸利用率達到82.5%~99.6%。
(3)在無菌條件下,藻細胞可直接利用氨基酸作為氮源供給自身生長;在生長過程中,羊角月牙藻會釋放其他種類的氨基酸,且主要以天冬氨酸和甘氨酸為主,藻細胞釋放氨基酸的種類和數量與添加的氨基酸種類以及生長過程中藻細胞生物量無關。
[1] BRADLEY P B,SANDERSON M P,FRISCHER M E,et al.Inorganic and organic nitrogen uptake by phytoplankton and heterotrophic bacteria in the stratified Mid-Atlantic Bight[J].Estuarine Coastal & Shelf Science,2010,88(4):429-441.
[2] ZHANG W,ZHANG Z,YAN S.Effects of various amino acids as organic nitrogen sources on the growth and biochemical composition ofChlorellapyrenoidosa[J].Bioresource Technology,2015,197:458-464.
[3] LINARES F.Effect of dissolved free amino acids (DFAA) on the biomass and production ofMicrophytobenthiccommunities[J].Journal of Experimental Marine Biology & Ecology,2006,330(2):469-481.
[4] YAO X,ZHU G,CAI L,et al.Geochemical characteristics of amino acids in sediments of Lake Taihu,a large,shallow,eutrophic freshwater lake of China[J].Aquatic Geochemistry,2012,18(3):263-280.
[5] 王麗玲,胡建芳,唐建輝.中國近海表層沉積物中氨基酸組成特征及生物地球化學意義[J].海洋學報,2009,31(6):161-169. WANG L L,HU J F,TANG J H.Amino acid composition and its biogeochemistry implications of surface sediments in coastal areas of China[J].Acta Oceanologica Sinica,2009,31(6):161-169.
[6] ZHANG Q,ANASTASIO C.Free and combined amino compounds in atmospheric fine particles (PM2.5) and fog waters from Northern California[J].Atmospheric Environment,2003,37(16):2247-2258.
[7] MATSUMOTO K,UEMATSU M.Free amino acids in marine aerosols over the Western North Pacific Ocean[J].Atmospheric Environment,2005,39(11):2163-2170.
[8] WESTRHOFF P,MASH H.Dissolved organic nitrogen in drinking water supplies:a review[J].Journal of Water Supply:Research and Technology,2002,51(8):415-448.
[9] PEHLIVANOGLU E,SEDLAK D L.Bioavailability of wastewater-derived organic nitrogen to the algaSelenastrumcapricornutum[J].Water Research,2004,38(14/15):3189-3196.
[10] URGUN-DEMIRTAS M,SATTAYATEWA C,PAGILLA K R.Bioavailability of dissolved organic nitrogen in treated effluents[J].Water Environment Research,2008,80(5):397-406.
[11] LIU H Z,JEONG J,GRAY H,et al.Algal uptake of hydrophobic and hydrophilic dissolved organic nitrogen in effluent from biological nutrient removal municipal wastewater treatment systems[J].Environmental Science and Technology,2012,46(2):713-721.
[12] QIN C,LIU H Z,LIU L,et al.Bioavailability and characterization of dissolved organic nitrogen and dissolved organic phosphorus in wastewater effluents[J].Science of the Total Environment,2015,511:47-53.
[13] SU M,ZHANG J,HUO S,et al.Microbial bioavailability of dissolved organic nitrogen (DON) in the sediments of Lake Shankou,Northeastern China[J].Journal of Environmental Sciences,2016,42:79-88.
[14] MULHOLL M R,GOBLER C J,CINDY L.Peptide hydrolysis,amino acid oxidation and nitrogen uptake in communities seasonally dominated byAureococcusanophagefferens[J].Limnology & Oceanography,2002,47(4):1094-1108.
[15] 徐寧,劉靜雅,賴海燕,等.海洋微藻對游離氨基酸的利用特性研究[J].環境科學學報,2013,33(4):1058-1065. XU N,LIU J Y,LAI H Y,et al.Uptake and utilization characteristics ofProrocentrumdonghaiense,Phaeoecystisglobosa,KareniamikimotoiandSkeletonemacostatumfor dissolved free amino acids[J].Acta Scientiae Circumstantiae,2013,33(4):1058-1065.
[16] JOHN E H,FLYNN K J.Amino acid uptake by the toxic dinoflagellateAlexandriumfundyense[J].Marine Biology,1999,133:11-19.
[17] DAI R,LIU H,QU J H,et al.Effects of amino acids on microcystin production of theMicrocystisaeruginosa[J].Journal of Hazardous Materials,2009,161(2/3):730-736.
[18] YAN Y W,DAI R H,LIU Y,et al.Comparative effects of inorganic and organic nitrogen on the growth and microcystin production ofMicrocystisaeruginosa[J].World Journal of Microbiology and Biotechnology,2015,31(5):763-772.
[19] LINDEHOFF E,GRANéLI E,GLIBERT P M.Nitrogen uptake kinetics ofPrymnesiumparvum(haptophyte)[J].Harmful Algae,2011,12:70-76.
[20] KILLBERG-THORESON L,MULHOLLAND M R,HEIL C A,et al.Nitrogen uptake kinetics in field populations and cultured strains ofKareniabrevis[J].Harmful Algae,2014,38:73-85.
[21] CONFER D R,LOGAN B E,AIKEN B S,et al.Measurement of dissolved free and combined amino acids in unconcentrated wastewaters using high performance liquid chromatography[J].Water Environment Research,1994,67(1):118-125.
[22] AHLUWALIA A S.Effect of amino acids and some chemicals on cellular differentiation inAnabaenaoscillarioides[J].Annals of Biology (India),1985,1:137-144.
[23] 于茜,朱元榮,王煥華,等.銅綠微囊藻培養過程中氨基酸的釋放特征及其對水體有機質的貢獻[J].環境科學研究,2016,29(3):360-367. YU X,ZHU Y R,WANG H H,et al.Release of amino acids fromMicrocystisaeruginosaand its contributions to organic matter[J].Research of Environmental Sciences,2016,29(3):360-367.
[24] BRONK D A,SEE J H,BRADLEY P, et al.DON as a source of bioavailable nitrogen for phytoplankton[J].Biogeosciences,2007,4(3):283-296.□
Bioavailability of dissolved free amino acids to algaSelenastrumcapricornutum
ZHAI Tianen, HUO Shouliang, ZHANG Jingtian, XI Beidou, XIAO Zhe
Innovation Base of Groundwater and Environmental System Engineering, Chinese Research Academy of Environmental Sciences,Beijing 100012, China
In order to understand the incubation process of algae on the low concentrations of dissolved free amino acids (DFAA), the growth ofSelenastrumcapricornutumwas studied in the laboratory. Six individual amino acids, i.e. serine, aspartic acid, glutamic acid, glycine, alanine and arginine, were used as the sole and mixed nitrogen sources for algal incubation under axenic conditions. The results showed that algae were able to utilize various amino acids for growth; meanwhile, algae could spread different amino acids in the incubation. DFAA concentration decreased with up to 90% in the 2 days, while the cells number of algae reached to the maximum in the 6-8 days, meaning that the growth of algae cell number lags behind the decrease of the of DFAA content. In the individual amino acids experiments, rank order of the use of amino acid was: arginine>alanine>glutamic acid>aspartic acid>serine>glycine. In the mixed amino acids experiments, the cell proliferation rate of algae was significantly higher than that of individual amino acid group; meanwhile with the increase of mixed amino acid concentration, the maximum number of algal cells was also increased.Selenastrumcapricornutumcan also release other kinds of amino acids in the use of the individual amino acid, among them, the main release amino acids are aspartic acid and glycine. Algae could use amino acid rapidly in the lack of inorganic nitrogen condition, which provided a theoretical basis to illustrate dissolved organic nitrogen promotes algae growth.
dissolved free amino acids (DFAA); dissolved organic nitrogen (DON);Selenastrumcapricornutum; bioavailability
2016-09-22
國家水體污染控制與治理科技重大專項(2012ZX07101-002)
翟天恩(1991—),男,碩士研究生,主要研究方向為溶解性有機氮的生物有效性,nyzhai@163.com
*通信作者:霍守亮(1981—),男,研究員,博士,主要從事湖泊營養物基準標準及氮磷遷移轉化研究,huoshouliang@126.com
503.23
1674-991X(2017)03-0348-09
10.3969/j.issn.1674-991X.2017.03.049
翟天恩,霍守亮,張靖天,等.游離態氨基酸對羊角月牙藻的生物有效性[J].環境工程技術學報,2017,7(3):348-356.
ZHAI T E, HUO S L, ZHANG J T, et al.Bioavailability of dissolved free amino acids to algaSelenastrumcapricornutum[J].Journal of Environmental Engineering Technology,2017,7(3):348-356.

