燈盞花素對Caco-2細胞中P-gp蛋白外排活性的影響
周 玄,曹昌娥,楊 嬌,陽美松,邵明園,高洋洋,賴 泳,2*
(1.大理大學藥學與化學學院,云南大理 671000;2.云南省昆蟲醫(yī)藥研發(fā)重點實驗室,云南大理 671000)
燈盞花素對Caco-2細胞中P-gp蛋白外排活性的影響
周 玄1,曹昌娥1,楊 嬌1,陽美松1,邵明園1,高洋洋1,賴 泳1,2*
(1.大理大學藥學與化學學院,云南大理 671000;2.云南省昆蟲醫(yī)藥研發(fā)重點實驗室,云南大理 671000)
目的:研究燈盞花素對Caco-2細胞中P-糖蛋白(P-gp)外排活性的影響。方法:采用MTT法檢測燈盞花素對Caco-2細胞存活率的影響,以確定其試驗劑量;通過BCA法測定燈盞花素對Caco-2細胞中總蛋白量的影響,羅丹明123(Rh123)轉(zhuǎn)運試驗評價燈盞花素作用后時間對P-gp外排活性的影響。結(jié)果:燈盞花素濃度<577.95μg/mL時,Caco-2細胞的存活率>90%;燈盞花素能增加Caco-2細胞中P-gp的外排活性,加入Rh123后,Rh123在Caco-2細胞內(nèi)的累積量先增加再減少;作用60 min后,燈盞花素(120、240μg/mL)對Caco-2細胞內(nèi)總蛋白量分別上調(diào)222.87%,154.23%。結(jié)論:燈盞花素能增加P-gp的外排活性,并上調(diào)Caco-2細胞中的總蛋白量。
燈盞花素;P-糖蛋白;Caco-2細胞;羅丹明123
燈盞花素是從燈盞花(菊科飛蓬屬植物短葶飛蓬)中提取的黃酮類活性成分〔1-2〕,主要為燈盞甲素和燈盞乙素(野黃芩苷),絕大多數(shù)為燈盞乙素。研究表明,燈盞花素具有擴張血管、增加腦血流量和動脈流量、降低血液黏度和外周阻力、抗血小板聚集等藥理作用〔3-4〕。P-糖蛋白(P-gp)是由人MDR1基因編碼的分子量為170 kDa的外排轉(zhuǎn)運蛋白,屬于能量依賴型ABC轉(zhuǎn)運超家族成員,其主要定位于成熟的腸上皮細胞的頂面、肝細胞小管膜、腎和腦血管內(nèi)皮細胞等組織〔5-6〕。P-gp介導許多外源性化合物的吸收轉(zhuǎn)運過程,其功能活性的改變對藥物體內(nèi)藥動學過程具有顯著影響〔7-8〕。體外研究表明,燈盞乙素在Caco-2細胞模型中的跨膜轉(zhuǎn)運由P-gp介導〔9-10〕,燈盞花素可能會抑制腦組織中P-gp的表達〔11〕;通過鈣黃綠素-AM熒光篩選試驗研究人轉(zhuǎn)移性惡性黑色素瘤細胞株WM-266-4中燈盞乙素對P-gp活性的影響,結(jié)果顯示:燈盞乙素對P-gp表現(xiàn)出弱的抑制作用〔12〕,但尚未明確燈盞花素對Caco-2細胞中P-gp活性的影響。因此,本研究旨在考察燈盞花素對Caco-2細胞中P-gp轉(zhuǎn)運活性的影響,為今后的研究提供依據(jù)。
1 材料與方法
1.1試劑與儀器Caco-2細胞(中科院昆明動物研究所細胞庫)。DMEM培養(yǎng)基、胎牛血清(FBS,Gibco公司);雙抗、0.25%胰蛋白酶(美國Millipore公司);MTT(噻唑藍)、PBS(磷酸緩沖鹽溶液)、羅丹明123(Rh123)均購自Solarbio公司;利福平(索萊寶公司);DMSO(二甲基亞砜,美國Sigma公司);燈盞花素(Breviscapin,含94.6%的燈盞乙素,云南植物藥業(yè)有限公司,批號:HB201201);RIPA裂解液(Beyetime,批號:P0013B,主要成分為50 mmol/L Tris(pH 7.4),150 mmol/L NaCl,1%Triton X-100,1% sodium deoxycholate,0.1%SDS以及sodium orthovan?adate,sodium fluoride,EDTA,leupeptin等);CO2培養(yǎng)箱(Thermo Scientific);Purifier Logic+二級生物安全柜(LABCONCO);Synergy HT多功能酶標儀(美國Bio Tek);熒光分光光度計(960MC,上海精科)。
1.2方法
1.2.1 細胞培養(yǎng) 將Caco-2細胞接種于75 cm2的培養(yǎng)瓶中,加入10~15 mL DMEM培養(yǎng)基(含1%雙抗和10%FBS),37℃,5%CO2培養(yǎng)箱中培養(yǎng),隔天換液,待細胞處于對數(shù)期生長(細胞融合率80%~ 90%)時,0.25%胰酶消化傳代。
1.2.2 細胞毒性實驗(MTT法) 取對數(shù)生長期細胞,以1×105個/mL的密度接種于96孔板,每孔終體積100μL,分為陰性對照組、空白對照組及實驗組,空白對照組不接種細胞。37℃,5%CO2培養(yǎng)箱中培養(yǎng)24 h后,去除每孔培養(yǎng)液,用PBS洗滌2遍。實驗組加入不同濃度的燈盞花素(溶于DMEM中)200μL,陰性對照組和空白對照組加入200μL空白培養(yǎng)基。37℃,5%CO2培養(yǎng)箱中分別培養(yǎng)24、48、72 h后,PBS清洗2遍,每孔加20μL的MTT(5 mg/mL)繼續(xù)孵育4 h,終止培養(yǎng),每孔加150μL DMSO,振蕩10 min使結(jié)晶物充分溶解。空白對照組調(diào)零后,用酶標儀測490 nm處的吸光度值(A),按下式計算細胞存活率(cellsurvivalrate),存活率大于90%可認為該濃度的燈盞花素對細胞生長無顯著影響。

1.2.3 燈盞花素作用后時間對Rh123攝取的影響
Caco-2細胞用0.25%胰酶消化制成單細胞懸液,離心(1 000 r/min,5 min)棄上清后,PBS分散成細胞數(shù)為1×106個/mL的單細胞懸液,取0.5 mL接種入1.5 mL滅菌的EP管中。空白對照組、陽性對照組和實驗組先分別加入500μL的PBS、利福平溶液(溶于DMEM中,10μmol/L)和燈盞花素溶液(120μg/mL、240μg/mL),37℃,5%CO2培養(yǎng)箱中培養(yǎng)60 min后,置冰上終止反應,4℃離心(2 500 r/min,15 min)棄上清,冰冷的PBS洗2次(每次1 mL),4℃離心(2 500 r/min,15 min)棄上清,再分別加入120μmol/L的Rh123(溶于DMEM中)溶液10μL,37℃、5%CO2培養(yǎng)箱中培養(yǎng)(20、40、60、80、100 min),每到1個時間點,隨機取出1批細胞,置冰上終止作用,4℃離心(2 500 r/min,15 min)棄上清,冰冷的PBS洗2次(每次1 mL),4℃離心(2 500 r/min,15 min)棄上清。加入50μL細胞裂解液,充分混勻,置冰上30 min,4℃離心(12 000 r/min,15 min)。取20μL上清,加入1 980μL PBS混勻后,用熒光分光光度計測定吸收值(激發(fā)波長:466 nm,發(fā)射波長:535 nm)。
1.2.4 燈盞花素對Caco-2細胞中總蛋白量的影響
取利福平和燈盞花素處理60 min后的Caco-2細胞,加入50μL細胞裂解液,充分混勻,置冰上30 min, 4℃離心(12 000 r/min,5 min),取上清液用BCA法測定蛋白量。
1.2.5 統(tǒng)計學處理 實驗結(jié)果采用SPSS 22.0軟件進行統(tǒng)計學分析,組間比較用one-way ANOVA檢驗,各組數(shù)據(jù)以(xˉ±s)表示。
2 結(jié)果
2.1燈盞花素對Caco-2細胞的毒性2 311.80,577.95,144.49,36.12,36.12,9.03和2.28μg/mL的燈盞花素分別與Caco-2細胞共孵育作用24、48及72 h后,除2 311.80μg/mL以外,其他濃度下細胞存活率均大于90%。表明濃度低于577.95μg/mL時,燈盞花素對Caco-2細胞無明顯毒性作用,故選用120、240 μg/mL的燈盞花素進行下一步研究。見表1。
表1 燈盞花素不同濃度下Caco-2細胞的存活率
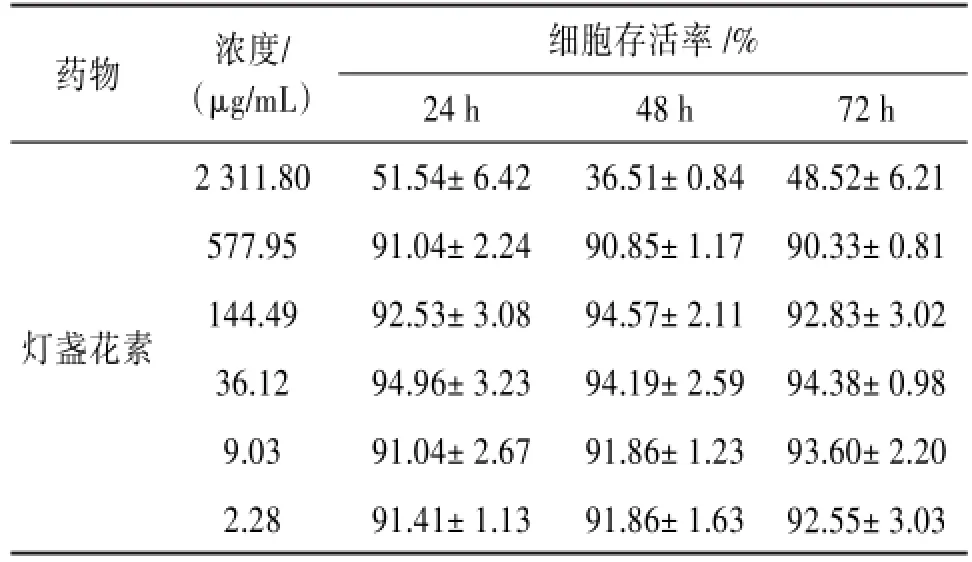
表1 燈盞花素不同濃度下Caco-2細胞的存活率
藥物燈盞花素濃度/(μg/mL)2 311.80 577.95 144.49 36.12 9.03 2.28細胞存活率/% 24 h 51.54±6.42 91.04±2.24 92.53±3.08 94.96±3.23 91.04±2.67 91.41±1.13 48 h 36.51±0.84 90.85±1.17 94.57±2.11 94.19±2.59 91.86±1.23 91.86±1.63 72 h 48.52±6.21 90.33±0.81 92.83±3.02 94.38±0.98 93.60±2.20 92.55±3.03
2.2燈盞花素作用后時間對Caco-2細胞胞內(nèi)Rh123累積量的影響利福平、燈盞花素(120、240μg/mL)與Caco-2細胞共孵育60 mim后加入Rh123,與空白對照組相比,20 min時Rh123在胞內(nèi)累積量分別減少16.64%,38.38%,22.12%(P<0.01);40 min時Rh123在胞內(nèi)累積量分別減少58.81%,52.19%,38.51%(P<0.01);60 min時Rh123在胞內(nèi)累積量分別減少78.81%,75.19%,70.69%(P<0.01);80 min時Rh123在胞內(nèi)累積量分別減少60.17%,61.74%,52.45%(P<0.01);100 min時Rh123在胞內(nèi)累積量分別減少20.56%,14.34%,34.94%(P<0.01);120 min時Rh123在胞內(nèi)累積量分別減少9.64%(P<0.01),1.16%,21.32%(P<0.01)。以上結(jié)果表明,燈盞花素能增加Caco-2細胞中P-gp的外排活性;加入Rh123后,其在Caco-2細胞內(nèi)的累積量先減少再增加,其中,高濃度(240μg/mL)對Caco-2細胞中P-gp的作用較強。見圖1。
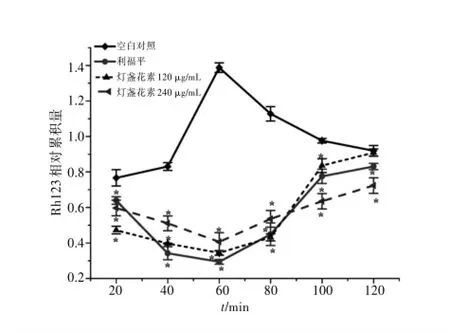
圖1 燈盞花素作用后時間對Caco-2細胞內(nèi)Rh123累積量的影響(
2.3燈盞花素對Caco-2細胞中總蛋白量的影響
利福平(10μmol/L)、燈盞花素(120、240μg/mL)作用于Caco-2細胞60 min后,與空白對照組相比,細胞內(nèi)總蛋白量分別上調(diào)123.60%,222.87%,154.23%(P<0.01)。由此可見,燈盞花素對Caco-2細胞中蛋白的表達具有誘導作用。見圖2。
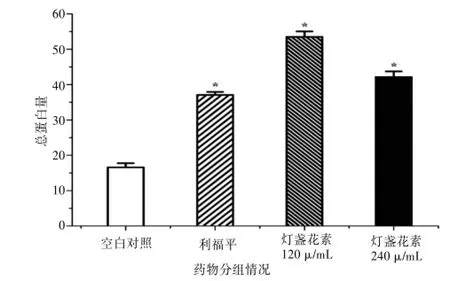
圖2 燈盞花素對Caco-2細胞中總蛋白量的影響
3 討論
燈盞花素臨床上常作為輔助藥物與其他西藥聯(lián)合用于心、腦血管疾病的治療,如冠心病、心絞痛、缺血性血管疾病損傷、腦栓塞等〔4〕。據(jù)文獻報道,燈盞乙素能抑制人肝微粒體CYP450酶(CYP1A2、CYP2C9、CYP2C19、CYP3A4等)及大鼠肝微粒體CYP450酶(CYP2C7、CYP2C11、CYP2D4、CYP3A1等)活性〔9,12〕。燈盞花素可能會抑制腦組織中P-gp的表達〔11〕,而燈盞花素對Caco-2細胞中P-gp活性的影響尚未明確。故本研究對燈盞花素對Caco-2細胞中P-gp活性的影響進行研究。
本實驗采用120、240μg/mL的燈盞花素分別與Caco-2細胞共孵育,通過測定Caco-2細胞內(nèi)P-gp底物Rh123的熒光強度來表示其累積量,以反映P-gp轉(zhuǎn)運活性的改變。結(jié)果顯示,共孵育60 min后,Caco-2細胞中P-gp的外排轉(zhuǎn)運活性增強;加入Rh123后,P-gp的轉(zhuǎn)運活性隨時間發(fā)生改變;其中,高濃度(240μg/mL)對Caco-2細胞中P-gp的作用較強。P-gp抑制劑可通過改變P-gp構(gòu)象逆轉(zhuǎn)多藥耐藥,也可通過與其底物競爭P-gp結(jié)合位點阻斷藥物的外排〔13〕,從而短時間內(nèi)即可產(chǎn)生作用。燈盞乙素在Caco-2細胞模型中的跨膜轉(zhuǎn)運由P-gp介導〔9-10〕。燈盞花素與Caco-2細胞共孵育60 min后,燈盞花素對Caco-2細胞的作用達到平衡,Caco-2細胞中P-gp的外排活性增加,Rh123在Caco-2細胞內(nèi)的累積量減少,60 min時達到最低。當加入P-gp底物Rh123后,Rh123將與燈盞花素競爭P-gp的結(jié)合位點,從而破壞已有平衡,使得Caco-2細胞中P-gp的外排活性逐漸降低,導致Rh123在Caco-2細胞內(nèi)的累積量又逐漸增加。燈盞花素高濃度(240μg/mL)時的變化趨勢相較于低濃度(120μg/mL)要緩,可能是燈盞花素高濃度時更能保持已有平衡。燈盞花素(120、240μg/mL)作用于Caco-2細胞60 min后,細胞內(nèi)總蛋白量分別上調(diào)222.87%,154.23%,結(jié)合燈盞花素能使Caco-2細胞內(nèi)Rh123的累積量減少,推測P-gp的量可能增加。但燈盞花素對P-gp蛋白表達量的影響還需進一步研究。
由于P-gp底物比較寬泛(如蒽環(huán)類和多肽類抗生素、生物堿、類固醇類激素、局麻藥等),且底物間化學結(jié)構(gòu)及性質(zhì)差異很大〔14〕,因此,單一底物所得的結(jié)果可能并不準確,仍需進一步驗證其他類型的P-gp底物作為探針時,燈盞花素對P-gp活性的影響;同時燈盞花素與其他藥物可能的藥物相互作用也值得深入研究。綜上,燈盞花素短時間內(nèi)(60 min)就能增強Caco-2細胞中P-gp的外排活性并上調(diào)胞內(nèi)總蛋白量。結(jié)果提示,燈盞花素與P-gp底物共同使用時可能產(chǎn)生潛在相互作用,這將為臨床合理用藥提供實驗性參考依據(jù)。
[參考文獻]
〔1〕JIANG N H,ZHANG G H,ZHANG J J,et al.Analysis of the transcriptome of Erigeron breviscapus uncovers puta?tive scutellarin and chlorogenic acids biosynthetic genes and genetic markers〔J〕.PLoS ONE,2014,9(6):100357.
〔2〕孫文基,繩金房.天然活性成分簡明手冊〔M〕.北京:中國醫(yī)藥科技出版社,1998.
〔3〕XU Q Y,LI X X.Influences of deng zhan xi xin injection on blood viscosity in patients with high blood viscosity〔J〕. Chin New Drugs Clin Rew,1995,14(4):233-235.
〔4〕ZHANG H F,HU X M,WANG L X,et al.Protective effects of scutellarin against cerebralischemia in rats:evidence for inhibition of the apoptosis-inducing factor pathway〔J〕. Planta Med,2009,75(2):121-126.
〔5〕ZHANG L,REYNOLDS K S,ZHAO P,et al.Drug interac?tions evaluation:an integrated part of risk assessment of therapeutics〔J〕.Toxicol Appl Pharmacol,2010,243(2):134-145.
〔6〕JONES P M,GEORGE A M.Opening of the ADP-bound active site in the ABC transporter ATPase dimer:evidence for a constant contact,alternating sites model for the cata?lytic cycle〔J〕.Proteins,2009,75(2):387-396.
〔7〕KUMAR Y S,ADUKONDALU D,SATHISH D,et al.PGlycoprotein and cytochrome P-450-mediated herbal drug interactions〔J〕.Drug Metabol Drug Interact,2010,25(1):3-16.
〔8〕MARCHETTI S,MAZZANTI R,BEIJNEN J H,et al.Con?cise review:Clinical relevance of drug drug and herb drug interactions mediated by the ABC transporter ABCB1(MDR1,P-glycoprotein)〔J〕.Oncologist,2007,12(8):927-941.
〔9〕CHEN X,JIN J,CHEN Y,et al.Effect of scutellarin on the metabolism and pharmacokinetics of clopidogrelin rats〔J〕. Biopharm Drug Dispos,2015,36(1):64-68.
〔10〕YOU H S,ZHANG H F,DONG Y L,et al.Absorption and transportation characteristics of scutellarin and scutella?rein across Caco-2 monolayer model〔J〕.Journal of Chi?nese integrative medicine,2010,8(9):863-869.
〔11〕金桂蘭,覃慧林,石孟瓊,等.燈盞花素對小鼠局灶性腦缺血損傷的保護作用及與腦組織P-糖蛋白表達研究〔J〕.中藥藥理與臨床,2015,31(1):76-79.
〔12〕HAN Y L,LI D,YANG Q J,et al.In vitro inhibitory ef?fects of scutellarin on six human/rat cytochrome P450 en?zymes and P-glycoprotein〔J〕.Molecules,2014,19(5):5748-5760.
〔13〕VARMA M V,ASHOKRAJ Y,DEY C S,et al.P-glyco?protein inhibitors and their screening:a perspective from bioavailability enhancement〔J〕.Pharmacol Res,2003,48(4):347-359.
〔14〕朱寶英,黃靜,王永林,等.P-糖蛋白及腫瘤多藥耐藥的逆轉(zhuǎn)〔J〕.中國藥房,2011,22(6):550-552.
Effectof Breviscapin on the Efflux Activity of P-gp in Caco-2 Cells
Zhou Xuan1,Cao Chang'e1,Yang Jiao1,Yang Meisong1,Shao Mingyuan1,Gao Yangyang1,Lai Yong1,2*
(1.College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China;2.Key Laboratory of Pharmaceutical R&D of Insects in Yunnan Province,Dali,Yunnan 671000,China)
Objective:To investigate the effect of breviscapin on the efflux activity of P-gp in Caco-2 cells.Methods:Cellsurvival rate of Caco-2 cells with differentbreviscapin concentrations were measured by MTT assay.The BCA assay was used to determine the total protein level of Caco-2 cells and the efflux activity of P-gp was determined by Rhodamine-123 assay after the incubation with breviscapin.Results:The cell survival rate of Caco-2 cells was higher than 90%when the concentration ofbreviscapin was less than 577.95μg/mL.The efflux activity of P-gp was increased by breviscapin(120μg/mL,240μg/mL)in Caco-2 cells.The intracellular accumulation of rhodamine-123 was increased and then decreased after the addition of rhodamine-123.After the incubation for 60 min with breviscapin(120μg/mL,240μg/mL),total protein level in Caco-2 cells was up-regulated 222.87%,154.23%respectively.Conclusion:Breviscapin can up-regulate totalprotein leveland increase the efflux activity of P-gp in Caco-2 cells.
Breviscapin;P-gp;Caco-2 cell;Rhodamine-123
R285
A
2096-2266(2017)04-0020-04
10.3969/j.issn.2096-2266.2017.04.006
(責任編輯 李 楊)
國家自然科學基金資助項目(81241139;81360511);云南省教育廳科學研究基金資助項目(2013J118)
2016-08-19
2016-11-08
周玄,碩士研究生,主要從事體內(nèi)藥物分析研究.
*通信作者:賴泳,教授.

