RBER生物降解溴酸鹽及微生物群落結構分析
鐘 宇,楊 麒,李小明,劉 湛,向仁軍,文 濤,成應向,尤翔宇,羅達通(.湖南省環境保護科學研究院,湖南 長沙 40004;2.水污染控制技術湖南省重點實驗室,湖南 長沙 40004;.湖南大學環境科學與工程學院,湖南 長沙 40082)
RBER生物降解溴酸鹽及微生物群落結構分析
鐘 宇1,2,楊 麒3*,李小明3,劉 湛1,2,向仁軍1,2,文 濤1,2,成應向1,2,尤翔宇1,羅達通1(1.湖南省環境保護科學研究院,湖南 長沙 410004;2.水污染控制技術湖南省重點實驗室,湖南 長沙 410004;3.湖南大學環境科學與工程學院,湖南 長沙 410082)
溴酸鹽(BrO3-)是由于含溴離子(Br-)的水體經過臭氧或加氯消毒后產生的消毒副產物,在毒理致癌性分級上被國際癌癥研究機構定為II類致癌物.實驗設計了一種旋轉電極生物膜反應器系統(RBER),可將濃度范圍為150~800 μg/L的溴酸鹽降解,且溴酸鹽被完全還原為溴離子,沒有其他中間產物生成.在反應器運行過程中發現,硝酸鹽與溴酸鹽對氫電子供體存在明顯的競爭關系,且硝酸鹽對氫電子供體競爭能力強于溴酸鹽.選取反應器運行不同階段的生物膜樣品進行 DNA提取和高通量測序分析微生物群落多樣性.結果表明,優勢菌屬主要有Bacillus(枯草桿菌屬)、Pseudomonas(假單胞菌屬)和 Lactococcus(乳球菌屬) 3類,其在總菌屬中相對豐度占比分別為37.0%、16.2%和11.1%,可能是實現溴酸鹽生物降解的主要優勢菌群.
溴酸鹽;硝酸鹽;高通量測序;微生物群落
水體中溴酸鹽的來源主要是含溴離子水體經過臭氧或加氯消毒工藝處理后形成的消毒副產物[1].此外,部分食品添加劑,如烘焙面包、魚肉火腿、香腸等用到的添加劑溴酸鉀,會隨著在生產及使用過程中進入到地表水中.在水體中,溴酸鹽的性質非常穩定,一經形成很難自然降解.在毒理致癌性分級上,溴酸鹽被國際癌癥研究機構定為2B級(較高致癌可能性)的潛在致癌物.成年人一次服用14g溴酸鈉時,在30min內會出現嘔吐、腹部疼痛、腹瀉和尿閉,在12h內會產生耳聾癥狀[2].2004年世界衛生組織(WHO)以及我國的《生活飲用水衛生標準》規定飲用水中溴酸鹽的最大濃度限值為10μg/L[1].
鑒于溴酸鹽的非揮發性、高溶解性和強氧化性特點,使它成為微生物新陳代謝的理想電子受體,利用微生物降解溴酸鹽被認為是修復溴酸鹽污染水體或場地最具前景的技術.研究發現[3],在乙醇做有機碳源和電子供體的厭氧條件下,部分反硝化細菌Pseudomonas spp在降解硝酸鹽同時,還能將溴酸鹽降解為溴離子;在反硝化細菌作用下,利用丙酮酸做電子供體的生物活性炭實現了對溴酸鹽的生物降解[4].此外,利用新型的中空纖維膜生物反應器外源供氫作為無機電子供體生物降解溴酸鹽也取得了較好的效果[5].但外源供氫過程中氫氣在水體中的溶解度很小,且氫氣易燃易爆炸,在一定程度上給實際應用帶來困難.作為改進,利用生物電化學反應器的陰極電解水原位產氫,為微生物提供電子供體降解溴酸鹽的技術成為解決該問題的關鍵.本文設計一種旋轉電極生物膜反應器系統(RBER),利用電解水產生的氫氣(H2)作為陰極微生物的電子供體,在厭氧條件下研究反應器對溴酸鹽的降解作用,并探討不同硝酸鹽濃度對溴酸鹽降解的影響;其次,利用高通量測序技術測定RBER中生物膜樣品的DNA分子序列,研究微生物群落變化與溴酸鹽降解的相關性,為富集溴酸鹽降解菌群提供借鑒和指導.
1 材料與方法
1.1 實驗材料
實驗用水以自來水添加一定量的NaNO3和NaBrO3(分析純)模擬進水,并在進水中投加適量的礦質元素[6]:1.55g/L K2HPO4,0.85g/L KH2PO4, 0.10g/LMgSO4·7H2O,0.25g/LNaHCO3和其他微量元素[7],微量元素組成見表1.
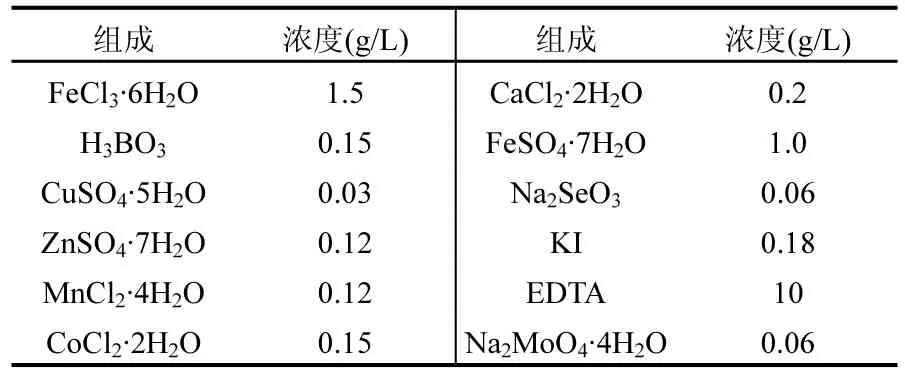
表1 微量元素組成Table 1 The composition of trace metals solution
1.2 實驗裝置及運行
本實驗采用自主設計的新型旋轉電極生物膜反應器(RBER),系統簡圖如圖1所示.整個系統主要由圓柱形聚乙烯玻璃反應器(內徑 12cm,高14cm)、直流電源、石墨陽極(直徑 0.5cm,長15cm)、活性炭氈陰極(長8cm,寬8cm,厚3cm)、增力攪拌器、蠕動泵、進出水水箱組成.在實驗中,把活性炭纖維陰極設計成自動旋轉型,通過緩慢旋轉的陰極來加快微生物在陰極上的掛膜速率;且反應器不需要外加攪拌裝置,在保持裝置良好氣密性的條件下,簡化了操作流程.陰極旋轉速度為(14±1)r/min(這個數值通過多次試驗測定,轉速太慢不利于溶液攪拌,轉速太快生物膜容易脫落);通過一個活動電刷給陰極供電.反應器主體體積 1.21L,并帶有橡膠墊圈的蓋板,保證反應器的氣密性.實驗施加的電流采用鴻寶電氣股份有限公司生產的直流穩壓電源(PS-303D);溶液初始 pH通過 0.1mol/L的 H2SO4和 0.1mol/L的NaOH調節.
長沙市第二污水處理廠的剩余活性污泥作為接種微生物來源,靜置30min后去掉上清液(過篩2遍,100目粗篩和200目細篩),作為接種污泥.將0.5L污泥接種于反應器內,定期向反應器內加入含 25mg/L硝酸鹽的培養液,維持反應器水溫為30℃,培養前5d電極不接通電源,讓微生物消耗掉污泥中存在的碳源.5d后,反應器接通電源,恒定電流強度為 10mA,進水水力停留時間設定12h,進行連續流缺氧培養15d.培養期間,每隔24h向反應器充氮氣 30min,維持反應器內的厭氧環境.馴化15d后,反應器出水pH穩定在6.5~8.0之間,硝酸鹽的去除率達到70%以上,即可判斷馴化基本完成.此時反應器不需要充氮氣即可維持厭氧環境,當在進水中添加一定濃度的溴酸鹽(具體條件見表 2),并逐漸降低硝酸鹽的進水濃度直至其進水濃度為零.整個運行周期被劃分為6個,分別是馴化期、A階段、B階段、C階段、D階段、E階段;每個運行階段分別持續15、8、17、15、15、20d.
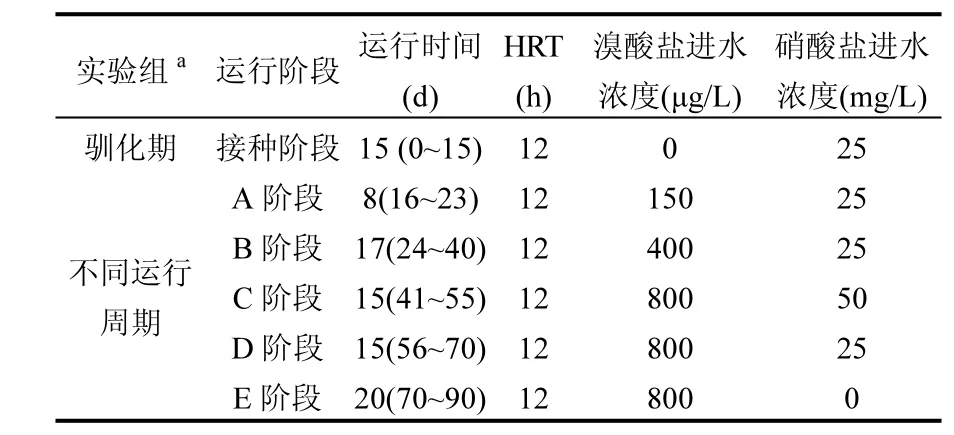
表2 旋轉電極生物膜反應器運行條件Table 2 The experimental conditions of RBER system
1.3 分析方法
1.3.1 進出水污染物濃度的測定 出水樣品經過0.22μm聚二氟乙烯膜過濾器過濾后采用戴安ICS-900 離子色譜儀測定溶液中 BrO3-、Br-、NO3-、NO2-濃度,色譜條件:陰離子分析柱為Dionex IonPac AS19(4mm×250mm),陰離子保護柱為Dionex IonPac AG19,MMS 300抑制器為Dionex MMS 300,淋洗液采用優級純Na2CO3和NaHCO3配置.實驗所用超純水均由密理博超純水機制取(Mili-Q,美國).
1.3.2 生物膜樣品的采集及基因組 DNA提取為研究 RBER系統生物膜樣品菌群富集程度及種屬組成,對接種的原始污泥取樣,用經過滅菌的雙面刀片直接刮取約7g污泥,并裝入無菌的7mL Eppendorf管中,編號為1號.對RBER系統運行的5個不同階段 (即運行第24d、第40d、第55d、第 70d和第 90d) 取樣時,停止陰極旋轉,采用滅菌的雙面刀片在活性炭氈陰極刮取約7g纖維絲,放入滅菌的去離子水中輕輕涮洗,以除去上面附著的非電極微生物或雜質,裝入無菌的 7mL Eppendorf管中,分別編號為2、3、4、5和6號樣品.收集的生物膜樣品首先使用掃描電鏡分析其形貌,并使用土壤基因組 DNA試劑盒(Soil DNA Kit, OMEGA公司)根據說明書步驟逐步抽提樣品基因組DNA.提取的DNA放置在-25℃冰箱冷藏,以備后續分析.
1.3.3 PCR擴增及高通量測序 以提取的基因組 DNA為模板,合成帶有標記物的特異引物.為了確定測序的樣品來源,PCR引物中標簽序列的插入位置標記為barcode.引物中barcode的前面序列是接頭序列,用于識別測序位置,barcode的后面序列是引物序列.擴增16S rDNA 的V3~V6區域,使用引物為 338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)進行擴增[8]. PCR擴增的反應體系(50μL)組成如下:10×Ex buffer(5μL), 4μL dNTPs(0.25mmol/L), DNA模板(20ng),正向引物1μL PCR primer F(10μmol/L),反向引物 1μL Primer R(10μmol/L),Taq聚合酶(0.3μL).
PCR擴增條件為:94℃預變性 5min,然后進行 25~35個循環:94℃變性 45s,50~60℃退火45s,72℃擴增延伸90s;完成以上循環后再在72℃最終延伸10min[9]. PCR擴增產物使用2%的瓊脂糖凝膠電泳檢測(150V,20min).利用SanPrep柱式DNA膠回收試劑盒對DNA進行回收,并送往上海美吉測序部使用MiSeq平臺進行高通量測序.
微生物群落結構分析中使用的主要設備有高通量測序儀(Illumina Miseq PE300,美國);高速離心機(黑馬,中國珠海);小型離心機(TGL-16G,上海安亭);PCR儀(MyCycler thermal cycle,美國伯樂);電泳電源(Basic PowerPac 200,美國伯樂);凝膠成像系統(Gel Doc 2000,美國伯樂);掃描電鏡(JSM-6700F,日本);超低溫冰箱(Haier,山東青島);高壓蒸汽滅菌鍋(YXQ-SG41-280,江蘇金壇);生化培養箱(SPX-250BIII,天津泰斯特);超凈工作臺(SW-CJ-1B,江蘇蘇州);精密電子天平(FA2004N,上海精科);超純水儀(Milli-Q,美國密理博);渦旋混合器(QL-901,上海琪特);電子萬用爐(天津泰斯特);pH計(梅特勒-托利馬 FE20,瑞士).
2 結果與討論
2.1 反應器不同運行周期結果
反應器陰極馴化掛膜完成后,開始向反應器中加入溴酸鹽,當反應器實現了對溴酸鹽穩定去除后,增加溴酸鹽進水負荷,在5個不同運行周期中,考察RBER反應器還原溴酸鹽的能力.5個周期的運行條件為:溫度(35±2)℃,溶液pH(7.2±0.2),溶解氧(0.4±0.1)mg/L,電流強度10mA.
當馴化完成后,反應器進入A階段運行,此時,進水中投加 150μg/L溴酸鹽,硝酸鹽依然保持馴化時的濃度.由圖 2(a)可知,出水中幾乎沒有檢測到溴酸鹽,但反應器出水中也沒有檢測到溴離子;此時,硝酸鹽依然保持較高的去除率(約 95%左右),出水中亞硝酸鹽濃度從 0.5mg/L增大到1.0mg/L,如圖2(b).這個結果表明,在投加150μg/L溴酸鹽時,由于濃度較低,消失的溴酸鹽主要是微生物膜進行了吸附作用,沒有檢測到還原產物,沒有發生還原降解;且進水溴酸鹽會影響自養反硝化過程,導致亞硝酸鹽濃度增大.
反應器運行至 B階段時,進水溴酸鹽為400μg/L,此時溴酸鹽全部被還原,且檢測到出水中有等摩爾量的溴離子,這表明反應器內微生物已經適應了溴酸鹽負荷,通過電子傳遞將溴酸鹽還原降解為溴離子.這個過程與溴酸鹽在氫基自養反硝化生物反應器(MBfR)中降解過程相似,當反硝化細菌馴化完成后,向反應器加入1500μg/L的溴酸鹽,在50min內可被降解到10μg/L以下[10].
反應器運行至C階段時,反應器已運行穩定,將進水硝酸鹽濃度從25mg/L提高到50mg/L,進水溴酸鹽濃度增大到800μg/L,研究RBER反應器對高濃度溴酸鹽和硝酸鹽的降解能力(如圖2(a).此時,出水中溴酸鹽的濃度超過80μg/L,超過國家標準規定的 10μg/L要求.與此同時,出水中亞硝酸鹽也有顯著的積累(超過 6mg/L),溴酸鹽和硝酸鹽降解效率也降低到90%和91%.這個結果可能是電子供體(H2)不足引起的,Zhao等[11]在研究高氯酸鹽和硝酸鹽的降解過程中發現,當進水高氯酸鹽負荷過高時,高氯酸鹽與硝酸鹽會競爭電子供體,當氫電子供體不足時,高氯酸鹽降解過程會受到抑制.
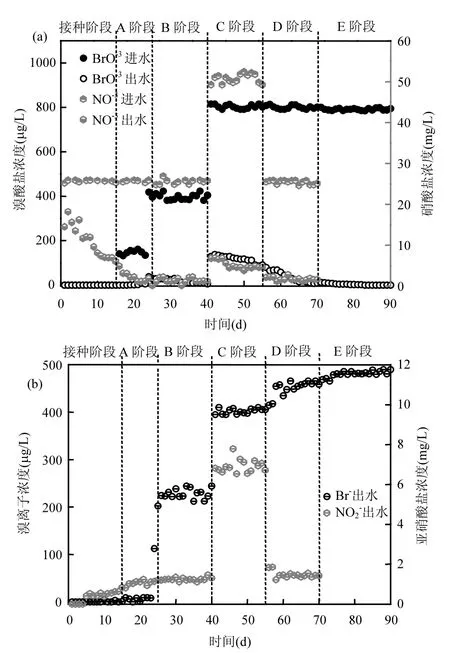
圖2 (a)RBER反應器進水和出水中溴酸鹽和硝酸鹽濃度;(b)RBER反應器出水中溴離子和亞硝酸鹽濃度Fig.2 (a) Influent and effluent concentration of bromate and nitrate in RBER, and (b) effluent concentration of bromide and nitrite
反應器運行至D階段時,為進一步考察溴酸鹽與硝酸鹽競爭電子供體關系,維持溴酸鹽濃度800μg/L不變,降低硝酸鹽的濃度至25mg/L.此時,出水中亞硝酸鹽濃度明顯下降,出水中幾乎檢測不到硝酸鹽,但出水中溴酸鹽濃度仍大于20μg/L.這說明,溴酸鹽與硝酸鹽對電子供體存在競爭關系,且反應器內微生物優先還原硝酸鹽.
反應器運行至E階段時,此時,溴酸鹽作為唯一的電子受體幾乎可以在反應器中被完全去除.連續運行 20d,溴酸鹽的去除率幾乎達到 100%,且出水檢測到等摩爾量的溴離子.這說明反應器已富集了溴酸鹽降解菌群,利用陰極產生的氫氣作為電子供體穩定地去除溴酸鹽.這5個運行階段末期的生物膜樣品都將收集,并將對其微生物群落變化做進一步分析.
2.2 生物膜樣品形貌
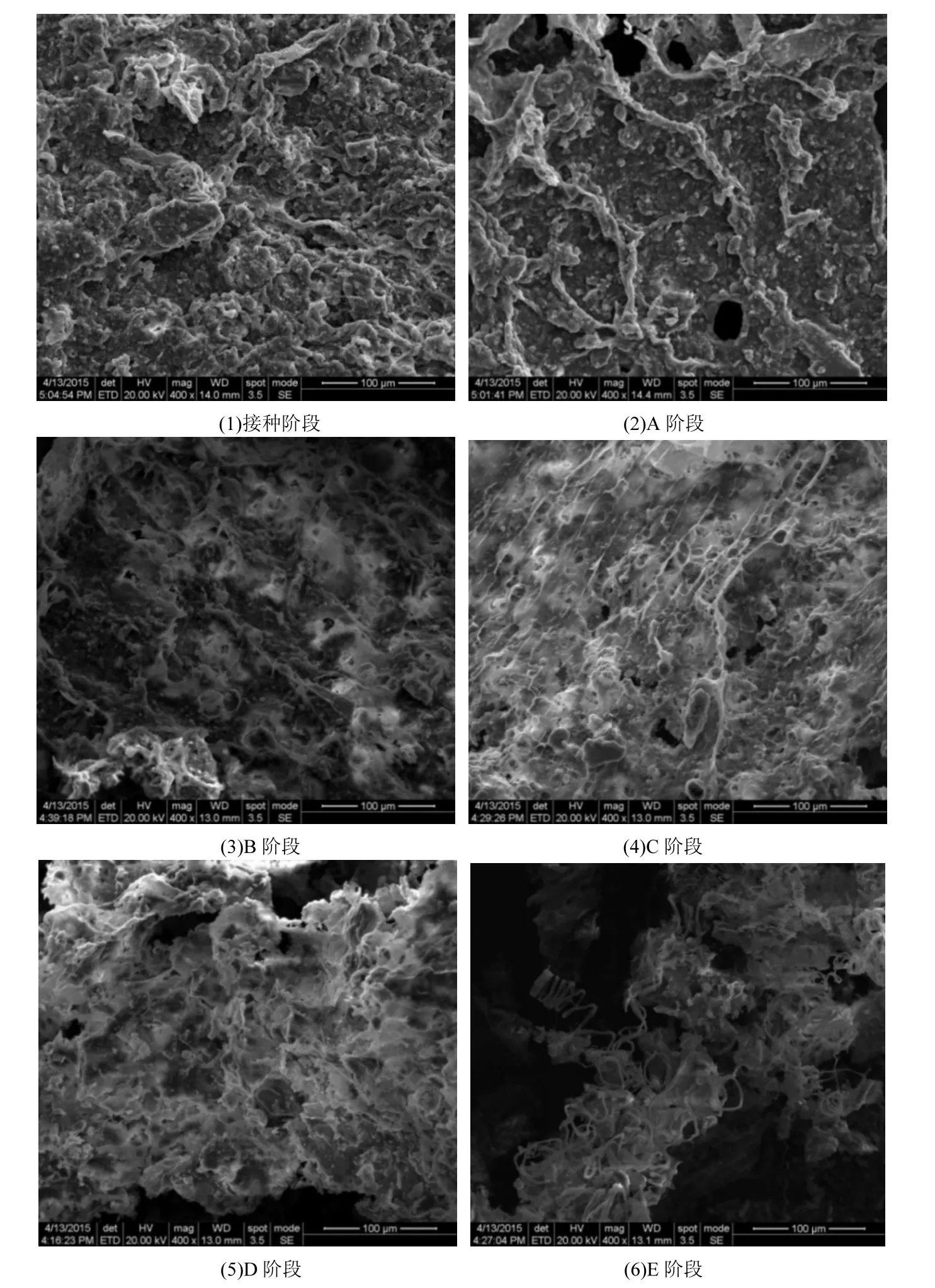
圖3 RBER反應器6個不同運行階段生物膜樣品SEM圖Fig.3 SEM images of the RBER biofilms at six different stages
反應器運行不同階段的生物膜樣品表面形 態直接利用掃描電鏡觀察,具體結果見圖3.如圖3所示,1號原始污泥呈現塊狀,且緊密的結合在一起.2號是反應器運行24d的樣品,此時生物膜已覆蓋陰極的活性炭纖維,但生物膜中間還存在一些微孔在,說明還沒有形成致密的生物膜.樣品3號、4號、5號生物膜結合愈發緊密,說明了生物膜上微生物生長良好,有利于提高其對溴酸鹽的降解能力;6號是僅加入溴酸鹽作為唯一電子受體培養的生物膜樣品,此時,膜樣品呈現絲狀,相比與其他膜樣品其形貌發生了很大變化,這可能預示著在這個階段,生物膜上微生物群落發生了較大變化.
2.3 樣品的多樣性分析
測序獲取的原始序列,將雙末端序列融合為一個方向的序列并進行質量控制,設置50bp的窗口,采用Trimmomatic和FLASH軟件去除各樣品的引物序列、低于50bp的序列、低復雜度序列和低質量序列.將相似度大于 97%的序列劃分為一個 OUT測定序列[12],經質量控制后根據差異水平在0.03,即相似度97%的水平上聚類得到操作分類單元(OUT)[13].各階段樣品獲得的有效序列數量和OTU分布如表3所示.從表中可看出,6個樣品 OTU數目經歷了由少到多,再減少的過程.1號樣(原始污泥)中的OTU數目為285個,隨著不斷馴化,OTU數目逐漸增大,這可能是一定濃度的硝酸鹽和溴酸鹽的加入使反應器內細菌多樣性增加,從而使 OTU數目逐漸增大,并在反應器運行55d后達到最大的381個.此后,由于富集了溴酸鹽降解復合菌群,抑制了其他菌群的生長,導致了OTU數目減少.
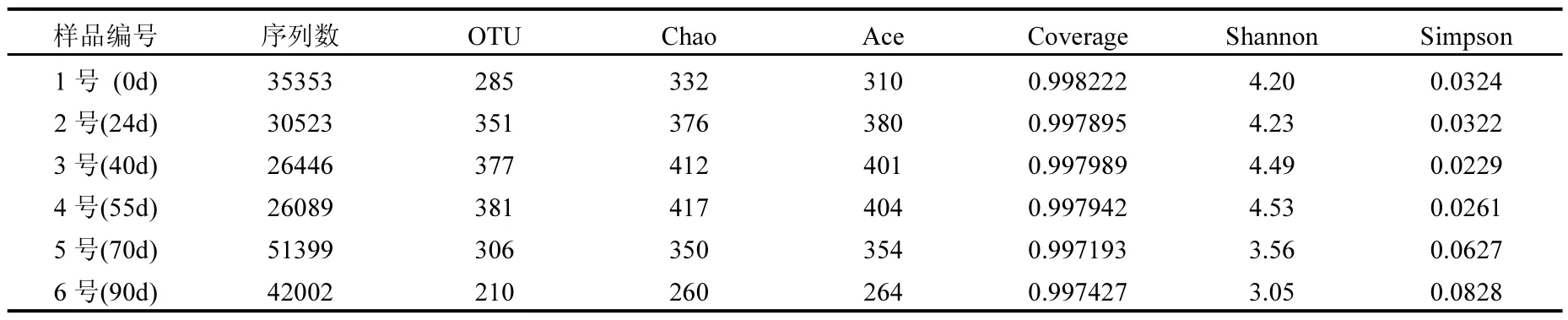
表3 多樣性指數分析Table 3 The analysis data of diversity index
從表 3中可以看出,原始污泥的 Chao值為285,隨著反應器運行時間延長,Chao值經歷了一個先增大后減小過程,而OTU數目也是先增大后減小, ACE指數變化趨勢與Chao指數相同,表明在馴化前期,細菌的物種總數逐漸增加,而到后期,培養馴化出了特異性降解溴酸鹽的復合菌群,抑制了其他菌群的生長,則豐度指數降低.6個樣品測序結果的Coverage值在97%相似度水平的樣品覆蓋率都在99%以上,表明該6個樣品的測序量合理,測序結果可以反映樣本中微生物的真實情況.Shannon值的變化趨勢與Simpson值相反,6號樣品的 Shannon值最小,同時,具有最大的Simpson值0.0828,這表明,6號樣品與其他5個樣品比較起來,生物多樣性最低.
2.4 測序物種分析
根據RBER反應器6個不同階段樣品在不同分類水平上的序列數,選擇門和屬水平研究樣品的細菌整體特性和其特定功能.在6組樣品中,共發現有 23個已知菌門和少量尚未定類門菌,為便于研究,選取相對豐度高于1%的9種門類微生物作圖,并將豐度低于 1%的部分合并為 other在圖中顯示,如圖4所示.
從圖中可看出,6個樣品中,主要的門類微生物為Firmicutes(厚壁菌門),Proteobacteria(變形菌門,Bacteroidetes(擬桿菌門),Actinobacteria(放線菌門)和Chloroflexi (綠彎菌門).原始污泥中,上述5類微生物分別占總菌門數的 38.0%、41.6%、2.2%、7.5%和4.0%.Firmicutes和Proteobacteria是RBER的優勢菌門,兩者OTU數總和為17009條.隨著反應器的運行,Firmicutes總體上呈現增加的趨勢,而Proteobacteria呈現下降趨勢.6號樣品中,Firmicutes占總菌門數從原始污泥的38.0%上升到 63.4%.已有研究表明降解溴酸鹽的微生物是形態差異很大的復合菌群,Firmicutes是其中的一種,可以通過呼吸代謝和共代謝作用降解溴酸鹽[14].Firmicutes大多為革蘭氏陽性細菌,屬于厭氧或兼性厭氧代謝,形狀有球狀、桿狀或不規則桿狀、絲狀或分枝絲狀等,大都是二分裂方式繁殖,少數可產生內生孢子(稱為芽孢)或外生孢子.在眾多的廢水生物處理反應器如 CAS(普通活性污泥反應器)、MBR、A/O-MBR等中都發現Firmicutes的數量分布僅次于Proteobacteri在降解污水中有機物、氮、磷等污染物中起著重要的作用[15].
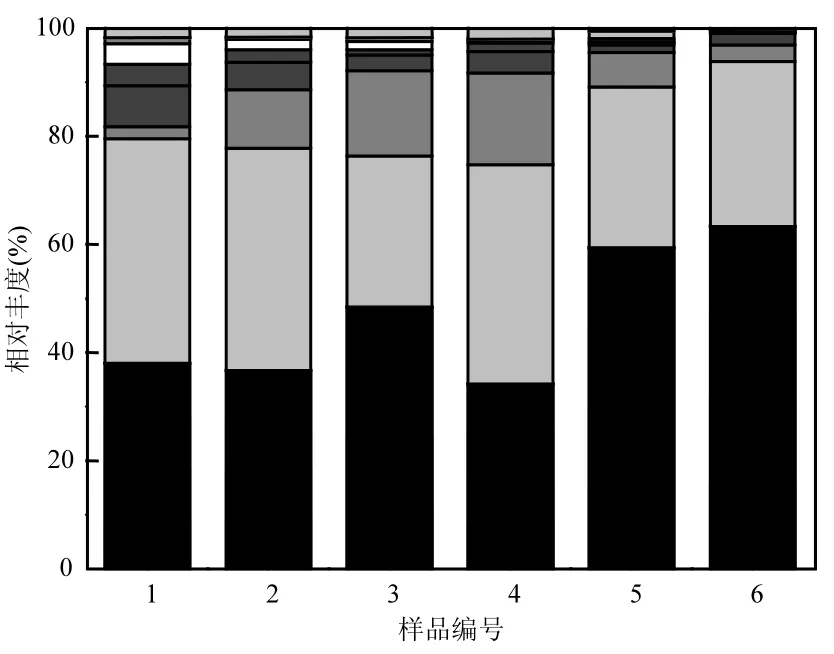
圖4 生物膜樣品在門水平上的物種相對豐度圖(相似水平≥97%)Fig.4 Phylum-level abundance of pyrosequences from the different stages of the RBER biofilms with cut-off threshold of 97% similarity
Proteobacteria的相對豐度從占總菌門數41.6%(原始污泥)逐漸下降到占比 30.4%(6號樣品).通過對溴酸鹽降解微生物群落結構進行解析,學者劉娟等[16]發現β-變形菌的紅環菌科類以及 γ-變形菌的假單胞菌科是降解溴酸鹽的優勢菌群.在氫基生物膜反應器降解硝酸鹽和高氯酸鹽中,Van Ginkel等[17]發現Proteobacteria是生物膜上最主要的菌門,其中,γ-變形菌綱又是降解硝酸鹽的主要菌綱(占總Proteobacteria數的87%).
Bacteroidetes的相對豐度經歷了一個逐漸增大,再減少的過程.在4號樣時,Bacteroidetes相對豐度達到最大 17.0%.當只有溴酸鹽存在時,相對豐度達下降到3.1%,這表明Bacteroidetes在溴酸鹽存在條件下,菌群數量下降.Xia等[15]在生物廢水處理中發現, Bacteroidetes大量存在于低氧或缺氧水體環境中,主要參與的是脫氮過程.Actinobacteria的相對豐度從原始污泥中占總菌門數的 7.5%逐漸減少,到 6號樣時僅占1.3%.Davidson等[14]利用活性炭柱過濾器去除溴酸鹽,通過對活性炭表面上的微生物進行 16S rRNA基因測序發現,Actinobacteria是其中優勢菌群之一. Actinobacteria是革蘭氏陽性菌,普遍分布于土壤中.
Chloroflexi是一種綠彎菌門,在反應器不同階段,其相對豐度的變化沒有規律,在原始污泥中占總菌門數的4.0%,在6號樣品中占總菌門數的0.5%.典型的綠彎菌門細菌屬于兼性厭氧生物,Wrighton等在微生物燃料電池中發現,陰極生物膜上主要存在著Chloroflexi菌群,是一類反硝化細菌.另外還有兩類沒有確定門類的Candidate-division-TM7和 Candidate-division-WS6,它們都屬于絲狀菌,這些菌門大多數屬于專性或間性厭氧菌、或氧親和系數較低的菌門.
利用菌群層序聚類分析來反映 6個樣本在屬類水平上群落組成的差異性(如圖5),并通過不同顏色梯度來對低豐度和高豐度的物種分別聚類.其中,橫向為各樣品名,縱向為各個物種名,圖5左側的聚類樹為物種的聚類樹,圖上方的聚類樹為樣品的聚類樹.由圖可知,6個生物膜樣品菌群聚集可為兩個大的分支, 1、2、3和4號樣品聚為一大類,5和6號樣品聚為一類.這表明,反應器運行前 4個階段的微生物菌群組成類似,而在運行后期的70d和90d的微生物菌群組成相似.
從圖 5還可看出,Bacillus(枯草桿菌屬)、Pseudomonas(假單胞菌屬)、Lactococcus(乳球菌屬)在細菌總數中的占比是逐漸增大的,在原始污泥樣品中Bacillus、Pseudomonas和Lactococcus相對豐度為0.41%、0.06%和0.13%;當反應器運行 90d后(僅有溴酸鹽作為電子受體),此時樣品中3者的占比分別增大到37.0%、16.2%和11.1%,這3類可能是降解溴酸鹽的優勢菌屬.
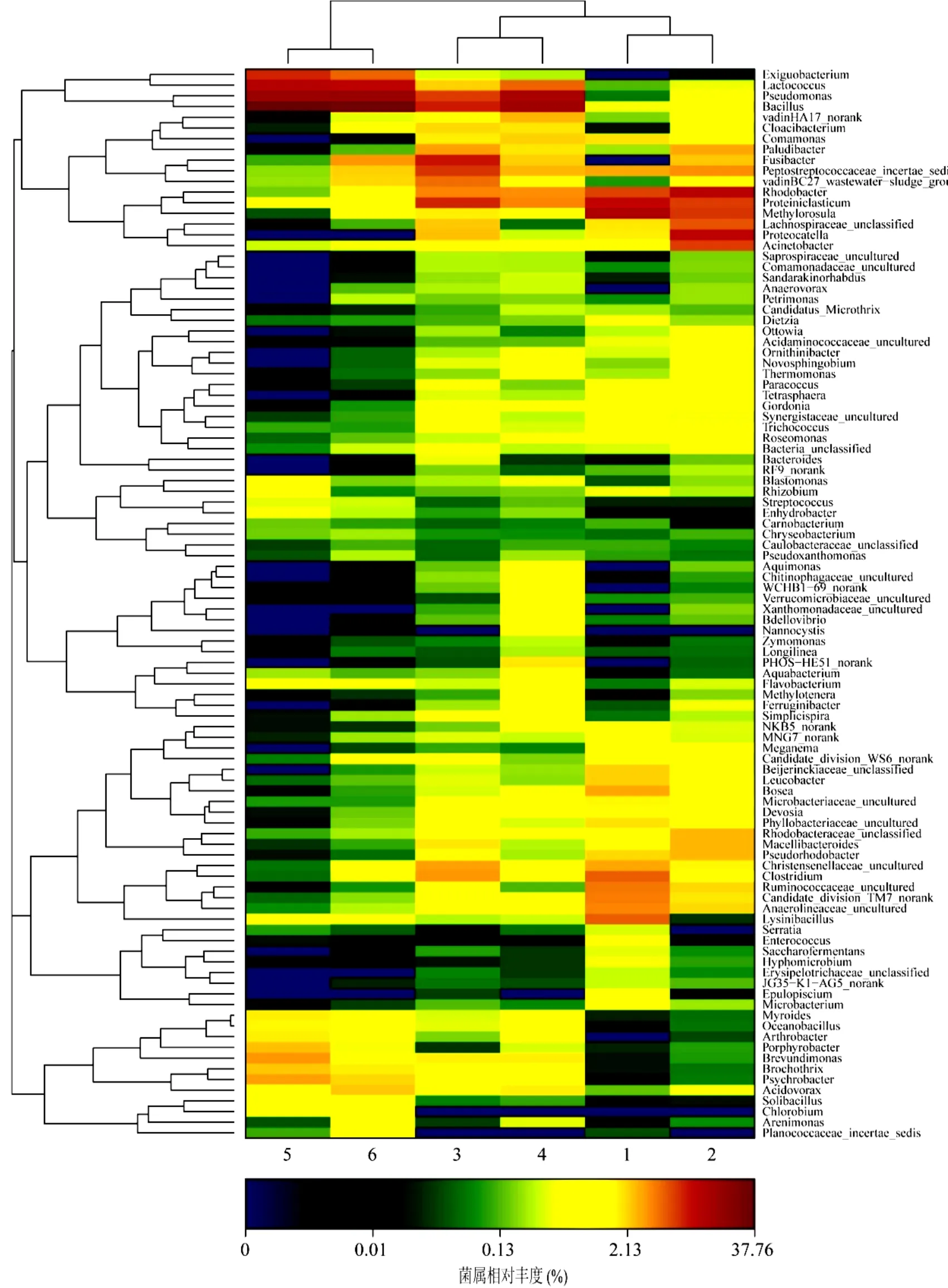
圖5 RBER反應器生物膜樣品菌屬層序聚類分析熱圖Fig.5 Heatmap showing the genus of bacterial community for RBER biofilm samples
與此同時,在僅有溴酸鹽作為電子受體的 6 號生物膜樣品中,還出現了原始污泥中未檢測到的 3種菌屬:Exiguobacterium(微小桿菌屬)、Arthrobacter(節細菌屬)和Chlorobium(綠硫菌屬).此時,反應器對進水溴酸鹽的降解效率接近100%,這3類細菌可能是降解溴酸鹽的特異性菌株.其中,Exiguobacterium是一類革蘭氏陽性、無芽孢、兼性厭氧菌,屬于厚壁菌門,Collins等[18]首次在馬鈴薯加工廠鑒定出Exiguobacterium菌屬.Arthrobacter是一類革蘭氏陽性球菌,被發現可用于降解高濃度的4-氯酚,并可用于污染物的生物降解.Chlorobium被認為是綠菌門的一種,生活在嚴格的厭氧環境特別是富營養化湖水的厭氧區域,可以用二氧化碳作為碳源進行自養厭氧生長.
3 結論
3.1 旋轉電極生物膜反應器可以將濃度范圍為150~800 μg/L的溴酸鹽完全降解,且硝酸鹽與溴酸鹽對電子供體存在明顯的競爭關系,硝酸鹽對電子供體競爭能力要強于溴酸鹽.
3.2 采用高通量測序對6個階段的樣品在屬水平上的微生物相對豐度分析,發現菌屬多樣性逐漸下降.優勢菌屬主要是 Bacillus、Pseudomonas和Lactococcus3類.
3.3 3類細菌Exiguobacterium、Arthrobacter和Chlorobium可能是降解溴酸鹽的特異性菌屬.
[1] 劉芳蕾,張 冬,呂錫武.臭氧生物活性炭工藝運行中產生溴酸鹽的可能性分析 [J]. 中國環境科學, 2014,34(9):2299-2305.
[2] Matsuyama Z, Katayama S, Nakamura S. A case of sodium bromate intoxication with cerebral lesion [J]. Rinsho Shinkeigaku Clinical Neurology, 1993,33(5):535-540.
[3] Hijnen W, Voogt R, Veenendaal H, et al. Bromate reduction by denitrifying bacteria [J]. Applied Environmental Microbiology, 1995,61(1):239-244.
[4] Kirisits M J, Snoeyink V L, Inan H, et al. Water quality factors affecting bromate reduction in biologically active carbon filters [J]. Water Research, 2001,35(4):891-900.
[5] Nerenberg R, Rittmann B E. Hydrogen-based, hollow-fiber membrane biofilm reactor for reduction of perchlorate and other oxidized contaminants [J]. Water Science Technology, 2004, 49(11):223-228.
[6] Chairez M, Luna V A, Field J A, et al. Reduction of bromate by biogenic sulfide produced during microbial sulfur disproportionation [J]. Biodegradation, 2009,21(2):235-244.
[7] Wang D B, Li X M, Yang Q, et al. Biological phosphorus removal in sequencing batch reactor with single-stage oxic process [J]. Bioresource Technology, 2008,99(13):5466-5473.
[8] 路 璐.生物質微生物電解池強化產氫及陽極群落結構環境響應 [D]. 黑龍江:哈爾濱工業大學, 2012.
[9] 侯愛月,李 軍,王昌穩,等.不同好氧顆粒污泥中微生物群落結構特點 [J]. 中國環境科學, 2016,36(4):1136-1144.
[10] Downing L S, Nerenberg R. Kinetics of microbial bromate reduction in a hydrogen-oxidizing, denitrifying biofilm reactor [J]. Biotechnology and Bioengineering, 2007,98(3):543-550.
[11] Zhao H P, Van G S, Tang Y, et al. Interactions between perchlorate and nitrate reductions in the biofilm of a hydrogen-based membrane biofilm reactor [J]. Environmental Science Technology, 2011,45(23):10155-10162.
[12] 宋云龍,張金松,朱 佳,等.基于高通量測序的微生物強化污泥減量工藝中微生物群落解析 [J]. 中國環境科學, 2016,36(7): 2099-2107.
[13] 蔡言安,李 冬,畢學軍,等.基于不同測序技術的生物群落結構及功能菌分析 [J]. 中國環境科學, 2016,36(6):1830-1834.
[14] Davidson A N, Chee S J, Lai H Y, et al. Characterization of bromate-reducing bacterial isolates and their potential for drinking water treatment [J]. Water Research, 2011,45(18): 6051-6062.
[15] Xia S Q, Liang D, Song Y H, et al. Bacterial community structure in geographically distributed biological wastewater treatment reactors [J]. Environmental Science Technology, 2010,44(44): 7391-7396.
[16] 劉 娟,于建偉,楊 敏,等.飲用水中溴酸鹽的微生物降解及群落結構解析 [C]//第六屆海峽兩岸水質安全控制技術與管理研討會論文集. 2010:13-19.
[17] Ginkel S W, Lamendella R, Kovacik W P J, et al. Microbial community structure during nitrate and perchlorate reduction in ion-exchange brine using the hydrogen-based membrane biofilm reactor (MBfR) [J]. Bioresource Technology, 2010,101(10):3747-3750.
[18] Collins M D, Lund B M, Farrow J a E, et al. Chemotaxonomic study of an alkalophilic bacterium, exiguobacterium aurantiacum [J]. Microbiology, 1983,129(7):2037-2042.
Removal of bromate by a rotating biofilm-electrode reactor (RBER) and microbial community analyses.
ZHONG Yu1,2, YANG Qi3*, LI Xiao-ming3, LIU Zhan1,2, XIANG Ren-jun1,2, WEN Tao1,2, CHENG Ying-xiang1,2, YOU Xiang-yu1, LUO Da-tong1(1.Hunan Research Academy of Environment Science, Changsha 410004, China;2.Hunan Key Laboratory of Water Pollution Control Technology, Changsha 410004, China;3.College of Environmental Science and Engineering, Hunan University, Changsha 410082, China). China Environmental Science, 2017,37(5):1945~1953
Bromate is an oxyhalid disinfection byproduct (DBP) during chlorination or ozonation of bromide-containing water, which has been classified as a group II carcinogen (as a possible human carcinogen) by the International Agency for Research on Cancer (IARC). In this study, an auto-hydrogenotrophic rotating biofilm-electrode reactor (RBER) was designed for bromate removal, and the running tests confirmed that the RBER system could completely reduce 150~800 μg/L bromate to bromide without accumulation of by-products. The competition for the electron donor H2appeared between bromate and nitrate during the RBER operation, and H2-utilization of NO3-was prior to BrO3-when H2was limiting. The high-throughput sequencing was employed to investigate the microbial communities of six biofilm samples from different stage of RBER. According to 16S rRNA gene sequencing, the dominant genus-level bacteria were Bacillus (37.0%), Pseudomonas (16.2%) and Lactococcus (11.1%). These three species are dominant genus-level bacteria, which may be the main bromate-reducing bacteria in RBER.
bromate;nitrate;high-throughput sequencing;microbial community
X172
A
1000-6923(2017)05-1945-09
鐘 宇(1988-),男,湖南郴州人,助理研究員,博士,主要從事水污染控制研究.發表論文19篇.
2016-09-14
國家自然科學基金資助項目(51378188,51478170);國家國際科技合作專項項目(2013DFG91190)
* 責任作者, 副教授, yangqi@hnu.edu.cn

