高中化學競賽試題中的電化學知識點的研究
鄒士金
摘要:電化學知識在高中化學中的一部分,雖然在競賽中題量較少,但起著至關重要的作用。隨著化學課程的不斷改革更新,題型也在不斷變化,出題的角度以及深度在不斷的改變。在保持考察基礎知識點以及必備化學理論和原則外,還會增加一些創新性的題型,考察學生對知識的變通能力。本文針對高中化學中的電化學進行研究,對知識點進行分析。
關鍵詞:化學競賽;電化學;知識點;特點分析
G633.8
電化學弘揚了化學的重要價值,主要研究電解原理、電解池以及原電池等的原理,在金屬防護方面也有相關涉及。電化學與生活息息相關,一直受到很大的重視,是化學競賽必考的內容之一,出題較為活躍,在理論研究的基礎上進行延伸,充分對化學知識進行拓展和挖掘,有益于學生對化學這門學科的理解,與實驗相結合,激發學生對化學學習的興趣。因此,在競賽中,電化學這一方面值得大家的重視。
一、命題特點與難點分析
對于新材料、新的科技產品,命題人會著重分析,通過這類事物考察學生的分析能力和解決事情的能力。題目以新為主,靈活的運用知識點是學生必備的技能。由于電化學知識與生活相聯系,因此要培養學生的知識運用和理解能力,清楚的了解電化學在生活中的應用。在出題的時候,命題人還會降綠色化學融入試題,幫助強化學生對此概念的理解。對于電化學的學習,至關重要的就是將知識與實驗相結合,通過實驗,更好的將知識記牢以及對其深入的理解。
1.對電極的認識和確定分析
在解答電化學題目的過程中,應該對電極進行有效的認識和確定分析,在進行答題的過程中,大題的分析需要在電極的確定開始,明確的電極確定可以有效的對電化學大題進行分析,從而提高做題的效果。在題目分析的過程中,多數會以電化學的現象為提示和參考,利用出現的電化學現象來確定電極的正負,進一步對反應的發生進行系統的分析。另外在進行分析之前,需要首先確定電化學的類型,電化學的類型可以決定了反應的效果和現象。因此在進行答題分析之前,需要明確答題的基礎,另外還需要對電化學反應方程式有明確的記憶,在解答題目之前需要了解反應發生過程的現象,對現象和反應前后的物質進行分析,從而確定題目中用到的電化學知識。在題目分析的過程中,對電極進行有效的認識和確定是解答電化學題目的基礎,同時也是對電化學知識進行有效合理分析的前提。
2.對電解過程的了解和分析
電解過程是電化學反應的重點,對于不同類型的電極和電解質會發生不同的反應,而滿足不同的需要。在對電解過程進行了解和分析的過程中,要對反應過程進行合理的控制,掌握電解反應過程各種操作的目的,同時應用到題目當中。例如在對電解過程進行分析中可以發現,有些題目中電解液中有一層選擇性膜,這種選擇性膜的設置可以控制電解液中的離子運動,對反應現象進行相應的變動。結合不同的反應類型,電解液的選擇也需要進行控制,同時電解液中的成分分析也可以對題目進行深入的解讀,從而分析電解反應,有效的對電化學知識進行了解和分析。
3.規避試題中的誤區和易錯點
在對電化學知識進行考察的過程中可以發現,電化學知識較為復雜且多樣化,在分析的過程中應該有一定的順序性,這樣才不會發生疏漏。在分析的過程中應該細致的審查題目,對題目中的條件進行分析和了解,對可能發生的化學反應方程式進行羅列,對電化學反應的過程進行熟練的掌握,這樣才能有效的避免錯誤,進而提高解題的效果。在對題目進行分析的過程中,試題中會存在一些易錯的問題,而這些問題往往會成為大題解題的誤區和陷阱。有效的規避這些誤區和陷阱才能提高解題的準確率。在題目的考察上也會有一定的開放性題目,在分析的過程中應該與生活進行聯系,這樣才能提高題目的得分,從而對電化學知識有一定的應用意識,進而真正掌握相應的電化學知識。
二、高中化學競賽試題化學知識點案例分析
在解題過程中當遇到信息生疏、思路障礙、概念模糊時,要自覺運用轉化思維,化陌生為熟悉、化抽象為形象、化繁雜為簡單,化含糊為明朗,從而拓展解題思路。轉化思維就是思維變通,條條大路通羅馬。轉化形式可以是概念轉化、組成轉化、物質轉化、表達方式轉化等,目的是信息等價替換,降低解題難度,進而達到解決問題的一種方法。數形轉化、司馬光砸缸等都是轉化思維的典例。
【例1】由乙炔、苯、乙醛組成的混合物、已知其中碳元素的質量分數為72.0%。試求氧元素的質量分數。
【解題思路】可將乙炔、苯、乙醛三種有機物進行化學式組成的變形轉化,即:C2H2、C6H6、C2H4O→(CH)2、(CH)6、(CH)2·H2O→(CH)n+H2O,碳元素的質量分數→“CH”的質量分數→“H2O”的質量分數→氧元素的質量分數
【解】氧元素的質量分數=(1﹣72.0%×13/12)×16/18=19.6%
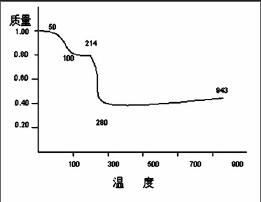
【例2】將固體MnC2O4·2H2O放在一個可以稱出質量的容器里加熱,固體質量隨溫度變化的關系如圖所示(相對原子質量:H 1.0,C 12.0, O 16.0,Mn 55.0 ),縱坐標是固體的相對質量。 說出在下列五個溫度區間各發生什么變化,并簡述理由: 0~50℃;50~100℃;100~214℃;214~280℃;280~943℃
【解題思路】圖示、圖表信息豐富,答案盡在圖表中顯現,故挖掘圖表內涵,轉化圖表信息,是解答圖形圖表類競賽題的關鍵。本題計算的基礎是如何將圖中相對失重的信息轉化為解題依據。
【解】轉化0~50℃時的圖示:圖像線段基本水平,說明是MnC2O4·2H2O穩定區域,MnC2O4·2H2O未分解。
轉化50~100℃時的圖示:圖像線段下坡,說明MnC2O4·2H2O(相對分子質量179)逐漸失水成為無水物MnC2O4(相對分子質量143),
MnC2O4·2H2O==MnC2O4+2H2O 143/179= 0.80
轉化100~214℃時的圖示:圖像線段基本水平,說明是MnC2O4 穩定區域,MnC2O4未分解。
轉化214~280℃時的圖示:圖像線段下坡,說明MnC2O4逐漸分解成為MnO(相對分子質量71),MnC2O4==MnO+CO+CO2 71/179 = 0.40
轉化280~943℃時的圖示:圖像線段有點上坡,說明固體增重,分解生成的MnO被O2氧化, 可能反應為3MnO+1/2O2==Mn3O4 (229×1/3)/179 = 0.43
三、結語
高中化學競賽試題中電化學知識的考察是重點,同時也是現階段學習的難點。在對電化學知識進行分析的過程中,熟練掌握相關知識,正確認識化學反應前后,了解相關應用知識,都可以提高電化學題目解題的全面性和準確性,進一步提高學生對化學知識的認識。
參考文獻:
[1]曾凡先.新課程背景下高中化學探究實驗教學的思考.《科學咨詢》.2015年4期
[2]崔躍東,高中化學探究教學研究.《新課程·中旬》.2015年3期
[3]趙海玉.談普通高中化學興趣小組活動的內容.《教育教學論壇》.2011年9期
[4]王進.淺談高中化學興趣點教學的應用--高三一輪復習原電池教學設計.《新課程·中旬》.2014年2期

