子宮內膜樣腺癌合并盆腔淋巴結淋巴管肌瘤病的臨床病理分析
朱 琳,周 莉,秦東瑞,遲亞松,馬廣貞
子宮內膜樣腺癌合并盆腔淋巴結淋巴管肌瘤病的臨床病理分析
朱 琳1,周 莉1,秦東瑞1,遲亞松2,馬廣貞1
目的 探討淋巴結淋巴管肌瘤病(lymphangiomyomatosis, LAM)的臨床病理學特征。方法 復習1例子宮內膜樣腺癌合并盆腔淋巴結LAM的臨床資料及病理特征,對其行HE及免疫組化EnVision法染色并復習相關文獻。結果 子宮內膜呈高-中分化子宮內膜樣腺癌改變,盆腔淋巴結被膜及髓質內見增生的LAM細胞呈梭形、上皮樣或多角形,圍繞腔隙排列,細胞質嗜酸性或空泡樣,細胞無明顯異型性,未見核分裂象。免疫表型:SMA、Caldesmon、desmin、vimentin、ER和PR均陽性,腔隙內襯細胞CD34和D2-40均陽性,上皮樣瘤細胞HMB-45陽性,Melan-A陰性,Ki-67增殖指數<1%。結論 LAM臨床較為少見,好發于肺部,子宮內膜樣腺癌合并盆腔淋巴結LAM極為罕見,結合組織學形態、臨床特點及免疫組化染色可確診,為今后進一步分析LAM的機制及治療提供重要價值。
子宮內膜腫瘤;淋巴管肌瘤病;淋巴管肌瘤;盆腔淋巴結
淋巴管肌瘤病(lymphangiomyomatosis, LAM)是一種原因不明、罕見的進行性間質腫瘤,由淋巴管及其周圍增生的細胞組成。LAM好發于肺部,肺外LAM可見于腹膜后、腸系膜、闊韌帶、子宮、網膜及縱膈等沿淋巴管分布的淋巴結。病變局限者稱為淋巴管肌瘤,累及多部位或廣泛發生者,則稱為LAM[1]。發生于肺外的LAM極其罕見,國內僅有個案報道。本文現報道1例子宮內膜樣腺癌合并盆腔淋巴結LAM,結合文獻分析其臨床病理特點、發生機制及預后。
1 材料與方法
1.1 臨床資料 患者女性,48歲,原發不孕,月經不規律20余年,既往糖尿病、高血壓病史,因腹痛來院行B超檢查:宮腔內實性占位,需除外內膜癌(宮腔內見高回聲,大小4.8 cm×3.2 cm,形態不規則,邊界不清,回聲不均,周邊見少許血流信號)。盆腔磁共振:符合子宮內膜癌MRI,子宮前傾前屈位、位置右偏,子宮體積飽滿、內膜明顯增厚,結合帶局部模糊,顯示不清,子宮頸管-陰道區見斑片狀長T2信號,膀胱充盈、壁尚光滑。宮頸液基細胞學檢查:較多異型細胞及壞死,考慮腺癌。診刮病理:子宮內膜樣腺癌,余檢查未見異常,遂于全麻醉下行筋膜外全子宮+雙側附件切除+盆腔淋巴結清掃+卵巢動靜脈高位結扎術,術中探查:子宮增大如孕2個月大小,雙側附件未見異常,右側盆腔淋巴結可見增大。
1.2 方法 切除手術標本均經10%中性福爾馬林固定,常規脫水,石蠟包埋及切片,采用HE及免疫組化EnVision法染色,光鏡下觀察。一抗SMA、Caldesmon、desmin、vimentin、ER、PR、CD34、D2-40、HMB-45、Melan-A及Ki-67,均購自福州邁新公司。根據免疫組化標記不同,分別滴加相應的一抗,選取已知陽性切片為陽性對照,以PBS代替一抗為陰性對照,具體操作步驟按試劑盒說明書進行。
2 結果
2.1 眼觀 全切子宮+雙側附件切除標本:頸管內見一灰白色腫物,大小3.5 cm×3.3 cm×0.8 cm,切面灰白色,質脆,肉眼觀察腫物似侵及淺肌層,距灰白色腫物1.5 cm宮腔內見一大小5.5 cm×3 cm×3 cm腫物,質脆,肉眼觀察腫物似侵及淺肌層,肌壁間未見明顯結節及出血點,雙側附件未見明顯病變。
2.2 鏡檢 術后病理:子宮內膜呈高-中分化子宮內膜樣型腺癌改變(圖1)。雙側盆腔檢出淋巴結34枚,其中3枚淋巴結可見病變(左側2枚面積分別為0.3 cm×0.2 cm、0.2 cm×0.2 cm,右側1枚面積為0.5 cm×0.4 cm)。盆腔淋巴結髓質及近被膜處見多灶片狀分布的梭形細胞區,其向淋巴組織及淋巴結周邊呈浸潤性生長,與周圍組織邊界尚清晰(圖2)。梭形細胞區內見增生的瘤細胞,散在或束狀分布于血管結構的周圍,細胞形態溫和,呈梭形、圓形、多角形及上皮樣,胞質嗜酸性或透明狀,胞核圓形、卵圓形或短梭形,無明顯異型性,核分裂罕見。可形成竇樣不規則腔隙,內襯以扁平內皮細胞,偶見淋巴細胞灶分散在瘤細胞間,多為淋巴結殘骸(圖3)。
2.3 免疫表型 增生的LAM細胞表達SMA、Caldesmon(圖4)、desmin等肌源性抗體;vimentin陽性,部分瘤細胞PR、ER(圖5)均陽性;腔隙內襯細胞CD34和D2-40(圖6)均陽性;上皮樣瘤細胞HMB-45(圖7)陽性,Melan-A陰性,Ki-67增殖指數較低(<1%)。
2.4 病理診斷 子宮內膜高-中分化子宮內膜樣型腺癌,盆腔淋巴結LAM。
2.5 隨訪 患者子宮內膜樣腺癌IIIA期合并盆腔淋巴結LAM,目前患者術后2個月,恢復尚可,已行子宮內膜癌1個療程化療,有輕微脂肪肝,余全身檢查尚無異常發現,正在密切隨訪中。
3 討論
LAM由VonTsosse于1937年首次報道;1966年Cornog和Enterline將其正式命名為肺淋巴管肌瘤病(pulmonary lymphangioleiomyomatosis, PLAM)。2010年歐洲呼吸學會發布全球首部PLAM指南,我國對其認識較晚,自1986年首次報道PLAM以來,近30年文獻報道僅有130余例[2],肺外LAM則更是鮮有報道。目前認為LAM來源于血管周細胞,分為散發LAM和遺傳病結節性硬化癥相關肺淋巴管肌瘤病兩種,一般以散發病例為主。本例屬于散發病例。
3.1 臨床特點 LAM好發于育齡期女性,偶有男性發生的報道[3],成年女性散發LAM發病率約1/400 000。LAM常見于肺部,臨床表現為進行性呼吸困難、反復發作的自發性氣胸、胸腔積液和乳糜性胸水等。CT示雙肺彌漫性薄壁囊性類圓形低密度影,病灶分布均勻,部分囊壁邊緣可見血管影。肺外LAM臨床極其罕見,多見于縱膈、盆腹膜后的器官或組織等,表現為淋巴結腫大或能觸及包塊等,有時伴腹脹、惡心、乳糜腹水,近半數患者伴發血管平滑肌脂肪瘤,發生于腹部或盆腔者,CT示囊實性不規則軟組織腫塊,增強后實性部分明顯強化,囊性部分無強化,累及淋巴結者,可表現為腸系膜、縱膈、頸部、盆腔及腹股溝淋巴結廣泛腫大,本例患者因腹痛前來就診,術前診斷為子宮內膜癌,術中發現淋巴結腫大,行淋巴結清掃時無意發現患有LAM,無血管平滑肌脂肪瘤表現,肺部檢查無異常,為原發性盆腔LAM。
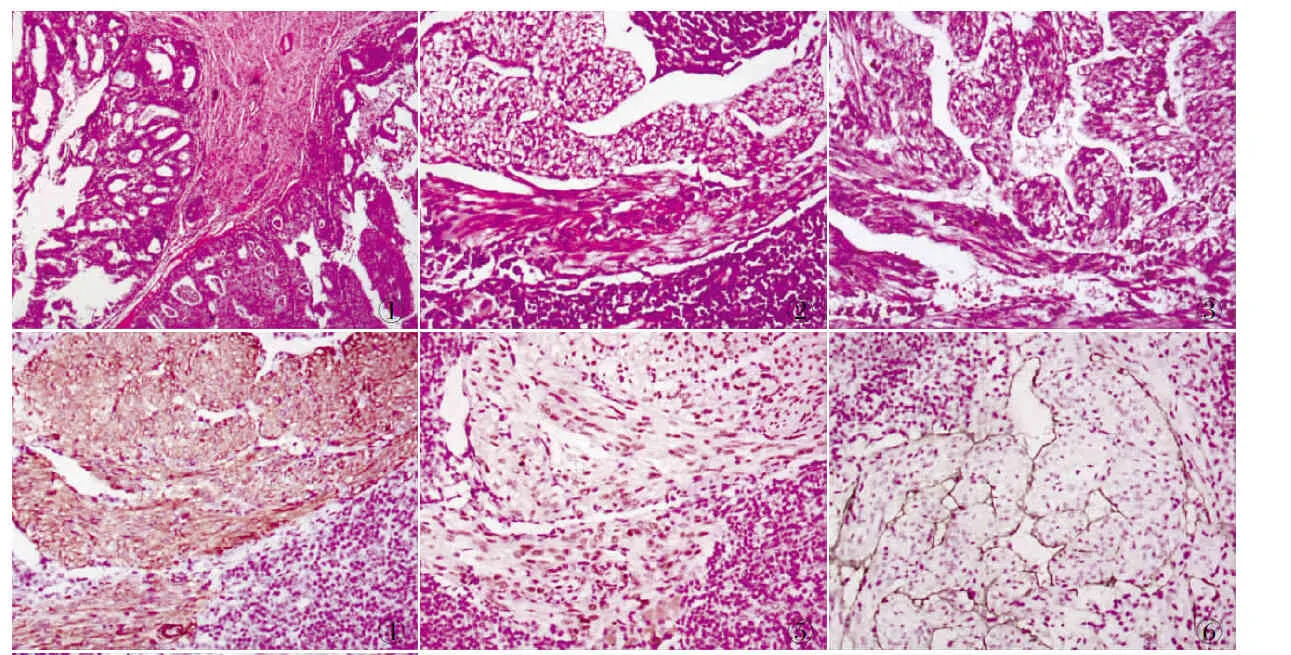

圖1 子宮內膜呈高-中分化子宮內膜樣型腺癌改變 圖2 淋巴結髓質及近被膜處見多灶片狀分布的梭形細胞區,其向淋巴組織及淋巴結周邊呈浸潤性生長,與周圍組織邊界尚清晰 圖3 梭形細胞區內見增生的瘤細胞,散在或束狀分布于血管結構的周圍,形成竇樣不規則腔隙,內襯以扁平內皮細胞,偶見淋巴細胞灶分散在瘤細胞間,多為淋巴結殘骸 圖4 LAM中Caldesmon呈陽性,EnVision法 圖5 LAM中部分瘤細胞ER呈陽性,EnVision法 圖6 LAM中腔隙內襯細胞D2-40呈陽性,EnVision法 圖7 LAM中HMB-45呈陽性,EnVision法
3.2 發生機制 目前,LAM病因及發病機制尚不明確,現普遍觀點有以下幾種。(1)LAM與TSC1及TSC2基因突變有關,TSC1編碼錯構素,而TSC2編碼馬鈴薯球蛋白,此兩種蛋白發生交互作用,結合成TSC1/TSC2復合體,是小GTP酶Rheb蛋白的抑制劑。發生LAM時,LAM細胞內TSC1/TSC2復合體功能喪失,刺激Rheb活化,從而影響哺乳動物雷帕霉素靶蛋白(mTOR)靶點失調,激活TSC-Rheb-mTOR-S6K1/4EBP1信號通路,促進腫瘤細胞生長與增殖[4-5]。(2)LAM發生與雌激素刺激有一定關系,Matsui等[6]報道LAM細胞上的ER、PR分布存在異常,而LAM的患者使用外源性雌二醇治療不孕癥后導致LAM病情惡化[7],說明該病與雌激素刺激有一定關系。此患者表現為高-中分化子宮內膜樣型腺癌,屬于Ⅰ型子宮內膜癌,為雌激素依賴型,大部分學者認為雌激素長期持續刺激是子宮內膜癌的發病因素之一,患者LMA中部分瘤細胞ER、PR均陽性,進一步證實雌激素在LMA中有一定作用,但具體機制尚不明確。本例雖同時存在子宮內膜癌和LMA,但致病因素卻相同。另外,患者多年不孕,且合并糖尿病及高血壓,與雌激素長期失調可能也存在一定關系。(3)LAM細胞通過降解細胞外基質促進LAM中網絡的形成[8],細胞外基質在維持細胞形態結構和功能完整性方面發揮重要作用。其主要成分為Ⅳ/Ⅶ型膠原、層粘連蛋白、蛋白聚糖等;其中,Ⅳ型膠原有六種α鏈。有研究者證實PLAM中Ⅳ型膠原中的α5減少或者缺失[9],因此諸如基質金屬蛋白酶(matrix metallo proteinases, MMP)等一些降解細胞外基質的蛋白可能在該過程中起一定作用,有文獻報道LAM中血清MMP-9表達升高[10],且MMP的抑制劑TIMP-3有所減少[11],在PLAM中會導致局部的蛋白水解酶和抑制蛋白酶的不平衡,使基膜的結構破壞,從而形成腔隙樣或囊性結構[12]。推測此過程與瘤細胞遷徙和轉移可能存在一定關系,但是在肺外LAM中此機制仍然有待明確。
3.3 病理特征 PLAM中肺泡破裂常形成多囊性改變,腫瘤細胞呈小巢狀或小簇狀分布于囊腔的邊緣或沿血管、淋巴管及細支氣管分布。盆腔淋巴結LAM中增生的細胞散在或束狀分布于血管結構的周圍,增生的LAM細胞之間有時可見淋巴細胞聚集灶。雖然發生部位有所不同,但總體來說LAM鏡下有兩種形態,一種為梭形肌纖維母細胞樣,可表達SMA、Caldesmon、desmin等肌源性抗體;另一種為多邊樣上皮樣特征,除表達肌源性抗體外,還可以表達HMB-45,HMB-45是惡性黑色素瘤特異的標記之一,此外還可以在血管平滑肌脂肪瘤、肺透明細胞瘤的細胞中表達,超微結構表明這些細胞由血管周細胞的前體衍變而來,從而更加證實包括LMA在內的上述疾病均屬血管周上皮樣細胞分化的腫瘤。HMB-45在該病發生、發展中的作用尚不清楚,眾多研究認為其為特征性病變,具有診斷意義,僅有較少病例中HMB-45呈陰性[13]。
3.4 鑒別診斷 LAM好發于肺部,原發于肺外者臨床罕見,患者常無明顯癥狀,有時因其他疾病進行診治時無意中發現,因此肺外LAM極易漏診和誤診,需與以下腫瘤鑒別。(1)血管平滑肌脂肪瘤:腫瘤內見不同比例的厚壁肌性血管、增生的平滑肌樣細胞和成熟脂肪組織,雖然免疫組化標記HMB-45及肌源性標記均陽性,但血管平滑肌脂肪瘤中成熟脂肪細胞可以表達S-100,大多數肌細胞及少數脂肪細胞有時可以表達CD117,另外形態上一般不形成腔隙樣結構,且厚壁血管及脂肪成分為LAM不具有的。(2)淋巴管瘤:可見大小不等相互吻合的囊腔,壁薄,內襯單層扁平上皮細胞,腔內充滿蛋白性液體,可見淡染的淋巴液和淋巴細胞,有時腔隙周圍可見不完整平滑肌組織,但是免疫組化標記HMB-45呈陰性。(3)多囊性間皮瘤:大小不等的薄壁囊腔,囊壁內襯細胞間皮和角蛋白標記均陽性,而LAM的囊腔內襯上皮CD34和D2-40均陽性。(4)孤立性纖維性腫瘤:由圓形或梭形細胞構成,胞質密集,界限不清,富于血管,血管形成“鹿角狀”,管腔大小不一,一般CD34、CD99及BCL-2均陽性。(5)平滑肌肉瘤:瘤細胞一般具有明顯的異型性,核分裂易見,細胞增殖活性高,多有壞死,梭形細胞不一定圍繞血管排列,且瘤細胞HMB-45呈陰性。
3.5 預后及治療 雖然LMA瘤細胞一般無明顯異型性,核分裂罕見,Ki-67增殖指數較低(<1%),形態表現為良性病變,但LAM呈進行性、持續性病程,瘤細胞可遷徙并轉移,形成新的病灶,故肺部LAM患者預后較差,自然病程一般為8~10年,死亡原因主要是呼吸衰竭、頑固性乳糜胸水、腹水引起的全身臟器衰竭。放、化療及糖皮質激素治療均無效,黃體酮治療和卵巢切除可不同程度緩解癥狀,最終需進行肺移植。散發于肺外的LAM一般局部切除后預后較好,但有學者指出部分肺外LAM在發病1~2年可發展為PLAM[14]。近年來,LAM作為低度惡性腫瘤的觀點逐步被國外廣大呼吸科及腫瘤科專家接受[15]。目前,LAM缺乏有效的治療方法,既往臨床主要采用細胞毒素劑、皮質甾類、抗雌激素進行治療,減緩病程進展速度,但其長期療效尚不能肯定。隨著對LAM分子發病機制的進一步揭示,MMP抑制劑多西環素、mTOR抑制劑、西羅莫司等分子靶向藥物被認為具有潛在的治療價值,是目前的研究熱點。子宮內膜樣腺癌合并盆腔原發淋巴結LAM臨床較為罕見,通過觀察其臨床資料、病理特征并復習相關文獻,為進一步分析LAM的機制及治療提供重要價值。
[1] Weiss S W, Goldblum J R. Enzinger and Weiss’s soft tissue tumors[M]. 薛衛成,方志偉, 主譯. 5版. 北京:北京大學醫學出版社, 2011:1144.
[2] 張龍舉,梁 毅,鐘小寧,等. 國內三十余年肺淋巴管肌瘤病130 例臨床與病理文獻復習分析[J]. 中國全科醫學, 2015,18(3):329-334.
[3] 楊文圣,胡君程,林搖蓁,等. 腸系膜淋巴管肌瘤病/淋巴管肌瘤1例及文獻復習[J].臨床與實驗病理學雜志, 2011,27(10):1136-1138.
[4] Martignoni G, Pea M, Reghelin D,etal. Molecular pathology of lymphangioleiomyomatosis and other perivascular epithelioid cell tumors[J]. Arch Pathol Lab Med, 2010,134(1):33-40.
[5] Glasgow C G, Steagall W K, Dasilva A. Lymphangioleiomyomatosis (LAM): molecular insights lead to targeted therapies[J]. Respir Med, 2010,104(Suppll):45-48.
[6] Matsui K, Takeda K, Yu Z X,etal. Downregulation of estrogen and progesterone receptors in the abnormal smooth muscle cells in pulmonary lymphangioleiomyomatosis following therapy. An immunohistochemical study[J]. Am J Respir Crit Care Med, 2000,161(3Pt1):1002-1009.
[7] Yano S. Exacerbation of pulmonary lymphangioleiomyomatosis by exogenous oestrogen used for infertility treatment[J]. Thorax, 2002,57:1085-1086.
[8] Moir L M. Lymphangioleiomyomatosis: current understanding and potential treatments[J]. Pharmacol Ther, 2016,158:114-124.
[9] Weckmann M, Moir L M, Heckman C A,etal. Lamstatin-A novel inhibitor of lymphangiogenesis derived from collagen IV[J]. Cell Mol Med, 2012,16:3062-3073.
[10] Zhe X, Yang Y, Jakkaraju S. Tissue inhibitor of metalloproteinase-3 downregulation in lymphangioleiomyomatosis[J]. Am J Respir Cell Mol Biol, 2003,28(4):504-511.
[11] Odajima N, Betsuyaku T, Nasuhara Y,etal. Matrix metalloproteinases in blood from patients with LAM[J]. Respir Med, 2009,103(1):124-129.
[12] Goncharova E A, Goncharov D A, Fehrenbach M,etal. Prevention of alveolar destruction and airspace enlargement in a mouse model of pulmonary lymphangioleiomyomatosis (LAM)[J]. Sci Transl Med, 2012,4(154):154ra134.
[13] 杜雪梅,昌搖紅,陳弈至,等. 淋巴管肌瘤病10例臨床病理分析[J]. 臨床與實驗病理學雜志, 2012,28(10):1146-1148.
[14] Matsuik, Tatsuguchi A, Valencia J,etal. Extrapulmonary lymphangioleiomyomatosis (LAM): clinicopathologic features in 22 cases[J]. Hum Pathol, 2000,31(10):1242-1248.
[15] McCormack F X, Travis W D, Colby T V,etal. Lymphangioleiomyomatosis: calling it what it is: a low-grade, destructive, metastasizing neoplasm[J]. Am J Respir Crit Care Med, 2012,186:1210-1212.
Endometrial endometrioid adenocarcinoma with lymphangiomyomatosis of pelvis lymph node: clinicopathological analysis
ZHU Lin1, ZHOU Li1, QIN Dong-rui1, CHI Ya-song2, MA Guang-zhen1
(1DepartmentofPathology,2DepartmentofGynecology,LiaochengtheSecondPeople’sHospital,Liaocheng252601,China)
Purpose To study the clinicopathological features of lymphangiomyomatosis(LAM)of pelvis lymph node. Methods A patient with endometrial endometrioid adenocarcinoma and LAM was analyzed including clinical data and pathological features. HE and immunohistoehemistry of EnVision stainings were used, and the literatures were reviewed. Results Well-moderately differentiated endometrioid adenocarcinoma could be observed in the endometrium. Proloferation of LAM cells were seen in the capsule and medulla of the pelvic lymph node. The LAM cell was spindle, epitheliod and polygonal cells with oxyphilic or clear cytoplasm which arranged surrounding lacunes. The LAM cells showed no atypia and mitosis could notseen. The tumor cells showed diffusely positive for SMA, Caldesmon, desmin, vimentin, ER and PR, the cells lining the lacunes were positive for CD34 and D2-40. The epitheliod cells were positive for HMB-45 and negative for Melan-A. The Ki-67 immunostaining showed a proliferation index of <1%. Conclusion LAM is an uncommon neoplastic multisystem disease that affects the lungs mostly. Endometrial endometrioid adenocarcinoma with LAM of pelvic lymph node is extremely rare. The diagnosis can be made according to the histological characteristics and immunohistochemical features. Moreover this conclusion will provide the clinicopathological materials for the future study about LAM.
endometrial neoplasm; lymphangiomyomatosis; lymphangiomyoma; pelvic lymph node
時間:2017-3-16 14:23
http://kns.cnki.net/kcms/detail/34.1073.R.20170316.1423.010.html
山東省聊城市第二人民醫院1病理科、2婦科 252601
朱 琳,女,碩士,主治醫師。Tel:(0635)2342343,E-mail: zhulin.kitty@163.com 馬廣貞,男,副主任醫師,通訊作者。E-mail: maguangzhen@163.com
R 737.33
A
1001-7399(2017)03-0278-05
10.13315/j.cnki.cjcep.2017.03.010
接受日期:2017-01-12

