嬰兒晚發型B族鏈球菌化膿性腦膜炎24例分析
喬凌燕,馬少春,李德華,于洪波,孫裕平
(青島大學附屬青島婦女兒童醫院,山東青島266000)
嬰兒晚發型B族鏈球菌化膿性腦膜炎24例分析
喬凌燕,馬少春,李德華,于洪波,孫裕平
(青島大學附屬青島婦女兒童醫院,山東青島266000)
目的 分析嬰兒晚發型B族鏈球菌(GBS)化膿性腦膜炎的特點、治療效果及轉歸情況,并與非GBS化膿性腦膜炎進行比較。方法 GBS化膿性腦膜炎患兒24例納入GBS組,以同期收治的21例非GBS化膿性腦膜炎患兒作為對照組,收集兩組患兒的的臨床表現、實驗室檢查結果、影像學檢查結果、治療轉歸及預后資料并比較。結果 兩組常見表現為發熱、喂養困難、反應差、氣促呻吟等。GBS組患兒外周血CRP高于對照組(P<0.01),腦脊液葡萄糖水平低于對照組(P<0.05),GBS組合并輕中度貧血比例高于對照組(P<0.05)。GBS組頭顱MRI檢查發現并發癥發生率高于對照組(P<0.05)。GBS組采用青霉素類聯合頭孢曲松治療4例,余均予萬古霉素聯合三代頭孢或美羅培南治療;對照組選擇三代頭孢、美羅培南或萬古霉素治療。GBS組患兒住院時間、腦脊液葡萄糖水平恢復正常所需時間較對照組延長(P均<0.05)。隨訪2個月~3.5年,GBS組生長發育基本正常7例、運動發育落后8例、癲癇發作1例、放棄治療后死亡3例、失訪5例。對照組生長發育基本正常8例、運動發育落后4例、癲癇發作2例、放棄治療后死亡4例、失訪3例。兩組預后情況差異無統計學意義。結論 晚發型GBS化膿性腦膜炎臨床表現無特異性,與非GBS化膿性腦膜炎相比更易合并貧血、治療周期長、并發癥發生率較高。
B族鏈球菌;化膿性腦膜炎;晚發型B族鏈球菌化膿性腦膜炎;貧血;并發癥;嬰兒
B族鏈球菌(GBS)又稱無乳鏈球菌,是一種β溶血性革蘭陽性鏈球菌,所引起的感染根據發病時間分為早發型和晚發型,其中,晚發型為出生后7~89 d發病[1]。西方國家對GBS感染的報道較早、較多,自2001年美國兒科年會制定《早發型GBS感染預防及治療指南》以來,早發型GBS腦膜炎的發病率及病死率已大幅降低[2],然而晚發型GBS腦膜炎仍是3個月齡內嬰兒化膿性腦膜炎的重要病原菌[3,4]。近年來國內對新生兒早發型GBS感染的報道日益增多[5,6],但對晚發型GBS腦膜炎的關注還遠遠不夠,多樣本病例報道也較少。本研究回顧性分析了2012年1月~2016年1月確診的24例晚發型GBS腦膜炎患兒的臨床資料并與非GBS化膿性腦膜炎進行比較,以期幫助兒科醫生了解該病的特點、治療效果及轉歸情況。
1 資料與方法
1.1 研究對象 晚發型GBS化膿性腦膜炎[7]患兒24例(GBS組),男18例、女6例,胎齡(37.0±2.7)周,出生體質量(3.27±0.42)kg,發病日齡(35.3±20.0)d,經陰產14例,胎膜早破7例,母乳喂養14例。選取同期住院的21例同年齡段非GBS化膿性腦膜炎患兒作為對照組,男15例、女6例,胎齡(35.8±2.5)周,出生體質量(3.21±0.50)kg,發病日齡(32.6±21.5)d,經陰產10例,胎膜早破4例,母乳喂養10例。兩組患兒性別比例、胎齡、出生體質量、母乳喂養比例、發病日齡、經陰產比例、胎膜早破比例等資料差異無統計學意義(P>0.05)。
1.2 資料收集方法 收集兩組患兒的臨床表現、實驗室檢查結果、影像學檢查結果、治療與轉歸及預后等資料。
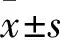
2 結果
2.1 臨床表現 GBS組最常見的表現為發熱(21/24),其次為喂養困難(13/24)及反應差(10/24);對照組最常見的表現為發熱(14/21)、反應差(11/21)、氣促呻吟(9/21)。兩組臨床表現差異無統計學意義(P>0.05)。見表1。

表1 兩組患兒臨床表現比較(例)
2.2 實驗室檢查結果 GBS組患兒外周血CRP高于對照組(P<0.01),腦脊液葡萄糖水平低于對照組(P<0.05),GBS組合并輕中度貧血比例高于對照組(分別為70.8%、28.6%,P<0.05)。見表2。
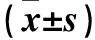
表2 兩組患兒外周血WBC、CRP及腦脊液葡萄糖和蛋白水平比較
注:與對照組相比,*P<0.01,#P<0.05。
2.3 頭顱MRI檢查 GBS組行頭顱MRI檢查19例,15例(78.9%)發現存在并發癥,其中硬膜下積液(膿)10例、多發腦軟化灶3例、蛛網膜下腔出血1例、雙側腦室管膜炎1例;對照組患兒行頭顱MRI檢查18例,6例(33.3%)發現存在并發癥,其中硬膜下積液4例、多發腦軟化灶2例。GBS組頭顱MRI檢查發現并發癥發生率高于對照組(P<0.05)。
2.4 治療與轉歸 根據藥敏試驗結果,GBS組患兒病原體均為GBS,采用青霉素類聯合頭孢曲松治療4例,余均予萬古霉素聯合三代頭孢或美羅培南治療;對照組病原體包括大腸埃希菌14例、李斯特菌3例、肺炎克雷伯菌2例、金黃色葡萄球菌1例、肺炎鏈球菌1例,選擇三代頭孢、美羅培南或萬古霉素治療。GBS組住院時間及腦脊液葡萄糖水平恢復正常所需時間較對照組延長(P均<0.05)。見表3。
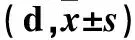
表3 兩組患兒轉歸情況比較
注:與對照組相比,#P<0.05。
2.5 預后情況 隨訪2個月~3.5年,GBS組生長發育基本正常7例、運動發育落后8例、癲癇發作1例、放棄治療后死亡3例、失訪5例。對照組生長發育基本正常8例、運動發育落后4例、癲癇發作2例、放棄治療后死亡4例、失訪3例。兩組預后情況差異無統計學意義。
3 討論
晚發型GBS化膿性腦膜炎多發生于生后1周~3個月的足月兒,常起病隱匿,約90%由血清型Ⅲ型引起[8,9],由垂直傳播、院內感染、家庭接觸或其他因素所致。國外一項前瞻性隊列研究發現,6%的患兒母親有GBS乳腺炎、64%的患兒母親存在GBS直腸部位感染[10]。本研究GBS組有14例系經陰產,14例系母乳喂養,考慮感染可能與母親GBS定植有關。對于晚發型GBS感染的預防,學界普遍認為GBS疫苗是減少母體定植、預防母嬰傳播的最有效工具,但目前仍在研究階段,臨床上尚未推廣使用[11,12]。
本研究發現,晚發型GBS化膿性腦膜炎缺乏特異性臨床表現,絕大多數以發熱為主要癥狀,其次為喂養困難、反應差、抽搐等,可能因嬰兒前囟和顱縫的緩沖作用,腦膜刺激征和顱內壓增高癥狀并不顯著。與對照組相比,GBS組患兒呈現外周血CRP明顯升高、腦脊液葡萄糖水平明顯降低的特點。故兒科醫生對外周血CRP顯著增高或腦脊液葡萄糖降低顯著的化膿性腦膜炎患兒應高度警惕GBS感染[13]。我們體會,GBS化膿性腦膜炎治療初期腦脊液白細胞數、葡萄糖及蛋白含量改善明顯,但后期白細胞數及蛋白含量改善緩慢,不少病例甚至不降反升,治療棘手。分析原因:抗生素通過嬰兒血-腦屏障能力較差,不能完全清除細菌,同時,治療后期腦脊液白細胞計數偏高可能系感染后炎癥反應,炎癥反應導致毛細血管通透性增高、蛋白質滲出,引起腦脊液蛋白水平升高,而非感染未得控制,此時是否仍有必要繼續應用抗生素至腦脊液白細胞計數及蛋白水平恢復正常值得商榷。本研究結果顯示,GBS組住院時間和腦脊液葡萄糖水平恢復時間均較對照組延長,其中GBS組住院天數超過35 d者18例,造成住院時間延長的主要原因與顱內感染控制困難及并發癥出現有關[14]。臨床實踐中發現,晚發型GBS化膿性腦膜炎患兒病程中并發貧血比例高于非GBS化膿性腦膜炎(分別為70.8%、28.6%),且往往于復查腦脊液白細胞數下降緩慢甚至不降反升時出現,這類病例外周血血紅蛋白亦呈降低趨勢。對于貧血嚴重者給予輸注洗滌紅細胞有利于腦脊液指標恢復。
目前較多文獻[15~17]報道,根據藥敏試驗,GBS對青霉素及萬古霉素敏感率在90%以上,對氯霉素不敏感,故大多學者推薦大劑量青霉素作為治療GBS腦膜炎的首選藥物。然而臨床工作中發現,抗生素體內實際療效與體外藥敏試驗存在一定差異,本研究GBS組中有4例入院后初始給予青霉素類及易透過血腦屏障的頭孢曲松抗感染治療,藥敏試驗提示這兩種抗生素均敏感,但腦脊液白細胞計數較前反而升高、葡萄糖水平降低,后予萬古霉素治療后病情明顯好轉,與國內相關報道[7,18,19]一致,這可能與國內青霉素類及頭孢曲松耐藥率較高有關。本研究中2例病程超過60 d的GBS組患兒在萬古霉素基礎上使用氯霉素后腦脊液指標好轉,且未出現明顯不良反應,考慮與氯霉素在腦脊液中濃度較高有關。但氯霉素不良反應較重,使用前需權衡利弊,獲家屬知情同意,同時需嚴密監測血常規及肝腎功能等。
我們對比分析了兩組患兒頭顱MRI檢查結果,結果顯示GBS組MRI檢查發現并發癥發生率明顯高于對照組,其中以硬膜下積液(膿)最為常見。有學者[20]報道,硬膜下積液量少者可不予特殊處理,積液量多且無其他并發癥者可定期穿刺放液,硬膜下積膿者即使無顱內高壓表現也要進行硬膜下穿刺并注入抗生素。本研究中GBS組隨訪期間生長發育基本正常7例,10例硬膜下積液(膿)患兒出院3個月內復查頭顱MRI均提示積液量明顯減少或消失,其中1例硬膜下積膿病例予鉆孔引流術并局部用藥,隨訪近兩年預后良好、無復發,與既往報道相比預后較好,考慮與早期積極聯用敏感抗生素、合理應用激素、完善搶救措施及恢復期積極康復訓練有關,但遠期預后尚需進一步隨訪。
總之,晚發型GBS化膿性腦膜炎臨床表現無特異性,與非GBS化膿性腦膜炎相比更易合并貧血、治療周期長、并發癥發生率較高。因此,產前預防、早期發現并給予及時有效的治療非常重要。
[1] Edmond KM, Kortsalioudaki C, Scott S, et al. Group B Streptococcal disease in infants aged younger than 3 months: systematic review and meta-analysis[J]. Lancet, 2012,379(9815):547-556.
[2] 仝凈凈.新生兒B族鏈球菌感染預防策略的研究進展[J].中國當代兒科雜志,2014,16(10):1075-1080.
[3] Berardi A, Rossi C, Lugli L, et al. Group B Streptococcus late-onset disease: 2003-2010[J]. Pediatrics, 2013,131:361-368.
[4] 羅俊,馬麗亞,徐芬,等.新生兒晚發型B族鏈球菌敗血癥臨床特征及預后分析[J].臨床兒科雜志,2013,31(9):805-808.
[5] 鄭直,黃靜.新生兒早發型B族鏈球菌敗血癥12例臨床分析[J].中國小兒急救醫學,2014,21(3):161-163.
[6] 龍艷明,賴穎瑜,李亞慧.新生兒B族鏈球菌敗血癥16例臨床分析[J].中國小兒急救醫學,2014,21(7):447-448.
[7] 朱敏麗,朱將虎,李海靜,等.新生兒B族鏈球菌腦膜炎13例臨床分析和隨訪[J].中華兒科雜志, 2014,21(2):101-103.
[8] Dangor Z, Lala SG, Cutland CL, et al. Burden of invasive group B Streptococcus disease and early neurological sequelae in South African infants[J]. PLoS One, 2015,10(4):e123014.
[9] 鞠慧群,貝斐,孫建華.B族鏈球菌感染所致新生兒化膿性腦膜炎臨床特點分析[J].中國新生兒科雜志,2016,31(3):178-181.
[10] Berardi A, Rossi C, Lugii L, et al. Group B Streptococcus late-onset disease: 2003-2010[J]. Pediatrics, 2013,131(2):e361-368.
[11] Edwards MS. Group B streptococcal conjugate vaccine: a timely concept for which the time has come [J]. Hum Vaccine, 2008,4:444-448.
[12] Kim SY, Russell LB, Park J, et al. Cost-effectiveness of a potential group B streptococcal vaccine program for pregnant women in South Africa[J]. Vaccine, 2014,32(17):1954-1963.
[13] 宋亞娟,石磊,張志昱.全程C-反應蛋白用于兒童急性細菌性腦膜炎診斷價值研究[J].中國實用兒科雜志,2013,28(8):620-621.
[14] 趙寧,王萍,魏謀,等.無乳鏈球菌致新生兒腦膜炎的臨床特點分析[J].中國小兒急救醫學,2015,22(3):177-179.
[15] Garland SM, Cottrill E, Markowski L, et al. Antimicrobial resistance in group B Streptococcus: the Australian experience [J]. J Med Microbiol, 2011,60:230-235.
[16] 陳海兒,陳群英,張慧萍.無乳鏈球菌213株標本分布及耐藥性分析[J].中華藥物與臨床,2013,13:252-254.
[17] 劉志勇,許景林,王瑞泉,等.新生兒B族鏈球菌敗血癥33例臨床分析[J].中國小兒急救醫學,2016,23(4):248-251.
[18] 雷梅芳,張玉琴,郭靜. B族鏈球菌相關小嬰兒化膿性腦膜炎22例臨床分析[J].中國實用兒科雜志,2015,30(9):696-700.
[19] 楊歡歡,李菁.新生兒無乳鏈球菌敗血癥合并腦膜炎12例臨床分析[J].臨床兒科雜志,2016,34(3):181-184.
[20] 鄭華,蘇穎,董慶華.化膿性腦膜炎合并硬膜下積液80例分析[J].中華兒科雜志,2002,40(4):196-198.
山東省醫藥衛生科技發展計劃項目(2015WS0356)。
孫裕平(E-mail: sunyuping999@163.com)
10.3969/j.issn.1002-266X.2017.15.024
R725
B
1002-266X(2017)15-0080-03
2017-01-02)

