白樺五個MYB轉錄因子的生物信息學分析
金秋++楊淼++史美葳++任如意++魏繼承

摘要:在白樺(Betula platyphylla Suk.)轉錄組數據庫中獲得5個MYB轉錄因子,將其進行蛋白質分子量與等電點、核定位信號、跨膜結構域和蛋白保守結構域預測,并與擬南芥的MYB蛋白質進行氨基酸序列比對分析和系統樹構建。結果表明,白樺的5個MYB轉錄因子都屬于R2R3-MYB類蛋白;系統進化樹表明白樺的5個MYB轉錄因子與擬南芥抗逆相關的MYB轉錄因子親緣關系較近,而與非抗逆相關的轉錄因子親緣關系較遠,說明白樺的5個MYB轉錄因子可能具有植物抗逆相關功能。
關鍵詞:白樺(Betula platyphylla Suk.);MYB轉錄因子;逆境脅迫
中圖分類號:S792.153;Q78 文獻標識碼:A 文章編號:0439-8114(2017)09-1759-04
DOI:10.14088/j.cnki.issn0439-8114.2017.09.040
Bioinformatics Analysis of Five MYB Transcription Factors from Betula piatyphylla Suk.
JIN Qiu,YANG Miao,SHI Mei-wei,REN Ru-yi,WEI Ji-cheng
(College of Life Sciences and Technology,Mudanjiang Normal University,Mudanjiang 157011,Heilongjiang,China)
Abstract:5 candidate MYB transcription factors were obtained from Betula platyphylla Suk. transcriptome datebase. The theoretical molecular weight(MW), isoelectronic point(pI), nuclear localization signal,transmembrane domain and amino acid conserved domain of 5 MYB transcription factors were predicted, amino acid sequence alignment and phylogenetic tree were contructed with the MYB transcription factors from Arabidopsis. The results indicated that 5 MYB transcription factors of birch were all belonged to R2R3 type MYB members according to amino acid sequence alignment. Phylogenetic construction showed that the 5 MYB transcription factors of birch were closely with MYB transcription factors related to stress resistance from Arabidopsis, which suggested that the 5 birch MYB members may function in stress resistance.
Key words:Betula platyphylla Suk.;MYB transcription factors;stress resistance
MYB(v-myb avian myeloblastosis viral oncogene homolog)轉錄因子參與植物生長發育、形態建成以及非生物脅迫等多種生物學過程。MYB轉錄因子在防蟲、耐高低溫、干旱、高鹽、調節開花轉型關鍵基因表達以及調控植株主根伸長通路等過程中起重要作用[1]。它是植物界轉錄因子家族成員之一,對植株抗逆性起關鍵作用[2]。研究發現,GhMYB11基因在黃萎病菌侵染,鹽、干旱和氧化脅迫反應處置后的棉花新苗葉片中表達明顯上調,表明GhMYB11基因在棉花生物和非生物脅迫反應中起關鍵作用[3]。GmMYB042基因在大豆的莖、根、根瘤、種子、花和莢果皮中均有表達,且在大豆中受到PEG、低溫、高鹽和輻射的誘導[4]。木薯R2R3-MYB類轉錄因子MeMYB63在葉面上有高強度抗旱反應,說明該基因對干旱脅迫誘導下的表達調控起關鍵作用[5]。水稻R2R3-MYB類鹽脅迫表明OsMPS基因有調控植物激素和細胞壁合成的功效,該基因的表達受多種植物激素的誘導[6]。擬南芥AtMYB13基因受激素誘導后強烈表達,能夠提高轉基因擬南芥對病原細菌(PstDC3000)的基本防衛反應。MYB15蛋白可以結合CBF基因啟動子的MYB元件,繼而調控抑制低溫相關基因的表達[7]。擬南芥AtMYB73基因可以通過影響水楊酸和茉莉酸抵抗病原菌丁香假單孢桿菌和核盤菌,從而在干旱脅迫中發揮作用[8]。AtMYB44在HrpNEa調控擬南芥預防桃蚜過程中起重要作用[9]。AtMYB44基因通過E1N2調控擬南芥對桃蚜與菜蛾的抗蟲性[9]。鄭博[10]通過基因槍轉化技術把擬南芥的AtMYB44基因轉導到揚麥158中,得到擁有良好耐寒、耐旱和抗鹽堿的優質轉基因小麥。MYB轉錄因子在紅根甘肅桃抗根結線蟲機制中能夠經過調控苯丙烷代謝途徑增長紅根甘肅桃根部花色素苷和其余類黃酮物質的含量,從而抵抗根結線蟲侵染[11]。多年生黑麥草3個轉錄因子LpMYB1、LpMYB2和LpMYB3參與黑麥草對紫外、干旱、高鹽脅迫的應答和形態建成[12]。目前,MYB轉錄因子對植物作用的分子機理還不完全清楚。
白樺(Betula platyphylla Suk.)為樺木屬落葉喬木,可用于建筑、園林觀賞以及保健藥用等方面。隨著對白樺研究的不斷深入,其潛在經濟市場價值也不斷被發掘。本研究首先利用擬南芥數據庫找到與植物抗逆相關的MYB轉錄因子,然后到白樺數據庫中進行比對,找到相似性最高的白樺MYB轉錄因子,進行氨基酸序列比對以及系統樹構建,推測白樺的MYB基因的抗逆性,從而為下一步深入研究白樺的MYB基因的功能提供基礎研究數據。
1 材料與方法
1.1 試驗軟件和生物信息學網站
計算5種白樺MYB轉錄因子的理論分子量和等電點登錄http://www.expasy.org/tools/protparam.html,核定位信號和跨膜域的預測利用Server 2.0軟件(http://bioinfo.tsinghua.edu.cn/SubLoc/),蛋白保守結構域預測采用NCBI(http://www.ncbi.nlm.nih.gov/),數據分析所用軟件為BioEdit和MEGA 5.1,MYB轉錄因子數據下載和DNA序列翻譯成蛋白序列采用TAIR-Home-Page(https://www.arabidopsis.org/)、Home(http://birch.genomics.cn/page/species/index.jsp)。序列在線處理登錄http://www.bio-soft.net/sms/。
1.2 試驗方法
1.2.1 白樺MYB氨基酸序列的獲得 從擬南芥數據庫里找到一些抗逆相關的轉錄因子,將其輸入到白樺基因組數據庫中Home(http://birch.genomics.cn/page/species/index.jsp)進行比對,找到同源性最高的白樺MYB序列,然后使用序列處理在線工具包(http://www.bio-soft.net/sms/)進行翻譯得到白樺MYB氨基酸序列。
1.2.2 白樺MYB轉錄因子的特征分析 預測白樺5個MYB轉錄因子的理論分子量和等電點登錄http://www.expasy.org/tools/protparam.html。通過SbLocv1.0、TMHMM server 2.0軟件(http://bioinfo.tsinghua.edu.cn/SubLoc/)預測白樺5個MYB轉錄因子的核定位信號和跨膜結構域。
1.2.3 白樺MYB氨基酸序列NCBI比對 將白樺MYB氨基酸序列輸入到NCBI網站(http://www.ncbi.nlm.nih.gov/)上進行保守結構域分析。
1.2.4 白樺MYB氨基酸序列的多重序列比對分析 采用Bio Edit軟件對白樺MYB氨基酸序列和擬南芥抗逆相關的氨基酸序列進行多重序列比對分析,進行白樺基因與擬南芥抗逆基因的同源性比較。
1.2.5 系統發育樹的構建 采用MEGA 5.1軟件將白樺MYB氨基酸序列和擬南芥抗逆相關的MYB氨基酸序列進行系統發育樹構建,并以擬南芥非抗逆相關的MYB氨基酸序列為外群,通過系統進化親緣關系遠近預測白樺MYB轉錄因子的功能。
2 結果與分析
2.1 白樺MYB轉錄因子的基因特征
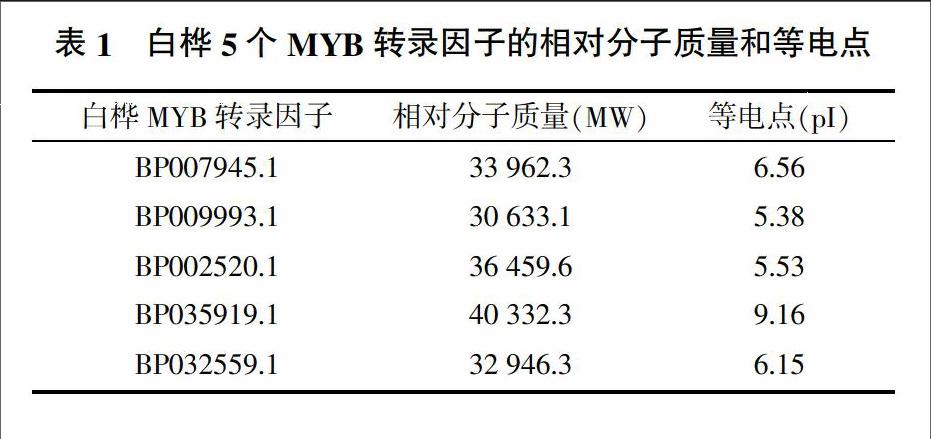
白樺5個MYB轉錄因子的相對分子質量和等電點如表1所示。將白樺5個MYB轉錄因子進行核定位信號預測,結果顯示BP007945.1、BP009993.1、BP002520.1和BP032559.1屬于核蛋白,BP035919.1屬于細胞質蛋白。
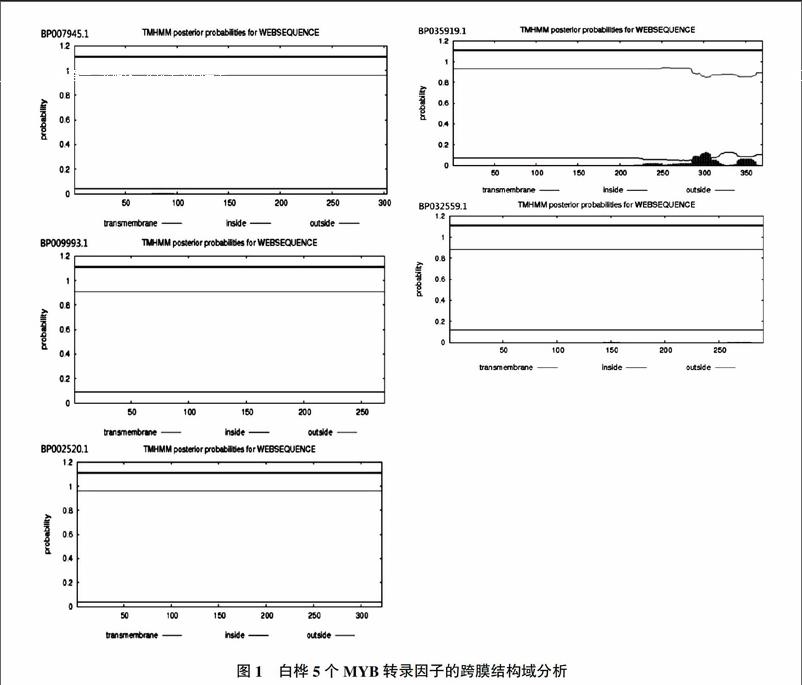
跨膜域預測分析如圖1所示。從圖1中可以看到,BP007945.1、BP009993.1、BP002520.1和BP032559.1無跨膜結構域,而BP035919.1有跨膜結構域。
2.2 白樺MYB轉錄因子的保守結構域分析
在NCBI上將白樺的5個MYB轉錄因子進行保守結構域分析,結果如圖2所示,BP007945.1在白樺氨基酸序列的17~60位和70~113位各有一個高度保守的SANT結構域;BP009993.1在白樺氨基酸序列的18~60位和70~113位各有一個高度保守的SANT結構域;BP002520.1在白樺氨基酸序列的20~62位和72~113位各有一個高度保守的SANT結構域;BP035919.1在白樺氨基酸序列的17~60位和70~111位各有一個高度保守的SANT結構域,同時在224~285位和224~340位各存在一個類似RNA酶(RNase_H_like)的家族保守結構域;BP032559.1在白樺氨基酸序列的17~60位和69~108位各存在一個高度保守的SANT結構域;白樺5個MYB轉錄因子具有這些保守結構域說明他們都屬于典型的SANT家族基因。
2.3 白樺MYB氨基酸序列比對分析
通過Bio Edit軟件對白樺5個R2R3型MYB轉錄因子氨基酸序列進行同源性分析,結果見圖3。如圖3所示,這5個MYB轉錄因子與擬南芥的AtMYB93和AtMYB74都具有典型的R2R3-MYB結構域。
2.4 系統進化樹分析
為了研究白樺MYB蛋白質的進化關系,用MEGA 5.1軟件構建了MYB轉錄因子蛋白質的進化樹,結果(圖4)表明,BP007945.1與擬南芥AtMYB60距離最近,之后與AtMYB96聚在一起;BP009993.1與擬南芥AtMYB13和AtMYB14距離最近,其次與AtMYB15聚在一起;BP002520.1與擬南芥AtMYB72距離最近,之后AtMYB10聚在一起;BP035919.1與擬南芥AtMYB8距離最近,之后再與AtMYB12聚在一起。從聚類關系可以看出,白樺的5個MYB轉錄因子與擬南芥抗逆相關基因親緣關系較近,與非抗逆基因MYB46和AtMYB2、AtMYB62等抗逆基因親緣關系較遠,說明這白樺這5個MYB轉錄因子可能具有抗逆性。
3 小結與討論
本試驗通過白樺5個MYB轉錄因子氨基酸序列與擬南芥的MYB轉錄因子比對,經過軟件Bio Edit和MEGA 5.1分析,構建系統進化樹,結果表明白樺的5個R2R3型MYB轉錄因子可能具有抗逆性。水稻OsmB3R-2基因在擬南芥中過表達后轉基因植株對凍害、干旱和高鹽的耐受性顯著提高[6]; Rahaie等[13]研究證明小麥TaMYBsduI轉錄因子是高鹽和干旱脅迫下的調控子,MdSIMYB1過表達能增強轉基因小麥抗逆境能力。可見,MYB轉錄因子在植物的生長發育過程中起著重要的調控作用。
參考文獻:
[1] 田雙梅.進擬南芥轉錄因子AtMYB44促抗病耐熱及抑制開花作用[D].南京:南京農業大學,2012.
[2] 劉 蕾,杜 海,唐曉鳳,等.MYB轉錄因子在植物抗逆脅迫中的作用及其分子機理[J].遺傳,2008,30(10):1265-1271.
[3] 李 菲,柳展基,王立國,等.棉花轉錄因子基因(GhMYB11)的克隆與表達分析[J].農業生物技術學報,2015,23(2):161-169.
[4] 杜 海,冉 風,馬珊珊,等.GmMYB042基因對類黃酮生物合成調控作用[J].作物學報,2016,42(1):1-10.
[5] 榮 晶.木薯干旱脅迫相關R2R3-MYB轉錄因子MeMYB63的基因特性及啟動子分析[D].海口:海南大學,2014.
[6] SCHMIDT R,SCHIPPERS J H,MIEULET D,et al.MULTIPASS,a rice R2R3-type MYB transcription factor,regulates adaptive growth by integrating multiple hormonal pathways[J].Plant J,2013,76(2):258-273.
[7] 許 瑞.RNA介導的啟動子DNA甲基化在調控擬南芥鹽脅迫應答中的作用研究[D].濟南:山東農業大學,2010.
[8] 徐 鈺.轉錄因子AtMYB13抑制擬南芥防衛反應的研究[D].南京:南京農業大學,2009.
[9] 呂貝貝.MYB44對HrpNEa誘導擬南芥抗蟲防衛信號傳導的調控作用[D].南京:南京農業大學,2012.
[10] 鄭 博.基因槍法介導擬南芥AtMYB44基因轉化小麥的研究[D].合肥:安徽大學,2013.
[11] 魏 瀟.紅根甘肅桃抗根結線蟲相關MYB轉錄因子基因的克隆與定位[D].北京:中國農業科學院,2010.
[12] 凌 瑤,李成磊,吳 琦.多年生黑麥草MYB轉錄因子基因的克隆及序列分析[J].河南農業科學,2012,41(8):171-176.
[13] RAHAIE M,XUE G P,NAGHAVI M R,et al. A MYB gene from wheat (Trhicum aestivvm L.) is up-regulated during salt and drought stresses and differentially regulated between salt-tolerant and sensitive genotypes[J].Plant Cell Reports,2010(29):835-844.

