鹽生植物小花堿茅CYP86A基因的RNAi載體構建
王沛,崔彥農,高麗,王鎖民*
?
鹽生植物小花堿茅CYP86A基因的RNAi載體構建
王沛1,2,崔彥農1,高麗1,王鎖民1*
(1.草地農業生態系統國家重點實驗室,蘭州大學草地農業科技學院,甘肅 蘭州 730020;2.西南民族大學青藏高原研究院,四川 成都 610041)
拒鹽型鹽生植物小花堿茅根系具有高度木栓化的內皮層可能是其抵御鹽脅迫的重要策略之一。本研究以鹽脅迫下小花堿茅幼苗的根為材料,采用RT-PCR方法擴增到木栓質生物合成關鍵基因CYP86A的RNAi靶片段,以中間載體pHANNIBAL和植物表達載體pART27為基礎,采用酶切連接結合In-Fusion的克隆方法成功構建了以35S啟動子驅動,含PtCYP86A基因片段反向重復序列的RNAi植物表達載體pARC,為利用RNAi技術深入探究根系木栓化在小花堿茅拒鹽中的功能奠定基礎。
小花堿茅;木栓質;PtCYP86A;RNAi載體構建
鹽生植物在長期適應逆境的過程中形成了較甜土植物更為強大的耐鹽結構和生理機制,蘊藏著更豐富高效的抗逆基因資源。小花堿茅(Puccinelliatenuiflora)是一種優良的牧草,同時因具有很強的耐鹽堿能力在改良作物抗性方面擁有巨大的潛力[1-3]。本課題組前期研究表明,限制根部Na+單向內流以減少Na+的凈積累,從而維持很高的K+、Na+選擇性是小花堿茅主要的耐鹽機制[4]。此外,Peng等[5]通過對小花堿茅根橫切面的X射線微區分析發現,Na+主要分布在內皮層細胞間隙,而K+主要分布在細胞內。解剖學研究也發現小花堿茅在鹽脅迫下內皮層明顯加厚[6-8]。因此,其高度木栓化的內皮層可能是阻斷Na+從皮層進入中柱的關鍵。
木栓質在內皮層細胞壁的內表面沉積形成木栓層(suberin lamella),是植物根系兩種重要的質外體屏障之一[9-10]。木栓質能有效阻止水分和溶質離子從質外體直接運輸到內皮層原生質體,因此影響離子在根中跨細胞途徑的徑向運輸,其屏障作用可能比凱氏帶更有效[11-13]。C16~C20的ω-羥基化脂肪酸和α,ω-雙羧基脂肪酸(簡稱α,ω-二酸)是構成木栓質的主要單體,是脂肪酸在細胞色素P450 ω-羥化酶(P450)的催化下形成的衍生物[14-19]。在擬南芥(Arabidopsisthaliana)和馬鈴薯(Solanumtuberosum)中分別證實了CYP86A1及其同源基因CYP86A33在木栓質單體合成中的重要作用[20-21]。
鑒于此,本研究在已克隆到的PtCYP86A基因序列的基礎上,構建了以PtCYP86A基因為靶標的RNAi植物表達載體,以期為深入分析PtCYP86A在小花堿茅拒鹽中的功能與作用奠定基礎。
1 材料與方法
1.1 實驗材料
植物材料為4周齡小花堿茅幼苗,種子、中間載體pHANNIBAL菌保、植物表達載體pART27菌保為蘭州大學牧草逆境生理與基因工程實驗室保存。試驗時間為2013年5-10月。
1.2 主要試劑
RNAprep Pure植物總RNA提取試劑盒、DNA marker購自北京天根,M-MuLV第一鏈cDNA的合成試劑盒、UNIQ-10柱式DNA膠回收試劑盒、SanPrep柱式質粒小量抽提試劑盒購自上海生工,Phusion高保真DNA聚合酶購自美國Thermo公司,普通Taq酶、In-Fusion HD Cloning Kit、pMD19-T simple vector、T4 DNA連接酶以及各種限制性內切酶購自大連寶生物,大腸桿菌DH5α感受態細胞購自北京全式金,其他生化試劑均為進口或國產分析純產品。
1.3 研究方法
1.3.1 材料培養 小花堿茅種子播撒于鋪有吸水紙的紗網架上,置于白瓷盤中進行暗培養,待種子發芽整齊后澆灌1/2 Hoagland營養液[4]。約5 d更換一次營養液。培養室溫度為25 °C,光照16 h/d,光強約為600 μmol/(m2·s),空氣相對濕度控制在60%~80%。
1.3.2 總RNA的提取及cDNA第一鏈的合成 用150 mmol/L NaCl處理4周齡小花堿茅幼苗24 h,取其根系,加入液氮磨至粉末狀,按照RNAprep Pure植物總RNA提取試劑盒的操作說明書提取總RNA,按照M-MuLV第一鏈cDNA合成試劑盒進行反轉錄反應。
1.3.3PtCYP86A基因RNAi靶位片段的擴增 參照Serra等[21]RNAi 靶片段的選擇以及invitrogen網站的設計軟件,選取1083~1620 bp (共538 bp)區段作為RNAi靶位區段,設計一對特異性引物并在上游引物上分別引入酶切位點XhoⅠ (C1-F)和XbaⅠ (C2-F),下游引物上分別引入酶切位點KpnⅠ(C1-R)和Hind Ⅲ(C2-R),分別進行PCR擴增。引物序列如下:
C1-F:CCGCTCGAGCTTCGACGAGCTGGACCG
C1-R:GGGGTACCCGCAGTGGTTGTCGGGAT
C2-F:GCTCTAGACTTCGACGAGCTGGACCG
C2-R:CCCAAGCTTCGCAGTGGTTGTCGGGAT
其中C1為正向插入片段,C2為反向插入片段(下劃線為酶切位點序列)。
使用UNIQ-10柱式DNA膠回收試劑盒回收PCR擴增產物,將回收產物連接到pMD19-T simple載體,轉化大腸桿菌E.coliDH5α感受態,藍白斑篩選得到的陽性克隆經質粒PCR鑒定確認后,送至上海生工測序,使用DNAMAN 6.0對序列進行分析。
1.3.4 以PtCYP86A為靶標的RNAi載體構建 用XhoⅠ/KpnⅠ雙酶切連有正向片段C1的pMD19-T simple vector載體,回收小片段(C1),與同樣雙酶切線性化的pHANNIBAL載體連接,轉化E.coliDH5α感受態,得到重組質粒pHC1;然后用XbaⅠ/Hind Ⅲ雙酶切連有反向片段C2的pMD19-T simple vector載體并回收小片段(C2),連接到XbaⅠ/Hind Ⅲ雙酶切后的pHC1載體,得到以pHANNIBAL載體的內含子(PDK intron)部位作為中心、兩側含有反向重復序列的表達盒pHC1C2 (圖1)。
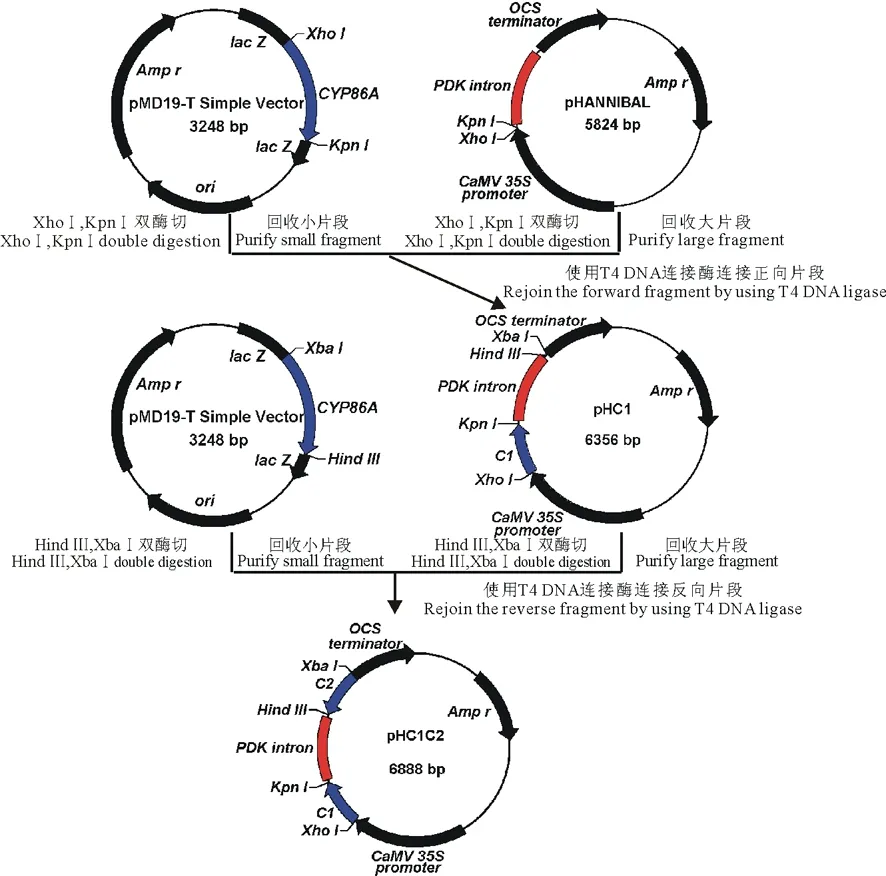
圖1 中間載體pHC1C2的構建流程Fig.1 Flow diagram of construction of intermedium vector pHC1C2
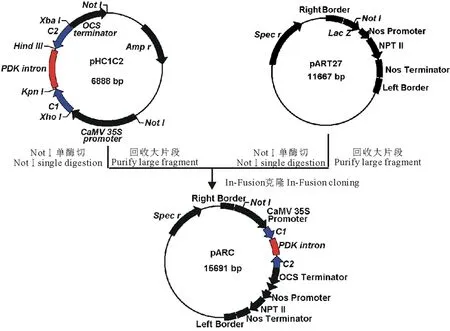
圖2 PtCYP86A-RNAi表達載體pARC的構建流程Fig.2 Flow diagram of construction of PtCYP86A-RNAi expression vector pARC
用NotⅠ單酶切線性化pART27載體;同時用NotⅠ單酶切pHC1C2并回收純化4044 bp的大片段,設計該片段的全長引物,并分別在上下游引物的5′端引入一段與線性化pART27載體末端互補的15 bp擴展序列,最終的引物序列如下:
P1:GACCTGCAGGCGGCCGCTCGACGAATTAATTCCAATCCC
P2:ATCACTAGTGCGGCCGCAGATTTAGGTGACACTATAG
采用高保真酶擴增目的片段,回收純化,按照In-Fusion HD Cloning Kit說明書,將該片段和線性化pART27載體連接,得到具有小花堿茅CYP86A反向重復序列的RNAi重組載體pARC (圖2)。
2 結果與分析
2.1 總RNA的提取及檢測
以150 mmol/L NaCl處理下小花堿茅根系為材料提取的總RNA通過電泳檢測,結果顯示28S RNA和18S RNA條帶清晰,前者亮度約是后者的2倍(圖略),說明所提取的RNA完整性較好;經NanoDrop1000核酸蛋白檢測儀測得OD260/OD280平均值為1.97,OD260/OD230平均值為2.13,表明RNA純度較高,可用于RT-PCR擴增。
2.2PtCYP86A基因RNAi靶片段的擴增
以總RNA反轉錄所得到的第一鏈cDNA為模板,用特異引物C1和C2分別進行PCR擴增,得到了預期538 bp的特異條帶(圖3)。將該條帶回收純化后連接到pMD19-T simple載體上,轉化E.coli.DH5α感受態。經藍白斑篩選后提取質粒,通過PCR檢測篩選陽性克隆。測序后分析表明,這兩個序列與PtCYP86A基因相應區段同源性為100% (結果未顯示),說明已成功擴增到目的片段。
2.3 以PtCYP86A為靶標的RNAi 載體構建
按照PtCYP86ARNAi植物表達載體的構建流程(圖1和圖2),通過酶切連接結合In-Fusion的方法,構建了具有PtCYP86A反向重復序列的RNAi植物表達載體pARC。通過質粒PCR檢測鑒定出陽性克隆后(圖4),根據pARC載體上的限制性酶切位點對其進行酶切分析,結果發現,經XbaⅠ/XhoⅠ雙酶切后,在1893 bp處出現特異條帶(圖5,泳道2),與C1+C2+PDK intron大小相符;經XbaⅠ/KpnⅠ雙酶切后,在1349 bp處出現特異條帶(圖5,泳道3),與C2+PDK intron片段大小相符。以上結果表明,以PtCYP86A為靶標的RNAi載體已構建成功,可用于農桿菌的轉化。
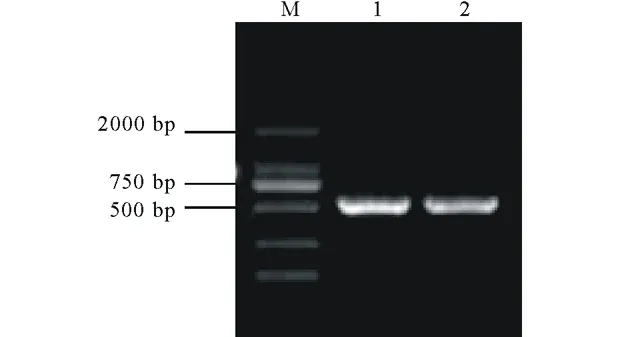
圖3 RT-PCR產物凝膠電泳圖Fig.3 Agarose gel electrophoresis of RT-PCR products
M為DNA標記;1,2為RT-PCR產物。M indicates DNA marker;1,2 indicate RT-PCR products.
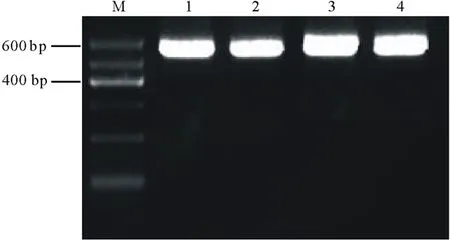
圖4 pARC重組質粒陽性克隆的PCR鑒定Fig.4 PCR identification of the positive clones of pARC recombinant plasmids
M為DNA標記;1,2,3,4為陽性克隆。M indicates DNA marker;1,2,3,4 indicate positive clones.
3 討論
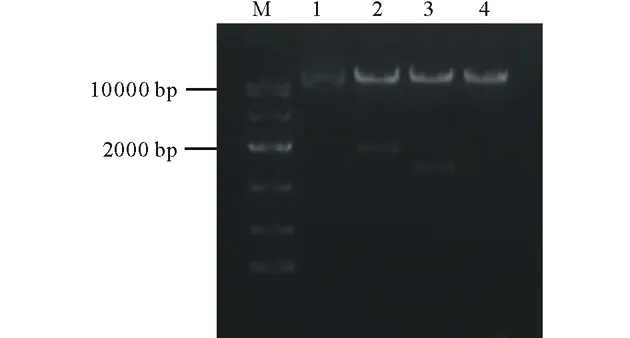
圖5 pARC重組質粒的酶切驗證Fig.5 Restrict digestion validation of the pARC recombinant plasmidM為DNA標記;1為環狀質粒;2為XbaⅠ/XhoⅠ雙酶切;3為XbaⅠ/KpnⅠ雙酶切;4為線性質粒。M indicates DNA marker;1 indicates circular plasmid;2 indicates double digestion by XbaⅠ/XhoⅠ;3 indicates double digestion by XbaⅠ/KpnⅠ;4 indicates linearized plasmid.
RNAi技術與其他基因表達抑制技術相比,具有特異、高效、穩定等優點,是基因功能研究中最常用且重要的手段之一。該技術主要通過少量小干擾RNA (small-interference RNA,siRNA) 或雙鏈RNA (double-stranded RNA,dsRNA)介導,特異降解目標序列的靶mRNA,從而抑制相應基因表達,屬于典型的轉錄后基因沉默(post-transcriptional gene silencing,PTGS)[22]。在植物中,最長效穩定的手段是構建表達載體并通過農桿菌侵染的方法將dsRNA 轉入植物體內,載體中連入的具有反向重復基因序列的結構在植物體內轉錄為mRNA后,自我互補形成hpRNA[23],進而導致植物內同源基因編碼的mRNA 特異性降解。
本研究中,使用T4 DNA連接酶始終無法將NotⅠ酶切pHClC2后得到的大片段連接至NotⅠ單酶切后的雙元載體pART27,甚至對線性化的pART27載體進行磷酸化處理后,仍得不到陽性克隆,最終通過In-Fusion的方法,對NotⅠ酶切pHClC2后得到的大片段進行PCR擴增,使用In-Fusion酶將純化后的PCR產物克隆到目標載體pART27上,得到了陽性克隆。In-Fusion克隆方法與傳統的T4連接酶相比,具有操作簡便、連接效率高、適用性廣等特點,其原理是向目的片段的引物5′端引入與線性化載體末端互補的15 bp同源序列,通過In-Fusion酶特異性識別該序列進而將目的片段與載體融合在一起,可以較輕松實現大片段的克隆。
靶基因干擾片段的選擇是RNAi能否成功的關鍵,有研究表明,干擾效率具有長度依賴性,dsRNA 越長效果越明顯:400~500 nt>200~300 nt>50~100 nt,內源性基因片段越短,對dsRNA的耐受性越高[24]。外源基因片段太短不利于載體的構建操作,過短的dsRNA 也不容易被核酸內切酶(Dicer)識別;而過長的片段在構建操作中易引起重組,并且結構并不穩定。因此,所選干擾片段長度應盡量控制在200~600 bp[25]。Elbashir等[26]認為靶基因序列應在基因轉錄起始位點下游100個核苷酸以后,且該段DNA的GC含量在40%~70%的范圍內。為了防止沉默到其他非標靶基因,本研究參照Altschul等[27]以及Serra等[21]的設計原則,設計選擇了小花堿茅CYP86A基因靠近3′端538 bp的非保守序列作為干擾片段,GC含量為66%,滿足高效RNAi載體的條件,理論上將對PtCYP86A基因產生較好的沉默效果。
4 結論
本研究通過酶切連接結合In-Fusion的方法,成功構建了鹽生植物小花堿茅木栓質合成關鍵基因PtCYP86A的RNAi載體,為研究木栓質在小花堿茅拒鹽中的作用奠定了基礎。
References:
[1] Wang S M,Zhu X Y,Shu X X.Studies on the characteristics of ion absorption and distribution inPuccinelliatenuiflora.Pratacultural Science,1994,3(1):39-43.王鎖民,朱興運,舒孝喜.堿茅離子吸收與分配特性的研究.草業科學,1994,3(1):39-43.
[2] Zhu X Y,Wang S M,Yan S G,etal.The research progresses of plant resistance to salt and its mechanism of resistance in the genusPuccinellia.Pratacultural Science,1994,11(3):9-15.朱興運,王鎖民,閻順國,等.堿茅屬植物抗鹽性與抗鹽機制的研究進展.草業科學,1994,11(3):9-15.
[3] Wang S M,Zheng W J,Ren J Z,etal.Selectivity of various types of salt-resistant plants for K+over Na+.Journal of Arid Environment,2002,52(4):457-472.
[4] Wang C M,Zhang J L,Liu X S,etal.Puccinelliatenuifloramaintains a low Na+level under salinity by limiting unidirectional Na+influx resulting in a high selectivity for K+over Na+.Plant Cell and Environment,2009,32(5):486-496.
[5] Peng Y H,Zhu Y F,Mao Y Q,etal.Alkali grass resists salt stress through high [K+] and endodermis barrier to Na+.Journal of Experimental Botany,2004,55:939-949.
[6] Stelzer R,L?uchli A.Salt- and flooding tolerance ofPuccinelliapeisonis.II.Structural differentiation of the root in relation to function.Zeitschrift für Pflanzenphysiologie,1977,84:95-108.
[7] Stelzer R,L?uchli A.Salt- and flooding tolerance ofPuccinelliapeisonis.III.Distribution and localization of ions in the plant.Zeitschrift für Pflanzenphysiologie,1978,88:437-448.
[8] Zhu Y J,Zhang Y,Hu Z Z,etal.Studies on the microscopic structure ofPuccinelliatenuifloraroots under different salinity stress.Grassland of China,2001,23(1):37-40.朱宇旌,張勇,胡自治,等.小花堿茅根適應鹽脅迫的顯微結構研究.中國草地,2001,23(1):37-40.
[9] Enstone D E,Peterson C A,Ma F.Root endodermis and exodermis:structure,function,and responses to the environment.Journal of Plant Growth Regulation,2002,21(4):335-351.
[10] Schreiber L.Transport barriers made of cutin,suberin and associated waxes.Trends in Plant Science,2010,15(10):546-553.
[11] Schreiber L,Hartmann K,Skrabs M,etal.Apoplastic barriers in roots:chemical composition of endodermal and hypodermal cell walls.Journal of Experimental Botany,1999,50:1267-1280.
[12] Ranathunge K,Schreiber L,Franke R.Suberin research in the genomics era-new interest for an old polymer.Plant Science,2011,180(3):399-413.
[13] Martinka M,Dolan L,Pernas M,etal.Endodermal cell-cell contact is required for the spatial control of Casparian band development inArabidopsisthaliana.Annals of Botany,2012,110(2):361-371.
[14] Werck-Reichhart D,Feyereisen R.Cytochromes P450:a success story.Genome Biology,2000,1(6):1-9.
[15] Nawrath C.The biopolymers cutin and suberin.The Arabidopsis Book,2002,1:e0021.
[16] Franke R,Briesen I,Wojciechowski T,etal.Apoplastic polyesters inArabidopsissurface tissues-a typical suberin and a particular cutin.Phytochemistry,2005,66(22):2643-2658.
[17] Beisson F,Li-Beisson Y,Bonaventure G,etal.The acyltransferase GPAT5 is required for the synthesis of suberin in the seed coat and root of Arabidopsis.Plant Cell,2007,19(1):351-368.
[18] Franke R,Schreiber L.Suberin-a biopolyester forming apoplastic plant interfaces.Current Opinion in Plant Biology,2007,10(3):252-259.
[19] Pollard M,Beisson F,Li Y,etal.Building lipid barriers:biosynthesis of cutin and suberin.Trends in Plant Science,2008,13(5):236-246.
[20] H?fer R,Briesen I,Beck M,etal.TheArabidopsiscytochrome P450CYP86A1 encodes a fatty acid omega-hydroxylase involved in suberin monomer biosynthesis.Journal of Experimental Botany,2008,59(9):2347-2360.
[21] Serra O,Soler M,Hohn C,etal.CYP86A33-targeted gene silencing in potato tuber alters suberin composition,distorts suberin lamellae,and impairs the periderm’s water barrier function.Plant Physiology,2009,149(2):1050-1060.
[22] Fire A,Xu S,Montgomery M K,etal.Potent and specific genetic interference by double-stranded RNA inCaenorhabditiselegans.Nature,1998,391:806-811.
[23] Waterhouse P M,Graham M W,Wang M B.Virus resistance and gene silencing in plants can be induced by simultaneous expression of sense and antisense RNA.Proceedings of the National Academy of Sciences,1998,95(23):13959-13964.
[24] Hammond S M,Bernstein E,Beach D,etal.An RNA directed nuclease mediates post-transcriptional gene silencing inDrosophilacells.Nature,2000,404:293-296.
[25] Burch-Smith T M,Miler J L.PTGS approaches to large-scale functional genomics in plants[M]//Hannon G,ed.RNAi:A Guide to Gene Silencing.New York:Cold Spring Harbor Laboratory Press,2003:243-263.
[26] Elbashir S M,Lendeckel W,Tuschl T.RNA interference is mediated by 21- and 22- nucleotide RNAs.Genes and Development,2001,15(2):188-200.
[27] Altschul S F,Gish W,Miller W,etal.Basic local alignment search tool.Journal of Molecular Biology,1990,215(3):403-410.
Construction of RNAi expression vector ofCYP86Agene in halophytePuccinelliatenuiflora
WANG Pei1,2,CUI Yan-Nong1,GAO Li1,WANG Suo-Min1*
1.StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China;2.InstitutionofQinghai-TibetanPlateau,SouthwestMinzuUniversity,Chengdu610041,China
The salt-excluding halophytePuccinelliatenuifloraexhibits a highly suberized endodermis in the root,which may contribute to its salt tolerance.In this study,the RNAi target fragment ofCYP86A,a key gene in suberin biosynthesis,was amplified by RT-PCR from roots ofP.tenuifloraseedlings under salt stress.Then based on the intermediate vector pHANNIBAL and the plant expression vector pART27,the RNAi plant expression vector pARC,which contained inverted repeats ofPtCYP86Aand was driven by the 35S promoter,was constructed successfully by restriction enzyme digestion,ligation and In-Fusion cloning.The work might be a good basis for further investigating the roles of roots suberization in Na+exclusion inP.tenuifloraby RNAi technique.
Puccinelliatenuiflora;suberin;PtCYP86A;construction of RNAi vector
10.11686/cyxb2017076 http://cyxb.lzu.edu.cn
王沛,崔彥農,高麗,王鎖民.鹽生植物小花堿茅CYP86A基因的RNAi載體構建.草業學報,2017,26(6):105-110.
WANG Pei,CUI Yan-Nong,GAO Li,WANG Suo-Min.Construction of RNAi expression vector ofCYP86Agene in halophytePuccinelliatenuiflora.Acta Prataculturae Sinica,2017,26(6):105-110.
2017-03-02;改回日期:2017-04-10
國家自然科學基金(31470503),教育部博士點基金優先發展領域項目(20130211130001)和甘肅省科技支撐項目(144FKCA058)資助。
王沛(1987-),男,甘肅慶陽人,在讀博士。E-mail:wp_10@lzu.edu.cn
*通信作者Corresponding author.E-mail:smwang@lzu.edu.cn

