熊果酸對人骨肉瘤MG-63細胞增殖和凋亡的影響研究
陳偉 劉海生 魏萌 王麗紅 師艷艷
?
熊果酸對人骨肉瘤MG-63細胞增殖和凋亡的影響研究
陳偉 劉海生 魏萌 王麗紅 師艷艷
目的 研究熊果酸對人骨肉瘤MG-63細胞增殖和凋亡的影響及其相關機制。 方法 以不同濃度熊果酸(40、20、10 μg/mL)和順鉑(40 μg/mL)干預對數生長期人骨肉瘤MG-63細胞;采用噻唑藍比色法測定細胞增值抑制率,通過流式細胞術(flow cytometry,FCM)檢測細胞周期和細胞凋亡狀況,采用逆轉錄PCR(reverse transcription-polymerase chain reaction,RT-PCR)檢測細胞中Bcl-2相關X蛋白(Bcl-2 associated X protein,Bax)mRNA、B細胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia,bcl-2)mRNA的表達,采用免疫印跡法(western blotting,WB)檢測細胞中半胱氨酸天冬氨酸蛋白酶-3(caspase-3)蛋白表達。 結果 經熊果酸干預48小時能夠顯著提高人骨肉瘤MG-63細胞增殖抑制率,延長細胞周期G0/G1期并縮短G2/M期,提高細胞凋亡率(apoptosis index,AI),上調Bax mRNA表達并下調bcl-2 mRNA表達、提高Bax/bcl-2比值,上調caspase-3蛋白表達,熊果酸上述作用具有一定的劑量依賴性。 結論 熊果酸具有抑制人骨肉瘤MG-63細胞增殖并促進其凋亡的作用,其機制可能與熊果酸能夠阻滯細胞周期以及調節凋亡相關基因和蛋白表達有關。
熊果酸; 骨肉瘤; MG-63細胞; 增殖; 凋亡
骨肉瘤發病率居原發惡性骨腫瘤之首[1-2],每年新發患者約5/100萬[3],多發于青少年且死亡率高,是臨床上亟待解決的一個難題。目前臨床上對于骨肉瘤的治療主要采取手術輔以放化療的方案,但80 %的患者因確診時體內已經出現轉移病灶而致使手術治療效果不佳[4],5年生存率僅30 %左右。因此,以抑制骨肉瘤細胞生長為切入點研究高效、低毒的新型抗腫瘤藥物以及新的治療方案是臨床上亟待解決的問題。熊果酸(ursolic acid,UA)是一種具有抗氧化、抗炎、抗纖維化等多種生物學活性的五環三萜類化合物[5-10],廣泛存在于熊果、女貞子等植物中;現代藥理學研究發現熊果酸對肺癌、肝癌、舌癌細胞等生長均具有一定的抑制作用[11-13],但熊果酸是否對人骨肉瘤MG-63細胞生長具有抑制作用尚未見文獻報道。本實驗通過體外培養人骨肉瘤MG-63細胞并給予熊果酸進行干預治療,研究熊果酸對人骨肉瘤MG-63細胞生長的影響及其機制。
1 材料與方法
1.1 細胞、藥物與試劑
人骨肉瘤MG-63細胞株引自河北醫科大學細胞生物研究室;熊果酸購自陜西慧科植物開發有限公司(純度≥98%,批號:140617);注射用順鉑購自山東齊魯制藥有限公司(批號:1503018);DMEM 高糖培養基、胰蛋白酶、胎牛血清購自美國HyClone公司(批號分別為:15010037、15040127、15050009);MTT購自美國Sigma公司(批號:M2128);Annexin V/PI細胞凋亡檢測試劑盒購自美國BD公司(批號:150419);Caspase-3單克隆抗體購自碧云天生物技術有限公司(20150127);bcl-2、Bax上下游引物購自上海博亞生物公司(批號分別為:20150216、20150120)。
1.2 主要儀器
超凈工作臺(購自蘇州安泰空氣技術有限公司);二氧化碳細胞培養箱(購自美國Thermo Scientific公司);酶標儀(購自美國 BIO-RAD公司);DYY-11 型多用電泳儀、DYCZ-40B 轉印泳槽(購自北京六一儀器廠);流式細胞儀(購自美國BD公司);RT-PCR儀(購自武漢新未來儀器技術有限公司)。
1.3 方法
1.3.1 細胞培養、分組與給藥 人骨肉瘤MG-63細胞株經復蘇后植入DMEM高糖培養基進行培養并取對數生長期細胞進行下一步實驗:0.25%胰酶消化、調整細胞濃度為5×104/mL后分為空白對照組、熊果酸低、中、高劑量(10、20、40 μg/mL)組和順鉑(40 μg/mL)組,n=10;各組分別給予相應濃度藥物進行干預,48小時后行各指標檢測。
1.3.2 各組人骨肉瘤MG-63細胞增值抑制率的測定 調整細胞濃度至5×104/mL,接種于96孔板,每孔滴加20 μL MTT溶液(5 mg/mL),培養4小時后去上清,加入DMSO 200 μL,振蕩10分鐘后通過酶標儀測定波長570 nm處吸光度(optical delnsity,OD)值,計算各組人骨肉瘤MG-63細胞增值抑制率:細胞增殖抑制率(%)=[1-(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)]×100%
1.3.3 細胞周期的檢測和細胞凋亡狀況的觀察 各組細胞經PBS洗滌、加入70%乙醇5 mL混勻并置4℃環境48小時后離心取細胞,經PBS洗滌并打散細胞團后加5 μL水解酶Rnase(10 mg/mL),置37℃環境1小時,加入碘化丙啶染液,避光孵育30分鐘,然后通過流式細胞儀進行檢測,采用CELL Quest軟件分析各組細胞的細胞周期時相及凋亡狀況。
1.3.4 各組MG-63細胞bcl-2 mRNA、bax mRNA表達的檢測及Bax/bcl-2比值的計算 通過基因文庫查詢并設計合成bcl-2、Bax、β-actin基因上、下游引物;bcl-2引物:上游5′-GGGATGCCTTTGTGGAACTA-3′,下游5′-TGATTTGACCATTTGC CTGA-3′;bax引物:上游5′-ATCCAGGATCGAGCAGG GAGGATGG- 3′,下游5′-AGATGGTCACTGTCTGCCATGTGGG-3′;β-actin引物:上游5′-CCTGTATGCC TCTGGTCGTA-3′,下游 5′-CCATCTCTTGCTCGAAGTCT-3′。經藥物干預48小時后,0.25 %胰酶消化并收集各組細胞,加入適量TRIzol試劑提取總RNA并測定總RNA濃度,反轉錄為cDNA后進行PCR反應,擴增完畢后取PCR產物于瓊脂糖凝膠電泳,最后通過凝膠成像儀觀察并照相。以β-actin為內參,以灰度值進行半定量分析bcl-2 mRNA、Bax mRNA表達并計算Bax/bcl-2表達比值。
1.3.5 各組人骨肉瘤MG-63細胞Caspase-3蛋白表達的檢測 各組細胞經PBS溶液洗滌后行超聲裂解,低溫離心(4℃,12000 rpm)20分鐘取沉淀,采用BCA法測定蛋白濃度,蛋白變性(沸水浴加熱5分鐘)、上樣(每孔上樣30 μg),經SDS-PAGE凝膠電泳后轉PVDF膜、室溫下5%脫脂奶粉封閉2小時,一抗(Caspase-3,β-actin)4℃過夜,洗膜、二抗(1∶100)室溫孵育1小時后經ECL系統顯影;以β-actin為內參,以條帶灰度值測定Caspase-3表達相對量。
1.4 統計學處理
運用軟件SPSS 15.0進行統計分析,組間均數比較采用單因素方差分析,兩兩比較采用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組人骨肉瘤MG-63細胞增殖抑制率
通過MTT比色法檢測細胞增殖抑制率,結果如表1所示:熊果酸各劑量組和順鉑組人骨肉瘤MG-63細胞增殖抑制率顯著高于空白對照組(P<0.01),且熊果酸對MG-63細胞增殖抑制作用呈現一定劑量依賴性;熊果酸高劑量組細胞增殖抑制率顯著高于順鉑組(P<0.05)。
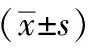
表1 各組人骨肉瘤MG-63細胞增殖抑制率比較
注: 與空白對照組比較,aP<0.01;與順鉑組比較,bP<0.05。
2.2 各組人骨肉瘤MG-63細胞周期
通過流式細胞術檢測細胞周期,結果如表2所示:熊果酸中、高劑量組人骨肉瘤MG-63細胞周期G0/G1期較空白對照組顯著延長,S期和G2/M期顯著縮短(P<0.05,P<0.01),其中熊果酸高劑量組較順鉑組具有統計學差異(P<0.05)。

表2 各組人骨肉瘤MG-63細胞周期比較
注: 與空白對照組比較,aP<0.05,bP<0.01;與順鉑組比較,cP<0.05。
2.3 各組人骨肉瘤MG-63細胞凋亡
采用流式細胞術檢測細胞凋亡狀況,結果如圖1所示:經熊果酸各劑量組和順鉑組人骨肉瘤MG-63細胞凋亡細胞數明顯增多,熊果酸誘導細胞凋亡的作用呈現一定的劑量依賴性;計算AI結果如表3所示:熊果酸各劑量組和順鉑組人骨肉瘤MG-63細胞AI顯著高于空白對照組(P<0.01),其中熊果酸高劑量組人骨肉瘤MG-63細胞AI顯著高于順鉑組(P<0.05)。
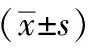
表3 各組人骨肉瘤MG-63細胞凋亡比較
注: 與空白對照組比較,aP<0.01;與順鉑組比較,bP<0.01。

注:A空白對照組;B熊果酸低劑量組;C熊果酸中劑量組;D熊果酸高劑量組;E順鉑組
β-actin mRNA bcl-2 mRNA Bax mRNA
注:自左至右依次為:空白對照組、熊果酸低劑量組、熊果酸中劑量組、熊果酸高劑量組、順鉑組
圖2 各組人骨肉瘤MG-63細胞bcl-2 mRNA、Bax mRNA表達
2.4 各組人骨肉瘤MG-63細胞bcl-2 mRNA、Bax mRNA表達和Bax/bcl-2比值
采用RT-PCR技術檢測并通過灰度值進行半定量分析,結果如圖2和表4所示:熊果酸中、高劑量組和順鉑組人骨肉瘤MG-63細胞bcl-2 mRNA表達顯著下調,且Bax mRNA表達顯著上調(P<0.05,P<0.01),Bax/bcl-2比值顯著提高(P<0.05,P<0.01);其中熊果酸高劑量組bcl-2 mRNA表達較順鉑組顯著降低(P<0.05)、Bax/bcl-2比值顯著升高(P<0.05)。

表4 各組人骨肉瘤MG-63細胞bcl-2 mRNA、Bax mRNA表達和Bax/bcl-2值對比
注: 與空白對照組比較,aP<0.05,bP<0.01;與順鉑組比較,cP<0.05。
2.5 各組人骨肉瘤MG-63細胞Caspase-3蛋白表達
通過Western blotting技術檢測并通過灰度值進行半定量分析,結果如圖3和表5所示:熊果酸各劑量組和順鉑組人骨肉瘤MG-63細胞Caspase-3蛋白表達較空白對照組顯著上調(P<0.05,P<0.01),熊果酸對Caspase-3蛋白表達的調控作用呈現一定的劑量依賴性;熊果酸高劑量組Caspase-3蛋白表達量顯著高于順鉑組(P<0.05)。

注:自左至右依次為:空白對照組、熊果酸低劑量組、 熊果酸中劑量組、熊果酸高劑量組、順鉑組
圖3 各組人骨肉瘤MG-63細胞caspase-3蛋白表達
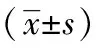
表5 各組人骨肉瘤MG-63細胞Caspase-3蛋白表達比較
注: 與空白對照組比較,aP<0.05,bP<0.01;與順鉑組比較,cP<0.05。
3 討論
熊果酸是一種具有多種生物學活性的五環三萜類化合物[5-10],近年來熊果酸抗腫瘤活性逐漸得到醫藥研究工作者的關注,付倫等[11]研究發現熊果酸能夠通過阻滯細胞周期于G0/G1期而對肺癌A549細和SPCA1細胞增殖起到抑制作用;崔兵兵等[12]研究發現熊果酸能夠誘導細胞凋亡而表現出對肝癌SMMC-7721細胞生長的抑制作用;李愛霞等[13]發現熊果酸能夠誘導人舌鱗狀細胞癌Tca8113細胞凋亡而抑制其生長;此外,熊果酸對卵巢癌、宮頸癌等婦科腫瘤細胞生長具有抑制作用[14-15]。本研究通過體外培養人骨肉瘤MG-63細胞并給予不同濃度熊果酸進行干預并以順鉑作為陽性對照進行研究發現,熊果酸能夠呈劑量依賴性地阻滯人骨肉瘤MG-63細胞周期、抑制增殖并提高其細胞凋亡率,且熊果酸高劑量組均優于順鉑組,提示熊果酸具有抑制人骨肉瘤MG-63細胞增殖并促進其凋亡的作用。
Caspase是激活各種凋亡刺激因子(Apaf-1)的關鍵蛋白酶,參與細胞凋亡的啟動及整個凋亡過程的調節;bcl-2能夠抑制線粒體破裂,可直接與Apaf-1結合而抑制Caspase-3激活,抑制促凋亡蛋白Bax細胞毒性作用,調節細胞內鈣濃度,從而起到抑制細胞凋亡的作用[16-17];Bax屬于Bcl-2基因家族成員,具有誘導線粒體滲透性改變而釋放細胞色素C、激活促凋亡蛋白Caspase-9,而表現出促細胞凋亡作用[18]。此外,Bax能夠與bcl-2聚合成二聚體,從而抑制bcl-2活性而促進細胞凋亡,所以Bax/bcl-2比值更加能夠體現Bcl-2基因家族對細胞凋亡的調控作用[19-21]。本研究發現,熊果酸能夠有效上調人骨肉瘤MG-63細胞Bax mRNA表達、下調bcl-2 mRNA表達并提高Bax/bcl-2比值,上調Caspase-3蛋白表達,這可能是熊果酸誘導人骨肉瘤MG-63細胞凋亡的重要分子機制。
總之,熊果酸具有抑制人骨肉瘤MG-63細胞增殖并促進其凋亡的藥理學作用,其作用機制可能與熊果酸阻滯細胞周期于G0/G1期以及調節凋亡相關基因(Bax、bcl-2)和蛋白(Caspase-3)表達有關。
[1] Van DE, Luijtgaarden AC, Kapusta L, et al. High prevalence of late adverse eventsin malignant bone tumour survivors diagnosed at adult age[J]. Neth J Med, 2014, 72(10): 516-522.
[2] Pu F, Chen F, Chen S, et al. Association between GSTP1 polymorphisms and prognosis of osteosarcoma in patients treated with chemotherapy: a meta-analysis [J]. Onco Targets Ther, 2015, 23(8): 1835-1842.
[3] Whelan J, McTieman A, Cooper N, et al. Incidence and survival of malignant bone sarcomas in England 1979-2007[J]. Int J Cancer, 2012, 131(4): 508-517.
[4] Moore DD, Luu HH. Osteosarcoma[J]. Cancer Treat Res, 2014, 162: 65-92.
[5] 趙瑞芳. 熊果酸對大鼠心肌缺血再灌注損傷的保護作用[J]. 中國醫藥導報, 2015, 12(7): 24-28.
[6] 郝冉冉, 王晨靜, 仲偉珍, 等. 熊果酸對ox-LDL誘導的人臍靜脈內皮細胞氧化損傷的保護作用[J]. 中藥藥理與臨床, 2014, 30(4): 29-32.
[7] 張明發, 沈雅琴. 齊墩果酸和熊果酸的抗動脈粥樣硬化作用[J]. 上海醫藥, 2014, 35(23): 73-79.
[8] 王翔, 閻昭, 王旭, 等. 熊果酸納米脂質體的鎮痛作用和抗炎活性[J]. 山東醫藥, 2013, 53(29): 31-35.
[9] 劉雙, 毛漢文, 劉佩文, 等. 熊果酸對高血壓大鼠心肌纖維化及 p38 活化的影響[J]. 內科急危重癥雜志, 2016, 22(1): 64-67.
[10] 周娟娟, 朱萱. 熊果酸抗肝纖維化作用及其機制的研究進展[J]. 世界華人消化雜志, 2015, 23(21): 3390-3395.
[11] 付倫, 朱敏, 李招云, 等. 熊果酸對肺癌細胞株A549及SPCA1細胞周期的抑制作用[J]. 醫學研究雜志, 2015, 44(5): 68-73.
[12] 崔兵兵, 程麗芳, 侯立靜, 等. 熊果酸抑制人肝癌SMMC-7721細胞生長及凋亡的實驗研究[J]. 中國實驗方劑學雜志, 2013, 19(18): 181-184.
[13] 李愛霞, 趙玉林, 張軍輝, 等. 熊果酸誘導人舌鱗狀細胞癌Tca8113細胞凋亡的作用[J]. 中國耳鼻咽喉頭頸外科, 2010, 17(9): 491-492.
[14] 王麗琴. 熊果酸對人上皮性卵巢癌SKOV3細胞增殖和凋亡的影響[J]. 安徽醫藥, 2016, 20(4): 647-650.
[15] 王艷杰, 王揚, 吳勃巖, 等. 熊果酸對人宮頸癌 hela 細胞體外抗腫瘤作用的形態學觀察[J]. 中醫藥信息, 2013, 30(6): 30-33.
[16] Ogura T, Tanaka Y, Tamaki H, et al. Docetaxel induces Bcl-2 and pro-apoptosis caspase-independent death of human prostate cancer DU145 cells[J]. Int J Oncol, 2016, 48(6): 2330-2338.
[17] Vizetto-Duarte C, Custódio L, Gangadhar KN, et al. Isololiolide, a carotenoid metabolite isolated from the brown alga Cystoseira tamariscifolia, is cytotoxic and able to induce apoptosis in hepatocarcinoma cells through caspase-3 activation, decreased Bcl-2 levels,increased p53 expression and PARP cleavage [J]. Phytomedicine, 2016, 23(5): 550-557.
[18] Farhadi F, Jahanpour S, Hazem K, et al. Garlic (Allium sativum) fresh juice induces apoptosis in human oral squamous cell carcinoma: the involvement of caspase-3,bax and bcl-2[J]. J Dent Res Dent Clin Dent Prospects, 2015, 9(4): 267-273.
[19] Saeedi Borujeni MJ, Hami J, Haghir H, et al. Evaluation of Bax and Bcl-2 Proteins Expression in the Rat Hippocampus due to Childhood Febrile Seizure[J]. Iran J Child Neurol, 2016, 10(1): 53-60.
[20] Renault TT, Dejean LM, Manon S, et al. A brewing understanding of the regulation of Bax function by Bcl-xL and Bcl-2[J]. Mech Ageing Dev, 2016, S0047-6374(16): 30049-30045.
[21] Dolka I, Król M, Sapierzyński R. Evaluation of apoptosis-associated protein (Bcl-2, Bax, cleaved caspase-3 and p53) expression in canine mammary tumors: An immunohistochemical and prognostic study[J]. Res Vet Sci, 2016, 105: 124-133.
(本文編輯: 韓虹娟)
Effects of ursolic acid on the proliferation and apoptosis of human osteosarcoma MG-63 cells
CHENWei,LIUHaisheng,WEIMeng,etal.
ThirdDepartmentofOrthopedics,HandanCentralHospital,Handan056001,China
CHENWei,E-mail:hdsyyzhrf@163.com
Objective To investigate the effects of Ursolic Acid(UA) on the proliferation and apoptosis of human osteosarcoma MG-63 cells. Methods The human osteosarcoma MG-63 cells in logarithmic growth phase was treated with UA (10, 20, 40μg/mL) and Cisplatin (40μg/mL). The cellular growth inhibition rate was calculated by MTT, cell cycle and apoptosis rate were analyzed by flow cytometry, the expression of Bax mRNA and bcl-2 mRNA were detected by RT-PCR, the expression of caspase-3 protein was detected by western blotting. Results The cellular growth inhibition rate of human osteosarcoma MG-63 cell in UA treated groups were significantly increased; the G0/G1 phase of the cell cycle was prolonged and the G2/M phase was shortened, the apoptosis rate was significantly increased; the expression of Bax mRNA was significantly increased, while the expression of bcl-2 mRNA was significantly decreased, and the ratio of Bax/bcl-2 was significantly increased; the expression of caspase-3 protein was significantly increased; all of the effects above were dose-dependent with a certain. Conclusions UA can effectively inhibit human osteosarcoma MG-63 proliferation and promote it apoptosis, which perhaps related to its effects of arresting cell cycle and regulating the expression of apoptosis-related genes and proteins.
Ursolic Acid; Osteosarcoma; MG-63 cell; Proliferation; Apoptosis
056001 邯鄲市中心醫院骨三科(陳偉、魏萌、王麗紅、師艷艷);邯鄲市人民醫院外一科(劉海生)
陳偉(1976- ),碩士,副主任醫師。研究方向:骨科疾病研究。E-mail:hdsyyzhrf@163.com
R738.1
A
10.3969/j.issn.1674-1749.2017.04.013
2016-07-03)

