膽堿能抗炎通路對大鼠腦缺血再灌注損傷的影響
王 瀟 蘇 躍 李天佐 趙斌江
(首都醫科大學附屬北京世紀壇醫院麻醉科, 北京 100038)
· 麻醉學與神經科學 ·
膽堿能抗炎通路對大鼠腦缺血再灌注損傷的影響
王 瀟 蘇 躍 李天佐 趙斌江*
(首都醫科大學附屬北京世紀壇醫院麻醉科, 北京 100038)
目的 本研究應用不同的膽堿能受體干擾劑M1受體激動劑McN-A-343(MA343)、M2受體拮抗劑美索曲明(methoctramine,MET)以及α7亞單位的N型受體激動劑膽堿(choline, CHO)分別作用于膽堿能抗炎通路(cholinergic anti-inflammatory pathway, CAP),通過檢測不同部位腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β,IL-1β)濃度,進一步探討CAP對大鼠腦缺血再灌注損傷的影響。方法 健康成年雄性SD大鼠25只,采用數字表法隨機分為5組(n=5):假手術組(sham operation group, Sham)、腦缺血再灌注組(ischemia reperfusion group, I/R)、MET組、MA343組和CHO組。四血管結扎法(four-vessel occlusion,4-VO)建立全腦缺血再灌注損傷模型,電凝大鼠雙側椎動脈(Sham組除外),于缺血前15 min分別經側腦室向MET組、MA343組及CHO組注射MET、MA343及CHO,Sham組及I/R組注射0.9%(質量分數)氯化鈉注射液10μL。除Sham組外,各組夾閉雙側頸總動脈20 min后再灌注。再灌注6 h后,斷頭處死動物,采集標本。放射免疫法(radio-immunoassay, RIA)檢測左側海馬、心、肝、肺、腎和血漿中TNF-α、IL-1β濃度。TdT介導的dUTP缺口末端標記技術染色(terminal deoxynucleotidyl-trallsferase meiated dUTP nick end labeling, TUNEL)檢測右側海馬CA1區細胞凋亡數。結果 再灌注后,MET組和MA343組海馬、心、肝、腎組織勻漿及血漿TNF-α、IL-1β濃度顯著低于I/R組(P<0.05)。CHO組海馬TNF-α濃度較I/R組有所降低(P<0.05),而心、肝、腎及血漿TNF-α、IL-1β濃度比較,差異無統計學意義(P>0.05)。MET、MA343和CHO均未能降低肺組織TNF-α、IL-1β濃度。與I/R組相比,MET、MA343及CHO組海馬CA1區凋亡細胞數目減少(P<0.05)。結論 TNF-α、IL-1β的釋放是腦缺血再灌注損傷的重要機制之一,CAP對腦缺血再灌注引發的局部及全身炎性反應均具有保護作用。其機制與MET、MA343和CHO抑制缺血再灌注后TNF-α、IL-1β的合成與釋放有關。
膽堿能抗炎通路;迷走神經;腦缺血再灌注;腫瘤壞死因子-α;白介素-1β;美索曲明;McN-A-343;膽堿
與缺血再灌注有關的急性炎性反應促進了繼發性腦損害的發展[1]。在腦缺血過程中,中樞神經系統(central nervous system,CNS)分泌的腫瘤壞死因子-α (tumor necrosis factor-α,TNF-α)、白細胞介素-1β (interleukin-1β,IL-1β)等構成了缺血性損傷向炎性反應性損傷轉變的基礎,隨后白細胞向缺血區聚集導致微血管再閉塞,引發“無復流”現象[2]。目前針對腦缺血再灌注損傷的治療主要為藥物性腦保護,其中許多藥物尚處于動物實驗階段,臨床效果尚有待證實。
新近研究[2-6]顯示膽堿能抗炎通路(cholinergic anti-inflammatory pathway,CAP)也許能為治療腦缺血再灌注的炎性反應損傷提供新的思路。CAP是一條神經-免疫調節通路,它通過迷走神經及其遞質乙酰膽堿與免疫系統相互作用,參與抗炎性反應。
本實驗建立大鼠短暫性全腦缺血再灌注模型,探討CAP對大腦局部和繼發全身炎性反應的影響,為腦缺血再灌注損傷提供新的治療方法。
1 材料與方法
1.1 實驗動物
健康成年雄性Sprague-Dawley大鼠25只,清潔級,體質量280~320 g。動物分籠飼養,每籠5只,自由飲食,飲自來水,標準顆粒飼料,室溫18~22 ℃。動物及飼料由北京結核病胸部腫瘤研究所動物實驗室,實驗動物許可證號:SCXK(京)2006-0008。
1.2 動物分組及給藥方法
SD大鼠采用數字表法隨機分為5組:①假手術組(Sham組);②腦缺血再灌注(ischemia reperfusion group, I/R組);③美索曲明組(methoctramine,MET組):注射劑量為500 ng/kg;④McN-A-343組(MA343組):注射劑量為500 ng/kg;⑤膽堿組(choline, CHO組):注射劑量為500 ng/kg。術前將藥物用0.9%(質量分數)氯化鈉注射液配制成10 μL溶液,Sham組及I/R組注射等劑量0.9%(質量分數)氯化鈉注射液。
1.3 四血管結扎法(four-vessel occlusion,4-VO)法全腦缺血再灌注損傷模型的制備及側腦室注藥
水合氯醛腹腔注射麻醉,將大鼠固定在立體定位儀上,直視下閉塞雙側椎動脈。仰臥位固定,暴露雙側頸總動脈,置4-0號絲線備用。置籠喂養,自由飲食。假手術組僅暴露雙側頸椎翼小孔。
4 h后經異氟烷麻醉,微量進樣器自腦表面垂直進針3.5 mm,回抽有清亮腦脊液后,將藥物3 min注射完畢。留針5 min。Sham組及I/R組注入10μL 0.9%(質量分數)氯化鈉注射液。手術過程及術后保持肛溫37 ℃。15 min后,清醒狀態下固定大鼠,提起分離的頸總動脈,用無創性小動脈夾夾閉,造成全腦缺血。缺血20 min,松開動脈夾實現再灌注,回籠飼養,自由飲食飲水,再灌注6 h。Sham組僅暴露雙側頸總動脈,不做夾閉手術。
模型成功的標準:大鼠在30~60 s內昏迷,翻正反射消失,雙側瞳孔放大,雙眼底變白,痛反射消失,但角膜反射存在,能自主呼吸。
1.4 標本提取
6 h后麻醉下斷頭取腦,冰盤取雙側海馬,迅速入液氮保存。取左肺下葉、心尖部、肝左葉下緣、左腎下緣組織標本,冰冷0.9%(質量分數)氯化鈉注射液沖洗,-70 ℃保存。
左側海馬50 mg置于冰浴的50 mmol/L醋酸緩沖液(pH=4.75)勻漿器中,用2 mL無水乙醇洗勻漿器,靜置5 min,離心,收集上清液,再用75%(體積分數)乙醇1 mL洗勻漿器連續2次,洗沉淀,混勻,離心后取上清-70 ℃保存,待測。心、肺、肝、腎組織的處理方法與上述相同。
右側海馬常規上行脫水、二甲苯固定后用石蠟包埋,連續切片,切片厚4 μm,每隔10張取1張,每個取4張。在60 ℃的溫水中充分展開,玻片貼片,備用。
取1.0 mL血清,加入10 μL抑肽酶,搖勻,-20 ℃保存。
1.5 觀察指標
放射免疫法測定組織 TNF-α、IL-1β的濃度;測定血清TNF-α、IL-1β的濃度;原位細胞凋亡檢測(TUNEL法)。
1.6 圖像分析
采用Motic MC Camera 1.1軟件對切片進行圖像分析。光學顯微鏡200高倍鏡視野下,對海馬區域中隨機取8個非重疊的視野,進行觀察并對陽性細胞進行計數分析,陽性細胞鏡下呈棕黃色,圓形或橢圓形致密塊。計算凋亡細胞百分率[凋亡細胞百分率=陽性細胞數/(陽性細胞陰性細胞數)×100%][4]。
1.7 統計學方法
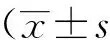
2 結 果
2.1 組織和血漿中TNF-α濃度變化
I/R組海馬、心、肺、肝、腎組織勻漿和血漿中TNF-α濃度均顯著高于Sham組(腎勻漿P<0.05,海馬、心、肺、肝和血漿P<0.01)。MET組及MA343組海馬、心、肝、腎組織勻漿和血漿中TNF-α濃度均顯著低于I/R組(腎勻漿P<0.05,海馬、心、肝和血漿P<0.01)。CHO組與I/R組相比,除海馬勻漿中TNF-α的減少差異有統計學意義(P<0.01)外,其余各組織及血漿TNF-α變化差異無統計學意義(P>0.05)。與I/R組相比,MET組、MA343組及CHO組中肺組織勻漿中TNF-α的濃度減少差異均無統計學意義(P>0.05)(表1,圖1)。
在I/R組中,與海馬相比,心、肺、肝、腎組織勻漿及血漿TNF-α濃度差異有統計學意義(均P<0.01),各組織間及血漿之間的差異具有統計學意義(P<0.05),其TNF-α濃度高低依次為海馬>血漿>肺>肝>心>腎(表1)。
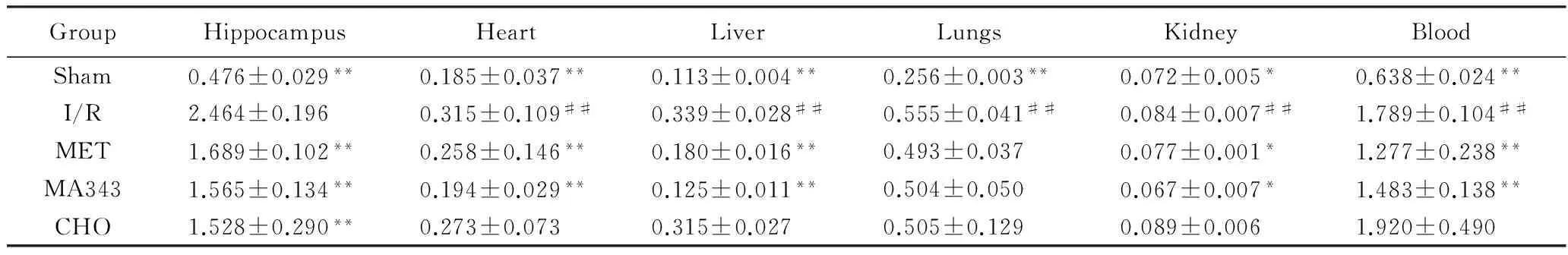
表1 左海馬、心、肺、肝、腎組織勻漿和血漿中TNF-α濃度變化Tab.1 Left hippocampus, heart, lungs, liver, kidney tissue homogenate and serum TNF-α content changes (n=5)
*P<0.05,**P<0.01vsI/R group,##P<0.01vshippocampus; TNF-α: tumor necrosis factor-α; Sham: sham operation group; I/R:ischemia reperfusion group; MET: methoctramine; MA343: McN-A-343; CHO: choline.
2.2 組織和血漿中IL-1β濃度變化
I/R組海馬、心、肺、肝、腎組織勻漿和血漿中IL-1β濃度均顯著高于Sham組(海馬、心、肺、肝、腎勻漿和血漿P均<0.01)。MET組及MA343組海馬、心、肝、腎組織勻漿和血漿中IL-1β濃度均顯著低于I/R組(海馬、心、肺、肝、腎勻漿和血漿P均<0.01)。CHO組與/IR組相比,除海馬勻漿中IL-1β的減少具有統計學意義(P<0.01)外,其余各組織及血漿IL-1β變化差異無統計學意義(P>0.05)。與I/R組相比,MET組、MA343組及CHO組中肺組織勻漿中IL-1β濃度減少,差異均無統計學意義(P>0.05)。
在I/R組中,與海馬相比,心、肺、肝、腎組織勻漿及血漿IL-1β濃度差異有統計學意義(均P<0.01),各組織間及血漿之間的差異統計學意義(P<0.05),其IL-1β濃度高低依次為海馬>血漿>肺>肝>心>腎(表2)。
表2 左海馬、心、肺、肝、腎組織勻漿和血漿中IL-1β濃度變化

GroupHippocampusHeartLiverLungsKidneyBloodSham0.478±0.018**0.097±0.004**0.104±0.001**0.249±0.009**0.042±0.002*0.422±0.006**I/R1.262±0.0060.312±0.103##0.354±0.012##0.495±0.002##0.074±0.001##1.217±0.002##MET0.878±0.128**0.232±0.003**0.135±0.003**0.382±0.0130.064±0.001**0.784±0.008**MA3430.986±0.005**0.285±0.007**0.137±0.002**0.425±0.0030.063±0.003**0.874±0.002**CHO0.778±0.007**0.308±0.0040.363±0.0130.488±0.0030.073±0.0031.213±0.002
*P<0.05,**P<0.01vsI/R group;##P<0.01vshippocampus; IL-1β: interleukin-1β; Sham: sham operation group; I/R:ischemia reperfusion group; MET: methoctramine;MA343: McN-A-343; CHO: choline.
2.3 TUNEL法檢測大鼠海馬凋亡細胞陽性率
再灌注6 h后,肉眼觀察Sham組大腦外觀左右兩側對稱,背側表面血管呈淡紅色,左右分布大體均一。I/R組可見雙側腦組織腫脹明顯,腦組織發白。MET組、MCA343組及CHO組腦組織腫脹程度較I/R組有所減輕。
用TUNEL法檢測凋亡細胞,本實驗凋亡細胞為棕黃色的圓形或卵圓形致密塊狀(圖1)。Sham組大鼠海馬CA1區組織切片中可見極凋亡細胞(圖1A),I/R組大鼠海馬組織切片中凋亡細胞散布于整個海馬CA1區內(圖1B),而MET組、MCA343組及CHO組大鼠海馬CA1區組織切片中凋亡細胞數明顯少于I/R組(均P<0.01)(表3,圖1C、D、E)。
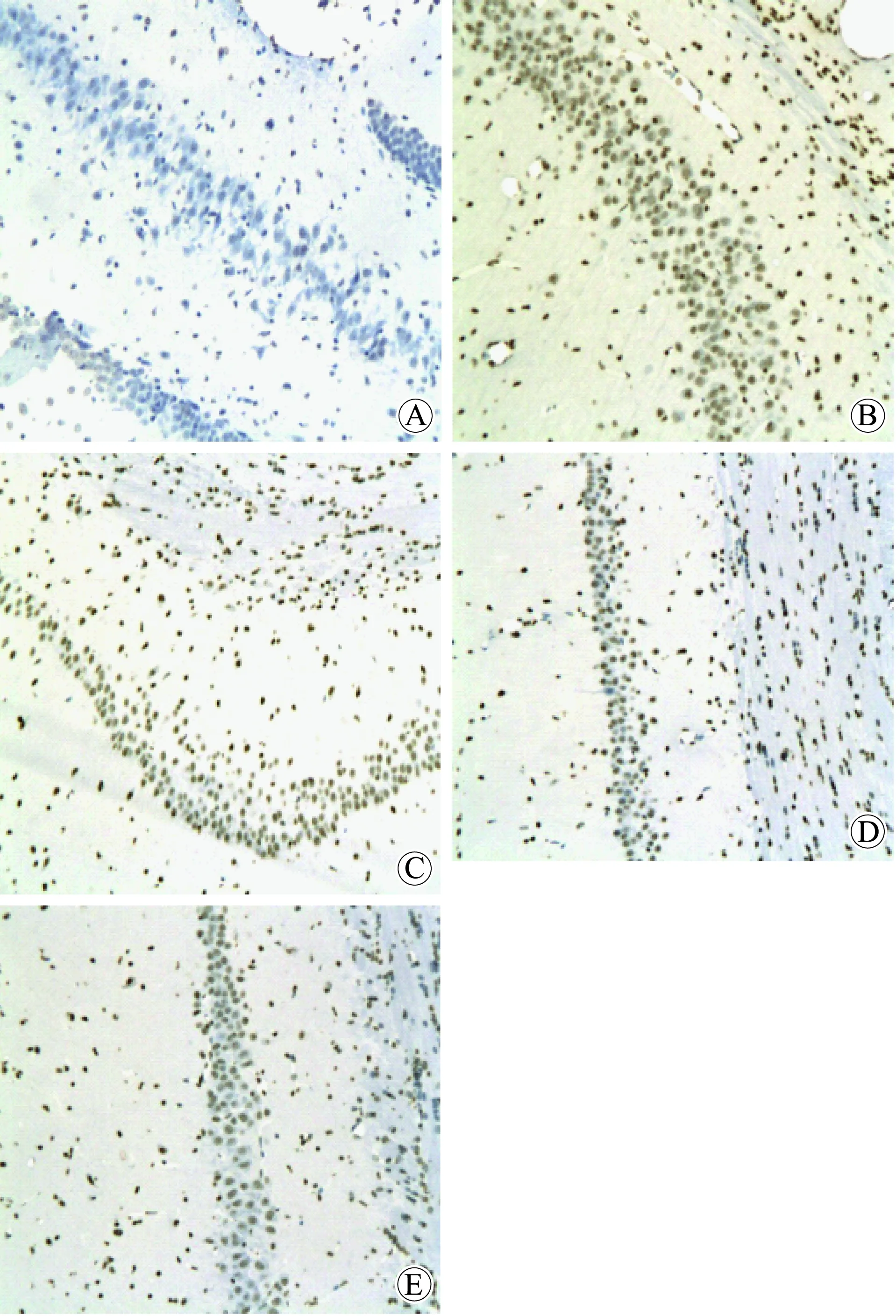
圖1 大鼠海馬CA1區凋亡細胞Fig.1 Apoptotic cells of rat hippocampal CA1 area (TUNEL,200×)
A:sham group; B:I/R group; C:MET group; D:MA343 group; E:CHO group;Sham: sham operation group; I/R:ischemia reperfusion group; MET: methoctramine;MA343: McN-A-343; CHO: choline; TNF-α:tumor necrosis factor-α; IL-1β:interleukin-1β.
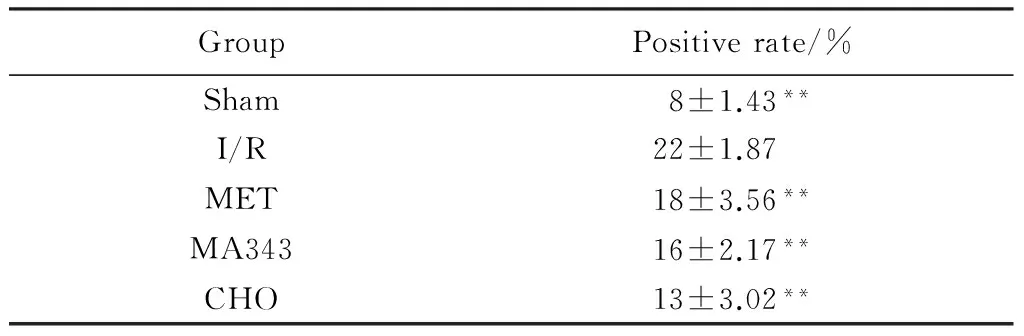
表3 各組大鼠海馬CA1區凋亡細胞陽性率比較Tab.3 Positive rate of each rat hippocampal CA1 area apoptotic cells (n=5)
**P<0.01vsI/R group; Sham: sham operation group; I/R:ischemia reperfusion group; MET: methoctramine; MA343: McN-A-343; CHO: choline.
2.4 大鼠海馬凋亡細胞陽性率與海馬組織勻漿TNF-α、IL-1β濃度的關系
大鼠海馬CA1區陽性細胞率的變化趨勢與海馬組織勻漿TNF-α、IL-1β濃度的變化相一致(表1、2,圖2)。

圖2 大鼠海馬凋亡細胞陽性率與海馬組織 勻漿TNF-α、IL-1β濃度的關系Fig.2 Relationship of rat hippocampal apoptotic cells rate positive with hippocampal tissue homogenate of TNF-α and IL-1β content
Sham: sham operation group; I/R:ischemia reperfusion group; MET: methoctramine;MA343: McN-A-343; CHO: choline;TNF-α:tumor necrosis factor-α; IL-1β:interleukin-1β.
3 討論
3.1 膽堿能抗炎通路對腦缺血再灌注損傷的影響
Borovikova等[7]研究發現,致病菌入侵時,體內的迷走神經及其遞質乙酰膽堿(acetylcholine,ACh)與免疫系統相互作用,參與抗炎過程,并將之命名為“膽堿能抗炎通路(cholinergic anti-inflammatory pathway,CAP)”。它可以被看作是一種神經免疫調節機制,當中樞收到機體受某種免疫刺激的信息后,就將這種信號投射到各迷走神經核團,激活傳出迷走神經纖維,引起外周神經末梢釋放ACh,與免疫細胞上具有α7亞單位的N型ACh受體結合,通過細胞內信號傳導途徑抑制促炎因子的釋放,調控炎性反應[3,8]。
傳出迷走神經能夠抑制外周炎性反應因子的產生,提示迷走神經與炎性反應細胞間存在信號傳導機制。在外周,ACh主要由交感神經的節前纖維、副交感神經節前和節后纖維釋放,通過毒蕈堿型受體(M受體)和煙堿型受體(N受體) 發揮作用。外周血單核細胞表面存在M受體和N受體,兩者均能與ACh結合,抑制TNF-α及IL-1β在體內的合成,但以N受體為主。
實驗[9]證明,CAP可以抗炎。直接刺激迷走神經可降低內毒素休克大鼠血TNF-α濃度,減緩內毒素引起的低血壓性休克的發生時相。內毒素血癥時頸迷走神經放電頻率明顯升高。反之,切斷迷走神經則使動物對內毒素的致死性效應更加敏感。Bernik等[10]也觀察到電刺激迷走神經能減少缺血再灌注損傷所導致的全血TNF-α濃度升高,抑制心臟和肝臟TNF-α生成,緩解缺血再灌注引起的休克。CAP還可以抑制腹腔動脈缺血再灌注引發的NF-B活化和TNF-α表達增加。
以往的研究[8-10]CAP主要通過切斷迷走神經來破壞CAP,觀察炎性反應是否有擴大,或通過電刺激迷走神經及藥物來達到刺激CAP的目的,驗證炎性反應是否減輕。本實驗應用M1受體激動劑McN-A-343、M2受體拮抗劑美索曲明(methoctramine)以及N型乙酰膽堿受體α7亞單位激動劑膽堿,這3種藥物均能直接或間接提高Ach的濃度,相當于刺激CAP,觀察藥物刺激CAP后,是否能降低腦組織及全身TNF-α及IL-1β濃度。
膽堿能神經系統和固有的免疫系統之間吻合的分子,是一種對α-銀環蛇毒敏感的巨噬細胞煙堿樣乙酰膽堿受體(nicotinic acetylcholine receptor α7 subunit,α7 nAChR)。Shytle等[11]發現腦單核巨噬細胞——小神經膠質細胞上含有α7 nAChR,推測中樞也同外周一樣,存在CAP。
本實驗應用了α7 nAChR激動劑膽堿。膽堿是ACh被膽堿酯酶水解后的產物,可穿過血腦脊液屏障。本實驗結果表明,與I/R組相比,膽堿顯著降低了左海馬組織勻漿的TNF-α及IL-1β濃度(P<0.01),抑制海馬TNF-α及IL-1β濃度的機制可能是膽堿直接與海馬小膠質細胞上的α7 nAChR結合,與Shytle等[11]的推測相符合。而對血液、心、肝、肺、腎組織中的TNF-α及IL-1β含量影響不大。其原因可能包括:(1)膽堿半衰期過短,給藥方式或給藥時機的保護作用有限;(2)N型α7受體對于膽堿的失敏時間過短;(3)缺血再灌注損傷過于嚴重,對保護措施不敏感。是否其他方式或時機及更高濃度的膽堿是否會產生更強的保護效應仍有待于進一步探討。
中樞和外周的毒蕈堿受體共有5種亞型(M1~M5),腦組織中廣泛分布著M1~M4亞型。M2受體主要分布于心臟、腦和平滑肌。自主神經元突觸前膜上分布著M2受體,美索曲明是M2受體激動劑。激動M2受體抑制ACh的釋放,而其拮抗劑美索曲明可抵消其負性調節,間接提高了ACh的濃度。M1受體分布在自主神經元突觸后膜,可正性調節ACh的釋放。McN-A-343可通過激動M1受體而促進ACh的釋放。應用美索曲明和McN-A-343相當于刺激迷走神經,興奮CAP。
本研究結果證實,側腦室注射美索曲明及McN-A-343可降低腦缺血再灌注損傷中海馬組織勻漿TNF-α及IL-1β的濃度。海馬神經元突觸前膜和突觸后膜上分布α7 nAChR,也存在M1、M2受體。在體外利用放射-配體結合實驗(radioligand-binding assay)中,α7 nAChR激動劑CNI-1493與M1受體高度特異性結合[12]。說明M1受體與N型乙酰膽堿受體α7亞單位復合物存在相互作用,中樞毒蕈堿受體(尤其M1受體)的活化,抑制TNF-α的釋放。在本實驗中,MET組與MCA343組相比,其海馬TNF-α濃度差異有統計學意義(P<0.05),美索曲明組海馬TNF-α濃度高于McN-A-343組,支持M1受體對TNF-α濃度降低起主要作用。膽堿降低TNF-α的作用與其聯合激動M1受體有關,或McN-A-343抑制TNF-α濃度也離不開N型乙酰膽堿受體α7亞單位的被激動。但目前本實驗尚無法驗證M1受體與N受體的聯合作用。
本研究結果表明,膽堿、美索曲明和McN-A-343 3種藥物均降低了中樞反應水平,說明中樞CAP存在的可能性。而美索曲明和McN-A-343這兩種無法穿過血腦脊液屏障的大分子藥物,卻降低了外周組織和血漿炎性反應水平。其原因不是藥物與迷走神經傳出神經核團——迷走神經運動背核(dorsal motor nucleus of the vagus nerve,DMN)的受體相結合,通過刺激傳出迷走神經而達到刺激外周CAP的目的。因為DMN上沒有毒蕈堿受體的結合位點,推測其降低外周性反應的原因可能是:(1)中樞ACh直接釋放入血,與外周血中的單核細胞和組織器官中的巨噬細胞相結合,減輕性反應?(2)可能與整合了交感神經的有關?CAP與下丘腦-垂體-腎上腺軸(hypothalamic-pituitary-adrenal axis, HPA)軸在中樞水平具有廣泛的聯系[3]。延髓的迷走神經背側復合體集中了重要的中樞迷走神經核團。其中孤束核(nucleus tractus solitaries, NTS)是重要組成部分,它與自主神經和內分泌功能均有關。NTS能將機體受到炎性反應侵害的信息傳遞到下丘腦核團,特別是室旁核(paraventricular nucleus of the hypothalamus, PVN)。PVN是促腎上腺皮質激素釋放激素合成和釋放的位置,可調節HPA軸的活性。這些機體結構和功能聯系將神經抗炎和內分泌體液抗炎通路有效地結合起來。當CAP興奮時,也同時激活了HPA軸,使其具有免疫抑制作用的終產物糖皮質激素釋放增加,協同抗擊機體的過度炎性反應。
3.2 腦缺血再灌注損傷后炎性細胞因子與細胞凋亡的關系
項潔等[12]實驗發現在缺血再灌注腦損傷,凋亡神經元主要分布在腦梗死周圍(即缺血半暗區),與TNF-α的表達區域一致。在時間進程上,李力仙等[13]發現缺血側半球皮質內TNF-α濃度于腦缺血再灌注后6 h明顯升高。而細胞凋亡的高峰在再灌注24~48 h,這說明從TNF-α的表達到細胞凋亡需要時間過程。而胡建鵬等[14]則發現TNF-α與c-myc基因的表達高峰相同,推測TNF-α與細胞凋亡相關。本實驗表明,MET組、MA343組及CHO組中大鼠海馬凋亡細胞陽性率的降低與TNF-α的降低趨勢一致,與上述結論相符合。IL-1β可通過增加細胞內Ca2+的濃度,繼而激活其靶酶,引起神經元的損傷和凋亡[15]。本實驗MET組、MA343組及CHO組中大鼠海馬凋亡細胞陽性率的降低與IL-1β的降低趨勢一致。
本實驗中,TNF-α及IL-1β濃度的降低,與激活CAP有關。而凋亡細胞陽性率隨TNF-α及IL-1β含量的降低而降低,可以說CAP間接抑制了凋亡,減輕了腦缺血再灌注損傷。
綜上所述,CAP對腦缺血再灌注引發的局部和全身的炎性反應均具有保護作用,并間接降低了凋亡細胞陽性率。其機制與活化CAP,提高ACh的濃度,減少TNF-α及IL-1β產生有關。
[1] Pulsinelli W A, Brierley J B. A new model of bilateral hemispheric ischemia in the unanesthetized rat[J]. Stroke, 1979, 10(3):267-272.
[2] Iadecola C, Alexander M. Cerebral ischemia and inflammation[J]. Curr Opin Neurol, 2001, 14(1):89-94.
[3] Pavlov V A, Wang H, Czura C J, et al. The cholinergic anti-inflammatory pathway: a missing link in neuroimmunomodulation[J]. Mol Med, 2003, 9(5-8): 125-134.
[4] Tracey K J. The inflammatory reflex[J]. Nature, 2002, 420(6917): 853-859.
[5] Tracey K J, Czura C J, Ivanova S. Mind over immunity[J]. FASEB J, 2001, 15(9): 1575-1576.
[6] Czura C J, Friedman S G, Tracey K J. Neural inhibition of inflammation: the cholinergic anti-inflammatory pathway[J]. J Endotoxin Res, 2003, 9(6): 409-413.
[7] Borovikova L V, Ivanova S, Zhang M, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J]. Nature, 2000, 405(6785): 458-462.
[8] Czura C J, Friedman S G, Tracey K J. Neural inhibition of inflammation: the cholinergic anti-inflammatory pathway[J]. J Endotoxin Res,2003, 9(6):409-13.
[9] 黃健,楊志煥.內毒素血癥大鼠頸迷走神經傳出放電變化[J].第三軍醫大學學報,2005,27(9):850-852.
[10]Bernik T R, Friedman S G, Ochani M, et al. Cholinergic anti-inflammatory pathway inhibition of tumor necrosis factor during ischemia reperfusion[J]. J Vasc Surg, 2002, 36(6): 1231-1236.
[11]Shytle R D, Mori T,Townsend K, et al. Cholinergic modulation of microglial activation by α7 nicotinic receptors[J]. J Neurochem, 2004,89(2):337-343.
[12]項潔,沈霞,耿德勤.腫瘤壞死因子-α在大鼠腦缺血再灌注中的表達及對神經細胞凋亡的影響[J].中國臨床康復,2004, 8(28):6094-6095.
[13]李力仙,樸明學,江濤,等.大鼠腦缺血再灌注后缺血側半球皮質與缺血核心區皮質TNF-α含量的對比研究[J].中國急救醫學,2002,22(6):318-319.
[14]胡建鵬,王鍵,呂磊,等. 局灶性腦缺血再灌注時神經元、膠質細胞形態變化與TNF-α、c-Myc表達相關的實驗研究[J]. 中國病理生理雜志,2004,20(7):1251-1255.
[15]王文鑫,王勝寶,束旭俊,等.刺激迷走神經對大鼠缺血性腦損傷保護作用的初步研究[J].中國腦血管病雜志,2014,11(6):317-322.
編輯 慕 萌
Effect of cholinergic anti-inflammatory pathway on cerebral ischemia-reperfusion injury in the rat
Wang Xiao, Su Yue, Li Tianzuo, Zhao Binjiang*
(DepartmentofAnesthesiology,CapitalMedicalUniversity,BeijingShijitanHospital,Beijing100038,China)
Objective To investigate the protective effect of cholinergic anti-inflammatory pathway (CAP) via the M1 receptor agonist,the M2 receptor antagonist and the nAChR7 agonist. during cerebral ischemia-reperfusion injury in rats. Methods Twenty-five male healthy Sprague-Dawley rats were randomly divided into five equal groups: sham operation (Sham) group, ischemia reperfusion (I/R) group, methoctramine (MET) group, McN-A-343(MA343) group and choline(CHO) group. Rats were subjected to four-vessel occlusion (4-VO) global cerebral ischemia.by electrocauterization of the bilateral vertebral arteries, except Sham group. 15 min before ischemia-reperfusion, we administered intracerebroventricularly (i.c.v.) Methoctramine(500 ng/kg,10 μL), McN-A-343(500 ng/kg,10 μL) and Choline(500 ng/kg,10 μL) to MET group, MA343 group and CHO group, other groups receiving saline (0.9%). Then forebrain ischemia was induced by tightening of the clasps that around the common carotid arteries for 20 minutes, except Sham group. Blood and tissue samples were collected after reperfusion for 6 h in all groups. Tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) levels of hippocampus, heart, liver, lung,kidney and plasma were measured by radio-immunoassay(RIA).Apoptosis was detected by terminal deoxynucleotidyl-trallsferase meiated dUTP nick end labeling(TUNEL). Results Methoctramine and McN-A-343 could markedly inhibit the increase of TNF-α and IL-1βcontent in hippocampus, heart, liver, kidney and plasma after ischemia.Choline could also attenuated TNF-α and IL-1βexpression in hippocampus but could not inhibit them in heart, liver, kidney and serum. TNF-α and IL-1β levels in lung could not be suppressed by methoctramine, McN-A-343 or choline. Compared with I/R, the apoptotic cells in MET group, MA343 group and CHO group were significantly decreased. Conclusion It is indicated that CAP plays a potential role in alleviating local and systemic inflammatory response during cerebral ischemia-reperfusion injury. The mechanisms of anti-inflammatory were likely to suppress the expression of TNF-α and IL-1β.
cholinergic anti-inflammatory pathway; vagus nerve; cerebal ischemia-reperfusion; tumor necrosis factor-α(TNF-α); interleukin-1β(IL-1β); methoctramine; McN-A-343; choline
國家自然科學基金(8157050441)。This study was supported by National Natural Science Foundation of China (8157050441).
時間:2017-06-09 17∶26 網絡出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170609.1726.010.html
10.3969/j.issn.1006-7795.2017.03.003]
R743.31
2016-01-15)
*Corresponding author, E-mail:zhaobinjiang@sina.com

