丙戊酸鈉神經保護作用機制及其應用研究
劉全樂 李天富 王保國*
(1.首都醫科大學三博腦科醫院麻醉科,北京 100093; 2.首都醫科大學三博腦科醫院神經內科,北京 100093)
· 麻醉學與神經科學 ·
丙戊酸鈉神經保護作用機制及其應用研究
劉全樂1李天富2王保國1*
(1.首都醫科大學三博腦科醫院麻醉科,北京 100093; 2.首都醫科大學三博腦科醫院神經內科,北京 100093)
丙戊酸鈉(sodium valproate)作為一種組蛋白去乙酰酶抑制劑,廣泛應用于抗癲癇治療以及精神分裂、雙相障礙等精神疾病的治療。丙戊酸鈉還能對神經元的生長、變異、凋亡產生影響,發揮神經保護作用。丙戊酸鈉的作用機制與神經傳遞和細胞內信號傳導通路的調節有關。丙戊酸鈉作為神經功能保護藥物治療神經損傷以及認知障礙有待于進一步研究。
丙戊酸鈉;神經保護;信號傳導;組蛋白去乙酰酶抑制劑
丙戊酸(valproic acid,VPA)是一種短支鏈脂肪酸,最初是由從植物中提取的纈草酸合成的[1]。常以丙戊酸鈉(sodium valproate)的形式被用于治療癲癇和雙相情感障礙等疾病[1-2]。近年來,VPA以其良好的安全性[3]、合并癥少[1]以及治療劑量下幾乎不對病人的意識產生影響等特性[4],日益受到神經外科醫生的推崇,成為神經外科術后預防性抗癲癇治療的首選藥物。除此之外,VPA應用于一些急性神經系統損傷動物模型中,如創傷性腦損傷(traumatic brain injury,TBI)、脊髓損傷(spinal cord injury,SCI)、腦卒中(stroke)等,顯示了良好的神經保護作用,在臨床中的應用也越來越受重視。目前VPA的神經保護作用機制成為國內外研究的熱點。本文就近年來VPA神經保護作用的相關機制和臨床應用作一綜述。
1 VPA抗癲癇作用機制
癲癇(epilepsy)是大腦神經元突發性放電,導致短暫的大腦功能障礙的一種慢性疾病。癲癇的發作主要是由于中樞神經系統興奮與抑制的不平衡所致,與離子通道、神經遞質及神經膠質細胞的改變有關。目前VPA治療癲癇的作用與以下幾方面有關:
1.1 作用于γ-氨基丁酸(γ-aminobutyric acid,GABA)能系統
VPA抗癲癇的作用機制與多種綜合因素造成神經元興奮性降低有關[5]。早在20世紀70年代,就有人提出VPA對于GABA能系統的作用。GABA是哺乳動物神經系統中重要的抑制性神經傳遞物質[6-7],癲癇的發生與GABA介導的抑制性突觸傳遞作用降低有關。VPA主要通過作用于GABA的代謝途徑進而影響GABA的水平,最終增強GABA介導的突觸后抑制作用[8]。如圖1所示,VPA通過作用于GABA的合成和分解代謝的關鍵酶發揮作用,最后總的結果是增加GABA的水平。近期一些研究[9-11]表明,VPA除了對于GABA代謝途徑的影響外,還能夠增強GABA受體的反應,能夠通過與GABA-A受體苯二氮卓結合位點相互作用延長突觸后抑制作用的時間。
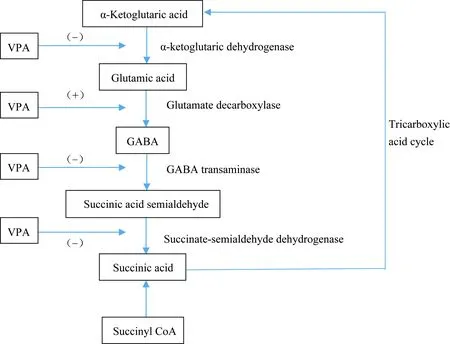
圖1 VPA對GABA能系統作用示意圖Fig.1 Schematic diagram of the effect of VPA on the GABA energy system
(+)shows the positive effect on the corresponding enzyme, and (-) indicates the negative inhibition of the corresponding enzyme;VPA: valproic acid;GABA: γ-aminobutyric acid.
1.2 作用于谷氨酸能系統
谷氨酸是一種興奮性神經遞質,對癲癇的誘發和發作起重要作用。研究[12]表明VPA能夠降低大腦內谷氨酸和天冬氨酸的水平。但是近年來有一些實驗[13]得出了相對矛盾的結果,VPA在腦內不同的區域對谷氨酸的作用是有差別的。例如在VPA慢性治療的大鼠模型中,VPA能劑量依賴性地提高海馬組織內谷氨酸的攝取能力,然而在額葉或者頂葉的皮質和小腦組織內卻沒有發現類似的結果[13]。VPA對谷氨酸的影響,在不同組織內得出了不同的觀察結果可能與谷氨酸能系統的突觸可塑性有關。
1.3 作用于離子通道
VPA的抗癲癇作用除了與上述兩個神經遞質系統有關外,還與VPA對細胞膜離子通道的作用有關。在早期的一項研究[14]中,研究者選取單個神經纖維的郎飛結,利用電壓鉗技術研究細胞膜鈉鉀電流,結果表明VPA能夠同步阻滯鈉和鉀的傳導,進而使細胞動作電位幅度、去極化最大速率降低,閾電位提高,最終導致了興奮性的降低。N-甲基-D天冬氨酸(N-methyl-D-aspartic acid, NMDA)受體作為谷氨酸的受體之一,其拮抗劑被用于臨床麻醉,逐步發展成為癲癇、卒中以及防止神經退行性損傷的治療藥物[15]。NMDA拮抗劑有明顯的神經毒性,NMDA受體功能不良可能與神經退行性疾病(如阿爾茨海默病、雙相情感障礙、精神分裂)有關。如圖2所示,谷氨酸與GABA能神經元和去甲腎上腺素能神經元的NMDA受體結合能夠維持這兩種神經元對兩種興奮通路的緊張性抑制(tonic inhibitory)作用。NMDA拮抗劑能夠消除這種抑制作用,從而受這兩種通路支配的神經元將會處于極度活躍狀態,進而導致多種細胞內通路的破壞,最終導致急性認知功能障礙等疾病的發生。VPA對鈉通道的阻滯能夠抑制NMDA拮抗劑相關的神經毒性作用。這也為VPA應用于臨床麻醉,抑制由NMDA拮抗劑類的麻醉藥物造成的神經毒性提供了理論依據。
2 VPA神經保護作用機制
組蛋白是真核生物體染色質中的堿性蛋白,是真核生物染色體基本結構蛋白,與帶負電荷的雙螺旋DNA結合成DNA-組蛋白復合物。染色質的局部重塑和動力學改變是基因表達的關鍵環節,進而影響細胞的變異、增生等功能[16]。其中影響染色質重塑的重要機制之一就是組蛋白N末端的乙酰化修飾。組蛋白的乙酰化作用由組蛋白乙酰轉移酶(histone acetyltransferase,HAT)介導;組蛋白去乙酰化作用由組蛋白去乙酰酶(histone deacetylase,HDAC)介導。在組蛋白的去乙酰化過程中,HAT和HDAC的活性是相互平衡的[17]。HDAC能夠影響細胞基因表達的修飾,VPA作為一種組蛋白去乙酰酶抑制劑(histone deacetylase inhibitor, HDACI),能夠激活細胞生存因子Akt,進而發揮多種神經保護作用。下面就VPA的抗凋亡作用、抗炎作用、抗氧化作用等方面分別敘述VPA的神經保護作用及相關機制。
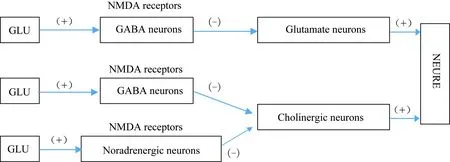
圖2 VPA作用于谷氨酸和GABA代謝機制Fig.2 Mechanisms of VPA action on the glutamate and GABA metabolism
NMDA receptors are a unique dual gated channel that is controlled by both membrane potential and by other neurotransmitters. Mainly in the neural cells of the postsynaptic membrane, NMDA receptors is a class of important excitatory amino acid receptors. Glutamate acts on GLU nerve pathway and energetic pathway through the GABAergic neurons and NEergic neurons NMDA receptor. Glutamate binds to NMDA receptors of GABAergic neurons and norepinephrine neurons to maintain the inhibitory effects of these two neurons on the Glutamate nerve pathway and cholinergic nerve pathways, and thus effectively inhibit the excessive activity of the neurons. (+) indicates excitement, (-) indicates inhibition;VPA: valproic acid;Glu:glutamate; NMDA:N-methyl-D-aspartic acid;GABA: γ-aminobutyric acid.
2.1 抗細胞凋亡作用
研究[2]表明,對于一些急性中樞神經系統損傷性疾病,神經元凋亡機制不恰當的激活是造成其病理學表現的主要機制。VPA已經被證實能夠在急性中樞神經系統損傷中抑制細胞的凋亡。VPA主要通過正向調節磷酸肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)/Akt通路,如圖3所示,磷酸化通路中的Akt和GSK-3β兩個因子,最終抑制凋亡激酶的激活進而發揮抗凋亡的作用[18]。PI3K/Akt信號通路在介導神經元的生存機制中起到重要作用[19]。PI3K是一種細胞表面因子,能夠激活Akt。Akt通過磷酸化多種酶、激酶和轉錄因子等作用調節細胞功能。TRB3和PTEN與PI3K的功能相反,可以減少Akt的活化。GSK-3β是一種與多種細胞生物過程有關的激酶,能夠調節多種細胞骨架蛋白,在中樞神經系統中有重要作用。VPA能夠抑制其活性,但是否可以直接抑制其活性仍然存在爭議。β連環蛋白可以通過提高抗凋亡蛋白質如Bcl-2的水平改善細胞生存能力。VPA主要通過抑制TRB3和PTEN促進Akt的磷酸化,上調P-GSK-3β和β連環蛋白的方式促進細胞存活,抵抗細胞凋亡。
VPA的抗凋亡機制除了與上述的細胞通路有關,還與熱休克蛋白70(heat shock protein70,HSP70)的誘導有關。熱休克蛋白家族有強效的細胞保護作用[20]。HSP70通過多種機制抗細胞凋亡。caspase-3的激活具有細胞色素酶c依賴性。HSP 70可以抑制caspase-3的激活,并且抑制其下游的凋亡介導因子。HSP還可以使JNK失活,抑制其興奮性細胞毒性作用,同時HSP作為分子伴侶,能夠防止蛋白的聚集,減少細胞死亡。在短暫局灶性腦缺血的大鼠模型中,VPA能夠上調大腦內HSP 70水平,減少缺血引起的大腦損傷[20]。除了HSP 70,VPA能夠誘導多種神經保護蛋白(如BCL-2、葡萄糖轉運蛋白78、腦源性神經營養因子等)的表達,但機制是否與VPA的組蛋白去乙酰酶抑制作用有關目前還尚不清楚。
除此之外,也有研究[21]表明VPA能夠激活一些細胞外信號調節激酶類,反過來影響轉錄因子活性和基因的表達。在一項以外傷性腦損傷和失血性休克大鼠為模型的實驗中,觀察了VPA對腦部基因表達的影響,結果顯示神經絲輕鏈基因(neurofilament light gene,NEFL)和SLX4兩種基因在應用VPA的大鼠神經元中過度表達。這兩種基因在神經元的再生、變異和成熟中有重要作用,并且與神經元凋亡的抑制有關。這些基因的表達對抑制細胞凋亡,提升神經元再生能力有重要作用[22]。
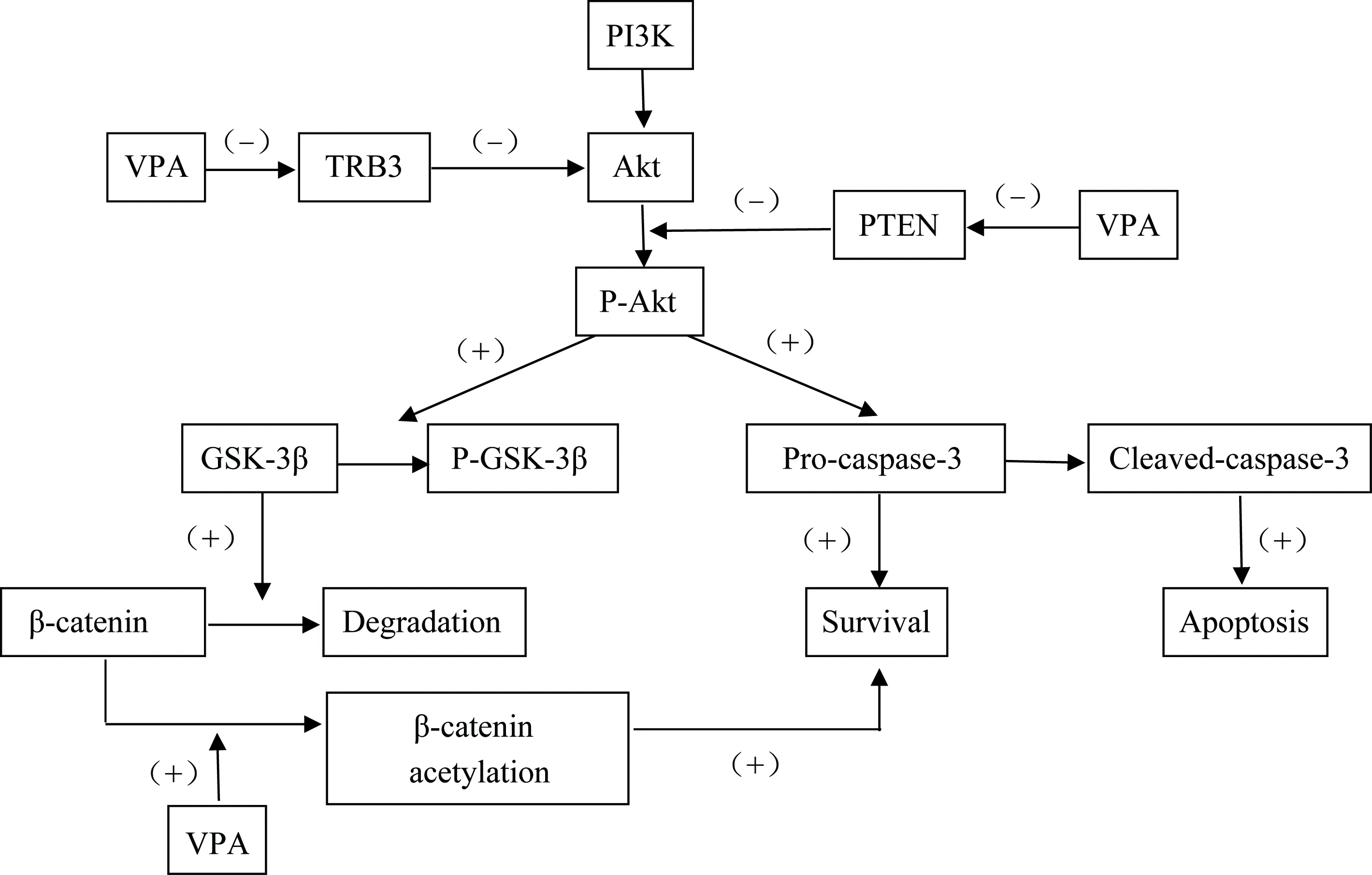
圖3 VPA作用于PI3K/Akt通路機制Fig.3 VPA acting on PI3K/Akt pathway mechanism
(+) indicates excitement, (-) indicates inhibition; PI3K: phosphatidylinositol 3 kinase;Akt: serine/threonine kinase;TRB3: tribbles 3, a pseudo-kinase that controls stress, cell growth and metabolic processes;PTEN:phosphate and tension homology deleted on chromsome ten,PTENgene is a novel tumor suppressor gene whose product PTEN protein has lipid phosphatase activity and protein phosphatase activity;P-Akt: phosphorylated Akt;GSK-3β: glycogen synthase kinase-3β; P-GSK-3β: phosphorylated GSK-3β;Pro-caspase-3: Cysteine-3 precursor, caspase-3 is considered to be the most important terminal cleavage enzyme in apoptosis. Cleaved-caspase-3: caspase-3 cleaves into cleaved-caspase-3 after cleavage, which is the active form of the former.
2.2 抗炎性作用
神經炎性反應是中樞神經系統功能紊亂十分重要的發病機制,同時在腦部損傷中也起到重要作用[23-24]。在一些神經損傷模型中,VPA的抗炎作用得到證實[2]。小膠質細胞(microglial)作為一種普通免疫細胞,在神經元的生理活動中起著支持、營養、保護和修復的重要功能。在炎性反應刺激下,抗原性增強,功能活躍。研究[25]證實VPA能夠抑制小膠質細胞的活性,并且在中腦神經元-神經膠質培養中,VPA能夠保護多巴胺能神經元不受脂多糖引起的炎性損傷。在人類神經膠質的培養中發現,VPA改變了小膠質細胞的表現型,并且能夠抑制小膠質細胞的吞噬作用[26]。在淋巴結中,VPA抑制Th1和Th7的反應但是能夠對Th2和調節性T細胞的反應起到促進作用。在腦脊髓炎大鼠模型中,VPA減少巨噬細胞和淋巴細胞在脊髓內的積累[27]。VPA的抗炎作用主要是對炎性小體聚集和活性的抑制發揮作用。在眾多炎性小體中,NLRP3是最近發現的胞質蛋白,主要參與免疫炎性應答反應。不論是內源性的還是外源性的刺激物都可以刺激NLRP3發生反應,NLRP3的激活涉及兩個過程:1)NF-κB通路的激活能夠啟動NLRP3的轉錄,提高其數量并促進其聚集;2)多種刺激可以激活NLRP3,如細胞內低鉀、增多的活性氧(reactive oxygen species, ROS)都能激活NLRP3炎性小體。參與免疫反應的早期和炎性反應各個階段的分子都受到NF-κB的調控,VPA能夠通過抑制NF-κB的活性進而減少NLRP3炎性小體的產生[28-33]。
2.3 神經營養作用
神經營養因子包括腦源性營養因子和膠質源性營養因子,對神經元的存活和功能都有重要作用。VPA能夠上調這些營養因子。機制可能是VPA加強營養因子基因周圍組蛋白的乙酰化,從而激活腦源性和膠質源性營養因子啟動子并促進其轉錄[34-36]。
2.4 抗氧化防御作用
氧化應激(oxidative stress,OS)是指體內氧化與抗氧化作用失衡,傾向于氧化。OS是由自由基在體內產生的一種負面作用。VPA通過抑制脂質過氧化和蛋白質氧化對氧化應激起防御作用。眾所周知,谷胱甘肽S-轉移酶(glutathione S-transferases,GSTs)是谷胱甘肽結合反應的關鍵酶。GSTs能夠清除體內氫過氧化物。GSTs同工酶能夠清除脂類自由基,在抗脂質過氧化反應中起重要作用,是抗氧化的重要保護因子。VPA能夠調節3種GST同工酶的表達。谷胱甘肽作為大腦內重要的抗氧化劑,在抗氧化防御中發揮重要作用。在培養的大鼠皮質細胞中,VPA既能夠提高谷胱甘肽的水平,同時還能增加谷胱甘肽合成限速酶的表達。通過這種方式,VPA抑制了過氧化氫誘發的細胞死亡[37]。Shao等[38]發現,同樣是在大鼠皮質細胞培養基中,VPA能夠明顯抑制谷氨酸鹽誘發的細胞內游離鈣的增加、脂質過氧化作用、蛋白質氧化作用、DNA的分裂和細胞死亡。有研究[39]表明,JNK信號通路在ROS介導的細胞死亡中發揮重要作用。VPA在含氧正常的細胞中對JNK沒有激活作用,但是在低氧細胞中,能夠顯著抑制JNK的活性,這可能與上述的VPA對HSP 70的上調作用有關。VPA的抗氧化防御作用可能是其神經功能保護的主要作用機制。
2.5 保護血腦脊液屏障作用
一些急性神經系統損傷性疾病,如創傷性腦損傷(traumatic brain injury,TBI)造成的認知和行為異常,不僅與初始損傷有關,還與進行性的病理發展性損傷相關。其中血腦脊液屏障(blood-brain barrier,BBB)的破壞導致的腦內環境的紊亂,大量興奮性神經遞質的釋放、神經元的炎性反應等都與大腦外傷后的二次損傷有關[40-44]。在TBI大鼠模型中,損傷后注射VPA可以減少血腦脊液屏障的滲透,改善血腦脊液屏障的完整性和功能[45]。該實驗[45]還證實了損傷后早期注射VPA對于運動和認知功能的改善都有作用。有研究[46-47]表明腦卒中后導致血腦脊液屏障破壞和功能紊亂的重要調節因子是基質金屬蛋白酶9。VPA能夠降低這種蛋白質的活性,同時能夠保護緊密連接,這也是其保護血腦脊液屏障的機制之一。
3 VPA的神經保護應用研究
VPA作為目前臨床上一線廣譜抗癲癇藥物廣泛應用于抗癲癇治療中,其在神經外科術后以及顱腦損傷后預防和控制癲癇發作越來越受到關注。神經外科術后癲癇發生的主要原因是手術操作過程中分離病變以及腦板牽拉腦組織造成皮質腦組織的損傷。即使目前微創手術也是如此。這些損傷會引起皮質局部內環境的改變而誘發早期癲癇。術后預防性使用抗癲癇藥物仍然存在爭議。但是術后預防性應用VPA可以明顯降低術后癲癇的發生率,而且在治療劑量下使用不良反應小,安全性高。
一些臨床前期的研究[2]顯示,VPA在一些急性神經系統損傷中,如缺血性腦卒中(ischemic stroke)、顱內出血(intracerebral hemorrhage,ICH)、TBI和脊髓損傷(spinal cord injury,SCI),均能表現出神經保護作用,能從上述多個方面發揮其神經保護作用。對于一些神經性損傷的疾病,VPA的應用同樣表現出了神經保護效應。例如皮下或經靜脈注射VPA能夠促進視網膜神經節細胞生存,使損傷的視神經重塑[48]。
4 前景與展望
通過以上對于VPA抗癲癇機制和神經保護作用機制的分析,以及一些VPA臨床前期證據,都提示VPA在治療急性中樞神經系統損傷中有重要作用。神經外科術后預防性應用VPA不僅能夠有效抑制術后癲癇的發生,同時還能夠有助于病人神經功能的恢復。這也為將丙戊酸鈉的鎮靜作用和神經保護作用有機結合起來,應用于神經外科麻醉領域提供了一個新的思路。也有文獻[49]報道,VPA對一些有認知障礙特點的神經退行性疾病有神經保護作用,并且可以加強記憶功能。越來越多的研究者投身于VPA抗阿爾茨海默病、帕金森病、亨廷頓舞蹈癥和認知功能障礙的研究中。然而,因為VPA缺乏以其神經保護作用應用于臨床的證據,以及藥物本身產生的不良反應和毒性的限制,使VPA作為神經保護藥物應用于臨床還處于探索階段。不同劑量的VPA能夠發揮不同的藥理效應,在臨床上,100~120 mg/kg的劑量時能夠發揮抗癲癇作用,高濃度的VPA(500 mg·kg-1·d-1)有組蛋白去乙酰酶抑制劑依賴性抗腫瘤作用,當VPA抑制組蛋白去乙酰化的作用提高細胞生存能力時,劑量范圍是非常狹窄的,使VPA發揮促進組蛋白乙酰化作用需要很高的血藥濃度,但是VPA的高濃度隨之而來的就是其毒性反應的增加。
探索丙戊酸鈉應用于臨床的劑量,使其既發揮其神經保護作用,又能減少其不良反應和毒性反應還有很長的一段路要走,但無疑具有獨特藥理學優勢的丙戊酸鈉值得我們為之努力探索。
[1] L?scher W. Basic pharmacology of valproate: a review after 35 years of clinical use for the treatment of epilepsy[J]. CNS Drugs, 2002,16(10):669-694.
[2] Chen S, Wu H, Klebe D, et al. Valproic acid: a new candidate of therapeutic application for the acute central nervous system injuries[J]. Neurochem Res, 2014,39(9):1621-1633.
[3] Venkataraman V, Wheless J W. Safety of rapid intravenous infusion of valproate loading doses in epilepsy patients[J]. Epilepsy Res, 1999,35(2):147-153.
[4] Mattson R H, Cramer J A, Collins J F. A comparison of valproate with carbamazepine for the treatment of complex partial seizures and secondarily generalized tonic-clonic seizures in adults. The department of Veterans Affairs Epilepsy Cooperative Study No. 264 Group[J]. N Engl J Med, 1992,327(11):765-771.
[5] L?scher W. Valproate: a reappraisal of its pharmacodynamic properties and mechanisms of action[J]. Prog Neurobiol, 1999,58(1):31-59.
[6] Hu J, Quick M W. Substrate-mediated regulation of gamma-aminobutyric acid transporter 1 in rat brain[J]. Neuropharmacology, 2008,54(2):309-318.
[7] Chiu C S, Brickley S, Jensen K, et al. GABA transporter deficiency causes tremor, ataxia, nervousness, and increased GABA-induced tonic conductance in cerebellum[J]. J Neurosci, 2005,25(12):3234-3245.
[8] Monti B, Polazzi E, Contestabile A. Biochemical, molecular and epigenetic mechanisms of valproic acid neuroprotection[J]. Curr Mol Pharmacol, 2009,2(1):93-109.
[9] Harrison N L, Simmonds M A. Sodium valproate enhances responses to GABA receptor activation only at high concentrations[J]. Brain Res, 1982,250(1):201-204.
[10]Motohashi N. GABA receptor alterations after chronic lithium administration. Comparison with carbamazepine and sodium valproate[J]. Prog Neuropsychopharmacol Biol Psychiatry, 1992,16(4):571-579.
[11]Cunningham M O, Woodhall G L, Jones R S. Valproate modifies spontaneous excitation and inhibition at cortical synapses in vitro[J]. Neuropharmacology, 2003,45(7):907-917.
[12]Thurston J H, Hauhart R E. Valproate doubles the anoxic survival time of normal developing mice: possible relevance to valproate-induced decreases in cerebral levels of glutamate and aspartate, and increases in taurine[J]. Life Sci, 1989,45(1):59-62.
[13]Hassel B, Iversen E G, Gjerstad L, et al. Up-regulation of hippocampal glutamate transport during chronic treatment with sodium valproate[J]. J Neurochem, 2001,77(5):1285-1292.
[14]VanDongen A M, VanErp M G, Voskuyl R A. Valproate reduces excitability by blockage of sodium and potassium conductance[J]. Epilepsia, 1986,27(3):177-182.
[15]Farber N B, Jiang X P, Heinkel C, et al. Antiepileptic drugs and agents that inhibit voltage-gated sodium channels prevent NMDA antagonist neurotoxicity[J]. Mol Psychiatry, 2002,7(7):726-733.
[16]G?ttlicher M, Minucci S, Zhu P, et al. Valproic acid defines a novel class of HDAC inhibitors inducing differentiation of transformed cells[J]. EMBO J, 2001,20(24):6969-6978.
[17]Li Y, Alam H B. Modulation of acetylation: creating a pro-survival and anti-inflammatory phenotype in lethal hemorrhagic and septic shock[J]. J Biomed Biotechnol, 2011,2011:523481.
[18]Bambakidis T, Dekker S E, Liu B, et al. Hypothermia and valproic acid activate prosurvival pathways after hemorrhage[J]. J Surg Res, 2015,196(1):159-165.
[19]Brunet A, Datta S R, Greenberg M E. Transcription-dependent and -independent control of neuronal survival by the PI3K-Akt signaling pathway[J]. Curr Opin Neurobiol, 2001,11(3):297-305.
[20]Ren M, Leng Y, Jeong M, et al. Valproic acid reduces brain damage induced by transient focal cerebral ischemia in rats: potential roles of histone deacetylase inhibition and heat shock protein induction[J]. J Neurochem, 2004,89(6):1358-1367.
[21]Yuan P X, Huang L D, Jiang Y M, et al. The mood stabilizer valproic acid activates mitogen-activated protein kinases and promotes neurite growth[J]. J Biol Chem, 2001,276(34):31674-31683.
[22]Dekker S E, Bambakidis T, Sillesen M, et al. Effect of pharmacologic resuscitation on the brain gene expression profiles in a swine model of traumatic brain injury and hemorrhage[J]. J Trauma Acute Care Surg, 2014,77(6): 906-912; discussion 912.
[23]Lucas S M, Rothwell N J, Gibson R M. The role of inflammation in CNS injury and disease[J]. Br J Pharmacol, 2006,147 Suppl 1:S232-240.
[24]Ahmad M, Graham S H. Inflammation after stroke: mechanisms and therapeutic approaches[J]. Transl Stroke Res, 2010,1(2):74-84.
[25]Chen P S, Wang C C, Bortner C D, et al. Valproic acid and other histone deacetylase inhibitors induce microglial apoptosis and attenuate lipopolysaccharide-induced dopaminergic neurotoxicity[J]. Neuroscience, 2007,149(1):203-212.
[26]Gibbons H M, Smith A M, Teoh H H, et al. Valproic acid induces microglial dysfunction, not apoptosis, in human glial cultures[J]. Neurobiol Dis, 2011,41(1):96-103.
[27]Zhang Z, Zhang Z Y, Wu Y, et al. Valproic acid ameliorates inflammation in experimental autoimmune encephalomyelitis rats[J]. Neuroscience, 2012,221:140-150.
[28]Bauernfeind F G, Horvath G, Stutz A, et al. Cutting edge: NF-kappaB activating pattern recognition and cytokine receptors license NLRP3 inflammasome activation by regulating NLRP3 expression[J]. J Immunol, 2009,183(2):787-791.
[29]Harder J, Franchi L, Muoz-Planillo R, et al. Activation of the Nlrp3 inflammasome by Streptococcus pyogenes requires streptolysin O and NF-kappa B activation but proceeds independently of TLR signaling and P2X7 receptor[J]. J Immunol, 2009,183(9):5823-5829.
[30]Segovia J, Sabbah A, Mgbemena V, et al. TLR2/MyD88/NF-κB pathway, reactive oxygen species, potassium efflux activates NLRP3/ASC inflammasome during respiratory syncytial virus infection[J].PLoS One,2012,7(1):e29695.
[31]Latz E, Xiao T S, Stutz A. Activation and regulation of the inflammasomes[J]. Nat Rev Immunol, 2013,13(6):397-411.
[32]Kwon K J, Kim J N, Kim M K, et al. Neuroprotective effects of valproic acid against hemin toxicity: possible involvement of the down-regulation of heme oxygenase-1 by regulating ubiquitin-proteasomal pathway[J]. Neurochem Int, 2013,62(3):240-250.
[33]Wang Z, Leng Y, Tsai L K, et al. Valproic acid attenuates blood-brain barrier disruption in a rat model of transient focal cerebral ischemia: the roles of HDAC and MMP-9 inhibition[J]. J Cereb Blood Flow Metab, 2011,31(1):52-57.
[34]Wu X, Chen P S, Dallas S, et al. Histone deacetylase inhibitors up-regulate astrocyte GDNF and BDNF gene transcription and protect dopaminergic neurons[J]. Int J Neuropsychopharmacol, 2008,11(8):1123-1134.
[35]Bredy T W, Wu H, Crego C, et al. Histone modifications around individual BDNF gene promoters in prefrontal cortex are associated with extinction of conditioned fear[J]. Learn Mem, 2007,14(4):268-276.
[36]Yasuda S, Liang M H, Marinova Z, et al. The mood stabilizers lithium and valproate selectively activate the promoter IV of brain-derived neurotrophic factor in neurons[J]. Mol Psychiatry, 2009,14(1):51-59.
[37]Cui J, Shao L, Young L T, et al. Role of glutathione in neuroprotective effects of mood stabilizing drugs lithium and valproate[J]. Neuroscience, 2007,144(4):1447-1453.
[38]Shao L, Young L T, Wang J F. Chronic treatment with mood stabilizers lithium and valproate prevents excitotoxicity by inhibiting oxidative stress in rat cerebral cortical cells[J]. Biol Psychiatry, 2005,58(11):879-884.
[39]Li Y, Yuan Z, Liu B, et al. Prevention of hypoxia-induced neuronal apoptosis through histone deacetylase inhibition[J]. J Trauma, 2008,64(4):863-870. discussion 870-871.
[40]Bramlett H M, Dietrich W D. Progressive damage after brain and spinal cord injury: pathomechanisms and treatment strategies[J]. Prog Brain Res, 2007,161:125-141.
[41]Kadhim H J, Duchateau J, Sébire G. Cytokines and brain injury: invited review[J]. J Intensive Care Med, 2008,23(4):236-249.
[42]Faden A I, Demediuk P, Panter S S, et al. The role of excitatory amino acids and NMDA receptors in traumatic brain injury[J]. Science, 1989,244(4906):798-800.
[43]Zhang X, Chen Y, Jenkins L W, et al. Bench-to-bedside review: Apoptosis/programmed cell death triggered by traumatic brain injury[J]. Crit Care, 2005,9(1):66-75.
[44]Raghupathi R. Cell death mechanisms following traumatic brain injury[J]. Brain Pathol, 2004,14(2):215-222.
[45]Dash P K, Orsi S A, Zhang M, et al. Valproate administered after traumatic brain injury provides neuroprotection and improves cognitive function in rats[J]. PLoS One, 2010,5(6):e11383.
[46]Sinn D I, Kim S J, Chu K, et al. Valproic acid-mediated neuroprotection in intracerebral hemorrhage via histone deacetylase inhibition and transcriptional activation[J]. Neurobiol Dis, 2007,26(2):464-472.
[47]Meaney D F, Ross D T, Winkelstein B A, et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex[J]. J Neurotrauma, 1994,11(5):599-612.
[48]Biermann J, Grieshaber P, Goebel U, et al. Valproic acid-mediated neuroprotection and regeneration in injured retinal ganglion cells[J]. Invest Ophthalmol Vis Sci, 2010,51(1):526-534.
[49]Bredy T W, Wu H, Crego C, et al. Histone modifications around individual BDNF gene promoters in prefrontal cortex are associated with extinction of conditioned fear[J]. Learn Mem, 2007,14(4):268-276.
編輯 陳瑞芳
Neuroprotective mechanism of sodium valproate and its application
Liu Quanle1, Li Tianfu2, Wang Baoguo1*
(1.DepartmentofAnesthesiology,SanboBrainHospital,CapitalMedicalUniversity,Beijing100093,China; 2.DepartmentofNeurology,SanboBrainHospital,CapitalMedicalUniversity,Beijing100093,China)
As an inhibitor of histone deacetylases,sodium valproate is often used in the treatment of neuropsychiatric disorders such as antiepileptic treatment,schizophrenia and bipolar disorder. Sodium valproate can also affect the growth,mutation and apoptosis of neurons and play a neuroprotective effect. The mechanism of neuroprotection of sodium valproate is related to the regulation of neurotransmission and intracellular signaling pathways. Sodium valproate as a neuroprotective drug for the treatment of nerve injury and cognitive impairment remains to be further studied.
sodium valproate;neuroprotection;signal transduction;histone deacetylase inhibitor
國家自然科學基金(81571275)。This study was supported by National Natural Science Foundation of China(81571275).
時間:2017-06-09 17∶50 網絡出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170609.1750.052.html
10.3969/j.issn.1006-7795.2017.03.008]
R971+.6
2017-03-20)
*Corresponding author, E-mail:wbgttyy@163.com

