116例正常人房水中阿爾茨海默病生物標志物與年齡相關性研究
盧 艷 李 臻 吳 越 張 健 蔣惠中 王寧利
(1.首都醫科大學附屬北京世紀壇醫院眼科, 北京 100038; 2.首都醫科大學宣武醫院眼科, 北京 100053;3.首都醫科大學附屬北京同仁醫院眼科, 北京 100730)
· 臨床研究 ·
116例正常人房水中阿爾茨海默病生物標志物與年齡相關性研究
盧 艷1*李 臻2吳 越2張 健2蔣惠中2王寧利3
(1.首都醫科大學附屬北京世紀壇醫院眼科, 北京 100038; 2.首都醫科大學宣武醫院眼科, 北京 100053;3.首都醫科大學附屬北京同仁醫院眼科, 北京 100730)
目的 檢測正常人房水中與阿爾茨海默病相關的生物標志物——淀粉樣蛋白(β-amyloid protein,Aβ)、Tau蛋白和淀粉樣前體蛋白(amyloid precursor protein,APP)與年齡的相關性。方法 收集116例常規白內障手術病人房水,按照年齡分為:A組(年齡小于60歲,n=25),B組(年齡60~69歲,n=30),C組(年齡70~79歲,n=32),D組(年齡≥80歲,n=29),運用Ellisa方法檢測樣本中APP、Tau 蛋白和Aβ40、Aβ42的濃度。結果 不同年齡組房水中Aβ40、Aβ42、Tau蛋白和APP的濃度差異無統計學意義(P>0.05)。結論 正常人房水中Aβ40、Aβ42、Tau蛋白和APP的濃度隨年齡改變沒有改變。
正常人;房水;淀粉樣蛋白;Tau蛋白;淀粉樣前體蛋白
阿爾茨海默病(Alzheimer’s disease, AD)是一種以記憶力減退、認知功能障礙為特征的中樞神經系統變性疾病,病情進行性加重。老年斑即淀粉樣蛋白(β-amyloid protein,Aβ)斑是AD標志性病理改變[2]。Aβ是各種原因誘發AD 的共同通路, 是AD形成和發展的關鍵因素。AD病人腦脊液內被公認的濃度變化最穩定的生物標志物包括Aβ40、Aβ42、總tau蛋白(total tau protein,T -tau) 以及磷酸化tau 蛋白(phospho-tau protein,P -tau),對AD的臨床診斷和病情評估有一定的臨床意義,但是由于大腦體積大,腦脊液容池大,循環慢,腦脊液內Aβ和tau 蛋白不能直接快速體現中樞神經系統Aβ的變化[1-2]。
視網膜是大腦的延續,是大腦的一部分,神經眼科學研究[3-14]已經證實AD動物模型和病人視網膜已經具有AD大腦病理改變的病理特點,可以作為AD病情變化的觀察窗口。
正常人和AD病人房水中Aβ40、Aβ42、Tau和淀粉樣前體蛋白(amyloid precursor protein,APP)的濃度與年齡以及AD病情變化的相關性目前還不清楚。本研究運用Elisa方法檢測正常人房水中Aβ40、Aβ42、Tau和APP的濃度,分析其與年齡的相關性。
1 對象與方法
1.1 研究對象
對116例有白內障適應證,準備做白內障手術的病人簽署知情同意書,進行眼科常規檢查包括屈光、裂隙燈、眼壓、眼底照相、眼底光學相干斷層掃描(optical coherence tomography, OCT)。
對所有入選者進行簡易精神狀態量表(Mini-Mental State Examination,MMSE)測試,得分大于或等于28分。所有受試者還需要同時滿足以下要求:①雙眼屈光度球鏡在-3.00D到+3.00D之間,柱鏡在-3.00D到+3.00D之間,雙眼屈光度之差小于等于2D;②雙眼眼壓3次測量均小于21 mmHg(1 mmHg=0.133 kPa)。
排除標準為:①視網膜脫離、視網膜血管阻塞、視神經病變、眼部腫瘤及眼部手術病史;糖尿病視網膜病變、黃斑病變等眼底病變;②腦卒中及其他系統性疾病;③有精神系統異常或癡呆與其他中樞神經系統疾病如Lewy體癡呆、血管性癡呆、額顳葉癡呆等。
例116例白內障手術病人按照年齡分為4組,A組(年齡小于60歲,n=25),B組(年齡60~69歲,n=30),C組(年齡70~79歲,n=32),D組(年齡≥80歲,n=29)。
1.2 樣本收集及Aβ40、Aβ42檢測
所有入選者白內障手術中收集房水0.05~0.1 mL,-80度冰箱保存。運用Elisa試劑盒檢測樣本中Aβ40、Aβ42、Tau和APP濃度。
1.3 統計學方法
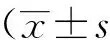
2 結果
116例正常人,年齡從小于60歲到大于80歲,房水中Aβ40、Aβ42、Tau和APP濃度并不隨年齡變化而變化,詳見表1。
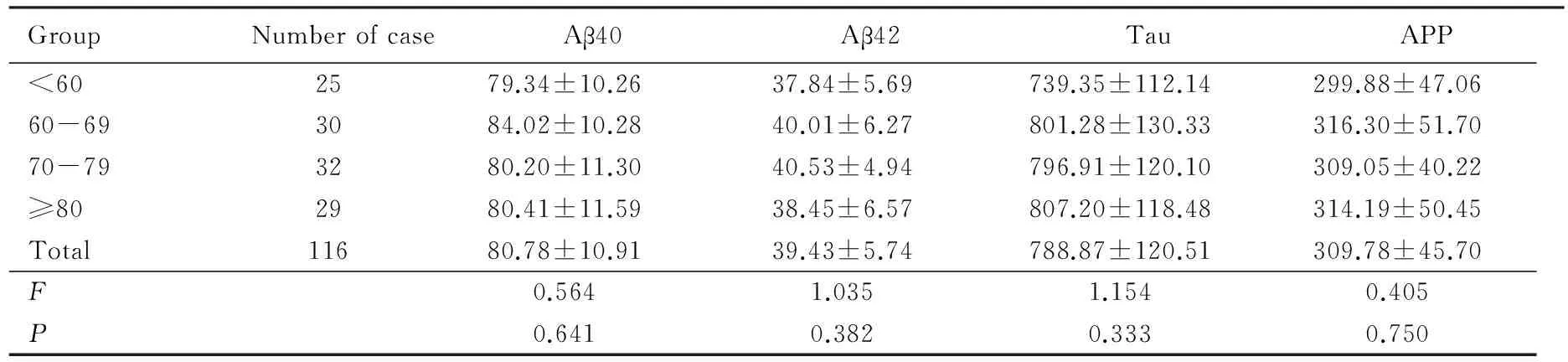
表1 正常人房水中Aβ40、Aβ42、Tau和APP的濃度Tab.1 Humor Aβ40 and Aβ42, Tau and APP in Normal aged people (pg·mL-1)
APP:amyloid precursor protein.
3 討論
3.1 視網膜神經退行性病變與 AD
Aβ級聯學說是目前比較公認的阿爾茨海默病發病機制,它認為有神經毒性的Aβ在腦內的沉積是AD大腦神經退變的關鍵病理變化。腦內異常增高的Aβ先沉積形成彌散性斑塊,并介導氧化應激、自由基形成、鈣代謝紊亂、細胞凋亡、結構破壞和慢性炎性反應,Aβ沉積在AD發病過程中起到了始發、中心和共同通道的作用。AD的核心病理過程為Aβ聚集和tau蛋白高度磷酸化。
APP是一種在神經系統高度表達的蛋白,半衰期短,只有20 min。它的代謝可導致Aβ42聚積,Aβ42聚集可產生寡聚體,誘發AD病理改變。Aβ是由APP經過內源性分泌酶裂解后形成,主要包含Aβ40和Aβ42。Aβ40在正常老年人和AD病人腦內均存在,而Aβ42則主要分布于AD病人腦內,Aβ42是形成老年斑的主要成分。
視網膜是大腦的延續,是大腦的一部分,和大腦具有相同的病理生理特點。視網膜發生任何異常均可直接或間接反映某些大腦的病理改變。
AD尸體病理檢查[3-4]顯示,AD病人視網膜節細胞減少,神經纖維減少。運用光學相干斷層掃描等現代技術檢查也證實AD病人視網膜神經纖維變薄。筆者前期運用光學相干斷層掃描研究也發現AD病人視網膜神經纖維層變薄,而且以顳上顳下為明顯[5-6]。
實驗研究[7-10]顯示APP單轉基因和APPswe/PS1dE9雙轉基因AD模型小鼠視網膜神經細胞APP過度表達,細胞內Aβ堆積,磷酸化Tau蛋白增加,視網膜炎性反應,膠質細胞增生,節細胞凋亡增加,視網膜和脈絡膜血管Aβ沉積。近年來有研究者[11-12]運用剛果紅、S硫磺素和姜黃素染色,發現APPswe/PS1dE9雙轉基因AD小鼠和AD病人視網膜有AD特征性病理改變——Aβ斑形成。
筆者前期的研究[10,13]顯示,APP單轉基因和APPswe/PS1dE9雙轉基因AD模型小鼠視網膜神經細胞數目減少,超微結構改變,視網膜節細胞凋亡增加,視神經纖維軸索減少。在APPswe/PS1dE9雙轉基因AD模型小鼠視上丘注射辣根過氧化物酶作為示蹤劑標記視網膜節細胞,發現小鼠視網膜節細胞數量減少。
上述研究表明AD視網膜神經退行性病變已具備AD大腦神經退行性病變的特點,可以作為AD病情的觀察窗口。
3.2 Aβ在眼內的產生與代謝
視網膜色素上皮屏障不能清除多肽和蛋白等大分子物質。所以視網膜APP代謝產物和Aβ不能通過視網膜色素上皮屏障進入脈絡膜。APP代謝產物和Aβ眼內代謝動力學研究[14]顯示:APP代謝產物和Aβ40、Aβ42,由視網膜神經細胞裂解分泌后直接進入玻璃體,通過玻璃體前界膜進入房水,通過房水循環很快排出眼外。由于玻璃體前界膜對相對分子質量較大的APP代謝產物有一定的屏障作用,而相對分子質量較小的Aβ可以直接彌撒進入房水。玻璃體直接和視網膜大范圍接觸,視網膜分泌產生的APP產物、Aβ及tau蛋白等可直接進入玻璃體、房水,而且在眼內快速運轉,受干擾因素更少,因此AD生物標志物濃度在房水中的改變比血液、腦脊液中的改變能更直接、更敏感反映AD的病理變化。
3.3 AD生物標志物與眼科相關疾病
Aβ40、Aβ42是APP裂解產物,Tau、APP、Aβ40、Aβ42與AD發病密切相關。AD動物模型和病人青光眼視網膜神經細胞減少,神經纖維丟失,AD病人青光眼發病率明顯高于正常人群[15-18],其原因可能與Aβ42的毒性作用相關,也可能與AD病人顱壓減低導致跨篩板壓力差降低相關[19]。有研究[20]顯示Aβ42與某些眼病相關。高眼壓可導致視網膜節細胞、視乳頭以及RNLF Aβ42表達增加,老年性黃斑病變者視網膜Aβ表達增加。正常人房水中Aβ40、Aβ42、Tau和APP濃度與年齡的相關性研究國內外尚未見報道。AD、青光眼和老年性黃斑病變都是老年性疾病,隨著年齡的增加,發病率增加,老年人房水中Aβ40、Aβ42、Tau和APP濃度是否增加或減少目前尚不明確[21]。本文研究結果顯示隨著年齡的增加,正常人房水中Aβ40、Aβ42、Tau和APP濃度沒有明顯改變。有報道[22]青光眼病人房水內Aβ42濃度增加,研究[14]顯示AD動物模型房水中Aβ40、Aβ42表達增加,提示房水中Aβ40、Aβ42、Tau、APP濃度變化可以作為某些與Aβ相關疾病的檢查指標。
[1] 葛夏, 徐曉云. 2型糖尿病與老年癡呆病人認知損害的相關生物學標記物研究進展[J]. 國際神經病學神經外科學雜志, 2012, 39(3): 274-278.
[2] 戎志斌, 吳正治. 阿爾茨海默病的病因病理和治療的研究進展[J]. 貴陽中醫學院學報, 2012, 34(5): 208-212.
[3] Hinton D R, Sadun A A, Blanks J C, et al. Optic nerve degeneration in Alzheimer’s disease[J]. N Engl J Med, 1986, 315(8): 485-487.
[4] Sadun A A, Bassi C J. Optic nerve damage in Alzheimer’s disease[J]. Ophthalmology, 1990, 97(1): 9-17.
[5] Kesler A, Vakhapova V, Korczyn A D, et al. Retinal thickness in patients with mild cognitive impairment and Alzheimer’s disease[J]. Clin Neurol Neurosurg, 2011, 113(7): 523-526.
[6] Lu Y, Li Z, Zhang X, et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer’s disease: evidence in optical coherence tomography[J]. Neurosci Lett, 2010, 480(1): 69-72.
[7] Shimazawa M, Inokuchi Y, Okuno T, et al. Reduced retinal function in amyloid precursor protein-over-expressing transgenic mice via attenuating glutamate-N-methyl-d-aspartate receptor signaling[J]. J Neurochem,2008,107(1): 279-290.
[8] Ning A, Cui J, To E, et al. Amyloid-β deposits lead to retinal degeneration in a mouse model of Alzheimer disease[J]. Invest Ophthalmol Vis Sci, 2008, 49(11): 5136-5143.
[9] Dutescu R M, Li Q X, Crowston J, et al. Amyloid precursor protein processing and retinal pathology in mouse models of Alzheimer’s disease[J]. Graefes Arch Clin Exp Ophthalmol, 2009, 247(9): 1213-1221.
[10]盧艷, 唐娜, 王蓉. APP/PS1雙轉基因阿爾茨海默病模型小鼠視網膜神經節細胞丟失的初步觀察[J]. 中華眼科雜志, 2012,48(9): 836-841.
[11]Koronyo-Hamaoui M, Koronyo Y, Ljubimov A V, et al. Identification of amyloid plaques in retinas from Alzheimer’s patients and noninvasive in vivo optical imaging of retinal plaques in a mouse model[J]. Neuroimage, 2011, 54(Suppl 1): S204-217.
[12]Koronyo Y, Salumbides B C, Black K L, et al. Alzheimer’s disease in the retina: imaging retinal Aβ plaques for early diagnosis and therapy assessment[J]. Neurodegener Dis, 2012, 10(1-4): 285-293.
[13]盧艷, 董海蓮, 張麗娜, 等. 淀粉樣前體蛋白轉基因癡呆模型小鼠視網膜和視神經纖維層病理改變[J]. 眼科新進展, 2012, 32(9): 810-813.
[14]Prakasam A, Muthuswamy A, Ablonczy Z, et al. Differential accumulation of secreted Abeta PP metabolites in ocular fluids[J]. J Alzheimers Dis, 2010, 20(4): 1243-1253.
[15]Glenner G G, Wong C W. Alzheimer’s disease and Down’s syndrome: sharing of a unique cerebrovascular amyloid fibril protein[J]. Biochem Biophys Res Commun, 1984, 122(3): 1131-1135.
[16]Tamura H, Kawakami H, Kanamoto T, et al. High frequency of open-angle glaucoma in Japanese patients with Alzheimer’s disease[J]. J Neurol Sci, 2006,246 (1-2):79-83.
[17]Ferri C P, Prince M, Brayne C, et al. Global prevalence of dementia: a Delphi consensus study[J]. Lancet, 2005, 366(9503): 2112-2117.
[18]吳越, 盧艷. 阿爾茨海默病眼底改變研究進展[J]. 中華眼底病雜志, 2015, 31(6): 610-613.
[19]Wostyn P, De Groot V, Van Dam D, et al. Senescent changes in cerebrospinal fluid circulatory physiology and their role in the pathogenesis of normal-tension glaucoma[J]. Am J Ophthalmol, 2013, 156(1):5-14.e2.
[20]Ito Y, Shimazawa M, Tsuruma K, et al. Induction of amyloid-β(1-42) in the retina and optic nerve head of chronic ocular hypertensive monkeys[J]. Mol Vis, 2012,18:2647-2657.
[21]羅輪杰, 羅本燕.視網膜微血管異常與認知功能障礙關系的臨床研究現狀[J].中國腦血管病雜志,2014,11(2):100-104.
[22]周金子, 魯建華, 張文芳. 青光眼病人房水中β淀粉樣蛋白的檢測[J]. 臨床眼科雜志, 2005, 13(3): 202-204.
編輯 陳瑞芳
Study of the correlation between biomarkers of Alzheimer’s disease in aqueous humor and age in normal people
Lu Yan1 *, Li Zhen2, Wu Yue2, Zhang Jian2, Jiang Huizhong2, Wang Ningli3
(1.DepartmentofOphthalmology,BeijingShijitanHospital,CapitalMedicalUniversity,Beijing100038,China; 2.DepartmentofOphthalmology,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China; 3.DepartmentofOphthalmology,BeijingTongrenHospital,CapitalMedicalUniversity,Beijing100730,China)
Objective To evaluate the correlation between biomarkers of Alzheimer’s disease in aqueous humor and age in normal people. Biomarkers of Alzheimer’s disease including amyloid β(Aβ), Tau protein, amyloid precursor protein(APP).Methods Aqueous humor was obtained from 116 patients undergoing routine cataract surgery and was divided into 4 groups as follows: A group (age<60 years old,n=25),B group (age from 60 to 69 years old,n=30),C group (age from 70 to 79 years old,n=32), D group (age ≥ 80 years old,n=29).Quantitative analysis of Aβ40,Aβ42,Tau protein, APP in the aqueous humor was evaluated via Elisa method.Results There was no significant difference in the expression levels of Aβ40,Aβ42, Tau, APP among the 4 groups(P>0.05).Conclusion The content of Aβ40,Aβ42, Tau, APP in aqueous humor had no association with age in normal people.
normal people; aqueous humor;β-amyloid protein; Tau protein, amyloid precursor protein
首都特色應用研究(Z141107002514116)。This study was supported by Capital Characteristic Clinic Project (Z141107002514116).
時間:2017-06-09 17∶50 網絡出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170609.1750.058.html
10.3969/j.issn.1006-7795.2017.03.025]
R331.5+6
2016-01-15)
*Corresponding author, E-mail:louiselu1964@163.com

