大強度運動導致肝臟線粒功能紊亂及姜黃素的拮抗效應
高 超,劉 陽,王宇飛,張雪松,徐維盛,楊月欣
(中國疾病預防控制中心營養與健康所,北京 100050)
大強度運動導致肝臟線粒功能紊亂及姜黃素的拮抗效應
高 超,劉 陽,王宇飛,張雪松,徐維盛,楊月欣
(中國疾病預防控制中心營養與健康所,北京 100050)
目的:探討姜黃素對大強度游泳運動小鼠肝臟線粒體功能紊亂的拮抗作用。方法:成年雄性BALB/C小鼠隨機分為安靜對照組、運動對照組、運動+姜黃素組[100 mg/(kg·d)]和安靜+姜黃素組[100 mg/(kg·d)]。干預期為4w,干預期最后1w同時進行游泳運動訓練,每天訓練90 min,每天采用上述方式游泳運動7d,動物末次運動完成后處死。觀察肝臟超微病理形態改變,測定血清谷丙轉氨酶、谷草轉氨酶水平,以及肝臟線粒體膜電位、呼吸控制率等線粒體功能學指標。結果:與安靜對照組相比,姜黃素干預明顯抑制了大強度運動導致的小鼠血清谷丙轉氨酶(P<0.05)和谷草轉氨酶(P<0.05)水平的上升,減輕了運動導致的肝細胞線粒體超微病理結構異常。姜黃素干預顯著抑制了運動導致的小鼠肝臟線粒體膜電位(P<0.05)和呼吸控制率水平(P<0.05)的下降。結論:姜黃素對大強度運動小鼠肝細胞線粒體超微結構損傷和功能紊亂具有良好的拮抗作用,為天然植物化學物應用于抗運動疲勞提供新的前景方向。
姜黃素;大強度運動;線粒體;超微病理
肝臟是體內以代謝功能為主的重要器官,發揮著去氧化、分泌性蛋白質的合成、儲存肝糖等關鍵作用,與機體運動應激密切相關,同時也可能成為運動過勞性損傷的重要靶點[1]。研究表明,細胞線粒體的氧化呼吸鏈是機體活性氧(ROS)的最主要來源,正常情況下超過90%的ROS由呼吸鏈的“電子漏”產生,在細胞有氧呼吸過程中,大多數電子沿呼吸鏈傳遞至末端,最終與氧分子反應生成H2O,但存在約2%~5%的電子可從呼吸鏈酶復合物Ⅰ和Ⅱ處漏出,生成自由基[2-3]。線粒體系統的功能一直是運動性損傷的重要研究內容,肝臟組織中線粒體含量豐富,耗氧量高,尤其在大強度運動過程中,肝細胞能量代謝和氧耗驟增的情況下,生成的大量ROS直接攻擊線粒體,可能導致其超微病理結構的改變以及膜電位和呼吸控制率的下降等功能紊亂[4-5],因此,線粒體可能成為大強度運動引發肝細胞損傷的關鍵靶點[6]。
從而,尋找天然、安全、合理的外源性抗勞損的營養補充劑,減輕肝臟線粒體功能紊亂,在預防大強度運動導致的肝臟損傷中至關重要[7,8]。姜黃素是從姜科、天南星科等植物中提取的一種植物多酚,很早就作為一種天然色素被廣泛用到食品工業中。研究表明,姜黃素具有很好的抗氧化、抗炎、降血脂、抗腫瘤以及免疫調節等功效[9-10],并且可能對運動過勞損傷及線粒體功能紊亂具有良好的拮抗作用[11-13]。本實驗建立動物大強度游泳訓練損傷模型,研究姜黃素對大強度運動導致肝臟線粒體結構及功能障礙的保護作用,為姜黃素應用于創制抗過勞性損傷的膳食營養補充劑提供支持。
1 材料與方法
1.1 實驗動物
40只健康雄性BALB/C清潔級小鼠,購自上海西普爾-必凱實驗動物有限公司,5w齡,體重18~20 g,飼養于實驗室清潔級動物房,動物房溫度20±2 ℃,相對濕度50%±5%。
1.2 主要實驗儀器和試劑
1.2.1 主要儀器 BS-200全自動生化分析儀,深圳邁瑞生物醫療電子股份有限公司;Tecnai G2 12透射電子顯微鏡,荷蘭FEI公司;Spectra Max M2 全能酶標儀,美國Molecular Devices公司;氧電極,英國漢莎科學儀器公司。
1.2.2 主要試劑 姜黃素,購自美國Sigma公司;谷草轉氨酶(AST)、谷丙轉氨酶(ALT)檢測試劑盒,購自深圳邁瑞生物醫療電子股份有限公司;組織線粒體分離試劑盒,購自碧云天生物技術有限公司;羅丹明123熒光探針(Rhodamine 123,Rh123),購自美國Sigama公司;線粒體呼吸控制率(Respiratory control ratio,RCR)試劑盒,購自上海杰美基因醫藥科技有限公司。
1.3 實驗方法
1.3.1 動物模型的建立 經適應性飼養1w后,40只成年雄性BALB/c小鼠,隨機分為安靜對照組(Ct)、運動對照組(Ex)、運動+姜黃素100 mg/(kg·d)組(Ex+Cur)和安靜+姜黃素100 mg/(kg·d)組(Cur),每組10只。姜黃素以灌胃方式進行干預,而安靜對照組和運動對照組則灌胃以等量的生理鹽水,干預期為4w,干預期最后1w同時進行游泳運動訓練,水溫控制在30±1℃,水深45 cm,進行連續7d無負重游泳訓練,每天持續90min。
1.3.2 取材及樣品制備 小鼠最后一次游泳結束后摘眼球取血,分離血清并檢測AST和ALT水平。迅速切取各組肝臟1 mm3左右放在2.5%戊二醛中4℃固定,進行電鏡樣品制備。按照線粒體分離試劑盒要求,取約100 mg新鮮肝臟組織于冰浴中制備勻漿液,4℃離心(600 g),取上清液再次4 °C離心(11 000 g),將沉淀制備線粒體重懸液,待測。
1.3.3 指標測定 ALT、AST由BS-200全自動生化分析儀檢測;線粒體膜電位(Mitochondrial membrane potential,MMP)采用Rhodamine123熒光探針檢測;線粒體呼吸控制率(RCR)采用氧電極法檢測。
1.4 統計分析

2 結果與分析
2.1 姜黃素對大強度運動小鼠血清ALT和AST水平的影響
結果如圖1所示,與安靜對照組相比,大強度游泳運動顯著提高了小鼠血清ALT(P<0.01)和AST(P<0.01)水平,表明大強度游泳導致了小鼠明顯的肝細胞損傷;而姜黃素干預顯著減輕了游泳小鼠血清ALT(P<0.05)和AST(P<0.05)水平。
2.2 姜黃素對大強度運動小鼠肝臟超微病理的影響
由圖2可見,安靜對照組小鼠肝細胞線粒體基質密度正常,脊清晰,結構基本完整。游泳運動小鼠肝細胞線粒體超微形態變異明顯,可見不同程度腫脹與變形,基質電子密度下降,其嵴減少甚至消失而變空。與運動對照組相比,姜黃素處理小鼠肝細胞線粒體的腫脹和脊減少的程度相對較輕,提示姜黃素對游泳引發的小鼠肝細胞超微病理結構紊亂具有良好的拮抗效應。
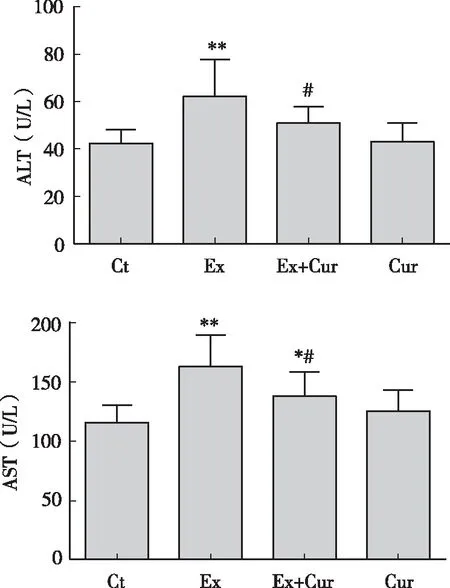
圖1 姜黃素對大強度運動小鼠血清ALT、AST水平的影響注:*、** P<0.05、 P<0.01 vs 安靜對照組;#P<0.05 vs 運動對照組
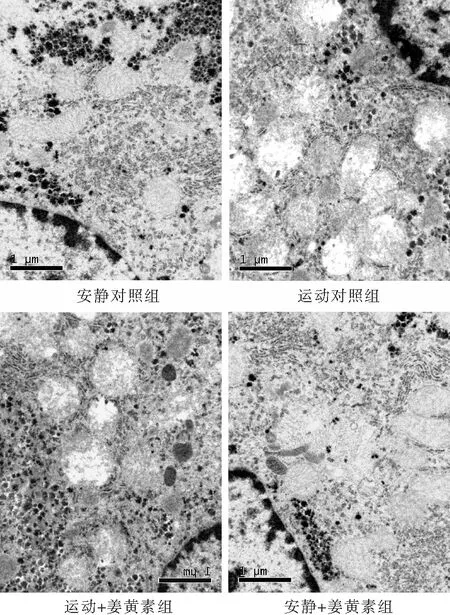
圖2 電鏡下觀察姜黃素對大強度運動小鼠肝臟超微病理改變的影響
2.3 姜黃素對大強度運動小鼠肝臟線粒體膜電位的影響
從圖3可知,大強度游泳運動導致小鼠肝臟線粒體膜電位下降35.9 %(P<0.01),姜黃素干預顯著抑制了游泳導致的小鼠肝臟線粒體膜電位的下降(P<0.05)。姜黃素本身對肝臟線粒體膜電位沒有明顯影響(P>0.05)。
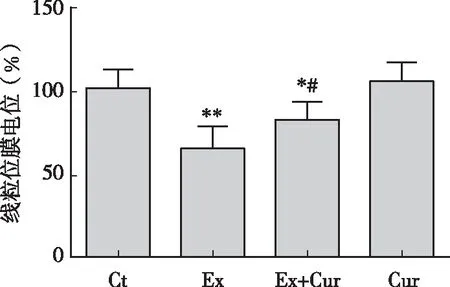
圖3 姜黃素對大強度運動小鼠肝臟線粒體膜電位的影響注:*、 ** P<0.05、 P<0.01 vs 安靜對照組; #P<0.05 vs 運動對照組
2.4 姜黃素對大強度運動小鼠肝臟線粒體呼吸控制率的影響
如圖4所示,與安靜對照組相比,游泳運動及姜黃素干預對肝細胞線粒體的3態呼吸未見顯著影響(P>0.05),但游泳運動組4態呼吸上調40.1 %(P<0.01),而姜黃素處理抑制了游泳小鼠4態呼吸的上調(P<0.05)。與安靜對照組相比,游泳運動小鼠肝臟線粒體RCR降低了31.1%(P<0.01),同時,姜黃素處理顯著緩解了游泳小鼠RCR水平的降低(P<0.05)。
3 討論
不同運動方式會對肝臟的形態、功能造成影響,而大強度運動導致的肝臟損傷卻往往在運動實踐中被忽視。研究表明,急性的劇烈運動能夠導致血清轉氨酶含量增加[14],而力竭性的運動甚至可誘發較重的肝臟組織結構改變以及炎性細胞浸潤等損傷表現[15]。肝臟富含線粒體,線粒體系統在機體運動機制中發揮著關鍵的生理作用,而以往研究中也發現,線粒體可能成為運動過勞性傷害的重要靶部位[6]。本試驗顯示,大強度運動導致了小鼠肝臟尤其是線粒體的結構和功能損傷,而姜黃素干預明顯地抑制了游泳導致的肝臟ALT和AST的釋放,顯著減輕了游泳引發的肝臟線粒體超微結構改變和功能紊亂。

圖4 姜黃素對大強度運動小鼠肝臟線粒體呼吸控制率的影響注:*、 ** P<0.05、 P<0.01 vs 安靜對照組; #P<0.05 vs 運動對照組
正常的線粒體膜電位(MMP)是維持細胞線粒體進行氧化磷酸化、生成ATP的重要前提,而MMP的改變與線粒體膜損傷及功能紊亂緊密相關[16]。本研究顯示,大強度游泳運動明顯降低了小鼠肝細胞線粒體MMP,揭示了線粒體膜損傷和病理結構改變。相關證據表明,高強度運動能夠引發線粒體膜通透性和流動性的異常,可部分歸因于活性氧的猝發[17-18]。研究表明,細胞的能量主要來源于線粒體呼吸鏈的氧化磷酸化,大約2%~5%的氧耗生成自由基,而大強度運動引發肝細胞氧化代謝加速,可能導致線粒體持續的ROS生成,同時,也使線粒體成為ROS攻擊的關鍵靶點[4,19]。有證據顯示,線粒體內膜的脂質結構易受到ROS直接攻擊和細胞氧化-抗氧化平衡狀態的影響,引起線粒體通透性轉換孔PTP開放,線粒體MMP下降,細胞色素c及凋亡誘導因子(AIF)等物質不斷釋放,線粒體過多攝入胞漿Ca2+,導致線粒體腫脹、變形等超微結構改變及相關功能障礙,最終引起細胞凋亡[6,20-21]。本研究中,姜黃素干預明顯減輕了運動小鼠肝臟線粒體膜電位的異常改變,可能與其良好的清除自由基作用有關。相關文獻顯示,姜黃素分子中含有酚羥基結構,能夠直接猝滅自由基,還可通過活化抗氧化酶系和抑制氧化酶系等途徑,發揮抗氧化活性,對線粒體膜的結構損傷以及功能紊亂發揮抗氧化保護效應[11,22]。
線粒體RCR可較好衡量呼吸鏈氧化磷酸化水平以及ATP的生產能力,是反映線粒體呼吸功能的重要標準[23],尤其4態呼吸的上調,可作為其內膜損傷的關鍵證據[24]。本試驗表明,大強度游泳運動導致肝細胞線粒體4態呼吸明顯上升,但并未使3態呼吸發生顯著改變,從而綜合表現為線粒體RCR的顯著降低。姜黃素干預則抑制了大強度游泳小鼠肝細胞線粒體4態呼吸,同時也緩解了RCR的降低,拮抗了線粒體呼吸功能障礙[6]。綜上所述,本研究結果表明姜黃素對大強度運動小鼠肝細胞線粒體結構損傷以及功能障礙表現出較好的拮抗作用,為姜黃素應用于預防大強度運動引發的肝細胞損傷、創制營養補劑提供證據支持。◇
[1]Pillon B R,et al.Oxidative stress and inflammation:liver responses and adaptations to acute and regular exercise[J]. Free Radic Res,2017,51(2):222-236.
[2]Powers S K,Radak Z,Ji L L.Exercise-induced oxidative stress:past,present and future[J]. J Physiol,2016,594(18):5081-5092.
[3]He F,et al.Redox Mechanism of Reactive Oxygen Species in Exercise[J]. Front Physiol,2016,7:486.
[4]Jackson M J,Vasilaki A,Mcardle A.Cellular mechanisms underlying oxidative stress in human exercise[J]. Free Radic Biol Med,2016(98):13-17.
[5]Yavari A,et al.Exercise-induced oxidative stress and dietary antioxidants[J]. Asian J Sports Med,2015,6(1):e24898.
[6]高超.槲皮素對劇烈運動小鼠心肌、肝臟損傷的保護作用及其機制研究[D]. 華中科技大學,2014.
[7]Myburgh K H.Polyphenol supplementation:benefits for exercise performance or oxidative stress[J]. Sports Med,2014,44 Suppl 1:S57-S70.
[8]Pingitore A,Lima G P,Mastorci F,et al.Exercise and oxidative stress:potential effects of antioxidant dietary strategies in sports[J]. Nutrition,2015,31(7-8):916-922.
[9]Prasad S,Gupta S C,Tyagi A K,et al.Curcumin,a component of golden spice:from bedside to bench and back[J]. Biotechnol Adv,2014,32(6):1053-1064.
[10]Takahashi M,Suzuki K,Kim H K,et al.Effects of curcumin supplementation on exercise-induced oxidative stress in humans[J]. Int J Sports Med,2014,35(6):469-475.
[11]Gupta S C,Patchva S,Aggarwal B B.Therapeutic roles of curcumin:lessons learned from clinical trials[J]. AAPS J,2013,15(1):195-218.
[12]Kawanishi N,et al.Curcumin attenuates oxidative stress following downhill running-induced muscle damage[J]. Biochem Biophys Res Commun,2013,441(3):573-578.
[13]劉麗霞.姜黃素結合遞增負荷有氧運動對中老年大鼠骨骼肌線粒體功能的影響[D]. 湖南師范大學,2016.
[14]Kayashima S,et al.Leucocytosis as a marker of organ damage induced by chronic strenuous physical exercise[J]. Eur J Appl Physiol Occup Physiol,1995,70(5):413-420.
[15]Huang C C,Lin W T,Hsu F L,et al.Metabolomics investigation of exercise-modulated changes in metabolism in rat liver after exhaustive and endurance exercises[J]. Eur J Appl Physiol,2010,108(3):557-566.
[16]Schlagowski A I,et al.Mitochondrial function following downhill and/or uphill exercise training in rats[J]. Muscle Nerve,2016,54(5):925-935.
[17]Perez A C,et al.Mitochondrial,sarcoplasmic membrane integrity and protein degradation in heart and skeletal muscle in exercised rats[J]. Comp Biochem Physiol C Toxicol Pharmacol,2003,134(2):199-206.
[18]Lundby C,Jacobs R A.Adaptations of skeletal muscle mitochondria to exercise training[J]. Exp Physiol,2016,101(1):17-22.
[19]Radak Z,Zhao Z,Koltai E,et al.Oxygen consumption and usage during physical exercise:the balance between oxidative stress and ROS-dependent adaptive signaling[J]. Antioxid Redox Signal,2013,18(10):1208-1246.
[20]Ascensao A A,et al.Cardiac mitochondrial respiratory function and oxidative stress:the role of exercise[J]. Int J Sports Med,2005,26(4):258-267.
[21]Conley K E.Mitochondria to motion:optimizing oxidative phosphorylation to improve exercise performance[J]. J Exp Biol,2016,219(Pt 2):243-249.
[22]de Oliveira M R,et al.Curcumin,mitochondrial biogenesis,and mitophagy:Exploring recent data and indicating future needs[J]. Biotechnol Adv,2016,34(5):813-826.
[23]Greggio C,et al.Enhanced Respiratory Chain Supercomplex Formation in Response to Exercise in Human Skeletal Muscle[J]. Cell Metab,2017,25(2):301-311.
[24]Ascensao A,Ferreira R,Magalhaes J.Exercise-induced cardioprotection--biochemical,morphological and functional evidence in whole tissue and isolated mitochondria[J]. Int J Cardiol,2007,117(1):16-30.
(責任編輯 李婷婷)
High-Intensity Excercise Induced Hepatic Mitochondrial Dysfunction in Mice and Protective Effects of Curcumin
GAO Chao,LIU Yang,WANG Yu-fei,ZHANG Xue-song,XU Wei-sheng,YANG Yue-xin
(National Institute for Nutrition and Health,Chinese Center for Disease Control and Prevention,Beijing 100050,China)

curcumin;intense exercise;mitochondria;ultrastructural pathology
國家科技支撐計劃(項目編號:2012BAD33B01);中國疾病預防控制中心營養與健康所青年科學基金(項目編號:NINH201606)。
高 超(1986— ),男,博士,助理研究員,研究方向:食物營養評價。
楊月欣(1955— ),女,研究員,研究方向:食物營養評價。

