肝復康經JNK信號通路在肝星狀細胞凋亡中的調節機制
李 驄,李寒姝,張彩華,姜妙娜,袁麗君,賈玉杰
肝復康經JNK信號通路在肝星狀細胞凋亡中的調節機制
李 驄,李寒姝,張彩華,姜妙娜,袁麗君,賈玉杰*
目的 探討中藥肝復康經JNK(c-Jun N-terminal kinase,JNK)信號通路在肝星狀細胞凋亡中的調節機制。方法 將SD大鼠隨機分為5組:正常對照組(C),模型組(M),肝復康高(HT)、中(MT)、低(LT)劑量治療組,每組給予相應的處理;HSC-T6細胞株隨機分為3組:正常對照組、乙醛組及肝復康治療組。HE染色法觀察肝組織形態結構變化;RT-PCR法測定MKK4、MKK7、JNK1、JNK2、COX-2、Survivin、Caspase-3、α-SMA、collagenⅠ和collagenⅢ的基因表達水平;免疫組織化學法和免疫蛋白印記法觀察COX-2在肝組織和肝星狀細胞中的表達。結果 正常組中COX-2幾乎不表達。與正常組相比,模型組中COX-2表達顯著增加(P<0.05)。與模型組相比,肝復康治療組各組中COX-2表達均明顯降低,其中,中劑量組最明顯(P<0.05)。與正常組相比,模型組中MKK4、MKK7、JNK1、JNK2、COX-2、Survivin的基因表達水平均顯著上調(P<0.05)。與模型組相比,肝復康治療組各基因表達水平均明顯減弱,中劑量組最明顯(P<0.05),其中Caspase-3基因表達呈相反趨勢。COX-2和Survivin的表達呈正相關,和Caspase-3的表達呈負相關。檢測α-SMA、collagenⅠ與collagenⅢ基因表達,與模型組相比,中劑量治療組表達水平明顯下調(P<0.05)。結論 肝復康可通過抑制JNK信號通路的傳導誘導肝星狀細胞凋亡,發揮抗纖維化作用。
肝纖維化;JNK;肝復康;肝星狀細胞;凋亡
0 引言
肝纖維化系指肝組織內細胞外基質(Extracellular matrix,ECM)過度增生與異常沉積,導致肝臟結構、功能發生異常改變[1-2]。其病理變化的中心事件是肝星狀細胞(Hepatic stellate cell,HSC)激活并產生大量ECM,ECM的分泌增加,而降解減少,以致其在肝內大量沉積,導致肝纖維化逐漸形成。肝纖維化是所有慢性肝病進展成肝硬化的共同病理基礎[3-4],且具有逆轉的可能[5]。因此一直以來都是相關研究領域的熱門課題。
c-Jun氨基末端激酶(c-Jun amino-terminal kinase,JNK)是絲裂原激活蛋白激酶(Mitogen-activated protein kinase,MAPK)家族中轉導并調控細胞凋亡信號的重要信號通路。JNK信號通路可以被多種胞外刺激激活,JNK有2個雙特異性上游激酶:絲裂原活化蛋白激酶激酶4 (Mitogen-activated protein kinase kinase 4,MKK4)和絲裂原活化蛋白激酶激酶7 (Mitogen-activated protein kinase kinase 7,MKK7)。研究表明,JNK參與了肝纖維化的發生發展[6],然而,目前JNK在凋亡中的作用尚不明確。環氧化酶2(Cyclooxygenase-2,COX-2)是一種誘導酶,在炎癥反應和腫瘤的發生發展中發揮重要作用。COX-2可以通過激活HSC從而在肝纖維化的發生發展中起到重要作用。而JNK通路的激活又可以調控COX-2的表達。Caspase在凋亡過程中處于關鍵地位,Caspase-3是各凋亡通路的最終執行者。Survivin是一種凋亡抑制蛋白,可通過多種調控機制發揮其強大的抗凋亡作用,促進細胞增殖。而COX-2可以通過上調Survivin的表達、下調Caspase-3的表達來實現其抗凋亡的作用。
本實驗采用CCI4誘導的肝纖維化模型,對于離體實驗部分選用乙醛作為有效刺激HSC-T6細胞的激活因子。目前許多研究證明,傳統中藥由于其多途徑、多靶點、不良反應少的特點,在肝纖維化的治療中具有顯著療效[7]。本實驗通過研究中藥肝復康對JNK信號通路在肝星狀細胞凋亡中的影響,以期探索肝纖維化治療的新的途徑。
1 材料與方法
1.1 材料
1.1.1 主要試劑 山羊抗大鼠COX-2多克隆抗體、兔β-actin多克隆抗體由Santa Cruz公司提供,兔血清工作液由北京中杉公司提供,二步法免疫組化檢測試劑盒由武漢博士德生物工程有限公司提供,DAB顯色液由北京中杉公司提供,PCR試劑盒由北京天根生物技術有限公司提供,引物由大連寶生物工程有限公司提供,胎牛血清由美國Sigma公司提供。
1.1.2 動物 清潔級健康SD大鼠55只,雌雄不限,體重180~220 g,由大連醫科大學實驗動物中心提供。
1.1.3 藥物 肝復康制劑由丹參、黃芪、白芍、白術、當歸、茯苓、赤芍、生地、柴胡、甘草、枳殼組成,其中以黃芪與丹參為主要成分,其次為茯苓與枳殼。前期多次預試驗已經確定了中藥的治療劑量。
1.1.4 細胞 大鼠肝星狀細胞HSC-T6細胞株由上海中醫藥大學肝病研究所徐列明教授贈送。
1.2 方法
1.2.1 動物分組 清潔級健康SD大鼠55只,體重180~220 g,雌雄不限,隨機分為5組:正常對照組(C),模型組(M),肝復康高(HT)、中(MT)、低(LT)劑量治療組。
1.2.2 造模 除正常對照組外,其余組大鼠每周2次皮下注射橄欖油稀釋的10% CCI4(0.5 mL/kg)共12周。正常對照組注射同體積生理鹽水。第12周末,處死模型組和正常組大鼠,迅速取出肝組織。肝復康治療組從CCI4注射的第9周開始,分別給予高、中、低劑量肝復康治療[3 125、312.5、31.25 mg/(kg·d)],至第20周末,與正常對照組一同處死,迅速取出肝組織。所有大鼠均標準飼料喂養,自由飲水。
1.2.3 藥物血清的制備 SD清潔級大鼠20只,體重300~350 g,雌雄各半。大鼠隨機分為2組,每組10只,分別為正常對照組和肝復康治療中劑量組。肝復康治療中劑量組大鼠每日中劑量肝復康灌胃1次,灌胃1周。最后一次灌胃前12 h禁食,灌胃后1 h用苯巴比妥鈉腹腔注射麻醉大鼠,在無菌條件下,打開腹腔,腹主動脈取血,取血后3 000 r/min、4 ℃離心10 min,離心后血清在無菌細胞間用0.22 μm濾器抽濾后,于56 ℃、30 min條件下滅活。置-80 ℃冰箱中保存備用。正常對照組血清制備方法同上。
1.2.4 細胞培養 大鼠HSC-T6細胞株用含10%胎牛血清、100 U/mL青霉素和100 U/mL鏈霉素的DEMN培養基于37 ℃、5% CO2混合氣體的孵箱中培養,所有細胞用無血清的DEMN培養基培養24 h后隨機分為3組:正常對照組(含10%正常大鼠血清的DEMN培養基);乙醛組(含10%正常大鼠血清、乙醛200 μmol/L的DEMN培養基);肝復康治療組(含10%肝復康治療中劑量組大鼠血清、乙醛200 μmol/L的DEMN培養基)。以上三組細胞均在37 ℃、5% CO2混合氣體的孵箱中培養48 h。
1.2.5 肝臟病理學評估標準 肝組織經多聚甲醛固定后制成4 μm厚石蠟切片,HE染色,光鏡下觀察肝臟組織形態結構變化。Ishak評分標準:0,正常組織,沒有發生纖維化;1+,部分匯管區發生纖維化,有或沒有短的纖維間隔;2+,匯管區纖維化,纖維間隔形成;3+,大部分匯管區纖維化伴明顯門門橋接;4+,可見門門橋接和門靜脈-中心靜脈橋接;5+,顯著的門門橋接和/或門靜脈-中心靜脈橋接,偶有結節。
1.2.6 免疫組織化學分析 石蠟常規脫蠟至水;3% H2O2滴到組織切片上,室溫靜置15 min,滅活內源性酶;高壓熱抗原修復,修復液為0.01 mol/L枸櫞酸鹽緩沖液,5 min;滴加正常兔血清封閉液,室溫20 min;滴加稀釋后的一抗(COX-2稀釋比例為1∶100) 4 ℃過夜;加生物素化二抗,37 ℃水浴箱中20 min;加辣根過氧化物酶標記,37 ℃水浴箱中20 min;DAB顯色,蘇木素復染3 min,流水沖洗10 min;氨水返藍,脫水,透明,封片。鏡檢:組織中棕黃色顆粒沉淀為陽性表達區域。Image-Pro-plus 圖像分析軟件進行定量分析,顯微鏡下每張切片隨機選取10個視野,統計這些區域累計光密度值(IOD),計算平均光密度值。
1.2.7 RT-PCR法測定基因表達水平 Trizol法提取總RNA,4 ℃孵育5 min;加入氯仿,蓋緊蓋后用力震蕩15 s,4 ℃孵育5 min;4 ℃、12 000 r/min離心15 min;移取上清至離心管中,加入250 μL異丙醇,混勻,-20 ℃靜置30 min;4 ℃、12 000 r/min離心10 min;棄上清,緩慢加入事先用冰預冷的75%乙醇1 mL,4 ℃、10 000 r/min離心5 min;棄上清保留沉淀,濾紙上倒置,空氣干燥5~10 min;加30 μL去DEPC水,室溫靜置10 min;瓊脂糖凝膠電泳和紫外分光光度計檢測RNA純度及完整性,應用Quant Reverse Transcriptase逆轉錄合成cDNA。以適量cDNA為模板、β肌動蛋白(β-actin)為內參照,PCR擴增各基因片段。RT-PCR相關引物序列及反應條件見表1。循環參數:94 ℃預變性5 min;94 ℃變性30 s,54~66 ℃退火30 s,72 ℃延伸30 s,32個循環;72 ℃時延伸5 min。取5 μL PCR產物在2%瓊脂糖凝膠中進行電泳,置于凝膠圖像分析(UVP)檢測條帶灰度,以β-actin作為內參校正,計算目的基因與β-actin基因擴增條帶像素灰度比值,并作為目的基因mRNA表達的相對水平。每個樣本、每個指標重復測量3次,取均值。

表1 RT-PCR相關引物序列及反應條件
1.2.8 免疫蛋白印記(Western blot)檢測 分別提取組織與細胞中的總蛋白,配置聚丙烯酰胺凝膠,濃縮膠5%,分離膠10%;按順序上樣,加入電泳液,跑膠電流:上膠25 mA,下膠30~35 mA。當電泳跑至底部需要位置時停止電泳;將電泳后凝膠切至需要大小,測量,將6張濾紙和PVDF膜剪成膠的大小,連同膠一起放入轉移緩沖液中平衡10 min;按順序制作“三明治”,連接石墨轉膜儀電源,轉膜50 min左右;取出轉膜后的PVDF膜,放入TBS和Tween20配置的5%脫脂奶粉封閉液中4 ℃過夜;取出封閉后的PVDF膜,加入用5%脫脂奶粉稀釋后的一抗(COX-2稀釋比例為1∶300),于37 ℃搖床中孵育3 h,TBST洗膜3次,每次10 min;加入按比例稀釋的HRP標記的二抗(稀釋比例為1∶2 000),37 ℃孵育1 h,TBST洗膜3次,每次12 min;配置需要體積的ECL發光液,將PVDF膜去除殘液,放入X光片夾中,滴上ECL發光液;暗室中打開X光片夾,根據熒光強弱來決定曝光時間。曝光完成后迅速取出膠片,浸入顯影液中晃動,當膠片上出現明顯條帶后,即刻終止顯影,將膠片放入定影液中,不停晃動,至膠片透明為止。然后用自來水沖去殘留的定影液終止反應。室溫下晾干。

2 結果
2.1 肝組織形態學改變肉眼觀察 正常組大鼠肝臟表面光滑,顏色紅潤,質地柔軟。模型組大鼠肝臟固縮,表面粗糙有結節,呈土黃色,肝質硬而脆,包膜緊張,油膩感。肝復康治療組與模型組比較肝臟略腫大,表面較光滑,質地較柔軟。根據Ishak評分,各組纖維化程度評分見表2。HE染色組織病理切片:正常組大鼠肝小葉結構完整、清晰,肝索放射狀排列,無炎癥細胞浸潤(圖1A)。模型組大鼠肝小葉結構紊亂,肝細胞排列紊亂,大量纖維組織增生,假小葉形成,肝細胞腫大,脂肪變性明顯,部分壞死,炎癥細胞大量浸潤(圖1B)。與模型組相比,肝復康治療組大鼠肝臟均有不同程度改善,中劑量組效果最明顯,肝小葉結構明顯改善,纖維增生明顯減輕,纖維間隔變細,肝細胞脂肪變性得到改善 (圖1C~圖1E)。
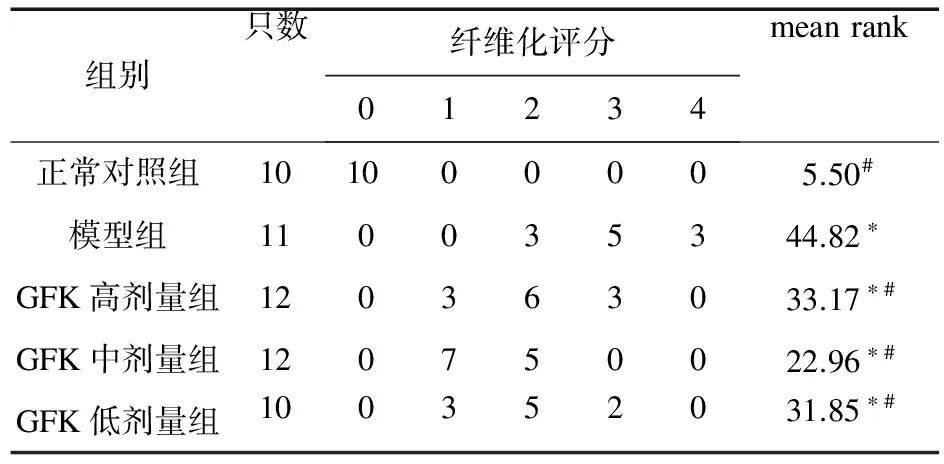
表2 GFK對肝纖維化評分的影響
注:*與正常對照組比較,P<0.05;#與模型組比較,P<0.05
2.2 免疫組織化學檢測肝復康對COX-2在肝組織中表達的影響 COX-2在正常組大鼠肝組織幾乎無表達,或偶爾少量表達于Disse間隙,門管區基底膜或間質細胞(圖2A)。在模型組大鼠肝組織中,可見大量棕黃色顆粒廣泛分布于細胞漿中,尤其在中心靜脈周圍的肝細胞和門靜脈周圍肥大的Kupfffer細胞中最為明顯(圖2B)。與模型組相比,肝復康治療組COX-2陽性表達顯著減少(圖2C~圖2E),以中劑量組最為明顯。見圖3。
2.3 Western blot檢測肝復康對COX-2在肝組織及HSC中表達的影響 正常組大鼠肝組織及細胞中COX-2低表達。與正常組相比,模型組大鼠肝組織及細胞中COX-2表達顯著上調。與模型組相比,肝復康治療組大鼠肝組織及細胞COX-2表達顯著下調(見圖4)。COX-2蛋白在各組中表達趨勢和基因表達相一致。
2.4 RT-PCR檢測肝復康對大鼠肝組織JNK通路各指標mRNA表達的影響 見圖5、表3。
與正常對照組相比,模型組中JNK通路主要的標志酶-MKK4、MKK7、JNK1和JNK2的mRNA表達明顯增多。與模型組相比,肝復康治療組各個酶的表達明顯降低,中劑量最為明顯。對于COX-2和Survivin的表達,與正常組相比,模型組表達顯著上調。肝復康治療組COX-2和Survivin的表達較模型組明顯下調,以中劑量組最為明顯。模型組凋亡蛋白Caspase-3的表達較正常組顯著下調。與模型組相比,肝復康治療組Caspase-3表達顯著上調,中劑量組最為顯著。為了證明凋亡的發生,本實驗亦檢測了凋亡標志物α肌動蛋白(α-SMA)、Ⅰ型膠原(ColleganⅠ)、Ⅲ型膠原(Collagen Ⅲ)的mRNA表達。與模型組相比,肝復康治療組中各指標的表達明顯下調。
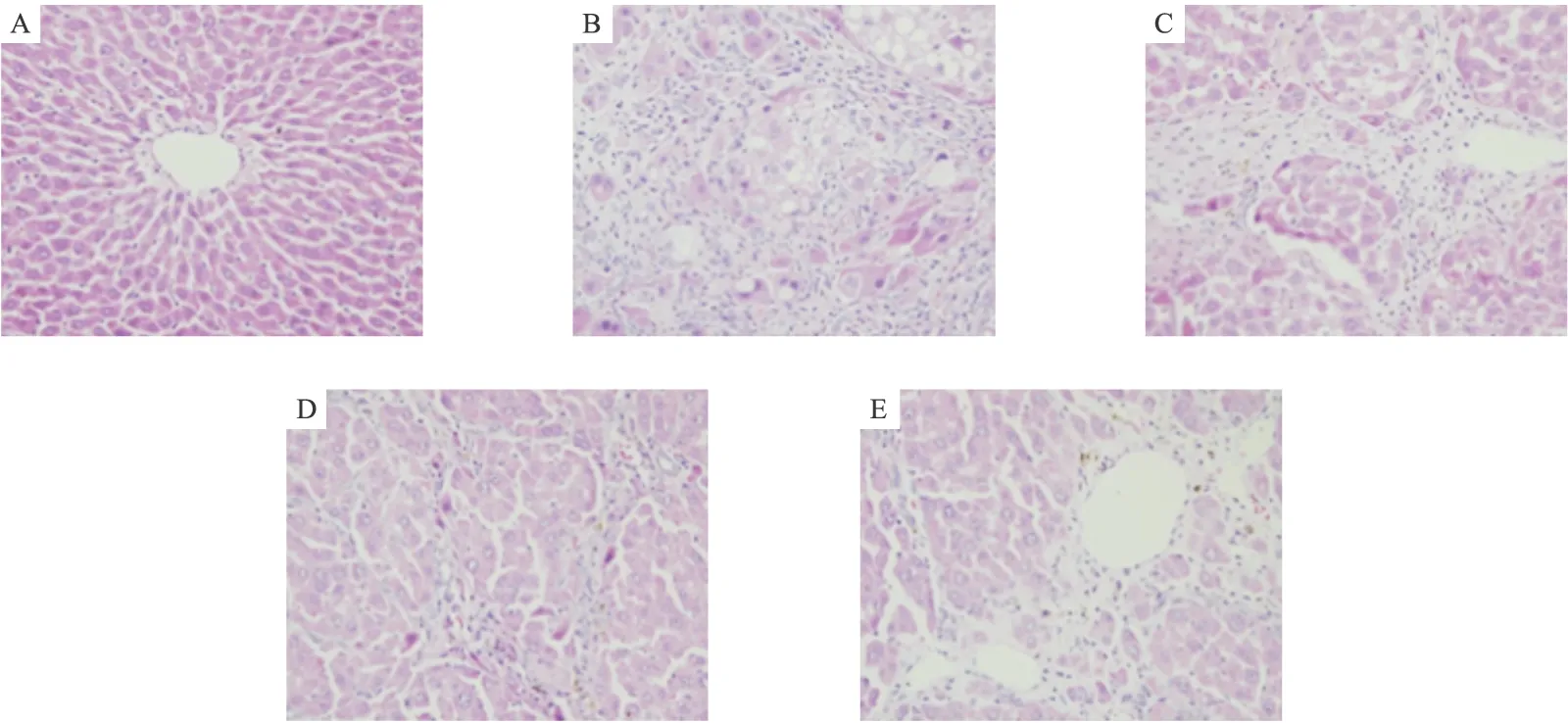
圖1 肝組織病理形態變化(HE,400×)
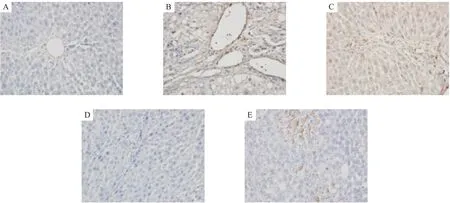
圖2 免疫組織化學檢測肝組織表達
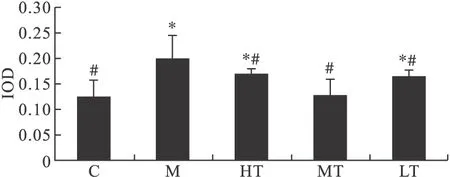
圖3 免疫組織化學檢測肝復康對COX-2在肝組織中表達的影響
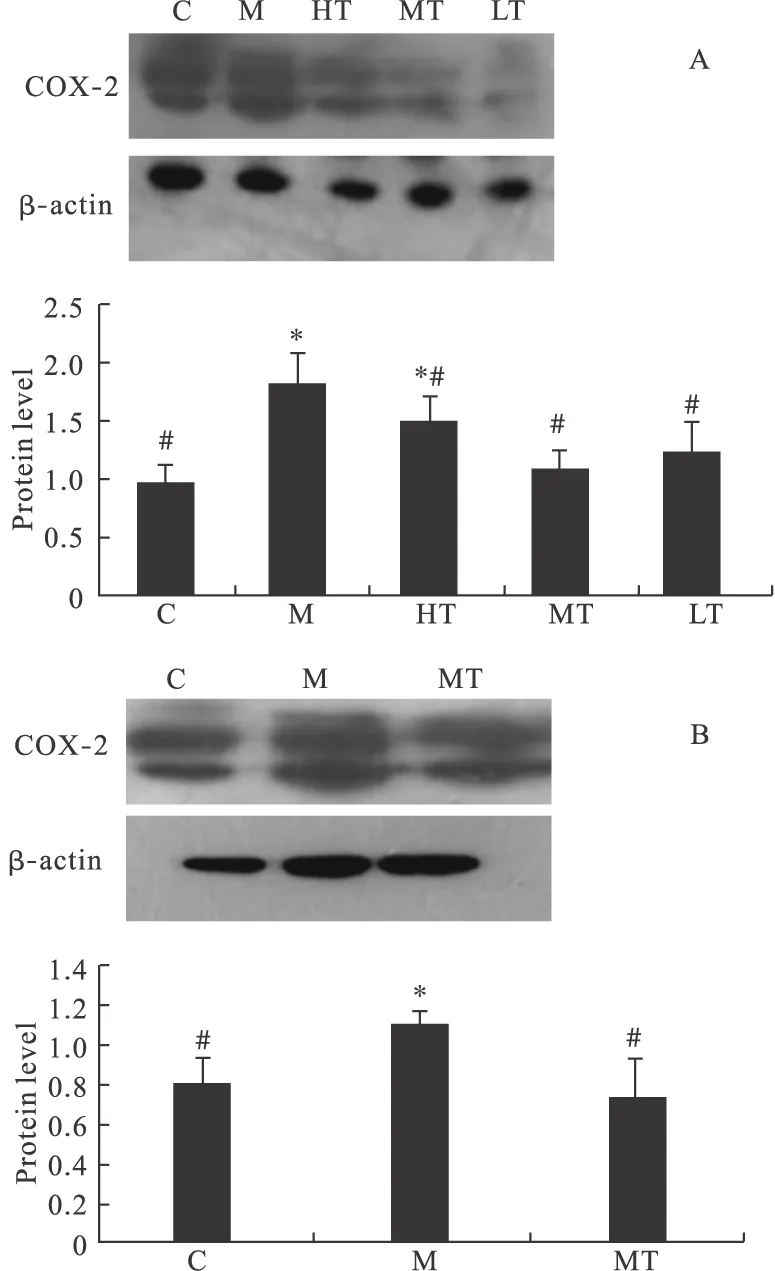
圖4 Western blot檢測肝復康對COX-2的影響
注:A.肝組織數據分析;B.細胞數據分析。圖4A中,C為正常對照組,M為模型組,HT為GFK高劑量組,MT為GFK中劑量組,LT為GFK低劑量組;圖4B中,C為正常對照組,M為乙醛組,MT為GFK治療組。*與C組比較,P<0.05;#與M組比較,P<0.05

圖5 JNK通路各指標mRNA的表達
注:肝組織中,C為正常對照組,M為模型組,HT為GFK高劑量組,MT為GFK中劑量組,LT為GFK低劑量組;HSC中,C為正常對照組,M為乙醛組,MT為GFK治療組
2.5 相關性分析 COX-2與JNK1、JNK2、Collagen Ⅰ、Collagen Ⅲ、α-SMA之間均呈正相關(P<0.01),見表4。COX-2與Survivin之間呈正相關,與Caspase-3之間呈負相關,見表5。
2.6 肝復康對HSC-T6 的作用 細胞RT-PCR結果顯示,乙醛組中JNK通路主要標志酶、COX-2和Survivivn的表達與正常組相比明顯上調;而肝復康治療組中上述指標的表達和乙醛組相比明顯下調(圖5、表6)。乙醛組中Caspase-3的表達與正常組相比明顯下調,肝復康治療組中Caspase-3的表達與乙醛組相比明顯上調(圖5、表6)。在Western blot實驗中,乙醛組中COX-2的蛋白表達水平與正常組相比明顯增多,肝復康治療組中COX-2的蛋白表達水平與乙醛組相比明顯減少(圖4)。

表3 JNK通路各指標mRNA 在肝組織中的表達
注:與C組比較,*P<0.05,**P<0.01;與M組比較,#P<0.05,##P<0.01
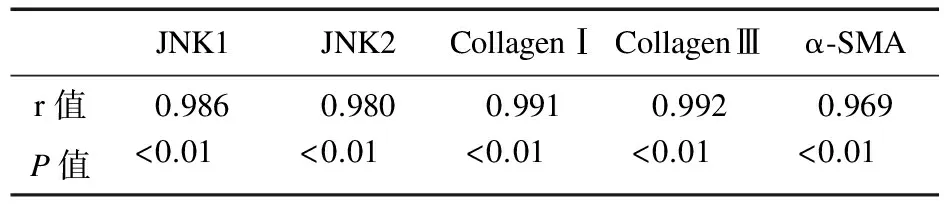
表4 COX-2與JNK1、JNK2、Collagen Ⅰ、Collagen Ⅲ和α-SMA之間的相關性分析

表5 COX-2與Survivin、Caspase-3之間的相關性分析

表6 肝復康對HSC-T6相關基因mRNA的影響
注:與C組比較,*P<0.05,**P<0.01;與M組比較,#P<0.05,##P<0.01
3 討論
肝纖維化是各種慢性肝損傷進展為肝硬化的必經階段,發病率較高。本實驗采用的中藥肝復康是以黃芪、丹參、白芍、赤芍、柴胡等為主要成分的中藥復方,具有活血化瘀、軟堅消癥的功效。盡管目前尚未應用于臨床治療,但以往的動物實驗已多次成功證實了肝復康對肝纖維化組織具有預防及治療作用[8-9]。
HSC是位于肝血竇內皮細胞與肝細胞之間的一種肝非實質細胞,正常情況下肝星狀細胞處于靜止狀態。當肝臟受到炎癥或機械刺激等損傷時,肝星狀細胞被激活并轉化為肌成纖維細胞樣細胞(Myofibroblastic-like cell,MFC)。體內外實驗均已證實,活化的HSC在肝纖維化的發生發展中起重要作用,亦是ECM的主要來源[10-11]。HSC活化的主要特征是HSC的大量而頻繁的增殖和α-SMA的表達,活化的HSC合成大量ECM,包括CollagenⅠ、Collagen Ⅲ、層黏連蛋白、透明質酸、纖維連接蛋白等多種ECM成分。凋亡在肝纖維化的逆轉中亦起到關鍵作用,HSC凋亡不僅可以減少已經活化的HSC的數量,還可以抑制HSC活化,進而有利于ECM的降解和肝纖維化的逆轉。
JNK是MAPK家族中轉導并調控細胞凋亡信號的重要傳導通路[12]。JNK位于胞質,作為JNK的2個特異性上游激酶,MKK4和MKK7通過雙磷酸化JNK的Thr、Tyr位點而激活JNK。JNK通路的活化也參與了HSC的活化和增殖,有研究證明,在大鼠HSC實驗中使用JNK特異性抑制劑抑制JNK活性,可以有效抑制肝星狀細胞的增殖,而且隨著抑制劑劑量的增加,其抑制 HSC 增殖的作用逐漸增強,表明激活JNK信號轉導通路與HSC的增殖和肝纖維化有著密切關系[13]。
本研究結果表明,與正常組相比,模型組中,隨著JNK通路中的2個特異性上游激酶MKK4和MKK7表達上調,JNK1和JNK2的表達亦顯著上調,同時,α-SMA、Collagen Ⅰ和Collagen Ⅲ的表達均上調;而與模型組相比,肝復康治療組中,MKK4和MKK7的表達顯著下調,JNK1和JNK2的表達亦明顯下調,同時α-SMA、Collagen Ⅰ和Collagen Ⅲ的表達均相應下調。與離體實驗結果相一致。結果表明,在CCI4誘導的肝纖維化大鼠和乙醛刺激的HSC中,JNK通路通過發揮抑制HSC凋亡的作用來促進肝纖維化的發展,而肝復康可以通過抑制JNK通路的表達來促進HSC凋亡的發生,最終緩解肝纖維化程度。
COX-2是一種炎癥反應過程中的誘導酶,具有促進HSC活化的作用[14]。JNK通路的激活也參與了對COX-2表達的調控。本實驗結果也證實了JNK通路在COX-2的表達調控中發揮重要作用。在COX-2抑制細胞凋亡事件中,兩種凋亡相關因子Caspase-3和Survivin亦起到重要作用。本研究顯示,與正常組相比,模型組中COX-2、Survivin的表達明顯增多,而Caspase-3的表達相對減少;在肝復康治療組中,伴隨著COX-2表達的下調,Survivin亦顯著下調,而Caspase-3表達明顯上調,即COX-2和Survivin的表達呈正相關,而與Caspase-3的表達呈負相關。以上結果證實,在CCI4誘導的肝纖維化大鼠和乙醛刺激的HSC中,COX-2通過發揮抑制凋亡作用,促進肝纖維化的發展,其抑制凋亡的發生是通過上調Survivin表達、下調Caspase-3表達的途徑來實現的。
綜上所述,傳統中藥復方制劑肝復康對于CCI4誘導的肝纖維化大鼠和乙醛刺激的HSC具有一定的抗纖維化作用,其機制可能是通過抑制JNK信號通路的傳導進而誘導HSC的凋亡來實現的。期待隨著細胞生物學、基因治療等研究的深入發展,能夠有更多新靶點、新途徑的抗肝纖維化藥物被研發。
[1] Liang L,Yang X,Yu Y,et al.Babao Dan attenuates hepatic fibrosis by inhibiting hepatic stellate cells activation and proliferation via TLR4 signaling pathway[J].Oncotarget,2016,7(50):82554-82566.
[2] Lim SW,Lee DR,Choi BK,et al.Protective effects of a polymethoxy flavonoids-rich Citrus aurantium peel extract on liver fibrosis induced by bile duct ligation in mice[J].Asian Pac J Trop Med,2016,9(12):1158-1164.
[3] Maiers JL,Kostallari E,Mushref M,et al.The unfolded protein response mediates fibrogenesis and collagen I secretion through regulating TANGO1 in mice[J].Hepatology,2017,65(3):983-998.
[4] Zhang YP,Zhao Q,Tao YZ,et al.Relationships between transient elastography values and liver fibrosis in chronic liver disease patients with normal or mildly abnormal aminotransferase levels[J].Genet Mol Res,2015,14(4):18172-18180.
[5] 彭成明,王俊平.Notch信號通路在肝纖維化中的作用[J].中國醫藥,2016,11(4):614-618.
[6] Fabre T,Kared H,Friedman SL,et al.IL-17A enhances the expression of profibrotic genes through upregulation of the TGF-β receptor on hepatic stellate cells in a JNK-dependent manner[J].J Immunol,2014,193(8):3925-3933.
[7] Zhang L,Schuppan D.Traditional Chinese Medicine (TCM) for fibrotic liver disease:hope and hype[J].J Hepatol,2014,61(1):166-168.
[8] Lou JL,Jiang MN,Li C,et al.Herb medicine Gan-fu-kang attenuates liver injury in a rat fibrotic model[J].J Ethnopharmacol,2010,128(1):131-138.
[9] Jia Y,Yuan L,Xu T,et al.Herbal medicine Ganfukang down-regulates Wnt/Ca2+ signaling to attenuate liver fibrogenesis in vitro and in vivo[J].Mol Med Rep,2016,13(6):4705-4714.
[10]Bai G,Yan G,Wang G,et al.Anti-hepatic fibrosis effects of a novel turtle shell decoction by inhibiting hepatic stellate cell proliferation and blocking TGF-β1/Smad signaling pathway in rats[J].Oncol Rep,2016,36(5):2902-2910.
[11]胡建鵬,宋正己,尋琳婷,等.美洲大蠊浸膏對大鼠HSC和SEC增殖及細胞外基質分泌的影響[J].實用藥物與臨床,2016,19(9):1061-1065.
[12]Lim W,Jeong M,Bazer FW,et al.Coumestrol inhibits proliferation and migration of prostate cancer cells by regulating AKT,ERK1/2,and JNK MAPK cell signaling cascades[J].J Cell Physiol,2017,232(4):862-871.
[13]Szuster-Ciesielska A,Mizerska-Dudka M,Daniluk J,et al.Butein inhibits ethanol-induced activation of liver stellate cells through TGF-β,NFκB,p38,and JNK signaling pathways and inhibition of oxidative stress[J].J Gastroenterol,2013,48(2):222-237.
[14]Xu Y,Zhao W,Xu J,et al.Activated hepatic stellate cells promote liver cancer by induction of myeloid-derived suppressor cells through cyclooxygenase-2[J].Oncotarget,2016,7(8):8866-8878.
Regulation mechanisms of Ganfukang in hepatic stellate apoptosis through JNK signaling pathways
LI Cong,LI Han-shu,ZHANG Cai-hua,JIANG Miao-na,YUAN Li-jun,JIA Yu-jie*
(Department of Pathophysiology,Dalian Medical University,Dalian 116044,China)
Objective To explore the regulation mechanisms of Ganfukang (GFK) in hepatic stellate cells (HSC) apoptosis through JNK signaling pathways.Methods All the SD rats were randomly divided into 5 groups:normal control group (group C),model group (group M) and high,middle and low dose treatment groups (group HT,group MT and group LT).HSC-T6 cell line was randomly divided into three groups:control group,acetaldehyde group and GFK group.The pathological changes of hepatic tissues were observed under light microscope by HE staining.The mRNA expression of MKK4,MKK7,JNK1,JNK2,COX-2,Survivin,Caspase-3,α-SMA,typeⅠcollagen and typeⅢcollagen was measured by RT-PCR,and the hepatic expression of COX-2 was detected by immunohistochemistry and western blot.Results The COX-2 was rarely expressed in group C.The expression of COX-2 protein in group M increased more significantly than that of group C (P<0.05).Compared with group M,the expression of COX-2 protein decreased in group MT (P<0.05).The expression levels of main kinases in JNK pathway (MKK4,MKK7,JNK1 and JNK2) and Survivin in group M were higher than those of group C (P<0.05),and they were lower in GFK treatment groups than those of group M (P<0.05),while the tendency of expression levels in Caspase-3 mRNA was contrary.The expression of COX-2 was significantly positively correlated with Survivin,and negatively correlated with Caspase-3.The expression of colleganⅠ,collagenⅢ and α-SMA mRNA in group MT was lower than that of group M (P<0.05).Conclusion GFK has therapeutic effect on liver fibrosis by inducing the apoptosis of HSC through inhibiting the transduction of JNK signal pathway in liver fibrosis.
Liver fibrosis;JNK;Ganfukang;HSC;Apoptosis
2017-01-21
大連醫科大學病理生理學教研室,大連 116044
遼寧省教育廳課題(2009A190)
10.14053/j.cnki.ppcr.201706003
*通信作者

