不同臨床評分結合耳褶征對于預測冠心病診斷價值的初步探討
馮 靜,鄒愛春,潘黎明,黃建芬,李世敬,王 軍
(北京市門頭溝區醫院 心內科,北京102300)
不同臨床評分結合耳褶征對于預測冠心病診斷價值的初步探討
馮 靜,鄒愛春,潘黎明,黃建芬,李世敬,王 軍
(北京市門頭溝區醫院 心內科,北京102300)
目的 分析升級的Diamond-Forrester法(updated Diamond-Forrester method,UDFM) 和Duke 臨床評分(Duke clinical score,DCS) 與耳褶癥的相關性,初步評價不同臨床評分與耳褶征所構建的診斷方法對于冠心病診斷的價值。方法 選擇2011年5月-2014年5月因胸痛疑診為冠心病而于2周內行冠狀動脈造影的住院患者373例。記錄每名患者耳褶征的情況并估算UDFM 和DCS評分。以CA 結果為金標準,分析ELC,DCS,UDFM,ELC+DCS,ELC+UDFM等不同診斷方法對于冠心病的診斷特性。結果 對于CAD診斷敏感性的比較,DCS組為89%,略高于其他各組;對于CAD診斷特異性的比較,ELC+DCS組為38%,為各組之最; ELC+DCS組與ELC+UDFM組對于CAD陽性預測價值為75%;以CA 為金標準,ELC+DCS組的ROC曲線下面積為0.613,略大于其他診斷模型;ELC+DCS組的診斷準確性為77%,略高于其他各組。結論 對于疑診冠心病的胸痛患者,ELC+DCS診斷組合較其他診斷形式更適用于冠心病擬診。
冠心病;冠脈造影;耳褶征
冠狀動脈造影(coronary angiography,CA) 是臨床診斷冠心病的金標準,但費用昂貴,大劑量輻射和造影劑可能會對患者造成不同程度損害[1,2]。具有怎樣臨床特征的疑診冠心病患者最適合進行CA檢查一直是臨床工作的難點和重點之一,Duke(Duke clinical score,DCS)及Diamond-Forrester臨床評分(Updated Diamond-ForresterMethod,UDFM)[3-5]為目前應用最為廣泛的冠心病診斷模型,通過對患病人群進行危險度分層,可以減少無冠心病患者進行昂貴診斷試驗和藥物治療的情況,但相關研究指出這些臨床評分可能會不同程度的過高估計患者的發病率。耳褶征 (earlobe crease ,ELC)較易識別,雖然不能替代客觀的檢測方法,但可為臨床診斷CAD提供一個重要線索,不失為普查篩選冠心病的重要體征[6]。臨床評分與耳褶征結合是否會增加CA的診斷價值,國內外研究少有報道,本文將初步探討耳褶征與現有的臨床評分系統的相關性,分析評價不同臨床評分與耳褶征所構建的診斷組合對于冠心病診斷的價值,并為CA的臨床診療提供參考和依據。
1 資料與方法
1.1 研究對象 選擇2011年5月-2014年5月因胸痛疑診為冠心病而于2周內行冠狀動脈造影的住院患者373例。排除重度瓣膜疾病、2周內的急性心肌梗死、先天性心臟病、心房顫動、預激綜合征、左束支傳導阻滯、起搏器植入術后、心肌炎、心肌病、心臟神經官能癥、肺栓塞、急性感染、惡性疾病、自身免疫性疾病、營養不良性疾病及近期服用激素者。
1.2 耳褶征判定 目測患者兩側耳垂自耳屏間切跡起,斜向外下的皮膚有無深陷褶痕,褶痕1 mm以上為耳褶征陽性;如果耳垂有數條褶痕,以較深的痕跡為準。所有患者在行CA前由兩名心內科醫師獨立觀察判定,結論不一致時協商判定,且兩名醫師對于患者的病史,及影像學檢查結果并不知情;兩名醫師對于耳褶征評判的一致性為97%。
1.3 臨床評分 計算每名患者的DCS及UDFM評分。
1.4 冠狀動脈造影及結果判斷 采用Judkins法行選擇性左、右冠狀動脈造影(coronary angiography,CA)。所有CA 圖像均利用德國西門子數字血管造影機采集,由2名有經驗的心內科醫師分析,結論不一致時由二者協商決定。冠狀動脈造影結果的劃分標準:冠狀動脈造影結果未達到異常標準的患者被視為正常(無冠心病)。冠狀動脈造影結果存在左冠狀動脈主干、右冠狀動脈、左冠狀動脈前降支、左冠狀動脈旋支及其主要分支血管中≥1支血管有/>50%管腔狹窄的患者被視為異常(有冠心病)。冠狀動脈造影結果存在左冠狀動脈主干有≥50%管腔狹窄、右冠狀動脈、左冠狀動脈前降支、左冠狀動脈旋支及其主要分支血管中/>3支血管有>50%管腔狹窄和/或有2支血管有≥50%管腔狹窄并且其中有1支為左冠狀動脈前降支近端的患者被視為嚴重異常(有嚴重冠心病)。
數據分析以CA 結果為金標準,分析ELC,DCS,UDFM,ELC+DCS,ELC+UDFM等不同診斷方法對于冠心病的診斷特性。所有連續的計量資料以均數±標準差表示,正態分布變量組間比較采用兩獨立樣本均數的t檢驗;非正態分布變量組間比較采用Mann-Whitney U 檢驗。用Kappa分析不同評價方法及方法組合間的診斷一致性。經受試者工作特征曲線分析不同診斷方法的敏感性,特異性,陽性預測價值,陰性預測價值,陽性似然比,陰性似然比。多變量邏輯回歸分析冠心病的獨立危險因素。P<0.05為差異具有統計學意義。所有統計數據均由SPSS13.0 軟件分析完成。
2 結果
2.1 共納入227例胸痛患者,平均年齡62±11歲,男性141例,女性86例,其中132例患者經CA明確診斷為CAD。CA結果陰性組與陽性組一般情況比較,兩組患者在年齡、性別比例、基礎心率、左室射血分數、基礎收縮壓和基礎舒張壓、BMI、吸煙史、家族史及合并高血壓,糖尿病,高脂血等方面的差異無明顯統計學意義。
2.2 對于CAD診斷敏感性的比較,DCS組為89%,略高于其他診斷模型或模型組合;對于CAD診斷特異性的比較,ELC+DCS組為38%,略高于其他診斷模型或模型組合; ELC+DCS組與ELC+UDFM組對于CAD具有相似的陽性預測價值,但前者的陰性預測價值略好于后者;以CA 為金標準,利用ROC曲線比較不同診斷模型的準確性,得到的ELC+DCS組的ROC曲線下面積為0.613,略大于其他診斷模型;ELC+DCS組的診斷準確性為77%,略高于其他診斷模型(見表1,圖1)。
2.3 227例胸痛患者中,分別以不同診斷模型及不同診斷模型間組合為獨立變量,并納入高脂血癥,高血壓,糖尿病,CAD發病家族史,吸煙等CAD發病危險因素,分別經多元邏輯回歸分析提示ELC,ELC+UDFM,ELC+DCS為冠心病發病的獨立危險因素(見表2,表3)。
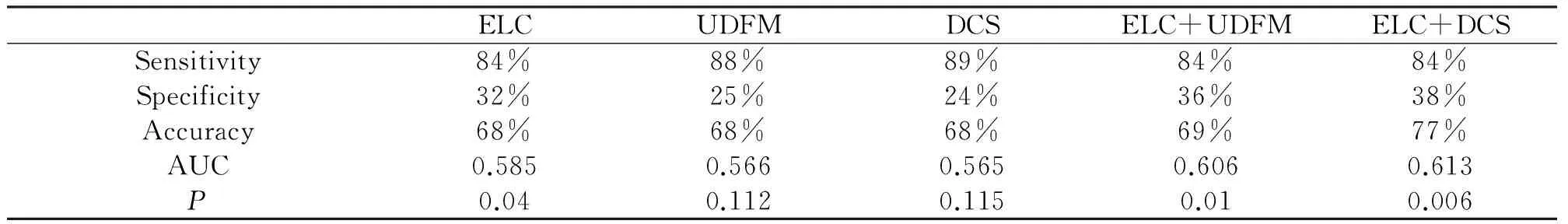
表1 不同診斷模型或模型組合間對于冠心病預測性診斷的特性
AUC area under curve;ELC earlobe crease;DF Diamond Forrester;DF+DELC Diamond Forrester and earlobe crease.* Statistically significant (ifP<0.05).
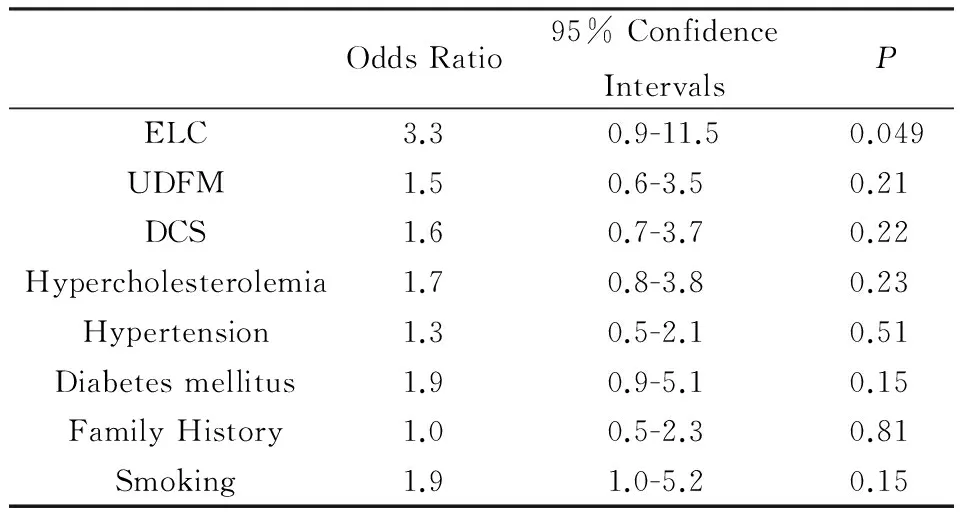
表2 分別以ELC,UDFM,DCS為獨立變量經多元邏輯回歸分析冠心病的獨立危險因素
ELC ear lobe crease;DF Diamond Forrester classification.* Statistically significant (ifP<0.05).

表3 分別以ELC+UDFM,ELC+DCS為獨立變量經多元邏輯回歸分析冠心病的獨立危險因素
*Statistically significant (ifP<0.05).DF+DELC Diamond Forrester and earlobe crease.

圖1 UDFM+ELC,DCS+ELC,ELC,UDFM,DCS對于胸痛患者診斷冠心病預測的ROC曲線
3 討論
近20年來,Duke評分和UDFM評分被世界各國所采納并逐步發展,已經成為冠心病無創檢查中診斷和判斷預后的重要指標。Manini等[3]對171例胸痛就診的患者行平板運動試驗,Duke評分低值組隨訪30天無心血管事件生存率達99.2%,并認為Duke評分低危組對短期心血管事件有較好的陰性預測價值。Alvarez等[4]研究表明,對于左主干病變、三支病變和包括前降支在內的雙支病變,Duke評分的診斷特異性和陽性預測價值,不受患者性別、年齡以及是否應用B受體阻滯劑、鈣通道阻滯劑或利尿劑的影響(P<0.01)。Kumamaru等[5]認為Duke評分的設計源于Duke資料庫中2842例因胸痛行Bruce平板試驗及CA檢查的高患病率群體,Duke評分本身在不同人群之間存在差異,在低患病率人群中對Duke進行外部驗證,可能會過高估計CAD患病可能。Jensen[7]等回顧性分析4781經CA明確診斷為CAD的患者,使用UDFM評分,Duke評分及Morris評分均可獲得一致的診斷敏感性,作者認為,相比其他評分,UDFM評分應用最為簡便,是最具有可操作性的臨床診斷模型。Meagan等[8]對114例疑診CA的患者行CTA檢查后發現許多經DF評分識別為中度風險組后經Duke評分識別為低度風險組的患者中,其中97%都不存在CAD;他們認為Duke評分相比與DF評分可能更適于識別低度風險組患者,但何種評分模型更適合甄別高風險組仍不清楚。
在我們的研究中,入組患者經UDFM評分和DCS評分預測CAD的驗前概率分別為88%和89%,遠高于實際58%的驗后概率,分析高患病率原因可能是不同研究所選擇的研究對象間存在偏倚,不同研究中存在高患病危險因素的比率存在差別;另一方面,與既往的研究相似,經UDFM評分和DCS評分的患病率遠高于實際患病率,評分系統本身受制于有限的變量,并不能完全甄別出患者的類型,判斷可能的預后以及為他們后續的診療提供有意義的指導,因此在現有評分內容及元素基礎上,引入何種臨床變量,權衡UDFM評分和DCS評分對CA患病率過高估計的影響及實現理想的評分功能,便是我們此次的重要研究目的。
Frank于1973年首次報到耳褶征與CAD的相關性,并在不同種族間經大規模流行病調查證實耳褶征能夠預測CAD的存在,并認為其與高膽固醇、高血糖、高血壓、吸煙以及心血管病家族史等CAD危險因素密切相關。Kaukola等[9]對286例胸痛患者行CA后發現,200例造影陽性的患者中ELC的比例為72%,而造影陰性的患者中ELC的比例為21%。Toyosaki[10]在對200例胸痛患者行CA檢查后,造影陽性患者中ELC的比例為26.1%,而造影陰性患者中ELC的比例為3.7%。Elliott等[11]經過尸檢發現,男性且耳褶征陽性者因心血管事件死亡的風險比耳褶征陰性者高1.6倍,而對于女性,這一比例為1.7。另一些研究[12]指出雖然耳褶癥與CAD存在一定相關性,但其局限的特異性和陰性預測價值限制了其臨床應用價值。
在我們的研究中,所有胸痛患者均經過CA進行明確診斷,DCS評分組診斷敏感性為89%, ELC+DCS組診斷特異性為38%,均略高于其他各組; ELC+DCS組與ELC+UDFM組對于CAD具有相似的陽性預測價值,但前者的陰性預測價值略好于后者; ELC+DCS組的診斷準確性為77%,為各組之最;ELC+DCS組的陰性似然比為0.42,為各組最低值,綜合評價,ELC+DCS評分組合在各評分組中表現最佳,但沒有一種評分或是評分組合接近實際的驗后概率。分別經多元邏輯回歸分析提示ELC,ELC+UDFM,ELC+DCS為冠心病發病的獨立危險因素。在將不同評分及評分組合及高脂血癥,高血壓,糖尿病 CAD發病家族史,吸煙為獨立變量,經多元邏輯回歸分析提示ELC,ELC+UDFM,ELC+DCS為冠心病發病的獨立危險因素。
最理想的評分模型莫過于它毫無例外的適合于所有患者,既可以準確的識別出最不可能或是僅有輕度可能患病的患者,又可以識別出最有可能患病的患者,后者可以通過進一步的檢查獲益最多。我們認為,對于胸痛擬診冠心病的患者,相比與傳統的依托冠心病獨立危險因素的臨床評分模型,通過與CAD密切相關的臨床表象相互結合,可以更合理的對冠心病的做出預測性的診斷。ELC+DCS組合的診斷形式,便是我們此次的嘗試之處,硬幣的一面是ELC豐富了現有臨床評分中的基本變量,另一面便是使得ELC在經DCS篩選目標人群中發揮靶向作用,以甄別出高患病風險人群。本研究為單中心研究,病例數量有限,選擇的病例不可避免地存在偏倚;且研究對象均為胸痛患者,并沒有與無胸痛的患者進行對照研究;同時,也沒有對患者的危險進行分層評分及比較,這些都是研究中存在的不足,僅為今后的臨床工作和研究提供一定的參考,期待多中心、前瞻性和大樣本量的研究以獲得更有說服力的結論,完善現有的CAD的診斷模型,使其經CA獲益更大,并避免低患病風險人群的有創檢查,以提高臨床冠心病診斷能力,優化醫療資源的利用。
[1]Wittlinger T,Voiglander T,Meyer J,et al.Possibilities and prospects of noninvasive bypass diagnosis.Comparison of different nuclear magnetic resonance tomography methods with conventional coronary angiography[J].Med Kiln,2002,97:209.
[2]Cheng VY,Berman DS,Rozanski A,et al Performance of the traditional age,sex,and angina typicality-based approach for estimating pretest probability of angiographically significant coronary artery disease in patients undergoing coronary computed tomographic angiography:results from the multinational coronary CT angiography evaluation for clinical outcomes:an international multicenter registry (CONFIRM)[J].Circulation,2011,124:2423.
[3]Manini AF,MeAfee AT,Noble VE,et al.Prognostic value of the Duke treadmill score for emergency department patients with chest pain[J].Emerg Med,2010,39:135.
[4]Alvarez-Tamargo JA,Simarro-ME,Romero-Tarin E,et al.Angiographie evaluation of high-risk treadmill scores in patients with unstable angina according to sex,age,or use of drugs with a negative chronotropic effect[J].Revista espanola de cardiologia,2006,59:448.
[5]Kumamaru KK,Arai T,Morita H,et al.Overestimation of pretest probability of coronary artery disease by Duke clinical score in patients undergoing coronary CT angiography in a Japanese population[J].J Cardiovasc Comput Tomogr, 2014,8(3):198.
[6]Frank ST.Aural sign of coronary-artery disease[J].N Engl J Med,1973,289:327.
[7]Jesper M.Jensen,Mette Voss,Vibeke B.Hansen,et al.Risk stratification of patients suspected of coronary artery disease:Comparison of five different models [J].Atherosclerosis,2012,220:557.
[8]Meagan M,Thomas J,Suhny Abbara,et al.Comparison of the Diamond-Forrester Method and Duke Clinical Score to Predict Obstructive Coronary Artery Disease by Computed Tomographic Angiography[J].The American Journal of Cardiology,2011,752:998.
[9]Kaukola S,Manninen V,Valle M,et al.Ear-lobe crease and coronary atherosclerosis[J].Lancet,1979,2:1377.
[10]Toyosaki N,Tsuchiya M,Hashimoto T,et al.Earlobe crease and coronary heart disease in Japanese[J].Heart Vessel,1986,2:161.
[11]Elliott WJ.Ear lobe crease and coronary artery disease 1,000 patients and review of the literature[J].Am J Med,1983,75:1024.
[12]Davis TM,Balme M,Jackson D,et al.The diagonal ear lobe crease (Frank’s sign) is not associated with coronary artery disease or retinopathy in type 2 diabetes:the Fremantle Diabetes Study[J].Aust New Zeal J Med,2000,30:573.
1007-4287(2017)06-0997-04
R541.4
A
2016-09-17)

