腎衰Ⅱ號方對5/6腎切除大鼠腎組織形態及腫瘤壞死因子-α表達的影響
祝婷婷,王琛,楊婧,周珊珊
?
腎衰Ⅱ號方對5/6腎切除大鼠腎組織形態及腫瘤壞死因子-α表達的影響
祝婷婷,王琛,楊婧,周珊珊
上海中醫藥大學附屬曙光醫院腎病科,上海中醫藥大學中醫腎病研究所,上海市中醫臨床重點實驗室,上海 200021
目的 觀察腎衰Ⅱ號方對5/6(A/I)腎切除慢性腎功能衰竭(CRF)大鼠殘腎組織病理形態及腫瘤壞死因子-α(TNF-α)表達的影響,探討其可能的作用機制。方法 制備5/6(A/I)腎切除CRF大鼠模型,隨機分為假手術組、模型組、西藥組和中藥組,各給藥組給予相應藥物。給藥60 d后,測定大鼠血肌酐(SCr)、尿素氮(BUN)、血紅蛋白(Hb)、內生肌酐清除率(Ccr),觀察殘腎組織病理形態,免疫組化檢測殘腎組織TNF-α的表達。結果 與模型組比較,各給藥組大鼠SCr和BUN水平顯著降低、Hb和Ccr顯著升高(<0.05,<0.01),各給藥組大鼠殘腎組織病理改變均有改善,各給藥組大鼠TNF-α水平顯著降低(<0.01),且中藥組均優于西藥組。結論 腎衰Ⅱ號方可改善CRF大鼠腎功能及腎組織病理改變,其抗腎間質纖維化機制可能與其改善腎組織缺血缺氧、調節TNF-α的表達有關。
腎衰Ⅱ號方;慢性腎衰竭;腫瘤壞死因子-α;腎間質纖維化;大鼠
腎間質纖維化是慢性腎臟疾病(chronic kidney disease,CKD)進展至終末期腎臟病的共同特征。有研究顯示,CKD存在腎小管間質的缺血缺氧[1-2]。缺氧長期以來被認為是CKD進展的主要因素之一,通過直接調控和協同作用促纖維化因子、某些缺氧反應基因,損傷細胞的能量代謝,影響炎性細胞的功能,促進腎臟纖維化的發生和發展[3]。課題組前期研究顯示,腎衰Ⅱ號方可改善慢性腎功能衰竭(CRF)大鼠腎功能、提高腎小球濾過率(GFR)、糾正貧血、增加腎血流量、降低殘余腎內氧耗[4]。本研究進一步觀察腎衰Ⅱ號方對5/6(ablation/infarction,A/I)腎切除大鼠殘余腎組織腫瘤壞死因子-α(TNF-α)蛋白表達的影響,探討腎衰Ⅱ號方改善腎間質纖維化(RIF)的作用機制。
1 材料和方法
1.1 動物
SPF級健康成年SD大鼠69只,雄性,8周齡,體質量190~210 g,上海西普爾-必凱實驗動物有限公司,動物許可證號SCXK(滬)2008-0016。飼養于上海中醫藥大學附屬曙光醫院實驗動物中心,溫度(22±2)℃,相對濕度(55±2)%,12 h光照,自由飲水攝食。
1.2 藥物
腎衰Ⅱ號方(黨參15 g、丹參15 g、當歸15 g、淫羊藿15 g、紫蘇葉15 g、川芎15 g、桃仁15 g等),上海中醫藥大學附屬曙光醫院制劑科制備,濃度7.58 g/mL;氯沙坦鉀片,杭州默沙東制藥有限公司,批號20120330,100 mg/片;福辛普利鈉片,中美上海施貴寶制藥有公司,批號201211,10 mg/片,蒸餾水制備混懸液,濃度6.42 mg/mL。
1.3 主要試劑與儀器
兔抗大鼠多克隆抗體TNF-α(批號ab66579),美國Abcam公司;SABC三步法免疫組化試劑盒(批號SA1022)、DAB顯色液(批號AR1022),武漢博士德公司。倒置顯微鏡(型號LEICA DMIL)、圖像采集系統(型號LEICA DFC295),德國LEICA公司;圖像分析系統(型號Image-pro-plus5.1),上海求為生物科技有限公司。
1.4 造模、分組及給藥
隨機選取14只大鼠為假手術組,其余55只制備5/6(A/I)慢性腎衰模型[2]。大鼠腹腔注射2%戊巴比妥鈉(0.2 mL/100 g)麻醉,常規消毒、備皮,在左側肋弓下0.5 cm、脊柱向左旁開1 cm處切口(垂直于脊柱,長約2.5 cm)。經腹膜后取左腎,分離腎包膜后,將左腎動脈的2/3分支結扎,縫合。1周后摘除右腎。4周后斷尾法采血,測定腎功能指標,剔除造模失敗和死亡動物共13只后,根據血肌酐(SCr)水平隨機分為模型組、西藥組、中藥組,每組14只。大鼠劑量按成人標準體質量(60 kg)常規用量20倍給藥。中藥組予腎衰Ⅱ號方藥液灌胃,西藥組予氯沙坦鉀聯合福辛普利鈉藥液灌胃,假手術組和模型組予等量0.9%氯化鈉溶液灌胃。給藥體積均為2 mL,每日1次,連續60 d。
1.5 取材
大鼠腹腔注射2%戊巴比妥鈉(0.2 mL/100 g)麻醉,腹主動脈采血,離心,收集血清。摘取殘腎組織于10%中性福爾馬林緩沖液中固定>24 h后脫水,石蠟包埋,制成3 μm切片。常規HE染色,觀察腎臟組織病理形態。
1.6 檢測指標
1.6.1 生化指標檢測 全自動生化分析儀檢測SCr、尿素氮(BUN)、血紅蛋白(Hb)。用內生肌酐清除率(Ccr)代替GFR。Ccr(mL/min)=尿肌酐×24 h尿量÷血清肌酐×1440[6]。
1.6.2 腎組織腫瘤壞死因子-α表達檢測 采用SABC免疫組化三步法。3 μm切片二甲苯脫蠟,梯度乙醇脫水,3%過氧化氫滅活內源性消化酶,0.01 mol/L檸檬酸緩沖液(pH 6.0)抗原修復,5%BSA封閉液封閉;適當稀釋一抗,4 ℃過夜,生物素化二抗,37 ℃、30 min;滴加SABC復合物,DAB顯色,蘇木素復染,中性樹膠封片。每個樣本隨機選取高倍鏡下5個不同視野,分析每個視野棕黃色染色區域反應面積作為陽性面積占總視野面積的百分比,取其平均值。
1.7 統計學方法
采用SPSS18.0統計軟件進行分析。計量資料以±表示,組間比較采用方差分析,多重比較采用法,組內治療前后比較采用重復測量設計的方差分析。<0.05表示差異有統計學意義。
2 結果
2.1 腎衰Ⅱ號方對模型大鼠給藥前后生化指標的影響
與假手術組比較,給藥前后模型組SCr、BUN水平明顯升高(<0.01),Ccr、Hb水平明顯降低(<0.01);給藥后與模型組比較,西藥組、中藥組SCr和BUN水平明顯降低(<0.05,<0.01),Ccr和Hb水平明顯升高(<0.01);西藥組、中藥組給藥后較給藥前SCr和BUN水平明顯降低(<0.05,<0.01),Ccr和Hb水平明顯升高(<0.01),且中藥組明顯優于西藥組,差異有統計學意義(<0.05)。結果見表1。
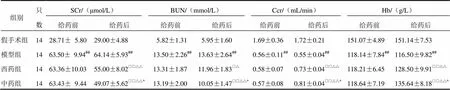
表1 各組大鼠給藥前后生化指標比較(±s)
注:與假手術組比較,##<0.01;與模型組比較,□<0.05,□□<0.01;與本組給藥前比較,△<0.05,△△<0.01;與西藥組比較,*<0.05
2.2 腎衰Ⅱ號方對模型大鼠殘余腎組織病理形態的影響
假手術組腎小球結構正常,Bowman囊腔結構清晰,腎小球基底膜較薄、無增厚;小管基底膜薄,管腔無擴張、無囊腫,管周無纖維化。腎間質無水腫、無炎癥細胞浸潤、無纖維化;模型組腎小球結構破壞嚴重,近全球性硬化,球周纖維化,毛細血管管腔閉塞、球囊粘連,腎小球基底膜彌漫增厚;腎小管擴展并充滿蛋白管型;腎間質大量炎癥細胞浸潤,可見纖維化。西藥組腎小球結構較模型組完整,Bowman囊腔結構較模型組清晰,無明顯球囊粘連,腎小球硬化程度明顯減輕;腎小管管腔無明顯擴張,管腔內見少量蛋白管型;間質炎性細胞浸潤較模型組減少。中藥組腎小球結構較西藥組完整,纖維化程度減輕,Bowman囊存在,無球囊粘連,囊腔結構較西藥組完整;管腔無明顯擴張,未見明顯蛋白管型;間質炎性細胞浸潤程度較西藥組減輕。結果見圖1。

假手術組模型組 西藥組中藥組
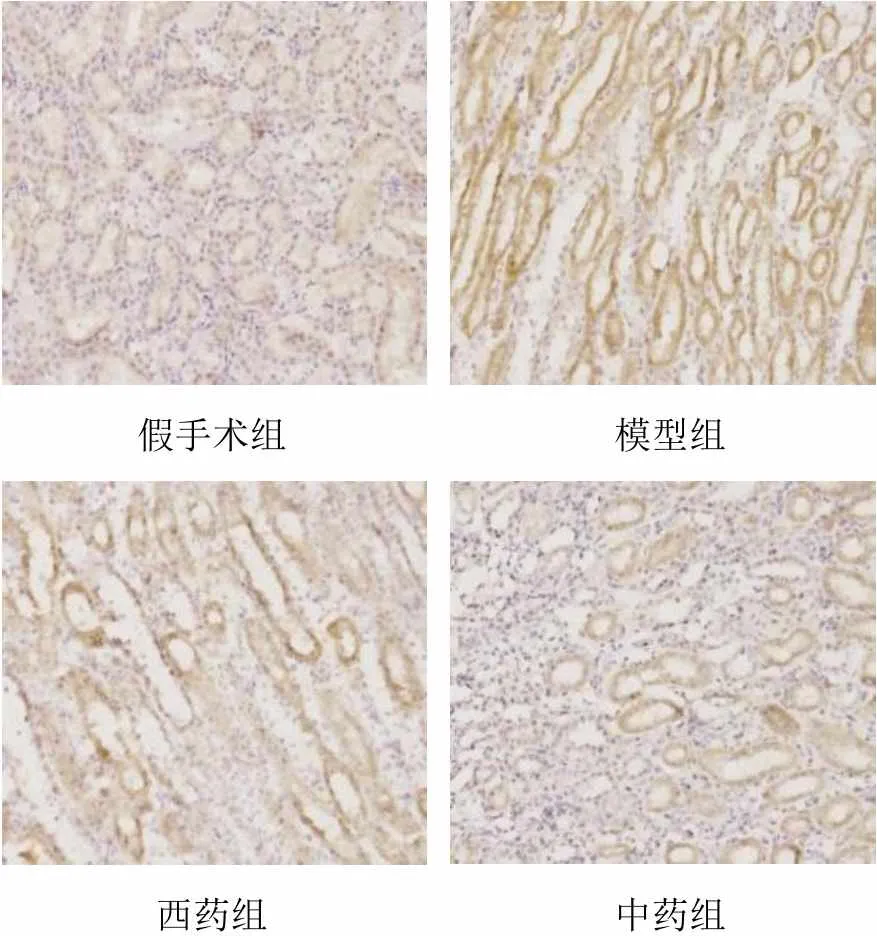
2.3 腎衰Ⅱ號方對模型大鼠殘余腎組織腫瘤壞死因子-α水平的影響
與假手術組比較,模型組大鼠腎組織TNF-α水平明顯升高(<0.01);與模型組比較,各給藥組大鼠腎組織TNF-α水平明顯降低(<0.01),且中藥組明顯低于西藥組(<0.01)。結果見表2、圖2。

表2 各組大鼠殘余腎組織TNF-α水平比較(±s,%)
注:與假手術組比較,##<0.01;與模型組比較,□□<0.01; 與西藥組比較,**<0.01
假手術組模型組 西藥組中藥組
圖2 各組大鼠殘余腎組織TNF-α陽性面積表達(免疫組化染色,×200)
3 討論
腎血流量占心輸出量的1/4,但僅有10%的氧被腎臟攝取,大多流向腎皮質以保證腎小球濾過和溶質的再吸收,腎髓質血流量較低[5]。腎皮質氧分壓約為50 mm Hg,髓質氧分壓只有10~20 mm Hg[6]。腎小管大量氧的需求和局部較低的氧供,導致生理性皮質和髓質的低氧壓張力,腎組織內環境處于低氧狀態。毛細血管對氧的通透性、氧耗、最初血流量等細小變化都能影響氧的供應和需求的平衡,在疾病狀態下,平衡一旦被打破,即表現為腎小管間質缺血、缺氧。
長期以來,慢性缺氧始終被認為是導致各類原因引起CKD進展的主要因素,缺氧影響細胞能量代謝和細胞功能、紅細胞和血管生成、炎癥細胞的信號傳導[3]。TNF-α是一種強效的促炎癥細胞因子,是參與炎癥性組織損傷的重要介質。TNF-α在腎小管間質中表達,主要存在于近端腎小管上皮細胞,通過減少腎臟血流、腎小球濾過率,改變毛細血管壁的屏障功能,形成毛細血管血栓,影響血細胞結構等途徑參與腎臟損傷。在腎組織炎癥反應中,TNF-α趨化單核細胞、中性粒細胞向炎癥部位聚集,誘導內皮細胞表達黏附分子,增強巨噬細胞的細胞毒性,調節其他炎癥細胞因子如白細胞介素(IL)-1、IL-6等釋放[7]。TNF-α誘導腎小管不同形式的炎癥基因的激活,促進腎小管間質炎癥反應,導致小管間質損害,最終引起腎功能不可逆性損傷的RIF[8]。研究顯示,TNF-α與腎功能之間存在顯著負相關[9]。抑制腎小管間質的炎癥反應,可以減少其結構和功能的破壞[10],延緩RIF進展[11]。
根據CRF臨床表現,其屬中醫學“水腫”“關格”“虛勞”“癃閉”等范疇。其形成機制復雜,或因正虛,或因邪實,或因失治誤治,每呈虛實并見,辨證除本虛外,還應注意邪實。總屬本虛標實、正虛邪實。本虛主要是脾、腎兩虛,可因病情進展影響到心、肺兩臟,及氣、血、精、陰、陽的虧損。邪實主要為外邪、痰濕、濕熱、瘀血、熱毒等。其中,痰濕、濁毒、瘀血既是臟腑功能失調的病理產物,又進一步加重臟腑虛損。腎衰Ⅱ號方中黨參健脾益氣養血,淫羊藿溫腎壯陽,共為君藥,培本固源,補腎與健脾協同并進,起到補火生土,健脾轉相滋腎的作用。臣以四味活血藥物:丹參活血養血,當歸補血活血,川芎行氣活血祛風,桃仁活血祛瘀,補瀉兼施,使補而不留邪,瀉而不傷正,氣行則血行,氣血同調。大黃瀉下攻積、清熱解毒、活血祛瘀,紫蘇葉行氣寬中、理氣和營、“散血脈之邪”(《本經逢原》),共為佐藥,使體內毒素從大便而解。全方共奏健脾補腎、益氣養血、降濁化瘀之功。
本實驗結果表明,腎衰Ⅱ號方可改善CRF大鼠腎功能,糾正貧血,減輕殘腎組織的病理改變,下調殘腎組織TNF-α的蛋白表達,其腎臟保護作用機制可能與改善腎臟血流量和缺氧環境,從而調節炎癥因子的表達有關。
[1] MANOTHAM K, TANAKA T, MATSUMOTO M, et al. Evidence of tubular hypoxia in the early phase in the remnant kidney model[J]. J Am Soc Nephrol,2004,15(5):1277-1288.
[2] ISEKI K, IKEMIYA Y, ISEKI C, et al. Haematocrit and the risk of developing end-stage renal disease[J]. Nephrol Dial Transplant, 2003,18:899-905.
[3] HAASE V H. Hypoxia-inducible factors in the kidney[J]. American Journal of Physiology-Renal Physiology,2006,291(2):F271-F281.
[4] 楊婧,王琛,邵命海,等.腎衰Ⅱ號方對5/6腎切除大鼠腎血流量和腎內氧耗影響及其作用機制[J].中國中西醫結合腎病雜志,2011,12(7):578-581.
[5] EPSTEIN F H, BREZIS M, ROSEN S. Hypoxia of the renal medulla-its implications for disease[J]. The New England Journal of Medicine, 1995,332(10):647-655.
[6] ZHANG W, EDWARDS A. Oxygen transport across vasa recta in the renal medulla[J]. American Journal of Physiology-Heart and Circulatory Physiology,2002,283:H1042-H1055.
[7] 吳金珠.TNF-α在慢性腎小球腎炎中的作用研究[J].遼寧中醫藥大學學報,2011,12(4):144-145.
[8] 杜義斌,吳曉,吳鋒,等.燈盞花膠囊對慢性腎功能衰竭大鼠腎組織炎癥因子的影響[J].中國中醫藥信息雜志,2014,21(12):63-65.
[9] PRUIJM M, PONTE B, VOLLENWEIDER P, et al. Not all inflammatory markers are linked to kidney function:results from a population- based study[J]. American Journal of Nephrology,2012,35(3):288- 294.
[10] LAMEIRE N, KRUSE V, ROTTEY S. Nephrotoxicity of anticancer drugs-an underestimated problem?[J]. Acta Clinica Belgica,2011, 66(5):337-345.
[11] THERRIEN F J, AGHARAZII M, LEBEL M, et al. Neutralization of tumor necrosis factor-alpha reduces renal fibrosis and hypertension in rats with renal failure[J]. American Journal of Nephrology,2012,36(2):151-161.
Effects ofⅡ Prescription on Renal Morphology and Expression of TNF-α in Rats with 5/6 Kidney Ablation/Infarction
ZHU Ting-ting, WANG Chen, YANG Jing, ZHOU Shan-shan
Objective To observe the effects ofⅡ Prescription on expressions of pathologic morphology and TNF-α in nephridial tissue of chronic renal failure (CRF) rats induced by 5/6th kidney (ablation/infarction, A/I); To investigate its possible mechanism of action. Methods 5/6 (A/I) nephrectomized CRF rat models were prepared and randomly divided into sham-operation group, model group, Western medicine group and TCM group. Each medication group was given relevant medicine. The levels of serum creatinine (SCr), blood urea nitrogen (BUN), hemoglobin (Hb) and endogenous creatinine clearance (Ccr) were measured after 60 days of administration. The histopathology of residual kidney was observed, and the expression of TNF-α in residual renal tissue was detected by immunohistochemistry. Results Compared with the model group, the levels of SCr and BUN significantly decreased, while Hb and Ccr significantly increased in each medication group (<0.05,<0.01). The pathological changes of the residual renal tissue were improved in each medication group. The expression of TNF-α protein in the rats of medication group was significantly lower than that in the Western medicine group (<0.05,<0.01). ConclusionⅡ Prescription can improve renal function and alleviate changes of renal pathology in CRF rats. The mechanism of anti-renal interstitial fibrosis may be related to the improvement of renal ischemia and hypoxia and the regulation of the expression of TNF-α.
Ⅱ Prescription; chronic renal failure; TNF-α; renal interstitial fibrosis; rats
10.3969/j.issn.1005-5304.2017.07.013
R285.5
A
1005-5304(2017)07-0054-04
國家自然科學基金(81573946);上海中醫藥事業發展三年行動計劃(ZY3-CCCX-2-1003);上海市衛計委科研基金(201540199)
王琛,E-mail:chenwang8@hotmail.com
(2016-07-11)
(2016-07-31;編輯:華強)

