芘番化學合成研究進展
楊軼浠, 張 玨, 邱 露, 郭曉強
(1.成都大學 海外教育學院, 四川 成都 610106; 2.成都大學 藥學與生物工程學院, 四川 成都 610106)
?
芘番化學合成研究進展
楊軼浠1, 張 玨2, 邱 露2, 郭曉強2
(1.成都大學 海外教育學院, 四川 成都 610106; 2.成都大學 藥學與生物工程學院, 四川 成都 610106)
芘番是環(huán)番的一種類型,其不僅具有芘的理化性質,同時也具有環(huán)番的理化性質.對于芘番的合成,國內鮮有報道.就芘番的定義、結構、合成和應用進行了介紹,通過對已知芘番合成路線的描述,對具有光物理、光化學活性的,能應用于熒光探針、分子識別等功能的芘番合成提供借鑒.
環(huán)番;芘番;合成
0 引 言
芘具有非常有效的光化學和光物理性質,當環(huán)番的芳香部分特定為芘的時候,此類型的化合物被稱為芘番.芘番是環(huán)番類化合物的一種類型,它同時具有芘和環(huán)番的化學、物理性質.本研究綜述了目前已知芘番的合成方法,對芘番的概念、物理性質和化學性質作了詳細的介紹,并對芘番類化合物光物理、光化學活性,熒光探針和分子識別功能的相關研究進行了探討,可進一步拓展人們對芘番類化合物新的合成方法的認識.
1 芘的結構與性質
1.1 芘的結構及其化學性質
1871年,科研人員在煤焦油中首次分離出了芘[1],其結構如圖1所示.芘作為最小的迫位稠合的多環(huán)芳香烴化合物開始進入了人們的視野.同苯相比,芘的化學反應相對局限.然而芘富含p電子,所以它在進行芳香烴的親電取代反應有相對活性.從最高被占用分子軌道來看,芘的1,3,6和8位具有非常高的軌道系數,此說明芘類化合物對于芳香烴的親電取代反應在這些位置上具有很高的選擇性[2].例外的是,當芘發(fā)生付—克異丁基化反應時,反應只會發(fā)生在芘的2位和7位上(見圖2).這主要是因為芘只有2位和7位是不受空間位阻效應影響的迫位[3].另外,芘還可以發(fā)生氧化反應,氧化后生成4,5-二酮化合物5或4,5,9,10-四酮化合物6(見圖3)[4].
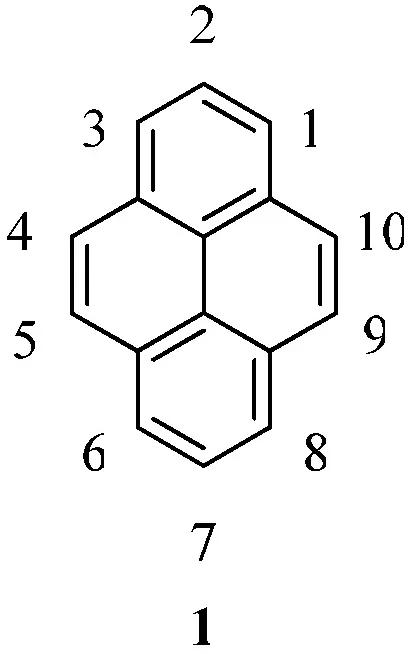
圖1 芘的結構及其編號
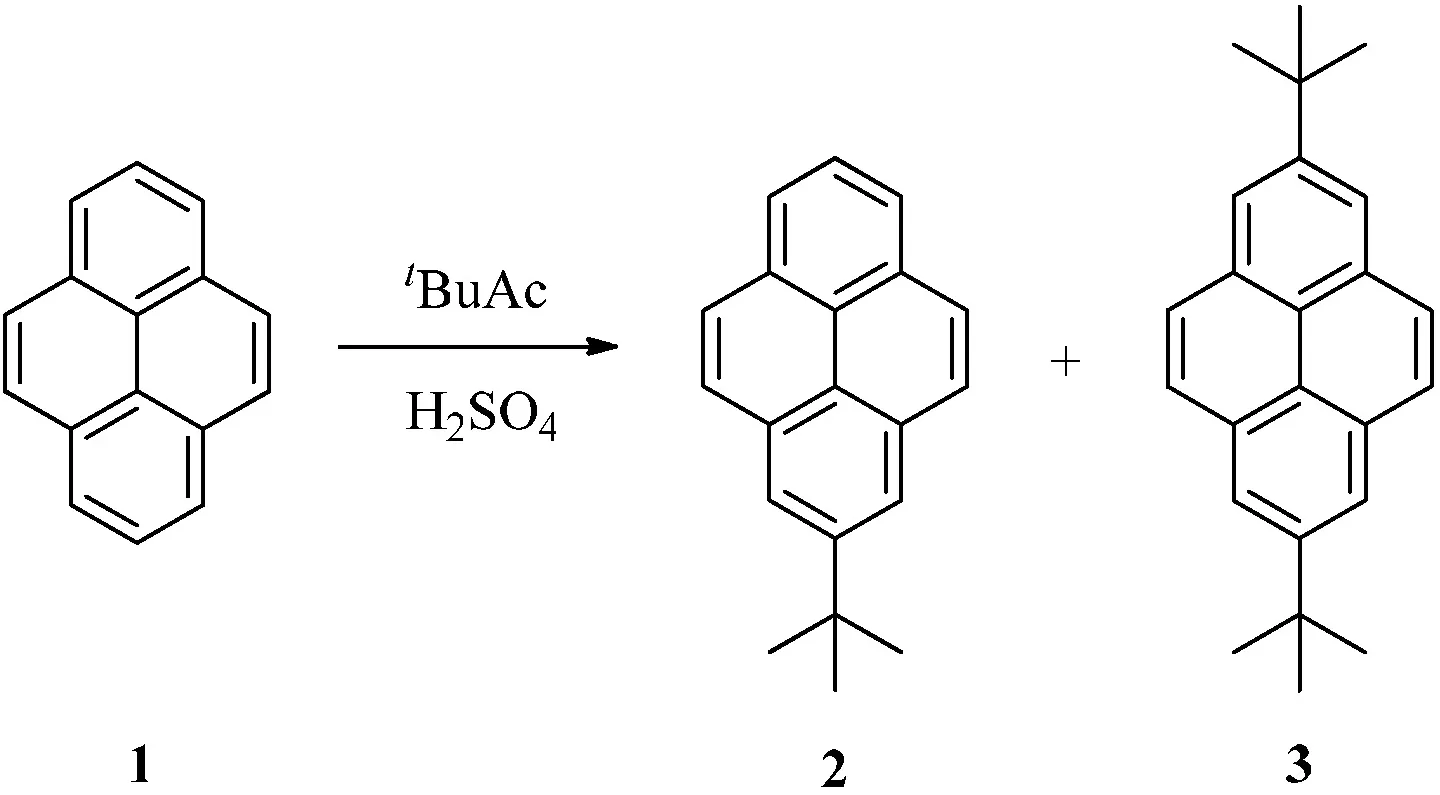
圖2 芘的付—克異丁基化反應
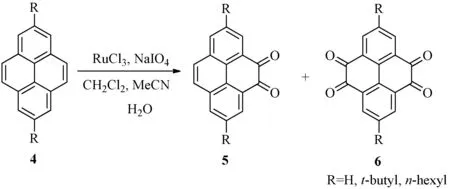
圖3 芘的氧化反應
1.2 芘的光物理與光化學性質
實驗證明,芘具有非常有效的光物理與光化學活性.芘的第一單重激發(fā)態(tài)(S1)有相當長的壽命,與基態(tài)(S0)相比,其第一單重激發(fā)態(tài)(S1)具有不同的結構[5].同時,芘有很高的熒光量子產率(Fem=0.65),非常容易形成激發(fā)態(tài)聚合物.另外,不論是熒光量子產率還是激發(fā)態(tài)聚合物對所處環(huán)境都非常敏感.
基于芘的光物理和光化學特性,一些相關的熒光探針可根據它的激發(fā)二聚體/單體的發(fā)射光譜和長熒光壽命來進行設計[6].一些分子聚合體當其含有芘結構時會有一定的識別功能,比如三氮唑連接二茂鐵芘二分體7可以選擇性的識別磷酸陰離子(見圖4)[7].
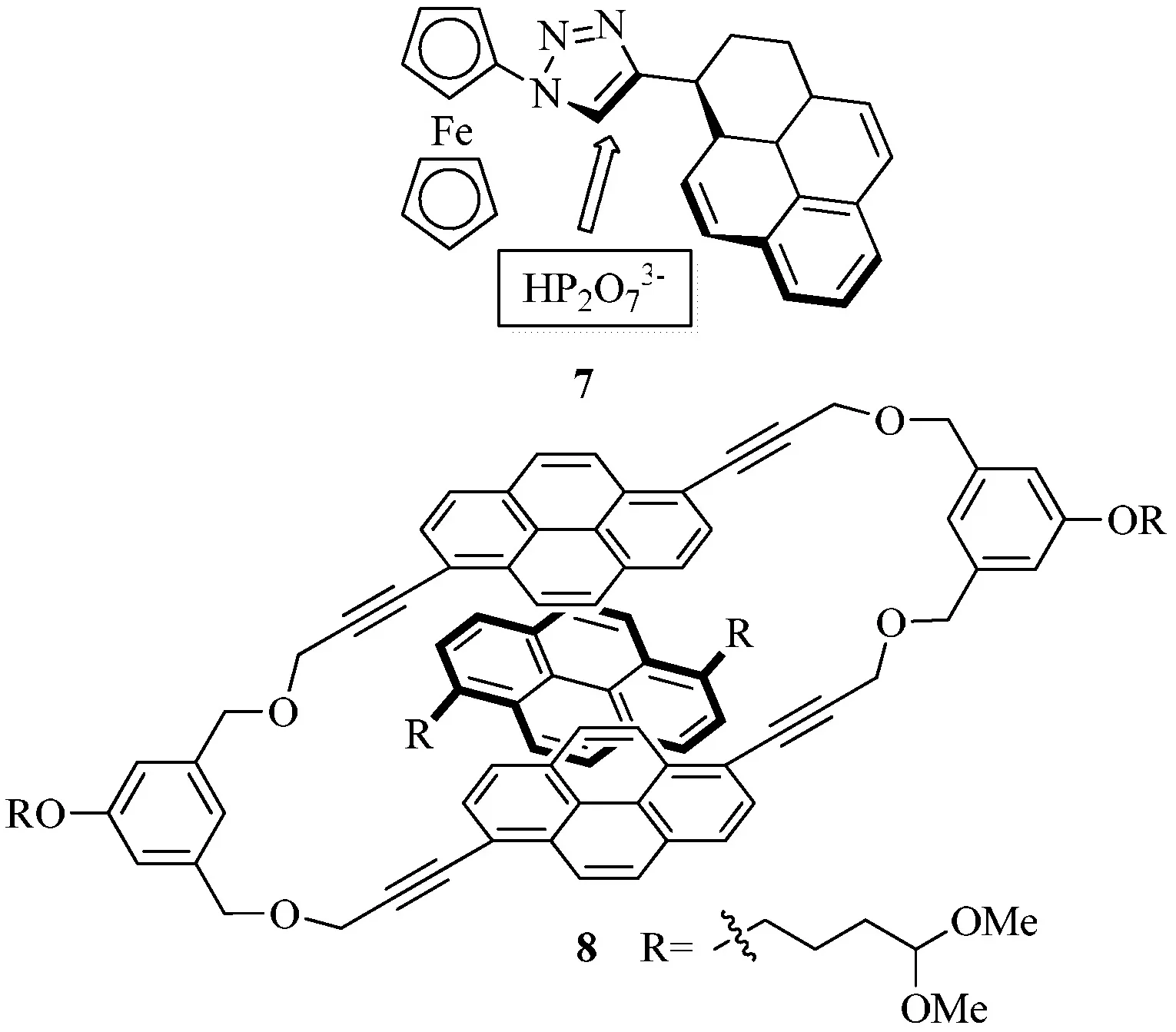
圖4 7和8的識別系統(tǒng)
目前,已知的芘衍生物應用于多個領域,如染料、農藥、醫(yī)藥和電致發(fā)光器等,并且芘衍生物作為一類較特殊結構的化合物,其開發(fā)與利用將有很大的空間及前景,如水溶性芘類衍生物8展現了分子識別的能力,由于其空腔大小為0.46×0.95×1.31 ?,這種大小的空腔可以用于識別陰性芳香烴化合物或者核酸[8].
2 芘番及其合成
2.1 芘 番
芘番是環(huán)番(Cyclophane)的一種類型,當環(huán)番的芳香烴部分特定為芘時,則稱之為芘番(見圖5).芘番是通過由線型的且各種不同數目原子所形成的橋鏈將芘上兩個不相鄰的原子連接起來的化合物.芘番所含的線型橋鏈或芘的數目可以為一個也可以為多個[9].芘番不僅具有芘的化學性質,同時也具有環(huán)番的化學性質.
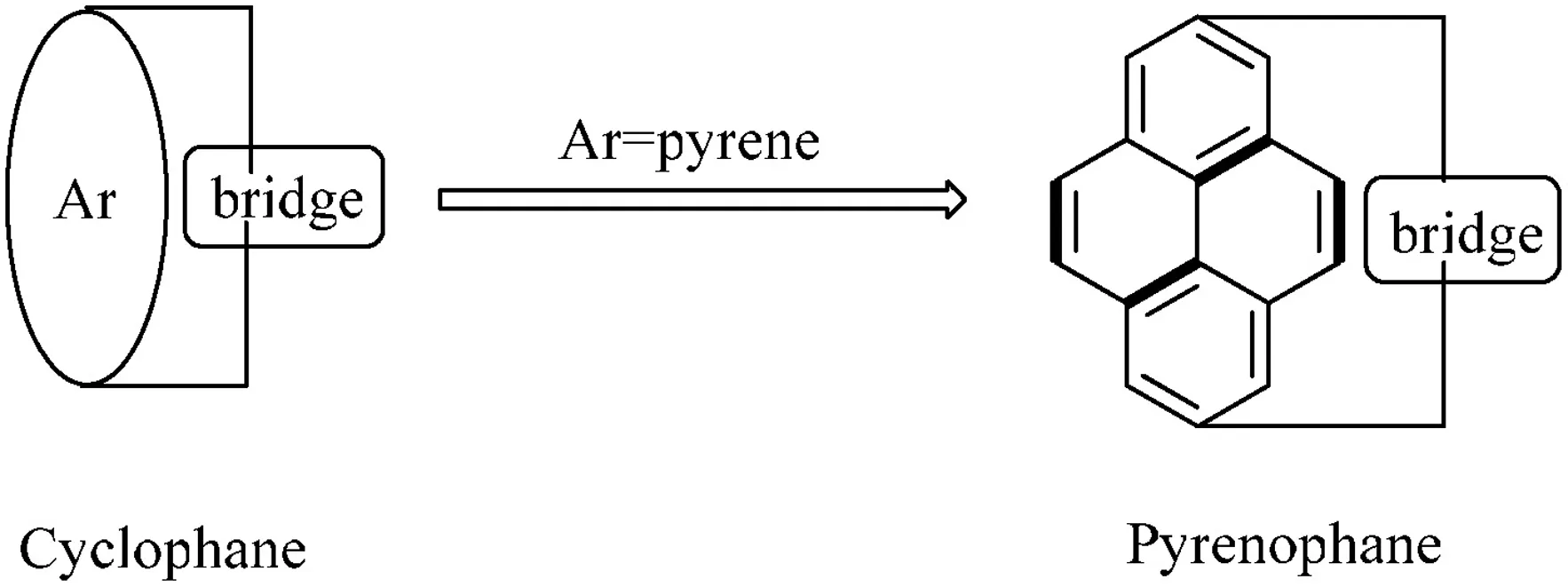
圖5 環(huán)番和芘番的關系
另外,從芘的結構上來看,其具有13種不相鄰碳原子兩兩配對的形式,這些是潛在的芘番橋鏈連接方式,如,(1,3)、(1,4)、(1,5)、(1,6)、(1,7)、(1,8)、(1,9)、(2,4)、(2,5)、(2,6)、(2,7)、(4,9)和(4,10)(見圖1).而目前僅有(1,3)、(1,6)、(1,8)、(2,4)、(2,7)和(4,9)相連接的方式被發(fā)現,其主要原因是合成具有對應取代基團的芘較為困難.
2.2 芘番的合成
2.2.1 (1,3)芘番的合成.
1993年,Yamato等[3]報道了(1,3)芘番的合成(見圖6).當芘的7位被叔丁基取代時,1,3-雙取代的芘9較為容易被合成,這主要是因為叔丁基處于芘的7位時可以阻礙6位和8位的取代反應.二溴化合物9和二巰基化合物10a在極稀釋濃度的條件下可以發(fā)生偶聯(lián)反應生成(1,3)芘番11.而當二溴化合物9和二巰基化合物10b發(fā)生偶聯(lián)反應時,由于10b化合物在二巰基之間有一個甲基取代,以至于只能生成反式構型的化合物12.另外,硫化物11和12發(fā)生氧化反應后生成砜類化合物,其構型保持不變.然而,經過高壓高溫分解,順式構型的硫化物11和反式構型的硫化物12都將生成反式構型的氧化產物(1,3)芘番13和(1,3)芘番14.其(1,3)芘番13和(1,3)芘番14的反式構型可通過對芘的2位氫的化學位移的測定(d順式11=6.85,d反式12=5.85,d反式13=5.09,d反式14=4.53)來進行證明[10-12].
2.2.2 (1,6)芘番的合成.
2004年,Inouye等[8]對一系列的具有聚陽離子和兩親性功能的大環(huán)(1,6)芘番的合成進行了報道,這些(1,6)芘番的合成主要利用的是交叉偶聯(lián)化學反應(見圖7).丁二炔15與1,6-二碘芘發(fā)生Sonogashira交叉偶聯(lián)反應后生成二碘化合物17,中間化合物17可以通過Stille交叉偶聯(lián)反應與二錫烷16(二錫烷16從化合物15反應制得)反應生成(1,6)芘番18.各式R基團,比如ω-乙縮醛,被引入來增加大環(huán)化合物的溶解度,以便進一步增強大環(huán)化合物的功能性.同時,Misumi等[13]在1978年也合成了[2.2](1,6)芘番并伴隨著[2.2](2,7)芘番的生成.
2.2.3 (1,8)芘番的合成.
化合物21是現在所知的惟一的(1,8)芘番(見圖8),二硫環(huán)番20是從化合物19通過4步化學反應而生成,硫化基團可以通過P(OEt)3來除去,通過使用DDQ的脫氫化反應可以生成反式化合物21.其中反式構型可以通過對Ha和Hb向高場移動的化學位移數值所證明(dHa=6.55,dHb=8.03)[13].
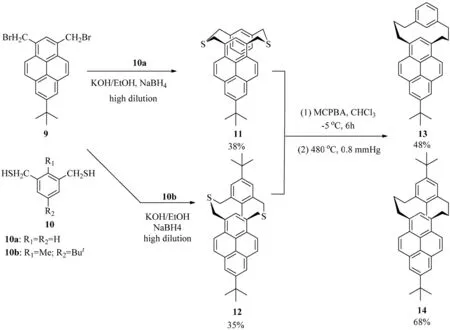
圖6 (1,3)芘番13和14的合成
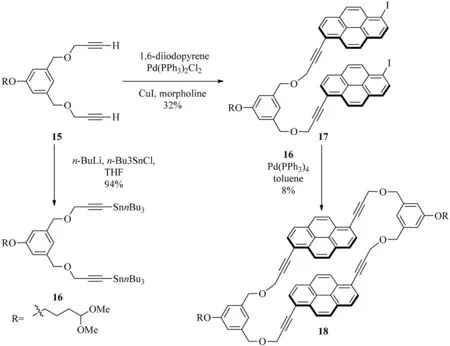
圖7 (1,6)芘番18的合成
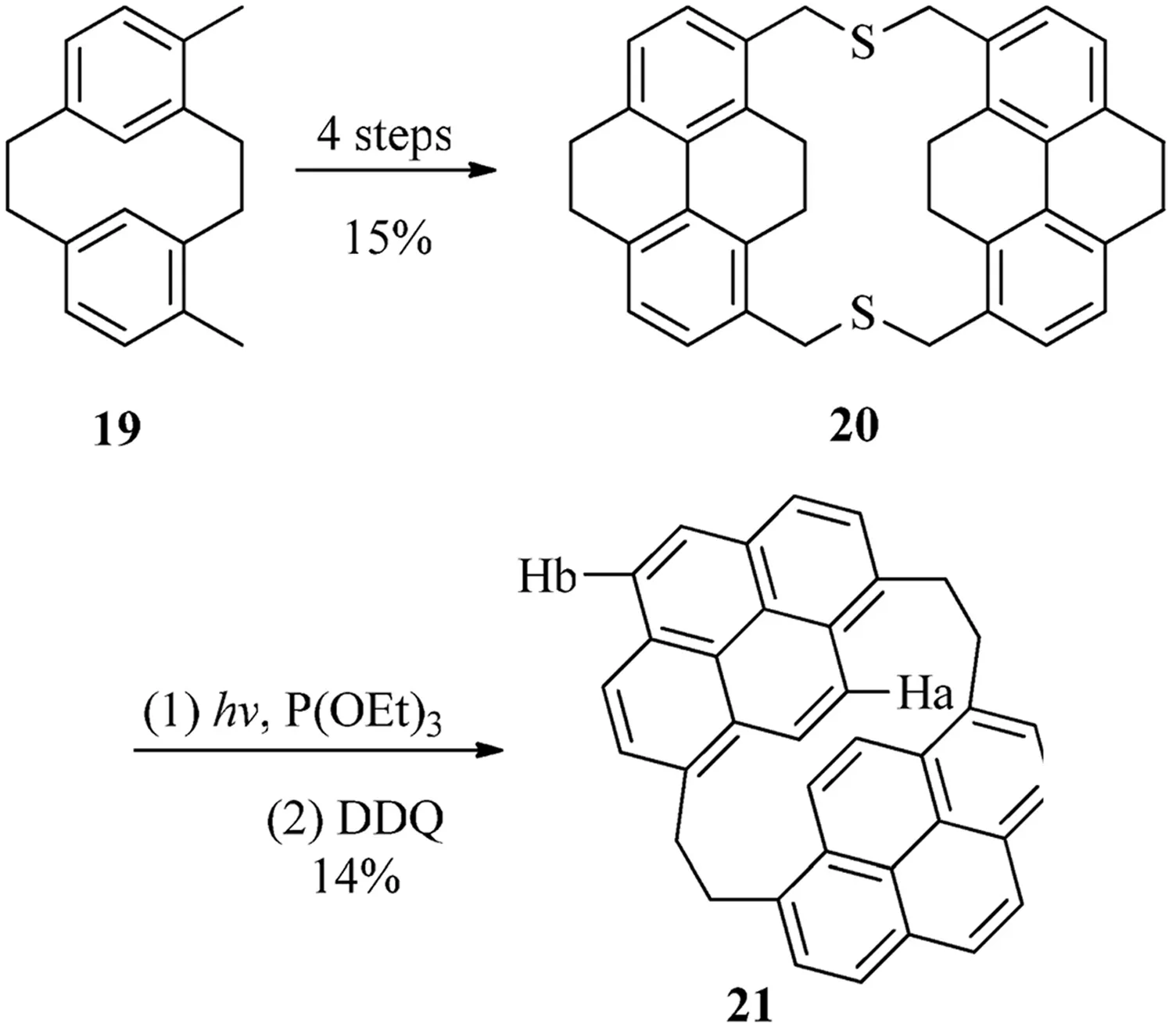
圖8 (1,8)芘番21的合成
2.2.4 (2,4)芘番的合成.
2000年,Meier等[5]合成了三芘[2,3,4-abc:2,3,4-ghi:2,3,4-mno][18]環(huán)輪烯32,實際上它也可以被看作為(2,4)芘番的一種(見圖9)[5].該合成沒有直接以芘作為起始原料,而是采用了2個起始模塊結構24和25,這2個模塊結構分別是從化合物22和23合成得到的,并且2個起始模塊可以通過Horner-Wadsworth-Emmons反應生成(E/Z)26.接著,光化學的環(huán)化脫氫反應可以生成菲的衍生物27.這時通過甲酰化Witting反應乙烯基被引入到化合物結構29中.第二次的環(huán)化脫氫反應生成具有完整芘結構的化合物30.其中它的溴化基團通過兩步化學反應被轉化為N-苯胺,同時通過三重高度(E)-選擇性的Siegrist反應最終生成(2,4)芘番32.從結構上來看,[18]環(huán)輪烯很容易在化合物32上識別出來,但是化合物32確實也是由3個芘通過橋鏈連接而成,因此屬于芘番的范疇.目前,Meier等合成的(2,4)芘番化合物是惟一已知合成的(2,4)芘番.
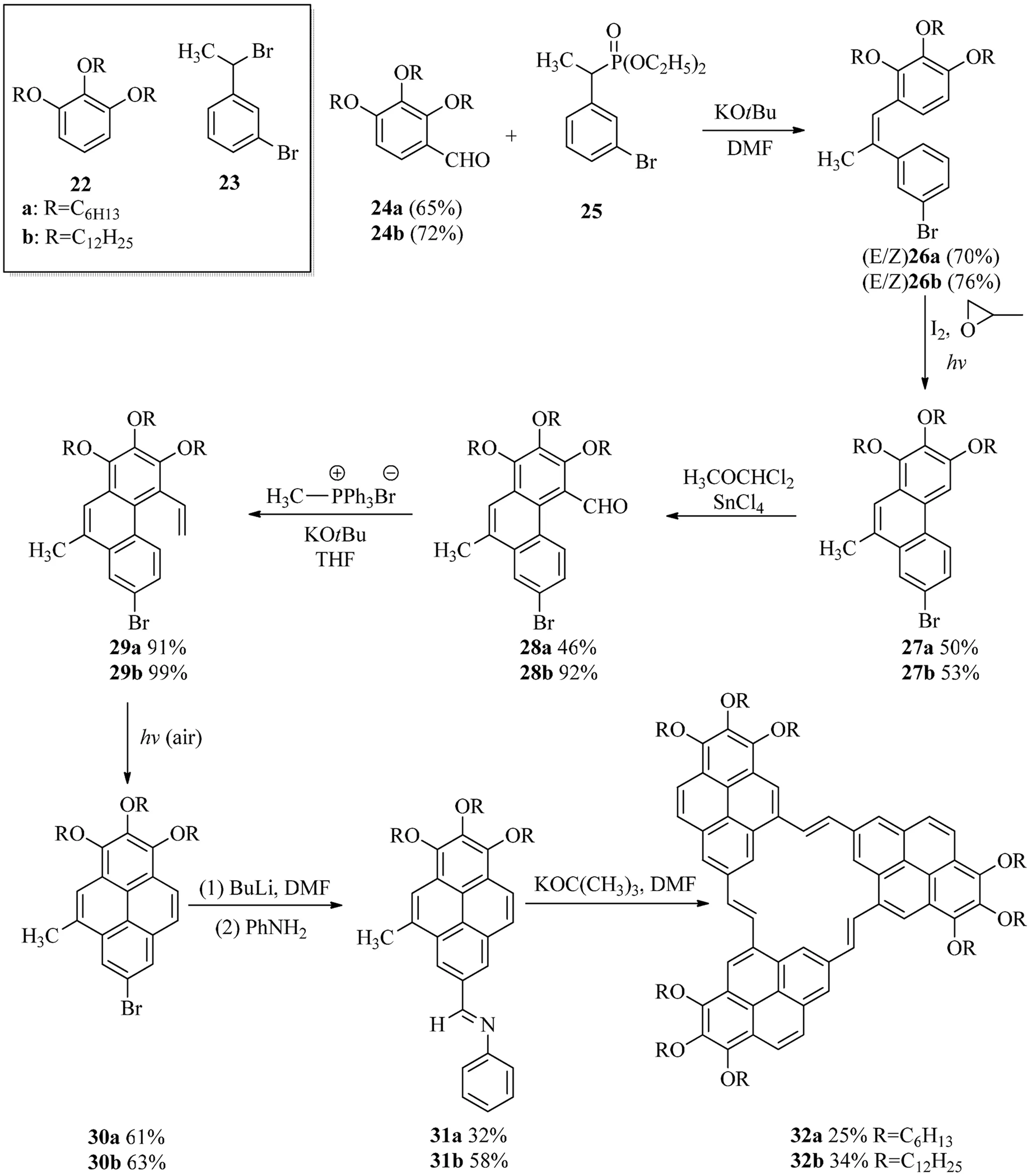
圖9 (2,4)芘番32a和32b的合成
2.2.5 (2,7)芘番的合成.
Bodwell研究團隊合成了一些列的[n](2,7)芘番,這些芘番一般都采用較為固定的合成策略(見圖10).在這個合成路線中,異構化反應/脫氫反應(VID)是最為關鍵的反應步驟,可將橋鏈[2.2]間環(huán)番-1,9-二烯生成完整的芘結構.當橋鏈的長度足夠短時,芘的結構可以被彎曲,并且當橋鏈的長度越短,芘結構的彎曲度越大[14].這種非平面性的芘可以對其彎曲度進行量化,并用彎曲度θ來表示.彎曲度θ為芘結構上C1-C2-C3 3個碳原子構成的平面與C6-C7-C8 3個碳原子構成的平面間所形成的最小夾角.現所測得芘番中最大的彎曲度θ是1,7-二氧[7](2,7)芘番34(X=1)的彎曲度,其數值為109.2 °.根據DFT計算,化合物36和37中芘結構的彎曲度分別為,93.6 °和95.8 °[15].
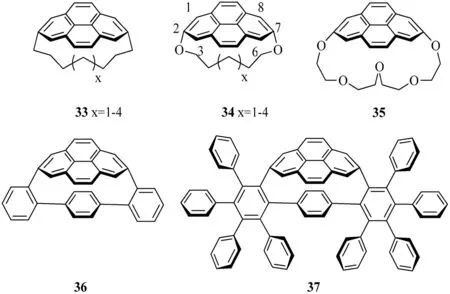
圖10 部分合成的[n](2,7)芘番
2003年,Bodwell等[16]報道了合成(2,7)芘番的方法.以1,10-二氧[10](2,7)芘番43為例(見圖11),該方法首先通過Williamson醚合成法,二酯38同1,8-二溴辛烷反應生成四酯化合物39.四酯基團與LiAlH4的還原反應所得到粗產物直接再跟HBr/H2SO4作用生成四溴化合物40,2步反應的收率為55%.此時,2個苯基除了橋鏈外,可以通過41與Na2S/Al2O3反應將1,3位側鏈連接起來進一步生成二噻環(huán)番41化合物.通過使用(MeO)2CHBF4(Borch試劑)對二噻環(huán)番41S-甲基化后再進行Stevens重排生成一系列不易分離的縮環(huán)異構混合物.第二次的S-甲基化反應和Hofmann消除反應最終生成了關鍵中間體順式-[2.2]間環(huán)番二烯42,4步反應的總產率為65%.通過氫核磁共振波譜法測定分析后發(fā)現,約一半數量的順式-[2.2]間環(huán)番二烯42可以直接轉化為終產物43.然而化合物41和42并不容易能夠分離,它們的混合物通過與DDQ反應過后,最終生成芘番43.同時,VID反應也被證明了是對于合成非平面性的芘非常有用的反應.
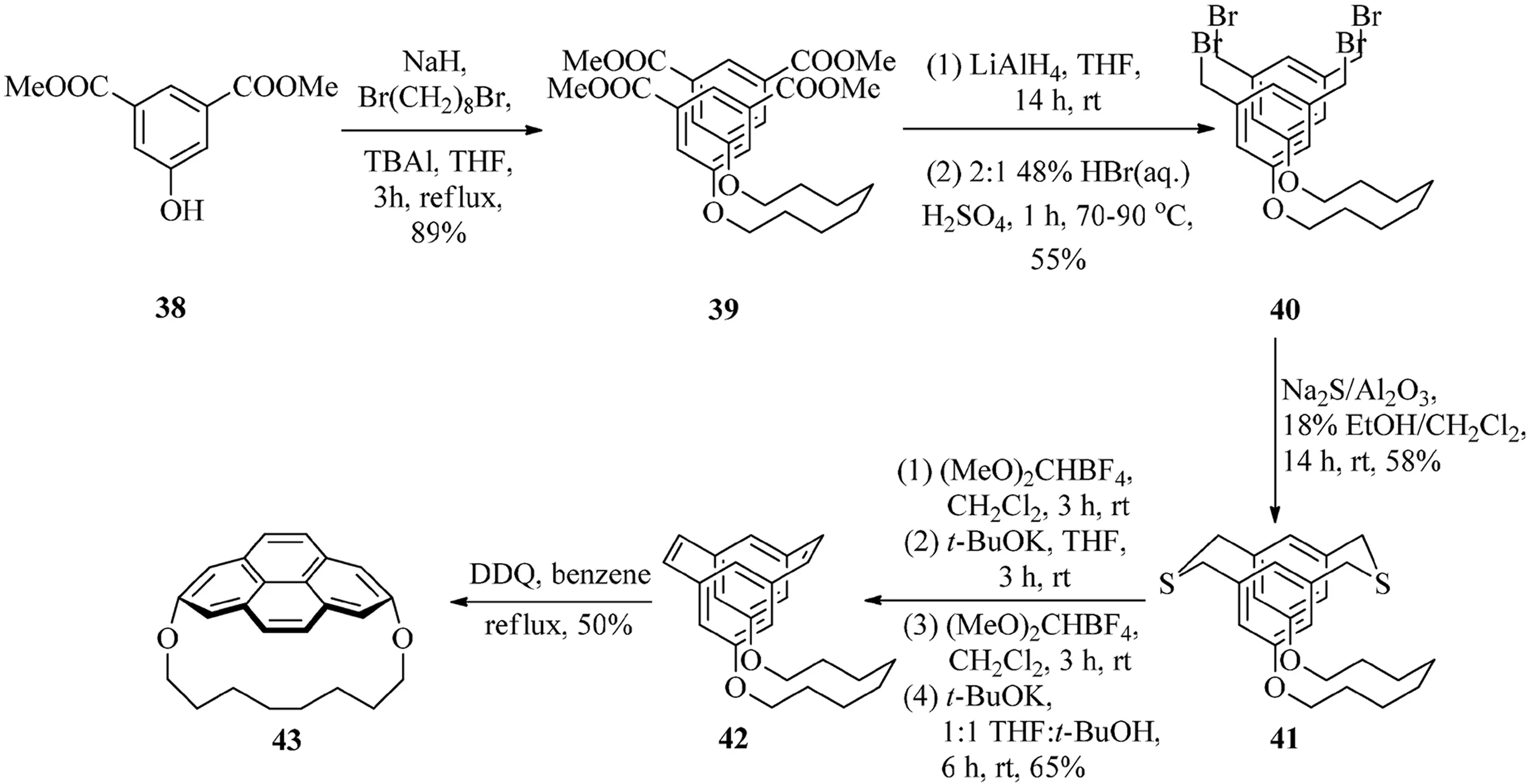
圖11 1,10-二氧[10](2,7)芘番43的合成
2.2.6 (4,9)芘番的合成.
2005年,Tsuge等[17]通過傳統(tǒng)的環(huán)番合成方法成功的合成了(4,9)芘番(見圖12),并且這個化合物是惟一的現今所知的(4,9)芘番.其方法是,雙氯甲基芘44同雙氫硫甲基苯45在Cs2CO3作用下在極稀濃度的溶液中可以制得二噻芘番46,如果將苯環(huán)上的硝基取代還原為氨基,這樣還可以用于研究氨基和芘的NH-π相互作用.
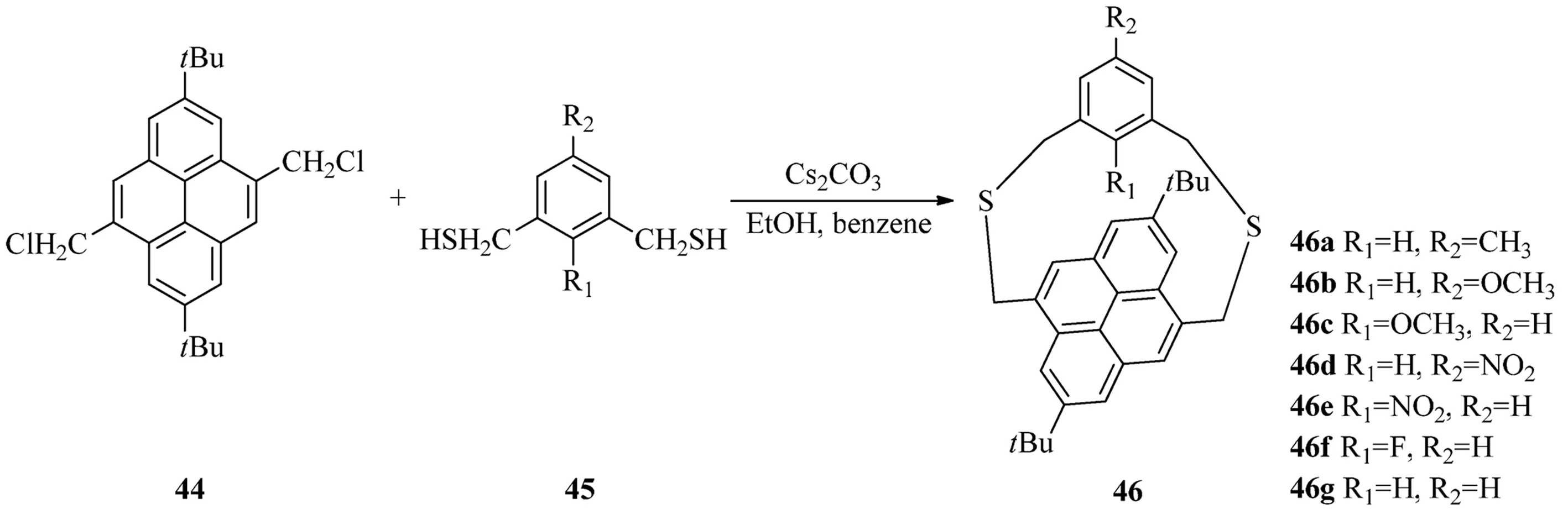
圖12 (4,9)芘番46的合成
3 結 語
本研究綜述了芘番的光化學和光物理特性及其合成方法.目前,僅(1,3)、(1,6)、(1,8)、(2,4)、(2,7)與(4,9)類型的芘番被科研人員合成出來.通過對已知芘番合成路線的研究,親核取代反應生成硫化物后再進行脫巰基氧化反應生成芘番是常采用的合成方法.另外,利用交叉偶聯(lián)反應或Siegrist反應也是合成芘番強有力的工具之一.在芘番結構的設計中,引入一些側鏈的R基團亦可增加芘番的溶解性,有利于芘番的合成.這些合成策略對于新類型芘番的合成和設計將有很強的指導意義.同時,隨著新類型芘番的合成,更多的芘番或芘番衍生物的應用將被人們開發(fā)出來.
[1]Graebe C.Ueberpyren[J].Eur J Org Chem,2010,158(3):285-299.
[2]Streitwieser A,Lawler R G,Schwaab D.Onthebromopyrenes[J].J Org Chem,1965,30(5):1470-1473.
[3]Yamato T,Miyazawa A,Tashiro M.Medium-sizedcyclophanes.part31.Synthesisiandelectrophilicsubstitutionof8-substituted[2]metacyclo[2](1,3)pyrenophanes[J].J Chem Soc,Perkin Trans 1,1993,25(12):3127-3137.
[4]Hu J,Zhang D,Harris F W.Ruthenium(III)chloridecatalyzedoxidationofpyreneand2,7-disubstituedprenes:anefficient,one-stepsynthesisofpyrene-4,5-dionesandpyrene-4,5,9,10-tetraones[J].J Org Chem,2005,70(2):707-708.
[5]Meier H,Schnorpfeil C,Fetten M.Synthesisoftripyreno[2,3,4-abc:2,3,4-ghi:2,3,4-mno] [18]annulenes[J].J Prakt Chem,2000,342(8):785-790.
[6]Ji S,Yang J,Yang Q,et al.Tuningtheintramolecularchargetransferofalkynylpyrenes:effectonphotophysicalpropertiesanditsapplicationindesignofoff-onfluoresentthiolprobes[J].J Org Chem,2009,74(13):4855-4865.
[7]Inouye M,Fujimoto K,Furusyo M,et al.Molecularrecognitionabilitiesofanewclassofwater-solublecyclophanescapabeofencompassinganeutralcavity[J].JACS,1999,121(7):1452-1458.
[8]Inouye M,Abe H,Mawatari Y,et al.Synthesisandmolecularrecognitionofpyrenophaneswithpolycationicoramphiphilicfunctionalities:artificialplate-shapedcavitantincorporationgarenesandnucleotidesinwater[J].J Org Chem,2004,69(2):495-504.
[9]Gleiter R,Rausch B J,Schaller R J.Moderncyclophanechemistry[M].Weinheim,Berlin,Germany:Wiler-VCH,2004.
[10]Sato T,Wakabayashi M,Okamura Y,et al.Medium-Sizedcyclophanes.IV.thehalogenationreactionsof[2.2]metacyclophane[J].BCSJ,1967,40(10):2363-2365.
[11]Mitchell R H,Mahadevan R.Synthesisofdiatropichighlybenzannelatedannulenes[J].Tetr Lett,1981,22(51):5131-5134.
[12]V?gtle F,Ostrowicki A,Begemann B,et al.Chiraledreilagigeundkondensierte[2.2]cyclophanesynthese,struktur,chiroptik[J].Chem Ber,1990,123(1):169-176.
[13]Misumi S,Kawashima T,Sakata O Y.Synthesesofthree[2.2]pyrenophanesasanexcimermodeloriginalresearcharticle[J].Tetr Lett,1978,19(51):5115-5121.
[14]Yao T,Yu H,Vermeij R,et al.Nonplanararomaticcompounds.Part10:astrategyforthesynthesisofaromaticbelts-allwrappedupordownthetubes?[J].Pure Appl Chem,2008,80(3):533-536.
[15]Zhang B,Manning G P,Dobrowolski M A,et al.Nonplanararomaticcompounds.9.synthesis,structure,andaromaticityof1:2,13:14-dibenzo[2]paracyclo[2] (2,7)-pyrenophane-1,13-diene[J].Org Lett,2008,10(2):273-276.
[17]Tsuge A,Otsuka M,Moriguch T,et al.Syntheses,structuralproperties,andcharge-transfercomplexesofpyrenophanes[J].Org Biomol Chem,2005,3(19):3590-3593.
Research Advances on Synthesis of Pyrenophanes
YANGYixi1,ZHANGJue2,QIULu2,GUOXiaoqiang2
(1.School of Oversea Education, Chengdu University, Chengdu 610106, China;2.School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China)
Pyrenophane is referred as one type of cyclophane,which obtains not only the physical and chemical properties of pyrene,but also the physical and chemical properties of cyclophane.However,the synthesis of this compound is rarely reported in China.In this paper,the definition,structures,synthesis and applications are briefly reviewed.Based on the description of the synthetic routes for the already known pyrenophanes,the paper provides reference for the pyrenophanes synthesis with photophysical and photochemical properties that will be applied in fluorescent probes and molecule recognition.
cyclophane;pyrenophane;synthesis
1004-5422(2017)02-0125-06
2017-03-02.
成都大學校科技發(fā)展基金(2014XJZ03)資助項目.
楊軼浠(1984 — ), 女, 碩士, 助理研究員, 從事有機合成研究.
O625.8
A

