鹽度對一株淡水柵藻Scenedesmus sp.生長及生化組成的影響
李嘉穎李濤譚麗吳嘉儀向文洲劉德海
(1. 中國科學(xué)院南海海洋研究所 中國科學(xué)院熱帶海洋生物資源與生態(tài)重點(diǎn)實(shí)驗(yàn)室,廣州 510301;2. 中國科學(xué)院大學(xué),北京 100049;3. 廣州市白云聯(lián)佳精細(xì)化工廠,廣州 510412)
鹽度對一株淡水柵藻Scenedesmus sp.生長及生化組成的影響
李嘉穎1,2李濤1譚麗1,2吳嘉儀1向文洲1劉德海3
(1. 中國科學(xué)院南海海洋研究所 中國科學(xué)院熱帶海洋生物資源與生態(tài)重點(diǎn)實(shí)驗(yàn)室,廣州 510301;2. 中國科學(xué)院大學(xué),北京 100049;3. 廣州市白云聯(lián)佳精細(xì)化工廠,廣州 510412)
通過管式光生物反應(yīng)器培養(yǎng),分析比較不同鹽度(0-40‰)對一株淡水柵藻(Scenedesmus sp.)生長和生化特性影響,評價海水培養(yǎng)該藻株的產(chǎn)業(yè)化潛力,探討其高鹽適應(yīng)機(jī)制,為進(jìn)一步海水馴化研究提供理論參考。采用顯微觀察、索氏提取法、凱氏定氮法、苯酚硫酸法、氣相色譜法及高效液相色譜法分別測定微藻生長及蛋白質(zhì)、油脂、多糖含量以及色素、脂肪酸組成情況。結(jié)果表明,高鹽條件下藻細(xì)胞明顯增大,并出現(xiàn)自然沉降現(xiàn)象,可實(shí)現(xiàn)低成本采收。隨鹽度增加,柵藻生長逐步被抑制,40‰鹽度條件下生長完全停止,但在3‰鹽度下仍良好生長,培養(yǎng)末期生物量可達(dá)2.84 g/L。30‰鹽度組蛋白質(zhì)含量相對淡水組提高95.40%、產(chǎn)率與淡水組相近,加之高鹽培養(yǎng)可較大幅度降低蛋白質(zhì)的生產(chǎn)成本,因此,采用海水培養(yǎng)柵藻來開發(fā)蛋白資源具有一定的潛力。研究還表明,30‰鹽度下藻細(xì)胞內(nèi)β-胡蘿卜素、蝦青素、可溶性多糖等成分大量積累,可能是其適應(yīng)高鹽脅迫的重要生理基礎(chǔ)。
淡水柵藻;Scenedesmus sp.;高鹽脅迫;生長;生化組成
微藻作為一種光合自養(yǎng)型生物,能夠利用光能及無機(jī)營養(yǎng)鹽合成多種生物活性物質(zhì),如脂質(zhì)、蛋白質(zhì)、多糖及色素等。目前,微藻脂質(zhì)應(yīng)用于生物柴油的研究已廣泛報(bào)道,除此之外,微藻的蛋白質(zhì)、多不飽和脂肪酸、類胡蘿卜素(如 β-胡蘿卜素、蝦青素、葉黃素)等生物活性物質(zhì)也被廣泛應(yīng)用于飼料、食品、保健等行業(yè)中[1,2]。由此可見,開發(fā)利用微藻資源,實(shí)現(xiàn)微藻資源產(chǎn)業(yè)化具有重要意義。
大量研究表明,溫度、光照、鹽度等環(huán)境因子的變化會影響微藻細(xì)胞內(nèi)生物活性物質(zhì)的合成[3,4]。通過高鹽誘導(dǎo)微藻內(nèi)油脂、類胡蘿卜素等高值化產(chǎn)物積累的相關(guān)研究得到了國際上的高度關(guān)注[5,6]。Kim等[7]分離的一株淡水微藻Chlorella sorokiniana在30‰鹽環(huán)境下,油脂含量是淡水培養(yǎng)的1.6倍。Paliwal等[8]報(bào)道,Synechocystis sp.的總胡蘿卜素含量隨著鹽度遞增呈現(xiàn)先增后減趨勢,在0.2 mol/L(約11.7‰)素含量隨著鹽度-胡蘿卜素在1 mol/L(約58‰)素含量隨著鹽度遞增呈現(xiàn)先增3倍多。
目前淡水和耕地資源匱乏問題正日益制約著全球經(jīng)濟(jì)、生態(tài)環(huán)境及人類生存發(fā)展。相比之下,我國海岸線長,擁有豐富的海水資源以及大面積待開發(fā)利用的灘涂、鹽堿地,是微藻規(guī)模化培養(yǎng)的理想用水、用地。另外,海水中富含無機(jī)營養(yǎng)鹽,利用海水培養(yǎng)微藻既能充分利用現(xiàn)有資源又能降低生產(chǎn)成本[9,10]。由此可見,利用海水培養(yǎng)微藻,發(fā)展微藻生物產(chǎn)業(yè)具有誘人前景。已有報(bào)道表明,有些耐鹽性強(qiáng)的淡水微藻通過在海水環(huán)境中馴化培養(yǎng)后,可成為在天然海水中良好生長的水微藻通過[11],其中經(jīng)海水馴化的螺旋藻不僅能快速生長,而且品質(zhì)得到顯著提高,目前已成功實(shí)現(xiàn)商業(yè)化生產(chǎn)[12]。
雖然微藻的高鹽適應(yīng)機(jī)制已被廣泛研究,但主要集中在杜氏鹽藻、螺旋藻等少數(shù)藻類[11-13],淡水藻種的海水馴化與海水培養(yǎng)模式也僅有個別成功案例,相關(guān)研究仍具有巨大的創(chuàng)新與應(yīng)用開發(fā)空間。本研究所用的柵藻(Scenedesmus sp.)藻株是一株生長速度快、能適應(yīng)高pH環(huán)境并富含多種高附加值產(chǎn)品的淡水微藻,適宜室外開放式培養(yǎng)。通過分析比較柵藻經(jīng)不同鹽度人工海水培養(yǎng)后生長及生化組成的變化, 評估海水培養(yǎng)該藻株的應(yīng)用開發(fā)潛力,初步探索其高鹽適應(yīng)機(jī)制,以期為進(jìn)一步的海水馴化與培養(yǎng)奠定理論基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 藻種 本實(shí)驗(yàn)藻株由中國科學(xué)院南海海洋研究所微藻組分離純化所得,經(jīng)18S rDNA測序,初步確定為柵藻。
1.1.2 培養(yǎng)條件 采用改良的ZSNT培養(yǎng)基培養(yǎng):1 g/L NaHCO3,1.5 g/L NaNO3,0.05 g/L NaH2PO4· 2H2O,0.02 g/L CaCl2,0.05 g/L MgSO4·7H2O,0.1 g/L KCl,1 mL/L A5solution。不同鹽度組通過補(bǔ)充NaCl調(diào)節(jié)。以300 mL管式光生物反應(yīng)器作為培養(yǎng)體系,培養(yǎng)溫度為(24±1)℃,光強(qiáng)為150 μmol/(m2·s),24 h持續(xù)光照。每組設(shè)置3個平行,培養(yǎng)周期12 d。
1.2 方法
1.2.1 顯微觀察與生長測定 用Olympus BX53顯微鏡觀察藻細(xì)胞,培養(yǎng)7 d后用NIS-Elements軟件測量藻細(xì)胞大小;微藻生物量采用干重法測定[14]。
1.2.2 主要生化組成測定
1.2.2.1 總脂測定與分級 采用改良的Khozin-Goldberg法提取總脂并測定含量[15];總脂分級采用Christie的方法[16],將總脂分為中性脂、糖脂、磷脂。1.2.2.2 總蛋白質(zhì)測定 采用凱氏定氮法測定總蛋白質(zhì)含量。以蛋白質(zhì)的F值為6.25計(jì)算。
1.2.2.3 多糖測定 稱取10 mg藻粉加入5 mL 0.5 mol/L H2SO4,于80℃水浴攪拌0.5 h,5 000 r/min離心5 min,收集上清。反復(fù)抽提3次,合并上清后用去離子水定容到100 mL,得到總糖提取液;可溶性糖的提取采用熱水浸提法;淀粉提取采用高氯酸水解法。多糖含量的測定采用苯酚-硫酸法[17]。
1.2.3 色素測定 稱取10 mg藻粉,置于10 mL玻璃離心管中,加入5 mL丙酮,避光冰浴攪拌提取1-2 d,直至藻渣變白,再5 000 r/min離心5 min,收集上清得到色素提取液。采用分光光度法測定總類胡蘿卜素含量[18]、HPLC法測定色素組成和蝦青素、法-胡蘿卜素組分含量[17]。色譜條件:Agilent Eclipse XDB-C18柱(150 mm*4.6 mm,5 μm);流動相A為90%乙腈、B為乙酸乙酯;流速1 mL/min;進(jìn)樣量10 μL;梯度洗脫如下:0-1 min,90% A、10% B;1-21 min,90%-0A、10%-100% B;21-23 min,0% A、100% B;23-25 min,0-90% A、100%-10% B。1.2.4 脂肪酸測定 稱取25 mg凍干藻粉放入離心管中,加入2 mL 2% H2SO4無水甲醇放入離心9∶1 V/V),充入氮?dú)猓?0℃水浴攪拌1.5 h,依次加入1 mL的去離子水和 1 mL正己烷,震蕩后3 500 r/min離心5 min,將上層有機(jī)相轉(zhuǎn)移到另一小玻璃瓶,氮?dú)獯蹈桑偌尤? mL 正己烷密封,并用孔徑為0.22 μm的濾膜過濾,最后通過氣相色譜(GC)進(jìn)行脂肪酸測定[14]。
1.3 數(shù)據(jù)統(tǒng)計(jì)和分析
采用SPSS13.0統(tǒng)計(jì)軟件進(jìn)行統(tǒng)計(jì)分析,數(shù)值變量資料以x-±s,再加入量素含量解法。多糖t檢驗(yàn)。檢驗(yàn)水平計(jì)α=0.05,P<0.05差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 不同鹽度對Scenedesmus sp.細(xì)胞及生長的影響
如表1所示,隨著培養(yǎng)鹽度遞增,細(xì)胞大小有增大趨勢。當(dāng)培養(yǎng)基鹽度較低時(0-10‰),藻細(xì)胞平均直徑約10.8 μm;當(dāng)培養(yǎng)鹽度升到20‰,細(xì)胞直徑極顯著增加(P<0.01),平均直徑13.5 μm;而當(dāng)鹽度進(jìn)一步升至30‰時,平均直徑達(dá)到15.8 μm,個別細(xì)胞直徑甚至達(dá)到了20 μm。

表1 不同鹽度組Scenedesmus sp.細(xì)胞(7 d)直徑及停止通氣后沉降情況
此外,實(shí)驗(yàn)還發(fā)現(xiàn)高鹽度(20‰-30‰)組的藻細(xì)胞在培養(yǎng)后期存在自然沉降現(xiàn)象(表1),其中30‰組最為明顯,培養(yǎng)末期停止培養(yǎng)通氣15 min后,藻細(xì)胞自然沉降于反應(yīng)器底部并與培養(yǎng)液形成明顯的分層,靜置過夜后,所有藻細(xì)胞沉降粘結(jié)為更薄更實(shí)的“藻泥層”,此時,可將上清液(培養(yǎng)基)與藻細(xì)胞傾析分離,收獲幾乎全部的藻細(xì)胞。
在12 d的培養(yǎng)周期內(nèi), 柵藻生長受培養(yǎng)基中鹽度的影響。如圖1所示,在培養(yǎng)早期,低鹽度對其生長影響較小,低鹽度各組的生長速度相近,隨后逐漸出現(xiàn)差異。到達(dá)第12天,各鹽度組的生物量隨鹽度遞增而極顯著下降(P<0.01)。其中,0鹽度組和30‰鹽度組生物量分別為6.38 g/L和2.84 g/L,而40‰鹽度組生長完全被抑制。

圖1 不同鹽度組Scenedesmus sp.生長曲線
2.2 不同鹽度對Scenedesmus sp.蛋白質(zhì)、油脂與多糖的影響
經(jīng)不同鹽度培養(yǎng)12 d后,對各鹽度組柵藻的生化組成進(jìn)行分析。結(jié)果如圖2所示,三大生化成分占據(jù)各組藻細(xì)胞含量的85%-92%。高鹽環(huán)境下蛋白質(zhì)大量積累,其含量隨鹽度增加而極顯著增加(P<0.01)。30‰組含量達(dá)到27.74%,與淡水組相比提高了95.40%,最終使得各組蛋白質(zhì)產(chǎn)率變化不大,在65-75 mg/(L·d)范圍內(nèi);總脂作為主要的生化組分不受鹽度的影響,各組含量均占干重42%左右,差異并不顯著(P>0.05)。但隨著鹽度的提高,中性脂比例略微下降,與此同時,糖脂、磷脂比例有所增加;總糖和淀粉含量則隨鹽度的增加而減少,然而可溶性糖成分含量卻有所增加。盡管各組油脂含量無顯著變化,但受高鹽導(dǎo)致的生物量下降影響,產(chǎn)率隨著鹽度增加而逐步下降,30‰組的中性脂產(chǎn)量下降了58.98%。高鹽下含量下降的多糖,其產(chǎn)率更是大幅度下降,30‰組多糖產(chǎn)率下降了66.01%。2.3 不同鹽度對Scenedesmus sp.色素的影響
通過分光光度法和HPLC法對培養(yǎng)末期各鹽度組色素成分進(jìn)行分析,結(jié)果如表2、表3所示,柵藻主要由葉綠素a、葉綠素b、葉黃素、蝦青素、綠-胡蘿卜素、角黃素等色素組成。

圖2 不同鹽度組Scenedesmus sp.蛋白質(zhì)(A)、油脂(B)和多糖(C)含量及產(chǎn)率
高鹽環(huán)境下,總類胡蘿卜素含量顯著增加(P<0.05),30‰鹽度組提高到0‰組的1.5倍。其中β-胡蘿卜素、蝦青素等成分大量誘導(dǎo)生成,隨鹽度提高含量逐步提高,最終30‰組的β-胡蘿卜素、蝦青素含量提高到0組的193.65%和156.86%。
綜合含量與生物量變化對產(chǎn)率的影響進(jìn)行分析,總類胡蘿卜素與蝦青素在低鹽度下產(chǎn)率有所提高,5‰鹽度達(dá)到最高。此條件下的總類胡蘿卜素產(chǎn)率比0組提高12.74%,而β-胡蘿卜素產(chǎn)率略有降低。當(dāng)鹽度達(dá)到30‰,總類胡蘿卜素與蝦青素產(chǎn)率都較大幅度降低。
2.4 不同鹽度對Scenedesmus sp.脂肪酸組成的影響
GC分析結(jié)果(表4)顯示,柵藻的脂肪酸主要包括C16∶0、C18∶1、C18∶2、C18∶3。不同鹽度條件下的特征脂肪酸種類沒有發(fā)生改變,但個別成分含量發(fā)生了變化:C16∶0和C18∶2隨著鹽度的遞增有增加的趨勢;而C18∶1則呈現(xiàn)相反的趨勢,隨著鹽度的遞增減少;C18∶3在各組中無明顯的變化趨勢。對脂肪酸組成進(jìn)一步分析發(fā)現(xiàn),隨著鹽度的增加,單不飽和脂肪酸含量減小,飽和脂肪酸和多不飽和脂肪酸含量增加,30‰組分別提高了7.4%和9.8%。

表2 Scenedesmus sp.的色素組成
3 討論
3.1 高鹽度(海水)培養(yǎng)對Scenedesmus sp.細(xì)胞形態(tài)的影響及其潛在價值
本研究結(jié)果(表1)顯示,高鹽培養(yǎng)會導(dǎo)致柵藻細(xì)胞變大,當(dāng)反應(yīng)器停止通氣后,藻細(xì)胞極易出現(xiàn)自然沉降現(xiàn)象,初步推測細(xì)胞變大以及蛋白、可溶性糖含量的較大變化可能是其自然沉降的原因。在規(guī)模化生產(chǎn)過程中,由于微藻細(xì)胞微小,目前普遍采用高成本的離心法采收,采收成本約占整個生產(chǎn)成本的20%-30%[19],成為制約微藻大規(guī)模養(yǎng)殖開發(fā)的關(guān)鍵因素之一,而利用細(xì)胞自然下沉的特性,可以實(shí)現(xiàn)低成本高效率采收,采收成本幾乎可以忽略不計(jì)。本實(shí)驗(yàn)室目前已開展采用天然海水培養(yǎng)淡水柵藻的室外培養(yǎng)試驗(yàn),規(guī)模已達(dá)40 m2。試驗(yàn)中采用自然沉降法采收藻細(xì)胞,加之海水富含無機(jī)營養(yǎng)鹽,可節(jié)約大量肥料元素,使其生產(chǎn)總成本降低了30%以上(結(jié)果另文發(fā)表)。因此,通過海水培養(yǎng)降低柵藻的生產(chǎn)成本具有重要的現(xiàn)實(shí)意義。
3.2 不同鹽度對Scenedesmus sp.生長與品質(zhì)的影響
鹽度是影響微藻生長繁殖的重要環(huán)境因子。很多淡水微藻都能在一定的鹽度范圍內(nèi)生長[20],但調(diào)節(jié)滲透壓需要消耗高能量,因而鹽度變化往往會導(dǎo)致生物量下降甚至停止生長[21]。本研究的柵藻在高達(dá)30‰鹽度環(huán)境下仍有生長或醒,說明該藻株具有一定的耐鹽能力。
目前我國的蛋白源高度依賴進(jìn)口,其中飼料蛋白源進(jìn)口量已達(dá)到6 300 t/年[22]。本研究結(jié)果表明,在高鹽條件下,柵藻細(xì)胞中許多有價值的生物活性物質(zhì)含量得以提高。隨著鹽度增加,蛋白質(zhì)含量變化最為顯著,在30‰鹽度組達(dá)到最高,比淡水0組提高了95.40%,并且高鹽對蛋白質(zhì)產(chǎn)率的影響不大,30‰鹽度組可達(dá)65.66 mg/(L·d)。綜合考慮前文所討論的成本因素,通過海水培養(yǎng)可以較大幅度降低柵藻蛋白質(zhì)的生產(chǎn)成本。同時,由于高鹽培養(yǎng)的柵藻β-胡蘿卜素、蝦青素及多不飽和脂肪酸含量也顯著增加,這些生物活性物質(zhì)對維持動物正常生長繁殖、體色,提高飼料利用效率具有重要作用[23,24],可增加飼料蛋白源的應(yīng)用價值。因此,海水培養(yǎng)柵藻用作飼料蛋白源開發(fā)具有一定的潛力。
而柵藻β-胡蘿卜素、蝦青素等類胡蘿卜素及油脂的產(chǎn)率在高鹽(20%-30‰)條件下均顯著降低。同時,根據(jù)油脂產(chǎn)率和脂肪酸相對含量變化可以推測,脂肪酸產(chǎn)率也應(yīng)顯著降低。因此,綜合考慮前文所述的成本降低因素,采用海水培養(yǎng)柵藻開發(fā)類胡蘿卜素、油脂及不飽和脂肪酸的意義不大。
目前,已有淡水螺旋藻成功馴化成“海水種”并藉此提高其產(chǎn)量和品質(zhì)、實(shí)現(xiàn)商業(yè)化生產(chǎn)的報(bào)道[12]。本研究顯示,有必要進(jìn)一步增強(qiáng)柵藻對海水高鹽度的適應(yīng)性,篩選、馴化完全適宜天然海水培養(yǎng)、快速生長的優(yōu)勢藻株。
3.3 Scenedesmus sp.的高鹽適應(yīng)機(jī)制
微藻適應(yīng)鹽度的機(jī)制因藻種不同而存在差異,但大體上都是通過合成具有滲透調(diào)節(jié)作用的物質(zhì),以平衡胞外高鹽所形成的高滲透壓[25,26]。或者通過膜上的離子轉(zhuǎn)運(yùn)體將K+運(yùn)輸?shù)桨麅?nèi),Na+排出胞外,實(shí)現(xiàn)細(xì)胞內(nèi)外的離子滲透平衡[27]。

表3 不同鹽度組Scenedesmus sp.總類胡蘿卜素、β-胡蘿卜素和蝦青素含量及產(chǎn)率
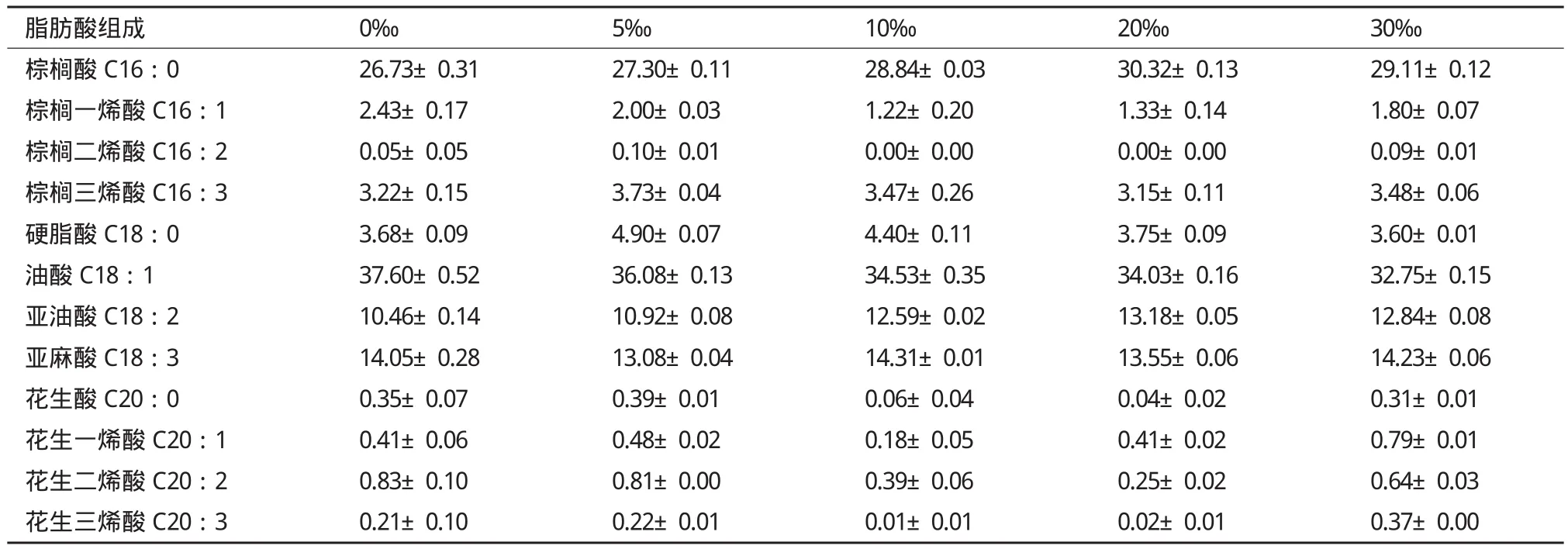
表4 不同鹽度組Scenedesmus sp.的脂肪酸組成(相對含量/%TFA)
已有研究表明,可溶性糖可作為鹽度適應(yīng)的滲透調(diào)節(jié)物質(zhì)[28,29],這也與本研究的結(jié)果一致:隨著鹽度增加,柵藻細(xì)胞內(nèi)可溶性糖含量逐步提高。而前人對杜氏藻(Dunaliella sp.)的研究發(fā)現(xiàn),淀粉與其滲透調(diào)節(jié)物質(zhì)可相互轉(zhuǎn)化[13]。在本研究中,高鹽條件也引起了柵藻淀粉含量的顯著下降。因此我們推測,柵藻可能通過淀粉(多糖)的分解形成小分子可溶性糖而實(shí)現(xiàn)對高鹽的適應(yīng)。
脅迫條件下 微藻細(xì)胞內(nèi)起抗氧化作用的β-胡蘿卜素、蝦青素等次生色素含量會顯著增加[8,30],以應(yīng)對脅迫引起的氧化壓力[31]。β-胡蘿卜素可消除鹽脅迫下大量積累的活性氧,從而提高對鹽脅迫導(dǎo)致的氧化脅迫抗性;蝦青素不但能通過淬滅活性氧原子獲得能量以實(shí)現(xiàn)自身的合成,其抗氧化能力甚至是β-胡蘿卜素的10倍[24,31]。本研究發(fā)現(xiàn)高鹽誘導(dǎo)了 柵藻內(nèi)β-胡蘿卜素的大量合成,同時總類胡蘿卜素、蝦青素的含量也有增加的趨勢。因此,抗氧化色素的積累也可能是其高鹽適應(yīng)的重要機(jī)制之一。
4 結(jié)論
隨著鹽度增加,淡水柵藻生長受抑制程度逐步增加,鹽度達(dá)40‰時,藻細(xì)胞生長完全停止。高鹽(20‰-30‰)培養(yǎng)導(dǎo)致藻細(xì)胞明顯變大、易自然沉降,可直接收獲藻細(xì)胞。在30‰鹽度下,該藻株仍能良好生長,此條件下培養(yǎng)的柵藻保持其高油脂含量,而蛋白質(zhì)、β-胡蘿卜素、蝦青素含量大幅度提高,蛋白質(zhì)產(chǎn)率略有降低,油脂、β-胡蘿卜素、蝦青素產(chǎn)率下降。
[1]Tang YT, Rosenberg JN, Bohutskyi P , et al. Microalgae as a feedstock for biofuel precursors and value-added products:green fuels and golden opportunities[J]. BioResources, 2016, 11:36.
[2]Spolaore P, Joannis-Cassan C, Duran E, et al. Commercial applications of microalgae[J]. Journal of Bioscience and Bioengineering, 2006, 101:87-96.
[3]Sibi G, Shetty V, Mokashi K. Enhanced lipid productivity approaches in microalgae as an alternate for fossil fuels-A review[J]. J Energy Inst, 2016, 89:330-334.
[4]Minhas AK, Hodgson P, Barrow CJ, et al. A Review on the assessment of stress conditions for simultaneous production of microalgal lipids and carotenoids[J]. Front Microbiol, 2016, 7:19.
[5]Rao AR, Dayananda C, Sarada R, et al. Effect of salinity on growth of green alga Botryococcus braunii and its constituents[J]. Bioresource Technology, 2007, 98:560-564.
[6]Fazeli MR, Tofighi H, Samadi N, et al. Effects of salinity on betacarotene production by Dunaliella tertiolecta DCCBC26 isolated from the Urmia salt lake, north of Iran[J]. Bioresource Technology, 2006, 97:2453-2456.
[7]Kim BH, Ramanan R, Kang Z, et al. Chlorella sorokiniana HS1, a novel freshwater green algal strain, grows and hyperaccumulates lipid droplets in seawater salinity[J]. Biomass Bioenerg, 2016, 85:300-305.
[8] Paliwal C, Pancha I, Ghosh T, et al. Selective carotenoid accumulation by varying nutrient media and salinity in Synechocystis sp. CCNM 2501[J]. Bioresource Technology, 2015, 197:363-368.
[9]劉建國, 龍?jiān)? 黃園, 等. 微藻生物柴油研究現(xiàn)狀與發(fā)展策略[J]. 海洋科學(xué), 2013, 37(10):132-141.
[10] 孫麗英, 何皓, 田宜水, 等. 微藻規(guī)模化生產(chǎn)的關(guān)鍵問題[J].可再生能源, 2012, 30(9):70-74.
[11] 吳伯堂, 何汝洪, 彭云輝. 鈍頂螺旋藻海水馴化的初步研究[J]. 海洋與湖沼, 1988, 19(2):197-200.
[12] 向文洲, 李濤, 吳華蓮, 等. 海水螺旋藻產(chǎn)業(yè)發(fā)展戰(zhàn)略研究[J].廣西科學(xué), 2014(6):573-579.
[13] Chen H, Jiang JG. Osmotic responses of Dunaliella to the changes of salinity[J]. Journal of Cellular Physiology, 2009, 219:251-258.
[14] Li T, Wan LL, Li AF, et al. Responses in growth, lipid accumulation, and fatty acid composition of four oleaginous microalgae to different nitrogen sources and concentrations[J]. Chin J Oceanol Limnol, 2013, 31:1306-1314.
[15] Khozin-Goldberg I, Shrestha P, Cohen Z. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa[J]. Biochimica Et Biophysica Acta-Molecular and Cell Biology of Lipids, 2005, 1738:63-71.
[16] Christie WW. Lipid analysis:isolation, separation, identification, and structural analysis of lipids[M]:Pergamon Press, 1982.
[17]Li T, Xu J, Gao B, et al. Morphology, growth, biochemical composition and photosynthetic performance of Chlorella vulgaris(Trebouxiophyceae)under low and high nitrogen supplies[J]. Algal Res, 2016, 16:481-491.
[18]Lichtenthaler HK. Chlorophylls and carotenoids:Pigments of photosynthetic biomembranes[M]. Method Enzymol:Academic Press, 1987:350-382.
[19]Grima EM, Belarbi EH, Fernandez FGA, et al. Recovery of microalgal biomass and metabolites:process options and economics[J]. Biotechnology Advances, 2003, 20:491-515.
[20]von Alvensleben N, Magnusson M, Heimann K. Salinity tolerance of four freshwater microalgal species and the effects of salinity and nutrient limitation on biochemical profiles[J]. Journal of Applied Phycology, 2016, 28:861-876.
[21]Oren A. Bioenergetic aspects of halophilism[J]. Microbiology and Molecular Biology Reviews, 1999, 63:334-348.
[22]麥康森. 水產(chǎn)飼料的蛋白源問題[J]. 科學(xué)養(yǎng)魚, 2014, 6:4.
[23]蘇小鳳, 邵慶均. 多不飽和脂肪酸在魚類營養(yǎng)與飼料中的作用及其氧化穩(wěn)定性[J]. 飼料研究, 2002, 3:11-14.
[24] Dufosse L, Galaup P, Yaron A, et al. Microorganisms and microalgae as sources of pigments for food use:a scientific oddity or an industrial reality?[J]. Trends in Food Science and Technology, 2005, 16(9):389-406.
[25] Lyon BR, Bennett-Mintz JM, Lee PA, et al. Role of dimethylsulfoniopropionate as an osmoprotectant following gradual salinity shifts in the sea-ice diatom Fragilariopsis cylindrus[J]. Environ Chem, 2016, 13:181-194.
[26] Scholz B, Liebezeit G. Compatible solutes in three marine intertidal microphytobenthic Wadden Sea diatoms exposed to different salinities[J]. European Journal of Phycology, 2012, 47:393-407.
[27] Talebi AF, Tabatabaei M, Mohtashami SK, et al. Comparative salt stress study on intracellular ion concentration in marine and saltadapted freshwater strains of microalgae[J]. Notulae Scientia Biologicae, 2013, 5:309.
[28] 畢永紅, 鄧中洋, 胡征宇, 等. 發(fā)狀念珠藻對鹽脅迫的響應(yīng)[J].水生生物學(xué)報(bào), 2005, 29(2):125-129
[29] 毛桂蓮, 許興, 徐兆楨. 植物耐鹽生理生化研究進(jìn)展[J]. 中國生態(tài)農(nóng)業(yè)學(xué)報(bào), 2004, 12(1):43-46.
[30] Sarada R, Tripathi U, Ravishankar GA. Influence of stress on astaxanthin production in Haematococcus pluvialis grown under different culture conditions[J]. Process Biochem, 2002, 37:623-627.
[31]Lemoine Y, Schoefs B. Secondary ketocarotenoid astaxanthin biosynthesis in algae:a multifunctional response to stress[J]. Photosynthesis Research, 2010, 106:155-177.
(責(zé)任編輯 狄艷紅)
Effects of Salinity on the Growth and Biochemical Properties of a Freshwater Algae Scenedesmus sp.
LI Jia-ying1,2LI Tao1TAN Li1,2WU Jia-yi1XIANG Wen-zhou1LIU De-hai3
(1. Key Laboratory of Tropical Marine Bio-resources and Ecology,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301;2. University of Chinese Academy of Sciences,Beijing 100049;3. Guangzhou Baiyun Lianjia Fine Chemical Factory,Guangzhou 510412)
The aims of this work are to analyze and compare the effects of different salt concentration(0-40‰)on the growth and biochemical characteristics of a freshwater algae Scenedesmus sp. incubated in small tubular bioreactors,and evaluate the industrialization potential of culturing this algae in seawater as well explore the adaptive mechanism at high salinity,which provides theoretical references for further study on seawater domestication. The growth of the microalgae,the content of protein,lipid and polysaccharide,and the composition of pigments and fatty acids were analyzed correspondingly by microscopic observation,Soxhlet extraction,Kjeldahl method,phenol sulfuric acid determination,gas chromatography technology,and HPLC. The results showed that cells grew bigger and naturally precipitated at high salinity,meaning that it can be harvested at low cost. The study also found that growth of Scenedesmus sp. was gradually inhibited with the increase of salinity,and completely inhibited at the salinity of 40‰;however,it still grew well at the salinity of 30‰ with biomass of 2.84 g/ L,and higher protein content(95.40% higher than 0‰ group)with similar protein productivity as that by freshwater. Combined with the great cost reduction of producing protein at high salinity,culturing Scenedesmus sp. in seawater for protein resource is of high potential. Moreover,with the increase of salinity,Scenedesmus sp. tended to accumulate more β-carotene,astaxanthin,and even soluble sugar,which might be the key physiological basis of adapting salt-stress.
freshwater microalgae;Scenedesmus sp.;high-salinity stress;growth;biochemical composition
10.13560/j.cnki.biotech.bull.1985.2016-1159
2016-12-22
廣東省海洋漁業(yè)科技攻關(guān)與研發(fā)項(xiàng)目(A201601A13),中國科學(xué)院可再生能源重點(diǎn)實(shí)驗(yàn)室基金(Y607k91001、Y507jb1001),廣東丹姿集團(tuán)科技研發(fā)項(xiàng)目(DZ201501)
李嘉穎,女,碩士研究生,研究方向:微藻生物技術(shù);E-mail:kar_in@163.com
向文洲,男,博士,研究員,研究方向:微藻生物技術(shù);E-mail:xwz@scsio.ac.cn;劉德海,男,碩士,研究方向:精細(xì)化工;E-mail:liudh@danzi.cn

