Sulfolobus acidocaldarius ATCC 33909麥芽寡糖基海藻糖合成酶在Bacillus subtilis中的重組表達和發酵優化
韓唱 宿玲恰 吳敬
(江南大學生物工程學院 工業生物技術教育部重點實驗室 江南大學食品科學與技術國家重點實驗室,無錫 214122)
Sulfolobus acidocaldarius ATCC 33909麥芽寡糖基海藻糖合成酶在Bacillus subtilis中的重組表達和發酵優化
韓唱 宿玲恰 吳敬
(江南大學生物工程學院 工業生物技術教育部重點實驗室 江南大學食品科學與技術國家重點實驗室,無錫 214122)
為實現Sulfolobus acidocaldarius ATCC 33909來源的麥芽寡糖基海藻糖合成酶(MTSase)基因treY在 枯草芽孢桿菌(Bacillus subtilis)中的重組表達,以質粒pET-24a(+)-treY為模板PCR擴增得到目的基因,并與表達載體pHY300PLK連接,轉入表達宿主Bacillus subtilis CCTCC M 2016536中,重組菌在TB培養基中培養48 h后MTSase酶活達到17.5 U/mL;在此基礎上對重組菌發酵條件進行優化,通過單因素實驗(氮源種類、氮源復配、氮源濃度、碳源種類、葡萄糖濃度、初始pH、誘導溫度)和正交實驗(氮源濃度、葡萄糖濃度、初始pH、誘導溫度)確定其搖瓶發酵產酶的最適培養基和培養條件為:氮源(工業蛋白胨∶棉籽粉=3∶1)48.0 g/L、葡萄糖為10.0 g/L、培養基初始pH為7.0,最適培養溫度為30℃;在此條件下,MTSase的酶活可達41.5 U/ mL,是優化前的2.4倍。
麥芽寡糖基海藻糖合成酶;枯草芽孢桿菌;重組表達;發酵優化
海藻糖(α-D-吡喃葡糖基-α-D-吡喃葡糖苷)是自然界中獨一無二的非還原性糖,是由兩個吡喃型葡萄糖單體以α,α-1,1-糖苷鍵連接而成的雙糖,有保護生物大分子抵抗不利環境的功能,它無色、無味并且性質穩定,在自然中廣泛分布[1-3];大量研究表明,海藻糖的生物學功能多種多樣,海藻糖既能作為儲存碳源和提供能量的物質,也能在極端環境下對生物體起到重要的保護作用,海藻糖特殊的性質使其在各個領域均有應用,如食品、醫藥和化妝品等[4-6]。
工業上生產海藻糖主要包括微生物提取法、單酶法與雙酶法,其中雙酶法因為能夠以較為便宜的淀粉為底物生產海藻糖而具有較高的應用價值[7];雙酶法包括麥芽寡糖基海藻糖合成酶(MTSase,EC 5.4.99.15)與麥芽寡糖基海藻糖水解酶 (MTHase,EC 3.2.1.141)。MTSase能夠催化麥芽寡糖(n)還原性末端的α-1,4糖苷鍵變成α-1,1糖苷鍵,生成麥芽寡糖基海藻糖;MTHase 能夠水解麥芽寡糖基海藻糖中與α-1,1糖苷鍵相鄰的α-1,4糖苷鍵從而得到海藻糖和麥芽寡糖(n-2),而麥芽寡糖(n-2)能夠繼續進行下一輪反應,因此將MTSase與MTHase復配能夠以淀粉為底物生產海藻糖[8-10]。
自從日本林原生化研究所從節桿菌Arthrobacter sp. Q36中發現MTSase和MTHase[11],多種能夠合成MTSase和MTHase的菌株陸續被發現,如分支節桿菌(Arthrobacter ramosus S34),嗜熱硫礦硫化葉菌(Sulfolobus solfataricus ATCC 35092),嗜熱硫礦硫化葉菌(Sulfolobus solfataricus KM1),嗜熱硫礦硫化葉菌(Sulfolobus solfataricus MT4),根瘤菌(Rhizobium sp. M-11)等[12-15]。
目前已有多篇文章報道了不同來源MTSase的異源表達,Masaru將來源于Sulfolobus solfataricus KM1的MTSase和MTHase基因在大腸桿菌中表達并用純化后的MTSase和MTHase作用于淀粉生產海藻糖,轉化率達到81.5%[16];吳襟等[17]將Sulfolobus acidocaldarius ATCC 49426來源的MTSase基因在大腸桿菌中進行克隆與表達,最高酶活達到21.1 U/g(wet cell);張文德等[18]從谷氨酸棒桿菌(Corynebacterium glutamicum)中克隆出MTSase基因并在E.coli BL21(DE3)中表達,可溶性蛋白占細胞總蛋白的45.3%;到目前為止,還沒有相關文獻提到MTSase在枯草芽孢桿菌中的異源表達。枯草芽孢桿菌(Bacillus subtilis)是一種原核表達宿主,是微生物研究的模式菌株,因其較強的分泌蛋白質的能力和非致病性而廣泛應用于工業生產[19,20],已被美國食品藥物管理局和中國相關部門認定為食品安全級菌株。本研究首次將 Sulfolobus acidocaldariusATCC 33909來源的麥芽寡糖基海藻糖合成酶基因在枯草芽孢桿菌中進行克隆表達,并對制備重組MTSase的發酵培養基進行優化。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 菌株Escherichia coli JM109和Bacillus subtilis CCTCC M 2016536由本實驗室保藏;質粒pHY300PLK、pET-24a(+)-treY由本實驗室保藏。
1.1.2 酶與主要試劑 Hind III限制性內切酶,Primer Star Taq DNA 聚合酶,dNTPs,氨芐抗生素,四環素,In-Fusion HD Cloning Plus kit均購自寶生物;DNA 純化試劑盒購自上海生工;蛋白胨、酵母粉購自英國Oxiod公司;其他試劑如蔗糖、葡萄糖等購自國藥集團。
1.1.3 培養基 Luria-Bertani(LB)培養基(g/L):蛋白胨10.0,酵母粉5.0,NaCl 10.0,pH 7.0(使用2 mol/L鹽酸2 mol/L NaOH調節pH,與固體培養基加1.5%-2.0%的瓊脂粉)。
Terrific Broth(TB)培養基(g/L):蛋白胨12.0,酵母粉24.0,甘油4.0,KH2PO42.3,K2HPO4·3H2O 16.4;pH7.0(使用2 mol/L鹽酸2 mol/L NaOH調節pH)
1.2 方法
1.2.1 引物設計 以質粒pET-24a(+)-treY為模板,按照同源臂設計原則設計如下引物:F1:5'-AG GAGAGGGTAAAGAATGATTAGCGCGACCTATCG-3' ;R1:5'-TCTTTACCCTCTCCTTTTAAAAAAAT-3'。
以質粒pHY300PLK為模板,按照同源臂設計原則設計如下引物:F2:5'-AAGCTTGGTAATAAAA AAACACCTCC-3';R2:5'-TCTTTACCCTCTCCTTTTA AAAAAAT-3'。
1.2.2 PCR獲得目的基因與表達載體 以質粒pET-24a(+)-treY為模板,F1/R1為正反向引物擴增treY基因片段;PCR參數:94℃預變性5 min;98℃變性10 s,55℃退火5 s,72℃延伸2.5 min,30個循環;最后72℃保存10 min,4℃保溫。
以質粒pHY300PLK為模板,F2/R2為正反向引物擴增表達載體片段。PCR參數:94℃預變性10 min;98℃變性10 s,55℃退火10 s,72℃延伸5 min 55 s,30個循環;最后72℃保存10 min,4℃保溫。1.2.3 連接與鑒定 將1.2.2步驟PCR得到的目的基因與表達載體用In-Fusion連接酶連接后轉入E.coli JM109,涂布LB固體培養基(含100 μg/mL氨芐抗生素),37℃培養箱過夜培養,挑取單菌落至LB液體培養基中培養8 h后收集菌體并提取質粒,用Hind III酶切正確后送測序公司測序。測序正確的質粒轉化至表達宿主B. subtilis中,涂布LB固體培養基(含20 μg/mL四環素抗性),37℃培養箱過夜培養,挑取單菌落至LB液體培養基中(含20 μg/mL四環素抗性),37℃培養10 h后保甘油菌并收集菌體提取質粒,用Hind III酶切正確后即可確定轉入表達宿主中。
1.2.4 搖瓶發酵及重組蛋白的檢測 將保存菌種以2%的接種量接種至LB液體培養基(含100 μg/mL四環素抗性),37℃、200 r/min培養10 h后,以5%接種量接種至TB培養基,37℃、200 r/min培養至2 h后轉移至33℃培養46 h。發酵結束后12 000 r/min離心收集菌體。將菌體重懸至20 mmol/L Tris-HCl(pH8.0)溶液中,用高壓勻漿機對菌體進行破壁,4℃,12 000 r/min離心25 min,收集上清即為目標酶液;使用SDS-PAGE對重組蛋白酶進行檢測。
1.2.5 重組蛋白酶活力測定 將麥芽六糖溶解于20 mmol/L pH5.5的醋酸-醋酸鈉緩沖液中,配成1%的麥芽六糖溶液,取190 μL該溶液,加入10 μL MTSase酶液,60℃反應10 min,100℃沸水中煮10 min終止反應,DNS法測酶活[21],具體方法為取100 μL反應液與900 μL水和1 mL DNS混合后煮沸7 min,冷卻后向其中加入8 mL水混勻,在540 nm處測量吸光度。MTSase的酶活單位定義為每1 min轉化1 μmol麥芽六糖生成麥芽四糖基海藻糖所需的酶量[22]。
1.2.6 菌濃(OD600)的測定 將發酵液稀釋適當倍數后,使用分光光度計在600 nm處測定吸光值,菌濃(OD600)=稀釋倍數×分光光度計在600 nm處讀數。
1.2.7 搖瓶發酵培養基對重組菌產酶的影響 通過單因素實驗考察氮源種類(工業酵母粉、工業蛋白胨、魚粉蛋白胨、大豆蛋白胨、牛肉浸膏、酪蛋白、棉籽粉、多聚蛋白胨、胰蛋白胨和牛肉粉)、氮源復配(工業蛋白胨與棉籽粉)、氮源濃度(12.0、24.0、36.0、48.0和60.0 g/L)、碳源種類(葡萄糖、果糖、蔗糖、淀粉、糊精和甘油)、碳源濃度(1.0、5.0、10.0、20.0和30.0 g/L)、初始pH(6.0、6.5、7.0、7.5和8.0)、溫度(25、30、33和37℃)對產酶的影響。
1.2.8 搖瓶發酵培養基正交試驗設計 選取4個因素分別為氮源(工業蛋白胨:棉籽粉=3:1),碳源(葡萄糖),初始pH和溫度,各取3個水平,進行L9(34)正交實驗,研究重組菌最優產酶條件。
2 結果
2.1 重組菌的構建與搖瓶發酵
以pET-24a(+)-treY為模板,擴增treY基因片段,以質粒pHY300PLK為模板,擴增表達載體片段;PCR 產物用1.0%瓊脂糖凝膠電泳檢測,擴增片段大小分別約為2 200 bp和5 900 bp,與理論值一致。用In-Fusion連接酶將目的基因與表達載體連接后轉入E.coli JM109,涂布LB固體平板后挑選單菌落,在LB液體培養基中培養后提取質粒,酶切驗證正確后送測序公司測序,測序正確后轉入表達宿主B. subtilis中,涂布LB固體平板后挑選單菌落至LB液體培養基中培養,提取質粒酶切驗證正確,可確定轉入表達載體。
重組菌按照1.2.4進行搖瓶發酵,發酵結束后用高壓勻漿破碎菌體,上清液進行 SDS-PAGE 分析,結果(圖1)顯示,在MTSase理論分子量附近出現明顯的可溶性蛋白條帶。酶活測定結果顯示,重組菌MTSase酶活力為17.5 U/mL。

圖1 重組MTSase蛋白電泳分析
2.2 搖瓶發酵優化
2.2.1 氮源種類對重組菌生長和MTSase產量的影響 以TB培養基為起始培養基,固定氮源濃度為36.0 g/L,分別以工業酵母粉、工業蛋白胨、魚粉蛋白胨、大豆蛋白胨、牛肉浸膏、酪蛋白、棉籽粉、多聚蛋白胨、胰蛋白胨、牛肉粉替代TB培養基中的氮源,其他條件不變,在33℃條件下進行發酵產酶。如圖2所示,采用棉籽粉作為氮源時菌體濃度最高,OD600達到20左右,酶活達到最高的17.8 U/mL;采用工業蛋白胨作為氮源酶活為12.1 U/mL,但OD600較低,只有8.0左右,因此使用工業蛋白胨獲得的單位菌體的酶活較高。可以看出棉籽粉能夠促進菌體生長,而工業蛋白胨則有利于目的蛋白的表達,故采用工業蛋白胨和棉籽粉為氮源復配進行下一步的研究。

圖2 不同氮源對菌體濃度和產酶的影響
2.2.2 氮源配比對重組菌生長和MTSase產量的影響 總氮源濃度為36.0 g/L,將工業蛋白胨和棉籽粉以不同的配比配置搖瓶發酵培養基(工業蛋白胨∶棉籽粉=1∶1,1∶2,1∶3,1∶4,4∶1,3∶1,2∶1)。圖3顯示,當工業蛋白胨:棉籽粉=3∶1時產酶能力最強,酶活達到23.6 U/mL,是只以棉籽粉為氮源時的1.3倍。因此,以工業蛋白胨:棉籽粉=3∶1為氮源比例做進一步優化氮源濃度的研究。
2.2.3 氮源濃度對重組菌生長和MTSase產量的影響 將工業蛋白胨:棉籽粉=3∶1為氮源比例,研究總氮源濃度(12.0、24.0、36.0、48.0和60.0 g/L)對MTSase產量的影響(圖4)。隨著總氮源濃度的增加,菌體濃度也在提高,但從36.0 g/L開始雖然菌體濃度增加但是MTSase酶活并沒有隨著增加,而是固定在24.2 U/mL左右。因此選擇氮源濃度36.0 g/L,蛋白胨∶棉籽粉=3∶1為氮源比例進行下一步的研究。

圖3 氮源配比對重組菌生長和MTSase產量的影響

圖4 氮源濃度對重組菌生長和MTSase產量的影響
2.2.4 碳源種類對重組菌生長和MTSase產量的影響 選擇上述優化好的36.0 g/L的蛋白胨∶棉籽粉=3∶1的復合氮源作為唯一氮源,分別使用10.0 g/L的葡萄糖、果糖、蔗糖、糊精和甘油作為唯一碳源,其他條件不變,在33℃條件下進行發酵產酶。結果(圖5)顯示以葡萄糖為碳源時MTSase酶活最高達到31.9 U/mL,以甘油為唯一碳源時的菌體濃度與以葡萄糖為唯一碳源時的菌體濃度并無較大差距,但酶活相差較大。查閱資料顯示這種分別以葡萄糖和甘油為唯一碳源,菌體濃度相差不大的情況普遍出現,包括大腸桿菌[23,24],因此推測葡萄糖與甘油均是適合枯草芽孢桿菌生長的碳源種類,故菌體濃度相差不大,并且葡萄糖的價格低于甘油價格,因此二者并沒有復配優化的價值,因此選取葡萄糖為碳源種類繼續優化其濃度。
2.2.5 葡萄糖濃度對重組菌生長和MTSase產量的影響 以優化好的復合氮源為唯一氮源,研究葡萄糖濃度(1.0、5.0、10.0、20.0和30.0 g/L)對MTSase產量的影響。如圖6所示,葡萄糖濃度為5.0 g/L時與10.0 g/L時的菌體濃度和MTSase酶活相差較小,考慮到實際應用中的經濟因素,選取5.0 g/L的葡萄糖濃度為最終濃度。同時當葡萄糖濃度超過20 g/L時菌體濃度下降較快,應該是過高的糖濃度使滲透壓較大,因此抑制了重組菌的生長。
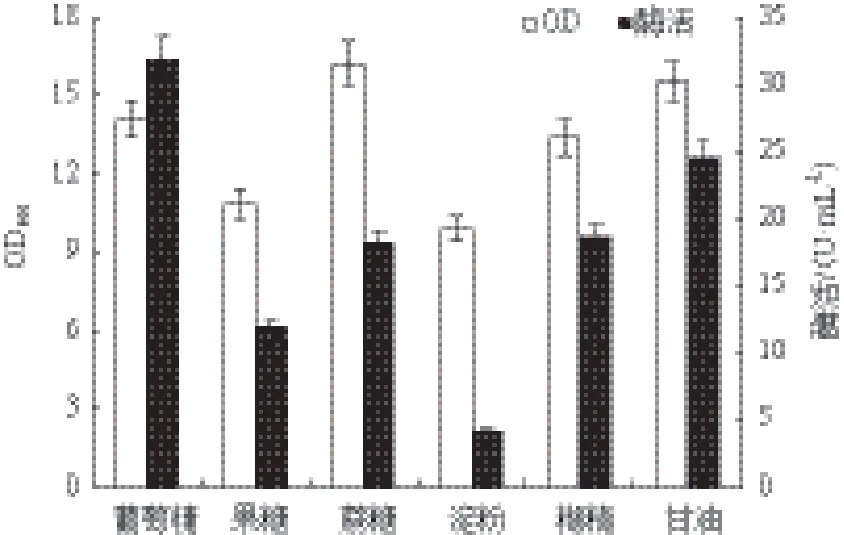
圖5 碳源種類對重組菌生長和MTSase產量的影響

圖6 葡萄糖濃度對重組菌生長和MTSase產量的影響
2.2.6 初始pH對重組菌生長和MTSase產量的影響 在確定了最優氮源、碳源后,為進一步確定初始pH對重組菌生長和MTSase產量的影響,使用2 mol/L的鹽酸與氫氧化鈉調節搖瓶培養基的初始pH并在33℃條件下進行發酵產酶。如圖7所示,在初始pH為7.0時菌體濃度和MTSase酶活最高,確定最適初始pH為7.0。
2.2.7 誘導溫度對重組菌生長和MTSase產量的影響 培養溫度對微生物的代謝過程有一定影響,適宜的溫度范圍對微生物的產酶有促進作用,以上述優化好的氮源、碳源和初始pH為搖瓶培養基配方,研究溫度(25、30、33和37℃)對微生物的生長和產酶的影響。圖8顯示。在溫度范圍25-33℃時菌體濃度隨溫度增加而上升,酶活也隨之增加,最高酶活為33℃所得33.9 U/mL,因此選擇33℃為最適發酵溫度。

圖7 初始pH對重組菌生長和MTSase產量的影響
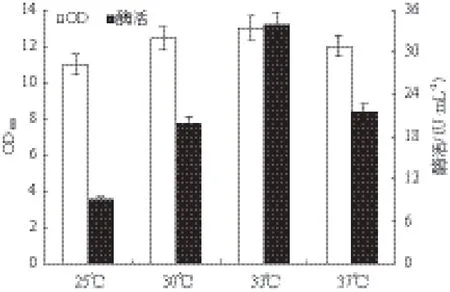
圖8 誘導溫度對重組菌生長和MTSase產量的影響
2.3 正交實驗
根據上述實驗結果,選取對B.brevis產MTSase影響較大的4個因素:氮源(工業蛋白胨∶棉籽粉=3∶1),葡萄糖,初始pH和溫度,各取3個水平,進行L9(34)正交實驗,實驗設計如表1,得出的實驗結果如表2。

表1 正交試驗因素水平設計
由表2中正交實驗結果中極差R值得出:4個因素對枯草芽孢桿菌產MTSase的影響大小依次是B(葡萄糖濃度)>C(初始pH)>A(氮源濃度)>D(溫度),根據正交實驗得到的最優組合為A3B3C2D1。即氮源總濃度為48.0 g/L,葡萄糖濃度為10.0 g/L,初始pH為7.0,溫度為30℃,在此條件下酶活可達41.5 U/mL。

表2 正交實驗結果與分析
3 討論
海藻糖在各個領域的廣泛應用使其需求量與日俱增,目前工業生產中主要采用酶法制取海藻糖,其中雙酶法以淀粉為底物的生產方式在工業應用方面極具價值。根據雙酶法中MTSase在不同菌種中的來源,可將其劃分為中溫酶和高溫酶兩種類型,中溫來源的MTSase大多具有表達量高,酶轉化溫度較低的特點;高溫來源的MTSase則具有較高的酶轉化溫度,大多數轉化溫度在60℃左右,但其表達量普遍不高,較高的酶轉化溫度有利于加快反應的進行且能有效地避免酶轉化過程中的菌體感染,因此從工業應用的角度,高溫酶更加有利。
E. coli表達系統具有蛋白表達量高和菌株生長較快等優點,但使用此系統表達的外源蛋白常常形成無活性的包涵體,特別是胞內表達的蛋白,從已報道的文獻來看,不同來源MTSase在大腸桿菌系統的異源表達中,包涵體普遍存在。例如,陸陽[25]從玫瑰微球菌(Micrococcus roesus QS412)中克隆MTSase基因并在大腸桿菌E.coli DH5α與E.coli BL(DE3)中表達,但在大腸桿菌中的表達產物均以包涵體的形式存在;de Pascale等[12]將來源于Sulfolobus solfataricus MT4的MTSase和MTHase編碼基因在大腸桿菌中進行融合表達并發現包涵體;本實驗室前期將高溫來源的S. acidocaldarius ATCC 33909 MTSase基因treY在大腸桿菌E. coli BL21(DE3)中進行表達,搖瓶酶活為24.2 U/mL,但表達的同時伴有大量包涵體的形成[26]。相對E.coli表達系統,枯草芽孢桿菌大多是非致病微生物,具有較強的分泌蛋白能力,但其對于表達胞內蛋白仍有較大的發展潛力,從本研究的結果來看,在枯草芽孢桿菌中的表達仍有MTSase包涵體存在,但相比于之前在大腸桿菌中表達的包涵體,枯草芽孢桿菌中的包涵體水平已經顯著下降。
本研究從實際應用的角度出發,選取高溫來源的S. acidocaldarius ATCC 33909 MTSase基因treY在枯草芽孢桿菌中進行表達,通過優化重組菌的發酵條件確定最適合MTSase表達的培養基和培養溫度,最終獲得能夠高表達耐高溫MTSase的菌株,為雙酶法的工業應用奠定基礎。雖然優化了枯草芽孢桿菌重組菌的搖瓶發酵條件,但沒有對重組菌在發酵罐中的上罐條件進行優化,這是以后進一步提高MTSase表達量可以進行的工作。
4 結論
本研究首次將Sulfolobus acidocaldarius ATCC 33909來源的麥芽寡糖基海藻糖合成酶在枯草芽孢桿菌中進行了克隆表達,重組菌在TB培養基中發酵48 h,MTSase酶活力為17.5 U/mL;在此基礎上對重組菌產MTSase的發酵條件進行優化,確定其搖瓶發酵產酶的最適培養基為:氮源(工業蛋白胨:棉籽粉=3∶1)為48.0 g/L、葡萄糖為10.0 g/L、初始pH為7.0,培養溫度為30℃。在最優條件下發酵培養,MTSase的酶活可達41.5 U/mL,在工業生產上具有較高的應用價值。
[1]Elbein AD, Pan Y, Pastuszak I, et al. New insights on trehalose:a multifunctional molecule[J]. Glycobiology, 2003, 13(4):17R-27R.
[2]Richards A, Krakowka S, Dexter L, et al. Trehalose:a review of properties, history of use and human tolerance, and results of multiple safety studies[J]. Food and Chemical Toxicology, 2002, 40(7):871-898.
[3] Mandels G, Vitols R, Parrish FW. Trehalose as an endogenous reserve in spores of the fungus Myrothecium verrucaria[J]. Journal of Bacteriology, 1965, 90(6):1589-1598.
[4] Retzinger G, Meredith S, Takayama K, et al. The role of surface in the biological activities of trehalose 6, 6’-dimycolate. Surface properties and development of a model system[J]. Journal of Biological Chemistry, 1981, 256(15):8208-8216.
[5]闞洪玲, 孫洪濤, 董建軍. 海藻糖在化妝品中的應用[J]. 食品與藥品, 2005, 7(9):48-50.
[6] Inoue H, Shimoda C. Changes in trehalose content and trehalase activity during spore germination in fission yeast, Schizosaccharomyces pombe[J]. Archives of Microbiology, 1981, 129(1):19-22.
[7]Schiraldi C, Di Lernia I, De Rosa M. Trehalose production:exploiting novel approaches[J]. TRENDS in Biotechnology, 2002, 20(10):420-425.
[8]Kato M, Takehara K, Kettoku M, et al. Subsite structure and catalytic mechanism of a new glycosyltrehalose-producing enzyme isolated from the hyperthermophilic archaeum, Sulfolobus solfataricus KM1[J]. Biosci Biotechnol Biochem, 2000, 64(2):319-326.
[9] Lama L, Nicolaus B, Trincone A, et al. Starch conversion with immobilized thermophilic archaebacterium Sulfolobus solfataricus[J]. Biotechnology Letters, 1990, 12(6):431-432.
[10] Mukai K, Tabuchi A, Nakada T, et al. Production of trehalose from starch by thermostable enzymes from Sulfolobus acidocaldarius[J]. Starch-Starke, 1997, 49(1):26-30.
[11]Nakada T, Maruta K, Tsusaki K, et al. Purification and properties of a novel enzyme, maltooligosyl trehalose synthase, from Arthrobacter sp. Q36[J]. Biosci Biotech Bioch, 1995, 59(12):2210-2214.
[12]de Pasale D, Di Lernia I, Sasso MP, et al. A novel thermophilic fusion enzyme for trehalose production[J]. Extremophiles, 2002, 6(6):463-468.
[13]Fang TY, Hung XG, Shih TY, et al. Characterization of the trehalosyl dextrin-forming enzyme from the thermophilic archaeon Sulfolobus solfataricus ATCC 35092[J]. Extremophiles, 2004, 8(4):335-343.
[14] Kato M, Miura Y, Kettoku M, et al. Purification and characterization of new trehalose-producing enzymes isolated from the hyperthermophilic archae, Sulfolobus solfataricus KM1[J]. Biosci Biotech Bioch, 1996, 60(3):546-550.
[15] Yamamoto T, Maruta K, Watanabe H, et al. Trehalose-producing operon treYZ from Arthrobacter ramosus S34*[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(6):1419-1423.
[16]Kato M. Trehalose production with a new enzymatic system from Sulfolobus solfataricus KM11[J]. Journal of Molecular Catalysis B Enzymatic, 1999, 6(3):223-233.
[17]吳襟, 于煒婷, 王輝, 等. 耐熱古菌芝田硫化葉菌海藻糖生成相關酶的基因克隆、表達和序列分析[J]. 生物化學與生物物理進展, 2003, 30(5):798-802.
[18]張文德, 喬宇, 丁宏標. 谷氨酸棒桿菌麥芽寡糖基海藻糖合成酶基因的克隆與表達[J]. 中國農業科技導報, 2009, 11(1):68-72.
[19]王曉閣. 枯草芽孢桿菌研究進展與展望[J]. 中山大學研究生學刊:自然科學與醫學版, 2012,(3):14-23.
[20]Kang Z, Duan X, Jing W. Multigene disruption in undomesticated Bacillus subtilis ATCC 6051a using the CRISPR/Cas9 system[J]. Scientific Reports, 2016, 2016(6):27943-27943.
[21] Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Anal Chem, 1959, 31(3):426.
[22] Nakada T, Ikegami S, Chaen H, et al. Purification and characterization of thermostable maltooligosyl trehalose trehalohydrolase from the thermoacidophilic archaebacterium[J]. Biosci Biotechnol Biochem, 1996, 60(2):263-266.
[23]胡爽, 蔡海波, 蔣加慶, 等. 碳源對重組大腸桿菌發酵生產GLP-1融合蛋白的影響[J]. 工業微生物, 2010, 40(4):57-62.
[24]楊海麟, 王長城, 張玲, 等. 產膽固醇氧化酶重組大腸桿菌的發酵培養基和誘導條件的優化[J]. 食品與生物技術學報, 2009, 28(5):670-674.
[25]陸陽. 玫瑰微球菌海藻糖合成相關酶基因的克隆以及基因工程菌的構建表達[D]. 北京:北京化工大學, 2005.
[26]吳世雄. 嗜酸熱硫化葉菌MTSase和MTHase的異源表達及應用[D]. 無錫:江南大學, 2016.
(責任編輯 李楠)
Recombinant Expression and Fermentation Optimization of Sulfolobus acidocaldarius ATCC 33909 Maltooligosyltrehalose Synthase in Bacillus subtilis
HAN Chang SU Ling-qia WU Jing
(State Key Laboratory of Food Science and Technology,Jiangnan University,School of Biotechnology and Key Laboratory of Industrial Biotechnology Ministry of Education,Jiangnan University,Wuxi 214122)
To obtain the recombinant expression of gene treY for maltooligosyltrehalose synthase(MTSase)from Sulfolobus acidocaldarius ATCC 33909 in Bacillus subtilis,the target gene was PCR-amplified using plasmid pET-24a(+)-treY as template,and ligated with the expression vector pHY300PLK,then transformed into the expression host Bacillus subtilis CCTCC M 2016536. The activity of MTSasereached 17.5 U/mL after cultivated in TB culture for 48 h. By single factor test(nitrogen source,nitrogen proportion,nitrogen concentration,carbon source,glucose concentration,initial pH,and induction temperature)and orthogonal test(nitrogen concentration,glucose concentration,initial pH,and induction temperature),the optimal fermentation condition was determined as:48.0 g/L of nitrogen source(industrial peptone∶cottonseed powder=3∶1),10.0 g/L of glucose,initial pH of medium=7.0,and the optimal temperature was 30℃. Under optimal conditions,the production of MTSase reached 41.5 U/mL,which was 2.4 times of that before optimization.
maltooligosyltrehalose synthase;Bacillus subtilis;recombinant expression;fermentation optimization
10.13560/J.cnki.biotech.bull.1985.2017-0086
2017-02-14
國家自然科學基金杰出青年基金項目(31425020),江蘇高校優秀科技創新團隊項目(吳敬)
韓唱,女,碩士,研究方向:工業微生物與酶技術;E-mail:lilyhanc@qq.com
吳敬,女,博士生導師,研究方向:食品與發酵;E-mail:jingwu@jiangnan.edu.cn

