錳超氧化物歧化酶基因轉染對豚鼠耳蝸組織Caspase 3蛋白活性的影響
林 馨,王一鳴
(浙江中醫藥大學醫學技術學院,浙江杭州 310053)
錳超氧化物歧化酶基因轉染對豚鼠耳蝸組織Caspase 3蛋白活性的影響
林 馨,王一鳴
(浙江中醫藥大學醫學技術學院,浙江杭州 310053)
采用雄性豚鼠按每天50 mg/kg給予醋酸潑尼松龍肌注連續10 d,在第6天按每天400 mg/kg給予硫酸卡那霉素肌注連續5 d的方法,制備腎虛耳聾模型。將攜帶MnSOD基因的慢病毒液經圓窗膜注入豚鼠耳蝸的外淋巴液中,并檢測耳蝸外源性MnSOD和Caspase 3的活性。以此研究錳超氧化物歧化酶(MnSOD)基因對腎虛耳聾豚鼠耳蝸組織的Caspase 3蛋白活性的影響,探討其對內耳氧化損傷的保護作用機制。結果表明外源性MnSOD基因轉染腎虛耳聾豚鼠耳蝸組織能夠抑制其Caspase 3的蛋白活性,從而對內耳氧化損傷起到保護作用。
錳超氧化物歧化酶;腎虛耳聾;Caspase 3
超氧化物歧化酶(Superoxide dismutase,SOD)是廣泛存在于生物體各個組織中的重要金屬酶,是唯一將超氧陰離子轉化為過氧化氫的抗氧化酶。目前已知的哺乳動物體內SOD有三種異構體,分別是銅/鋅超氧化物歧化酶(Cu/ZnSOD或SOD1)、錳超氧化物歧化酶(MnSOD或SOD2)和細胞外超氧化物歧化酶(ECSOD或SOD3)。Cu/ZnSOD主要存在于哺乳動物細胞的胞漿、胞核及溶酶體內,MnSOD主要存在于需氧細胞的線粒體中,ECSOD最初在人血漿、淋巴、腹水和腦脊液中發現,與肝素有較高的親和力,三種SOD主要在它們各自的部位發揮保護功能。線粒體的氧化呼吸鏈是體內自由基產生的最主要場所,MnSOD是線粒體內的主要酶性自由基的清除劑,在維持線粒體功能、體內外抗氧化損傷中發揮重要作用。NAKASHIMA等[1]將帶有Cu/ZnSOD和MnSOD的基因導入豚鼠耳蝸,發現能對抗氨基糖甙類藥物的部分毒性,且MnSOD起主導作用,MnSOD水平的調節可能是細胞所有氧化還原狀態的重要生理機制。
Caspase 3屬于Caspase(Cysteine-requiring Aspartate Protease)家族,在細胞凋亡過程中起關鍵作用。因此Caspase 3在海內外有關哺乳動物細胞研究中最受關注。Caspase 3可以剪切procaspase 2、6、7和9,并可直接特異性剪切眾多 Caspase底物,包括 PARP(poly(ADP-ribose)polymerase)、ICAD(Inhibitor of Caspase-activated deoxyribonuclease)等。上述由Caspase 3介導的蛋白剪切是細胞凋亡分子機制的重要組成部分。此外,Caspase 3對細胞起泡和細胞核的凋亡過程中也起關鍵作用。因此為了進一步研究MnSOD對豚鼠耳蝸組織中Caspase 3活性的影響,本課題將MnSOD基因導入腎虛耳聾豚鼠耳蝸組織產生持續高表達,測定其對Caspase 3表達的影響,從而說明MnSOD是否通過對細胞凋亡機制的抑制而起到有效的抗氧化保護作用。
1 材料與方法
1.1 實驗材料及儀器
超氧化物歧化酶(SOD)分型測試盒;Caspase 3活性檢測試劑盒(碧云天);EcoR I、Not I、XbaI(Fermentas)。
1.2 實驗方法
1.2.1 豚鼠MnSOD基因慢病毒載體的構建
從GenBank:U39843.1獲得豚鼠MnSOD基因信息,據此設計含cMnSOD基因的DNA片段,并由金斯瑞進行合成,其序列(674 bp)如下:

軟件驗證其翻譯后氨基酸序列與GenBank:U39843.1獲信息一致:
EFDLYDDDDKMLCRAVCSASRRLAPAL-
GILGVRQKHSLPDLPYDYGALQPHI -
NAEIMQLHHSKHHAAYLNNLNI
AEEKYQEALAKGDVTAQVALQ
PALKFNGGGHINHSIFWTNLSP
NGGGEPKGELLEAIKRDFGSFDK
FKEKLTAVSVGVQGSGWGWL
GFNKERGCLQIAACSNQDPLQGTTGLI
PLLGIDVWEHAYYLQLKNVRPDYLKAIWKVIKNS
合成基因(cMnSOD)克隆(EcoR I/Not I)至pLVHisSSD-Puro(慢病毒載體),獲得pLV-HiscMnSOD–Puro。最終質粒進行EcoRI/XbaI酶切鑒定和基因測序鑒定,結果如圖1。
1.2.2 MnSOD基因慢病毒的制備
轉染前 24 h,將 293V 細胞以(4~5)×106/10 cm2平皿密度接種,加入10 mL 293V培養基37℃,5%CO2培養。細胞轉染前密度應達到90%。漩渦震蕩混勻Polyfect-V轉染試劑。準備2個離心管,按以下順序分別制備質粒和轉染試劑稀釋液。離心管1:目的基因慢病毒載體質粒5 μg,pH1 質粒 3.75 μg,pH2 質粒 1.25 μg,加 DMEM 無血清培養基至 500 μL;離心管 2:Polyfect-V 轉染試劑 20 μL,加DMEM無血清培養基至500 μL。充分混勻。將轉染試劑稀釋液(離心管2)加入質粒DNA溶液(離心管1)中,立刻充分混勻。室溫孵育轉染混合液15 min。將轉染混合液逐滴加入步驟1準備的細胞培養皿,前后晃動培養皿,充分混勻。37℃,5%CO2培養。4~6 h后,用10 mL新鮮的293V培養基換液。轉染后24 h,用10 mL病毒培養基換液。轉染后48~72 h收集細胞培養上清。500 g離心10 min去除細胞碎片;上清過0.45 μm濾膜即可直接用于慢病毒感染。
圖1 pLV-HisSSD-Puro質粒圖譜及測序結果Fig.1 pLV-HisSSD-Puro plasmid map and sequencing results
1.2.3 動物模型的建立,制備腎虛耳聾動物模型
選用健康活潑、無耳疾、耳廓反射靈敏的白色紅目雄性豚鼠12只,體重250~350 g,由浙江中醫藥大學動物實驗中心提供。適應性飼養1周后隨機分為3組,腎虛耳聾模型組(模型組3只):50 mg/(kg·d)醋酸潑尼松龍(肌注,10 d)+400 mg/(kg·d)硫酸卡那霉素(從第6天開始,肌注,5 d)。腎虛耳聾治療組(治療組3只):醋酸潑尼松龍(劑量同致聾組)+硫酸卡那霉素(劑量同致聾組),同時在第6天開始經左耳圓窗膜向外淋巴液注射攜帶有MnSOD基因的慢病毒液體6 μL。空白對照組(空白組3只):單純給予醋酸潑尼松龍(劑量同致聾組),在第6天經左耳圓窗膜向外淋巴液注射生理鹽水6 μL。
手術操作-圓窗膜進路:10%水合氯醛麻醉動物,暴露并打開聽泡,擴大骨孔,手術顯微鏡下辨認蝸窗膜,用尖端彎曲的10 μL微量進樣器刺破圓窗膜,抽取MnSOD病毒液或生理鹽水(6 μL),以3 μL/5 min的速度緩慢地注入外淋巴,注射完畢后取顳肌筋膜填于圓窗龕內,以防止穿刺部位液體回漏,縫合皮膚切口。于經左耳圓窗膜注射4周后行下一實驗步驟。
1.2.4 外源MnSOD基因轉染腎虛耳聾豚鼠后耳蝸組織內的MnSOD及Caspase 3活性測定
1.2.4.1耳蝸組織錳超氧化物歧化酶(MnSOD)活性測定
各組動物麻醉處死,取聽泡,在解剖顯微鏡下剔除蝸殼,將蝸軸連同膜蝸管取下,雙耳合為一份標,稱重,以1 g:1 000 mL生理鹽水稀釋研磨,制成5%組織勻漿4 000 r/min離心15 min。取小量用Bradford法檢測待測樣品中的蛋白濃度。取上清30 μL按SOD分型測試盒說明書加入試劑,37℃水浴40 min后加入顯色劑,靜置10 min,用分光光度計550 nm下測吸光度,計算SOD總活性(U/mg pro)。取上述5%勻漿50 μL按說明書加入等體積試劑7混勻后4 000 r/min離心15 min,取上清按上述相同方法加樣測定,計算Zn-Cu-SOD活性(U/mg pro)。SOD總活性減去ZnCu-SOD活性即為MnSOD活性(U/mg pro)。
1.2.4.2耳蝸組織Caspase 3活性測定
樣本前處理同1.2.4.1。取上清10?L按Caspase 3活性檢測試劑盒說明書加入試劑。
A.取出pNA和適量的Ac-DEVD-pNA(2mM),置于冰浴上備用。
B.如下設置反應體系:

試劑 空白對照 樣品檢測緩沖液待測樣品Ac-DEVD-pNA(2 mM)總體積90 μL 0 μL 10 μL 100 μL 80 μL 10 μL 10 μL 100 μL
在設置反應體系時先加檢測緩沖液,再加待測樣品,適當混勻,注意避免在混勻時產生氣泡。隨后再加入 10 μL Ac-DEVD-pNA(2 mM)。
C.加入Ac-DEVD-pNA(2 mM)后混勻,注意避免在混勻時產生氣泡。37℃孵育60~120 min。發現顏色變化比較明顯時即可測定A405。
D.樣品的A405扣除空白對照的A405,即為樣品中Caspase 3催化產生的pNA產生的吸光度。
E.參考Chemicon公司的Caspase 3酶活力單位的定義,計算出樣品中含有多少個酶活力單位的Caspase 3。
1.2.5 數據處理
采用SPSS17.0軟件進行數據處理。統計分析采用單因素方差分析,P表示顯著性,數據以均數±標準差(±s)表示。
2 實驗結果
外源MnSOD基因轉染腎虛耳聾豚鼠后其耳蝸組織內的MnSOD活性測定結果表明(見表1和圖2),與空白組比,模型組豚鼠耳蝸組織內的MnSOD活性顯著降低,差異具有統計學意義(P≤0.01)。而與模型組比,MnSOD基因轉染組豚鼠耳蝸組織內的MnSOD活性顯著升高,差異具有統計學意義(P≤0.05),說明MnSOD外源基因轉染成功。
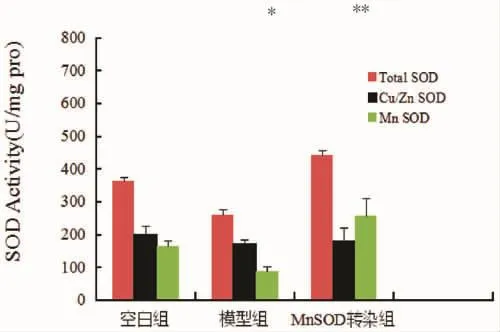
圖2 豚鼠耳蝸組織內的總SOD、ZnCu-SOD及MnSOD活性Fig.2 Total SOD,ZnCu-SOD and MnSOD activities in guinea pig cochlea

表1 豚鼠耳蝸組織內的MnSOD活性(n=3)Tab.1 MnSOD activity in guinea pig cochlear tissue(n=3)
為了進一步明確外源MnSOD基因轉染后對豚鼠耳蝸組織的作用,本實驗檢測了外源MnSOD基因轉染前后腎虛耳聾豚鼠耳蝸組織內的Caspase 3活性。表2結果表明,其耳蝸組織內的Caspase 3活性測定結果如表2。腎虛耳聾模型組耳蝸組織內的Caspase 3活性與空白組相比顯著升高,差異具有統計學意義(P≤0.05)。而外源MnSOD基因轉染腎虛耳聾豚鼠后,MnSOD轉染組的Caspase 3活性明顯降低,差異具有統計學意義(P≤0.05),說明外源MnSOD基因轉染抑制了虛耳聾豚鼠后耳組織內的Caspase 3的活性。
3 討論
感音神經性聾是臨床難治性疾病之一。據統計,目前我國聽力障礙殘疾人有2 057萬,占全部人口的1.67%,其中超過80%是感音神經性聾。劉蓬等[2-3]研究證實,聽力障礙多表現為腎虛的主要征象,腎虛易致耳聾。前期調查研究表明,浙江省7歲以下進行聽覺語言康復訓練的感音神經性聾兒童,其中辨證為腎虛型的占30.5%[4]。由于耳蝸的特殊解剖位置且具有血-迷路屏障,藥物難以在耳蝸局部達到有效濃度,故目前尚無有效的治療感音神經性聾的藥物和方法。

表2 豚鼠耳蝸組織內的Caspase 3活性(n=3)Tab.2 Caspase 3 activity in guinea pig cochlear tissue(n=3)
“腎為先天之本”。腎氣、腎陽是一身陽氣根本。對人體有推動、溫煦功能,腎陰為一身陰液根本,對人體有滋養、濡潤作用。腎的精氣旺盛,體內清除自由基的酶類和非酶類系統功能正常,自由基對人體的損害較小;相反,腎氣衰弱,則必然引起機體正氣不足,影響機體的代謝能力,則機體內清除自由基的酶類和非酶類系統功能低下,自由基造成的過氧化反應導致對人體的損害。陳揚榮等[5]研究表明腎氣虛組患者的SOD活性明顯低下,血漿中過氧化脂含量增多,提示腎虛與SOD活力的低下關系密切。腎虛導致內耳自由基蓄積,氧自由基的堆積是引發聽毛細胞退行性變的始動因素。
近年來的研究表明自由基可通過生物膜中不飽和脂肪酸的過氧化導致生物膜形態和功能的改變,從而引起細胞壞死或凋亡,細胞凋亡是細胞在各種死亡信號刺激后發生的一系列程序性的死亡過程,Caspase家族是細胞凋亡最關鍵的執行因子,尤其是Caspase3[6]。多種多樣刺激因素啟動的信號激活Caspase3,活化的Caspase3可作用于一些其它Caspase成員,并以瀑布式活化引起細胞形態上的改變,最終完成凋亡過程,因此Caspase3的激活被認為是凋亡蛋白酶級聯反應的必經之路[7-8]。Caspase 3表達陽性意味著細胞凋亡在進行過程中。
MnSOD是線粒體內的主要酶性自由基的清除劑,在維持線粒體功能、體內外抗氧化損傷中發揮著重要作用,也是內耳組織細胞中十分重要的抗氧化酶類。結果證明腎虛耳聾豚鼠耳窩組織內MnSOD水平比空白組明顯降低,而轉染外源MnSOD基因后,耳窩組織內MnSOD水平顯著升高。同時,從Caspase3活性的檢測結果可以看出,與空白組相比,腎虛耳聾豚鼠耳窩組織內Caspase3活性顯著上升,而轉染外源Mn-SOD基因后,Caspase3活性明顯下降。由此推斷,腎虛耳聾可能與耳蝸組織內清除自由基功能低下、Caspase3活性升高有關,而外源性MnSOD基因能成功在腎虛耳聾豚鼠耳窩組織內表達,并且外源性MnSOD能夠顯著抑制耳蝸組織內Caspase 3的活性,從而有可能抑制了耳蝸組織內的細胞凋亡途徑,但其抑制凋亡的具體機制仍有待深入探討。
[1]NAKASHIMA T,UEDA H,FURUHASHI A,et al.Large vestibular aqueduct syndrome treated by hyperbaric oxygen[J].International Journal of Pediatric Otorhinolaryngology,2000,51(3):207-210.
[2]劉 蓬,王培源,邱寶珊,等.腎陰虛對卡那霉素耳毒易感性的影響[J].中國中醫基礎醫學雜志,2002,8(3):24-27.
[3]劉 蓬,邱寶珊,王培源,等.腎陰虛對豚鼠聽力的影響及補腎中藥的拮抗作用 [J].中國中西醫結合耳鼻咽喉科雜志,2001,9(2):57-63.
[4]王永華,樓蘭花,劉金洪,等.中藥“天鼓”對卡那霉素中毒性耳聾的預防作用及機理研究[J].中國中醫基礎醫學雜志,2001,7(10):28-31.
[5]陳揚榮,江 明,李慶陽.老年脾腎虛證LPO、SOD、血脂關系的探討[J].中國中醫基礎醫學雜志,2002,8(7):44-45.
[6]NOOR R,SHUAIB U,WANG Chenxu,et al.High-density lipoprotein cholesterol regulates endothelial progenitor cells by increasing eNOS and preventing apoptosis[J].Atherosclerosis,2007,192(1):92-99.
Effects of Manganese Superoxide Dismutase Gene Transfection on the Activity of Caspase 3 Protein in Guinea Pig Cochlear Tissue
LIN Xin,WANG Yi-ming
(College of Medicine and Technology,Zhejiang Chinese Medical University,Hangzhou 310053,China)
First,the model of kidney deficiency deafness was prepared,male guinea pigs were given 50 mg/kg/day prednisolone acetate for 10 days.Then from day 6 each guinea pigs were intramuscular injection kanamycin 400mg/kg/day.The lentiviral solution carrying manganese superoxide dismutase(MnSOD)gene was injected into the perilymph of guinea pig cochlea through round window membrane,and the activities of exogenous MnSOD and Caspase 3 were detected.In order to studied the effect of MnSOD gene on the activity of Caspase 3 protein in cochlear tissue of guinea pigs with kidney vacuity deafness.And explored the protective mechanism of MnSOD gene on oxidative damage in inner ear.The results showed that the cochlear tissue of guinea pigs transfected with exogenous MnSOD gene could inhibit the activity of Caspase 3 protein and protect the inner ear from oxidative damage.Inhibit the activity of Caspase 3 protein,and thus protect the inner ear from oxidative damage.
MnSOD;kidney vacuity deafness;Caspase 3
R965
:A
2016-12-10
浙江省教育廳科研項目(Y201121286)
林馨(1962-),女,浙江杭州人,主任中醫師,研究方向:中西醫結合耳聾康復.E-mail:595188264@qq.com
1008-830X(2017)01-0081-05

