水產養殖用復合微生物粉劑中菌種的分子生物學鑒定
郭婉萍,趙晶,欒春雨,郭灣,權春善
(大連民族大學生命科學學院,大連民族大學生物技術與資源利用教育部重點實驗室,大連 116600)
?
水產養殖用復合微生物粉劑中菌種的分子生物學鑒定
郭婉萍,趙晶*,欒春雨,郭灣,權春善
(大連民族大學生命科學學院,大連民族大學生物技術與資源利用教育部重點實驗室,大連 116600)
對兩種市售水產養殖用復合微生物粉劑中微生物菌種進行鑒定。利用平板分離技術對粉劑中的微生物進行分離純化,進行了形態學觀察、16S rDNA和26S rDNA序列分析,并構建系統發育樹。結果表明,兩種微生物粉劑中菌群結構存在一定差異,S1粉劑中鑒定出5株芽孢桿菌和2株酵母菌,分別為枯草芽孢桿菌、地衣芽孢桿菌或索諾拉沙漠芽孢桿菌、葡萄牙棒孢酵母和庫德里阿茲威畢赤酵母;S2粉劑中鑒定出3株芽孢桿菌、1株放線菌、2株酵母菌和3株腸球菌,分別為解木糖賴氨酸芽孢桿菌、環狀芽孢桿菌、地衣芽孢桿菌或索諾拉沙漠芽孢桿菌、芬氏纖維微菌、釀酒酵母、庫德里阿茲威畢赤酵母、鶉雞腸球菌、屎腸球菌或乳酸腸球菌。明確水產養殖用復合微生物粉劑的菌群結構,為同類產品的安全性及有效性評估提供理論基礎。
水產養殖;復合微生物粉劑;菌群結構;鑒定;16S rDNA;26S rDNA
隨著水產養殖業集約化程度的提高,養殖水體污染嚴重、水產養殖動物病害發生率增加等問題不斷凸顯,嚴重制約了水產養殖業的可持續發展。水產養殖病害防治的傳統方法主要是使用抗生素及化學藥物,然而,該方法會導致病原微生物的耐藥性提高、養殖對象體內藥物殘留甚至藥害事故,具有一定的局限性,不利于水產品的質量安全。近年來,微生物制劑作為一類新型的水產養殖用藥,由于其廉價、安全高效、無污染、有效改善水體環境、防治病害及促進養殖對象生長等特點,已在國內外得到廣泛重視[1-3]。按照菌種組成,微生物制劑分為單一菌種制劑和復合菌種制劑,其中市售的多為復合微生物制劑,不同品牌存在微生物菌種及配比的差異。目前,我國對于水產養殖用微生物制劑缺乏有效管理,尤其是對于用于水質改良的微生物制劑菌種,缺乏明確規定。目前市售復合微生物制劑存在菌種種類標注不完整,產品說明存在夸大效果等問題,產品質量良莠不齊,是否適合水產養殖環境有待考察[4]。對水產養殖復合微生物制劑的有效性和安全性進行評價,是確保產品質量和使用效果的必要手段,而菌種組成是評價的重要指標之一。目前僅有少數研究對農業及環保領域使用的復合微生物制劑進行了菌種鑒定[5-7],對于水產養殖用復合微生物制劑尚無菌種組成分析的研究。
微生物制劑主要有固體、半固體和液體制劑三種劑型,其中固體制劑以粉劑劑型為主,具有便于運輸和保存、菌種數量較為穩定的特點[4]。本研究選擇兩種市售水產養殖復合微生物粉劑為研究對象,利用分子生物學鑒定方法,鑒定其中的菌種多樣性,為該類產品的質量檢測和所含菌種的安全性評估奠定基礎。
1 材料與方法
1.1 材料
1.1.1 水產養殖用復合微生物粉劑 市售EM菌劑 (下文中用S1表示),產地河北,標注菌群包括乳酸桿菌、芽孢桿菌、放線菌等,活菌總數未注明。市售復合菌劑(下文中用S2表示),產地河南,標注菌群包括放線菌、乳酸菌、芽孢桿菌、酵母菌等,活菌總數≥500億/克。
1.1.2 主要試劑及儀器 2×Taq預混PCR反應體系購自北京康潤誠業生物科技有限公司,DL2000 DNA Marker、λ-Hind Ⅲ digest DNA Marker、細菌基因組DNA提取試劑盒、DNA膠回收試劑盒、DNA純化試劑盒等均購自寶生物(Takara)工程(大連)有限公司,酵母基因組DNA快速抽提試劑盒購自生工生物工程(上海)股份有限公司。HVE-50高壓滅菌器購自日本Hirayama公司,DH500A電熱恒溫培養箱購自天津泰斯特儀器有限公司,ZWY-240恒溫搖床購自上海智城分析儀器制造有限公司,ABI Veriti PCR儀購自美國ABI公司 ,Mupid-2plus核酸電泳儀購自日本Mupid公司,GelDoc-ItTM300凝膠成像系統購自美國UVP公司。
1.2 方法
1.2.1 菌種篩選培養基的配置 菌種篩選培養基的配置按文獻[8]進行。
1.2.2 菌種分離培養及形態學觀察 以無菌藥匙稱取固體菌劑10 g至盛有90 mL滅菌蒸餾水的錐形瓶中,振搖30 min,制成10-1的菌懸液并進行梯度稀釋。采用平板稀釋涂布法對酵母菌、放線菌、乳酸菌、芽孢桿菌分別進行分離,其中乳酸菌采用雙層平板法培養。酵母菌培養條件為28 ℃恒溫培養3~5 d,放線菌培養條件為28 ℃恒溫培養5~7 d,芽孢桿菌培養條件為30 ℃恒溫培養2~3 d,乳酸菌培養條件為36 ℃恒溫培養2~3 d。挑取單菌落劃線分離獲得純種,觀察菌落特征,并于光學顯微鏡下觀察細胞形態。純化后的菌種接種于未加瓊脂的菌種篩選培養基,180 r/min振蕩培養。
1.2.3 菌種分子生物學鑒定
1.2.3.1 基因組提取 酵母基因組提取按照酵母基因組DNA快速抽提試劑盒說明書進行,放線菌、乳酸菌、芽孢桿菌基因組DNA提取按照細菌基因組DNA提取試劑盒說明書進行,用1% 瓊脂糖凝膠電泳檢測基因組 DNA的完整性。
1.2.3.2 16S rDNA和26S rDNA的PCR擴增 以提取的放線菌、乳酸菌、芽孢桿菌基因組DNA為模板,利用通用引物16S-27f和16S-1541r進行16S rDNA PCR擴增,正向27f引物序列為5′-AGAGTTTGATCCTGGCTCAG-3′,反向1541r引物序列為5′-AAGGAGGTGATCCAGCC-3′;以提取的酵母菌基因組DNA為模板,利用通用引物NL1和NL4進行26S rDNA D1/D2區PCR擴增,正向NL-1引物序列為:5′-GCATATCAATAAGCGGAGGAAAAG-3′,反向NL-4引物序列為5′-GGTCCGTGTTTCAAGACGG-3′,由生工生物工程(上海)公司合成。 PCR反應條件為:95 ℃預變性2 min;94 ℃變性30 s,50 ℃退火30 s,72 ℃延伸1 min,30個循環;72 ℃延伸5 min。取5 μL PCR產物于1%瓊脂糖凝膠中進行電泳,100 V恒壓30 min,UVP凝膠成像系統觀察并成像分析。擴增產物經純化后送生工生物工程(上海)公司測序。
1.2.3.3 PCR產物鑒定及系統發育進化樹的構建
采用BLAST檢索GenBank數據庫,對測序結果進行同源性分析,確定其種屬。利用MEGA 5.0軟件對測序結果進行16S rDNA和26S rDNA序列比對分析,并采用鄰接法(Neighbor-joining method)構建系統發育樹,通過1000次的自舉分析(bootstrap)進行置信度檢測。序列提交GenBank數據庫獲取登錄號。
2 結果與分析
2.1 篩選菌株的形態學觀察 利用菌種篩選培養基對S1和S2兩種粉劑中的菌株進行分離培養,從S1粉劑中篩選得到的5株芽孢桿菌分別編號為S1-B1、S1-B2、S1-B3、S1-B4和S1-B5;2株酵母菌分別編號為S1-Y1和S1-Y2。從S2粉劑中篩選得到的3株芽孢桿菌分別編號為S2-B1、S2-B2和S2-B3;1株放線菌編號為S2-A1;2株酵母菌分別編號為S2-Y1和S2-Y2; 3株腸球菌分別編號為S2-L1、S2-L2和S2-L3。對各菌株的菌落及細胞形態特征進行觀察,結果見表1。其中3株腸球菌均能使溴甲酚綠變為黃色。
2.2 16S rDNA和26S rDNA基因序列 PCR 擴增 以提取的各篩選菌株基因組DNA為模板進行PCR擴增,電泳結果顯示(圖1),擴增的目的片段電泳條帶清晰,芽孢桿菌、放線菌及腸球菌16S rDNA PCR擴增產物大小約為1500 bp左右;酵母菌26S rDNA D1/D2區PCR擴增產物大小約為500~650 bp左右。
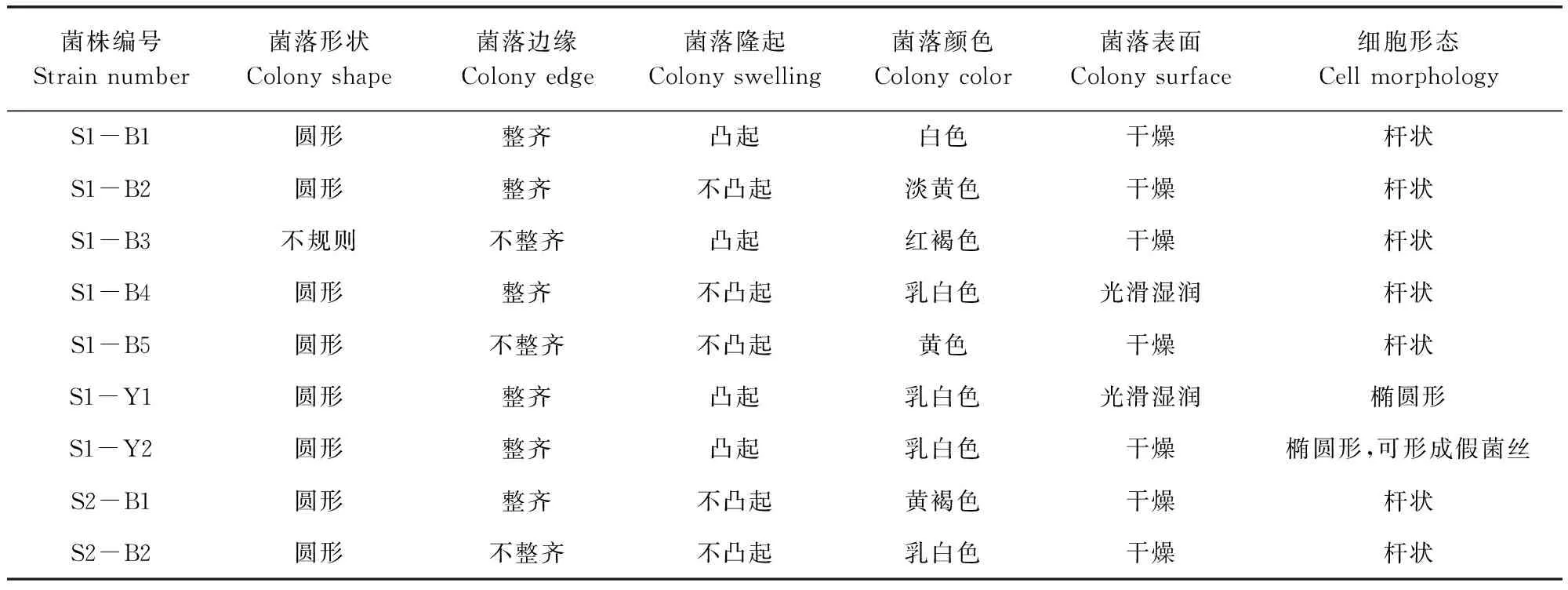
表1 菌落及細胞形態特征觀察結果Tab 1 The morphological characteristics of cells and colonies

續表

M:DL2000 DNA Marker;圖(a)為S1和S2菌劑中芽孢桿菌16S rDNA PCR擴增產物;圖(b)為S2菌劑中放線菌16S rDNA PCR擴增產物;圖(c)為S1和S2菌劑中酵母菌26S rDNA PCR擴增產物;圖(d)為S2菌劑中腸球菌16S rDNA PCR擴增產物M: DL2000 DNA Marker; (a): PCR products of 16S rDNA of Bacillus strains in S1 and S2 microbial powders;(b): PCR product of 16S rDNA of an Actinomycete strain in S2 microbial powder;(c): PCR products of 26S rDNA of yeast strains in S1 and S2 microbial powders; (d): PCR products of 16S rDNA of Enterococcus strains in S2 microbial powder圖1 16S rDNA和26S rDNA PCR擴增產物電泳圖Fig 1 Electrophoresis of 16S rDNA and 26S rDNA PCR products
2.3 同源性比對及系統發育分析
2.3.1 芽孢桿菌同源性比對及系統發育分析 將S1和S2菌劑中篩選得到的8株芽孢桿菌與Gene Bank數據庫中已收錄菌株的16S rDNA序列進行比對,并構建系統發育樹(圖2)。
結果表明,S1菌劑中5株芽孢桿菌均為芽孢桿菌屬,其中S1-B1和S1-B5與Bacillussubtilis(枯草芽孢桿菌)相似性在99%-100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將兩株菌鑒定為枯草芽孢桿菌;S1-B2、S1-B3和S1-B4與Bacilluslicheniformis(地衣芽孢桿菌)和Bacillussonorensis(索諾拉沙漠芽孢桿菌)相似性在99%~100%之間,系統發育樹顯示這三株菌與Bacilluslicheniformis及Bacillussonorensis處于同一分支,親緣關系最近,因此這三株菌為地衣芽孢桿菌或索諾拉沙漠芽孢桿菌。
S2菌劑中,S2-B1與賴氨酸芽孢桿菌屬菌株相似性在99%~100%之間,系統發育樹顯示其與Lysinibacillusxylanilyticus(解木糖賴氨酸芽孢桿菌)處于同一分支,親緣關系最近,因此將S2-B1鑒定為解木糖賴氨酸芽孢桿菌。S2-B2與S2-B3為芽孢桿菌屬,其中S2-B2與Bacilluscirculans(環狀芽孢桿菌)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將S2-B2鑒定為環狀芽孢桿菌;S2-B3與Bacilluslicheniformis(地衣芽孢桿菌)和Bacillussonorensis(索諾拉沙漠芽孢桿菌)相似性在99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此S2-B3為地衣芽孢桿菌或索諾拉沙漠芽孢桿菌。
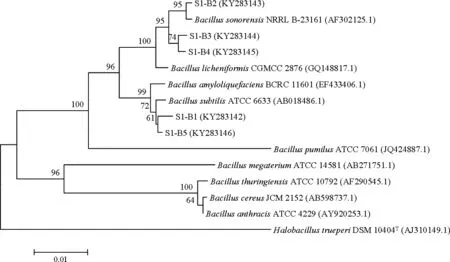
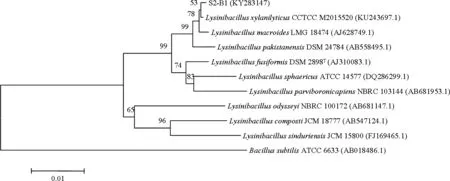
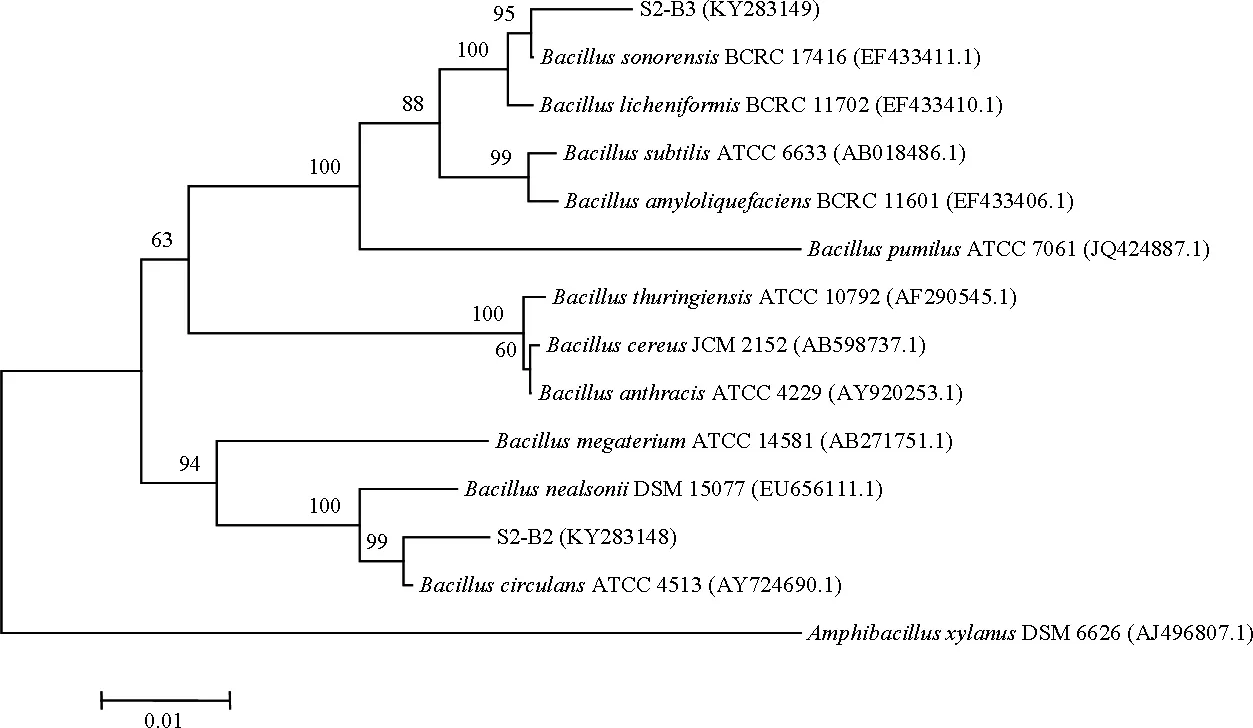
圖2 芽孢桿菌系統發育樹Fig 2 Phylogenetic trees of Bacillus strains
2.3.2 放線菌同源性比對及系統發育分析 將S2菌劑中篩選得到的1株放線菌與Gene Bank數據庫中已收錄菌株的16S rDNA序列進行比對,并構建系統發育樹(圖3)。結果表明,S2-A1與Cellulosimicrobiumfunkei(芬氏纖維微菌)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將S2-A1鑒定為芬氏纖維微菌。
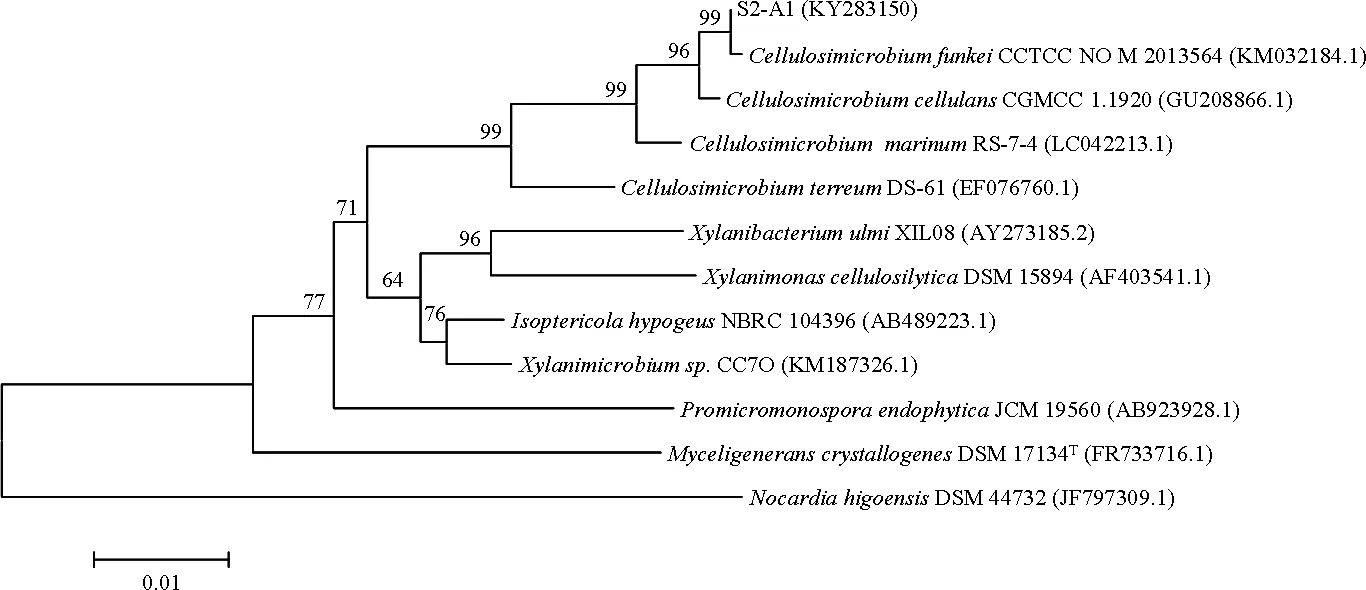
圖3 放線菌系統發育樹Fig 3 Phylogenetic tree of an Actinomycete strain
2.3.3 酵母菌同源性比對及系統發育分析 將S1和S2菌劑中篩選得到的4株酵母菌與Gene Bank數據庫中已收錄菌株的26S rDNA序列進行比對,并構建系統發育樹(圖4)。結果表明,S1-Y1與Clavisporalusitaniae(Candidalusitaniae)(葡萄牙棒孢酵母)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將S1-Y1鑒定為葡萄牙棒孢酵母。S1-Y2與Pichiakudriavzevii(庫德里阿茲威畢赤酵母)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將S1-Y2鑒定為庫德里阿茲威畢赤酵母。S2-Y1與Saccharomycescerevisiae(釀酒酵母)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將S2-Y1鑒定為釀酒酵母。S2-Y2與Pichiakudriavzevii(庫德里阿茲威畢赤酵母)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將S2-Y2鑒定為庫德里阿茲威畢赤酵母。
2.3.4 乳酸菌同源性比對及系統發育分析 將S2菌劑中篩選得到的3株腸球菌與Gene Bank數據庫中已收錄菌株的16S rDNA序列進行比對,并構建系統發育樹(圖5)。結果表明,S2-L1和S2-L3與Enterococcusfaecium(屎腸球菌)或Enterococcuslactis(乳酸腸球菌)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此這兩株菌為屎腸球菌或乳酸腸球菌。S2-L2與Enterococcusgallinarum(鶉雞腸球菌)相似性在 99%~100%之間,系統發育樹中處于同一分支,親緣關系最近,因此將S2-L2鑒定為鶉雞腸球菌。三株菌均為乳酸菌。

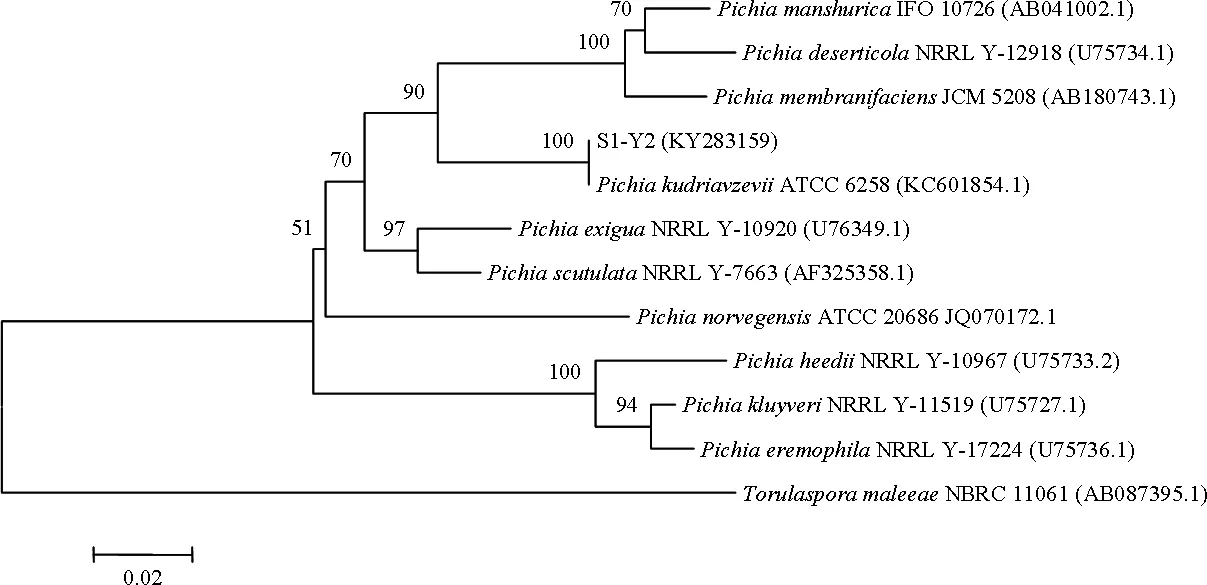
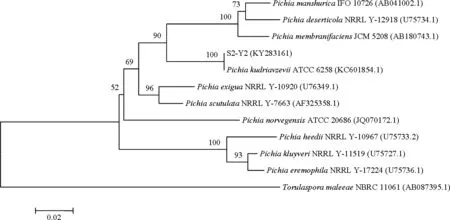
圖4 酵母菌系統發育樹Fig 4 Phylogenetic trees of yeast strains
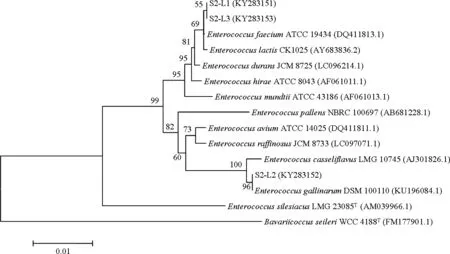
圖5 腸球菌系統發育樹Fig 5 Phylogenetic tree of Enterococcus strains
3 討 論
本研究對兩種市售水產養殖復合微生物粉劑中分離純化的微生物菌株進行形態學及分子生物學鑒定,S1粉劑中鑒定出5株芽孢桿菌,2株酵母菌;S2粉劑中鑒定出3株芽孢桿菌,1株放線菌,2株酵母菌,3株腸球菌。
芽孢桿菌在水產養殖中既可以作為飼料微生態添加劑,也可以作為水質改良微生態調節劑使用。在兩種微生物粉劑中均鑒定出芽孢桿菌。其中,枯草芽孢桿菌、地衣芽孢桿菌為我國農業部2013年公布的可作為飼料添加劑的微生物菌種[4]。索諾拉沙漠芽孢桿菌與地衣芽孢桿菌有很近的親緣關系[9],兩者的區分還需進一步鑒定。解木糖賴氨酸芽孢桿菌目前相關的研究較少,該菌可作為抗黃曲霉素的生防菌株,具有纖維蛋白分解酶活性[10-12],用于水產養殖的有效性和安全性仍有待進一步評價。環狀芽孢桿菌能夠有效修復水產養殖環境,也可以作為水產飼用菌種,研究表明,其能夠提高鯉魚苗和虹鱒魚生長速率和免疫能力[13-14]。
放線菌僅在S2粉劑中鑒定出。有研究顯示芬氏纖維微菌能夠降解纖維素和黃曲霉毒素,可用于畜禽飼料的降解處理以及受污染飼料中黃曲霉毒素的去除,對于促進畜禽類的生長繁殖具有重要作用[15-16]。然而,目前并無芬氏纖維微菌應用于水產養殖業的研究報道,其有效性和安全性仍有待評估。
酵母菌是水生動物消化道的常見優勢菌群之一,在兩種微生物粉劑中均鑒定出酵母菌。其中,釀酒酵母為我國農業部2013年公布的可作為飼料添加劑的微生物菌種[4],在促進水產動物生長、提高水產飼料利用效率及增強水產動物免疫能力等方面具有重要作用[17]。Clavisporalusitaniae是Candidalusitaniae的有性型,可能是白酒、陳醋等食品釀造大曲中的功能菌,然而,也有報道認為其為條件性致病菌[18-20],目前并無研究表明葡萄牙棒孢酵母用于水產養殖。庫德里阿茲威畢赤酵母在健康凡納濱對蝦和印度鯪消化道和養殖水體中是優勢菌株,該酵母菌具有多種胞外酶和單寧酶活性,可能對水生動物具有較好的益生效果[21-23];另有研究表明,庫德里阿茲威畢赤酵母RY55菌株能夠合成殺傷毒素,對多種病原菌有顯著抗菌活性,有望成為新型生物防治菌株[24]。
乳酸菌僅在S2粉劑中鑒定出,包括屎腸球菌或乳酸腸球菌和鶉雞腸球菌。其中,屎腸球菌和乳酸腸球菌為我國農業部2013年公布的可作為飼料添加劑的微生物菌種[4],由于親緣關系較近,兩者的區分還需進一步鑒定。目前并無乳酸腸球菌應用于水產養殖業的研究報道,其有效性和安全性仍有待評估。多項研究認為屎腸球菌可以作為水產動物養殖中的益生菌使用。Bogut等[25]研究表明,飼料中添加屎腸球菌能夠提高六須鯰魚的生長速率,降低腸道中有害菌如金黃色葡萄球菌、大腸桿菌等的數量。Gopalakannan等[26]發現,屎腸球菌能夠有效控制鯉魚的嗜水氣單胞菌感染。Avella等[27]研究顯示,屎腸球菌能顯著降低鰨魚腸道中弧菌數量,促進其生長性能。然而,屎腸球菌也可能存在安全隱患,Sun等[28]認為,飼料中添加屎腸球菌能夠使斜帶石斑魚血清溶菌酶活性顯著降低,可能會影響其免疫功能,此外,屎腸球菌對多種抗生素的耐藥性和致病性屎腸球菌的使用也會危害水產養殖安全[29]。鶉雞腸球菌在水產養殖中應用的研究較少,有研究表明其對鰻弧菌有強抑制作用,對鱸魚無致病性,可作為益生菌使用[30]。然而,一些鶉雞腸球菌菌株也能引起多種感染及疾病,對多種抗生素有耐藥性[31]。綜上所述,在水產養殖中使用腸球菌的安全性仍有待深入研究。
菌種組成和菌種特性是微生物制劑的關鍵指標,對于水產養殖業具有重要影響。本研究發現,微生物制劑存在著實際菌群種類與標注不符的問題,其中部分菌種并不屬于國家規定的飼用微生物菌種,對于水產養殖的水質改良能力亦不明確,可能對水生動物健康與水產品質量安全造成一定隱患。因此,當前水產養殖微生物制劑的生產工藝、質量檢測與監控力度有待加強。
[1] 俞愛萍. 微生態制劑及在水產養殖上應用研究[J]. 中國水產, 2015, (12): 76-78.
Yu A P. Study on Microecological Agents and Their Application in Aquaculture[J]. China Fisheries, 2015, (12): 76-78.
[2] 王亞敏, 王印庚. 微生態制劑在水產養殖中的作用機理及應用研究進展[J]. 動物醫學進展, 2008, 29(6): 72-75.
Wang Y M, Wang Y G. Advance in the Mechanisms and Application of Microecologics in Aquaculture[J]. Progress in Veterinary Medicine, 2008, 29(6): 72-75.
[3] 劉文珍. 水產養殖中微生物的應用及研究進展[J]. 水產科學, 2010, 29(1): 57-62.
Liu W Z. Application and Research Advances of Microorganisms in Aquaculture[J]. Fisheries Science, 2010, 29(1): 57-62.
[4] 呂永輝, 李明爽. 我國水產養殖用微生態制劑行業現狀與發展策略[J]. 中國水產, 2015, (8): 34-36.
Lv Y H, Li M S. Current Situation of Industry and Development Strategy of Microecological Agents in Aquaculture of Our Country[J]. China Fisheries, 2015, (8): 34-36.
[5] 陳艷玲. 一種EM菌的組成鑒定及應用初探[D]. 舟山: 浙江海洋學院, 2014.
Chen Y L. Study on the Identification and Preliminary Application of an Effective Microorganisms[D]. Zhoushan: Zhejiang Ocean University, 2014.
[6] 彭鐵成, 陳俊, 謝俊, 等. 農業微生物制劑的活性菌分離與鑒定[J]. 廣東農業科學, 2012, (1): 82-84.
Peng T C, Chen J, Xie J,etal. Isolation and Identification of Active Bacteria from Agricultural Microbial Agents[J]. Guangdong Agricultural Sciences, 2012, (1): 82-84.
[7] 曹旸. 不同工藝條件下BM復合微生物制劑區系分析[D]. 合肥: 安徽農業大學, 2013.
Cao Y. The Floristic Analysis of BM Micrioorganism Composite under Different Process Conditions[D]. Hefei: Anhui Agricultural University, 2013.
[8] 韋成相, 雷奇, 張福蓉, 等. 水產養殖復合微生物制劑中菌群數量的分析[J]. 天津農業科學, 2016, 22(5): 41-45.
Wei C X, Lei Q, Zhang F R,etal. Analysis of Microbial Flora Quantity of Compound Microbial Preparations for Aquaculture[J]. Tianjin Agricultural Sciences, 2016, 22(5): 41-45.
[9] Palmisano M M, Nakamura L K, Duncan K E,etal.Bacillussonorensissp. nov., a close relative ofBacilluslicheniformis, isolated from soil in the Sonoran Desert, Arizona[J]. Int J Syst Evol Microbiol. 2001, 51(5):1671-1679.
[10]Lee C S, Jung Y T, Park S,etal.Lysinibacillusxylanilyticussp. nov., a xylan-degrading bacterium isolated from forest humus[J]. Int J Syst Evol Microbiol. 2010, 60(2): 281-286.
[11]Wang K, Yan P S, Cao L X. Plackett-Burman Design for Media Nutrients of BiocontrolLysinibacillusxylanilyticusBPM1againstAflatoxin[J]. Applied Mechanics&Materials, 2014, 522-524: 295-298.
[12]Reshma C V, Fathimathu Z K.LysinibacillusXylanilyticus, a novel bacterial strain isolated from soil with fibrinolytic activity[J]. International Journal of Pharma&Bio Sciences, 2013, 4(4): 1030-1037.
[13]Jafaryan H, Taati M M, Jafarzadeh M. The enhancement of growth parameters in common carp (Cyprinuscarpio) larvae using probiotic in rearing tanks and feeding by variousArtemianauplii[J]. AACL Bioflux, 2011, 4(4): 511-518.
[14]李秋芬, 袁有憲, 辛福言, 等. 利用環狀芽孢桿菌的水產養殖環境生物修復方法: 中國,1340463[P]. 2002-03-20.
Li Q F, Yuan Y X, Xin F Y,etal. Method for bioremediation of aquaculture environment usingBacilluscirculans:China,1340463[P]. 2002-03-20.
[15]吳翔, 甘炳成, 黃忠乾, 等. 纖維素降解細菌 DBJ 的篩選鑒定及其特性研究[J]. 西南農業學報, 2016, 29(1): 81-84.
Wu X, Gan B C, Huang Z Q,etal. Characteristics and Identification of Cellulase-decomposing Strain DBJ[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(1): 81-84.
[16]Sun L H, Zhang N Y, Sun R R,etal. A novel strain ofCellulosimicrobiumfunkeican biologically detoxify aflatoxin B1 in ducklings[J]. Microbial Biotechnology, 2015, 8(3): 490-498.
[17]朱志明, 朱旺明, 藍漢冰, 等. 釀酒酵母營養調控功能及其在水產飼料中的應用研究進展[J]. 動物營養學報, 2014, 26(12): 3550-3560.
Zhu Z M, Zhu W M, Lan H B,etal. Research Development of Saccharomyces cerevisiae: Nutritional Manipulation and Application in Aqua Feed[J]. Chinese Journal of Animal Nutrition, 2014, 26(12): 3550-3560.
[18]Gargeya I B, Pruitt W R, Simmons R B,etal. Occurrence ofClavisporalusitaniae, the Teleomorph ofCandidalusitaniae, among Clinical Isolates[J]. Journal of Clinical Microbiology, 1990, 28(10): 2224-2227.
[19]董凱鋒, 安娜, 李東樂, 等. 水塔老陳醋大曲酵母的分離鑒定及產乙醇和乙酸乙酯特性[J].食品工業科技, 2016, 37(10): 213-216.
Dong K F, An N, Li D L,etal. Isolation and identification of yeats in Daqu for aged vinegar production and their capacity for producing ethly alcohol and ethly acetate[J]. Science and Technology of Food Industry, 2016, 37(10): 213-216.
[20]衛春會, 楊曉東, 黃治國, 等. 濃香型大曲中兩株酵母菌的分離及其Biolog微生物鑒定[J]. 釀酒科技, 2013(4): 30-32.
Wei C H, Yang X D, Huang Z G,etal. Isolation and Biolog Identification of Two Yeast Strains from Nong-flavor Daqu[J]. Liquor-making Science &Technology, 2013(4): 30-32.
[21]林治宇, 蝦塘酵母菌優勢菌株的分離篩選及應用研究[D]. 海口: 海南大學, 2015.
Lin Z Y, Study in Screening and Application of Yeast in Shrimp Pond[D]. Haikou: Hainan University, 2015.
[22]Banerjee S, Ghosh K. Enumeration of gut associated extracellular enzyme-producing yeasts in some freshwater fishes[J]. Journal of Applied Ichthyology, 2014, 30(5): 986-993.
[23]Mandal S, Ghosh K. Isolation of tannase-producing microbiota from the gastrointestinal tracts of some freshwater fish[J]. Journal of Applied Ichthyology, 2013, 29(1):145-153.
[24]Bajaj B K, Raina S, Singh S. Killer toxin from a novel killer yeastPichiakudriavzeviiRY55 with idiosyncratic antibacterial activity[J]. Journal of Basic Microbiology, 2012, 52, 1-11.
[25]Bogut I, Milakovic Z, Brkic S,etal. Effects ofEnterococcusfaeciumon the growth rate and content of intestinal microflora in sheat fish (Silurusglanis)[J]. Veterinární Medicína, 2000, 45(4): 107-109.
[26]Gopalakannan A, Arul V. Inhibitory activity of probioticEnterococcusfaeciumMC13 againstAeromonashydrophilaconfers protection against hemorrhagic septicemia in common carpCyprinuscarpio[J]. Aquaculture International, 2011, 19(5): 973-985.
[27]Avella M A, Olivotto I, Silvi S,etal. Use ofEnterococcusfaeciumto improve common sole (Soleasolea) larviculture[J]. Aquaculture, 2011, 315(3-4): 384-393.
[28]Sun Y Z, Yang H L, MA R L,etal. Effect ofLactococcuslactisandEnterococcusfaeciumon growth performance, digestive enzymes and immune response of grouper Epinephelus coioides[J]. Aquaculture Nutrition. 2011, 18(3): 281-289.
[29]葛龍, 李波. 屎腸球菌在飼用微生態制劑中的研究與應用[J]. 飼料與畜牧:新飼料, 2013(6): 57-59.
Ge L, Li B. Study and Application ofEnterococcusfaeciumin Feed Microecological Agents [J]. Feed and Husbandry: New Feed, 2013(6): 57-59.
[30]Sorroza L, Real F, Acosta F,etal. A Probiotic Potential ofEnterococcusgallinarumagainstVibrioanguillaruminfection[J]. Fish Pathology, 2013, 48 (1): 9-12.
[31]王怡婷, 金東, 楊晶, 等. 喜馬拉雅旱獺源鶉雞腸球菌的分離及其耐藥性檢測[J]. 疾病監測, 2016, 31(5): 380-386.
Wang Y T, Jin D, Yang J,etal. Isolation and antibiotic resistance detection ofEnterococcusgallinarumsfromMarmotahimalayana[J]. Disease Surveiliance, 2016, 31(5): 380-386.
(編輯:陳希)
Molecular Identification of Strains Isolated from Composite Microbial Powders for Aquaculture
GUO Wan-ping, ZHAO Jing*, LUAN Chun-yu, GUO Wan, QUAN Chun-shan
(CollegeofLifeScience,DalianMinzuUniversity,KeyLaboratoryofBiotechnologyandBioresourcesUtilization(DalianMinzuUniversity),MinistryofEducation,Dalian116600,China)
ZHAOJing,E-mail:zhaojing@dlnu.edu.cn
In order to identify microbial strains in two commercial composite microbial powders for aquaculture, plate separation method was used to isolate and purify the microorganisms, morphological characteristics was observed, 16S rDNA/26S rDNA gene sequences analysis was conducted and phylogenetic trees were constructed. Variation in microflora structure existed between two microbial powders. Five Bacillus strains and two yeast strains were identified in S1 powder, includingBacillussubtilis,BacilluslicheniformisorBacillussonorensis,ClavisporalusitaniaeandPichiakudriavzevii; ThreeBacillusstrains, oneActinomycetestrain, two yeast strains and threeEnterococcuswere identified in S2 powder, includingLysinibacillusxylanilyticus,Bacilluscirculans,BacilluslicheniformisorBacillussonorensis,Cellulosimicrobiumfunkei,Saccharomycescerevisiae,Pichiakudriavzevii,Enterococcusgallinarum,EnterococcusfaeciumorEnterococcuslactis. Determination of the microflora structure of composite microbial powders for aquaculture would provide theoretical basis for evaluation of safety and effectiveness of similar products.
aquaculture,composite microbial powder,microflora structure,identification,16S rDNA,26S rDNA
大連民族大學2016年大學生創新創業訓練計劃項目(G201612026012, XA201603072);中央高校基本科研業務費項目(DC201502020407) 作者簡介: 郭婉萍,從事生物化工方向研究。
趙晶。E-mail: zhaojing@dlnu.edu.cn
10.11751/ISSN.1002-1280.2017.6.02
2016-12-07
A
1002-1280 (2017) 06-0009-10
S942.3;Q939

