基質金屬蛋白酶-26在人腦膠質瘤血管新生中的作用
張玉輝,李 偉,李香香,房 波,常曉娜,唐辰晨,張麗紅,李一雷
基質金屬蛋白酶-26在人腦膠質瘤血管新生中的作用
張玉輝1,2,李 偉1,李香香1,房 波1,常曉娜1,唐辰晨1,張麗紅1,李一雷1
目的 探討MMP-26在人腦膠質瘤血管新生中的作用及可能的作用機制。方法 用MMP-26質粒和pc-DNA3.1空質粒穩定轉染人膠質瘤細胞株U251,構建裸鼠異種移植瘤模型,進而構建體外基于人腫瘤組織塊的三維血管生成模型,觀察MMP-26轉染組(U251-MMP-26)、空載組(U251-pcDNA3.1)和未轉染組(U251)的新生血管,統計有血管生成孔所占的百分比(I%),以及根據新生血管的長度和密度用半定量法對新生血管進行評分(血管生成分數AI,0~16分);采用RT-PCR法和免疫組化法測定U251-MMP-26、U251-pcDNA3.1和U251中MMP-26和VEGF mRNA和蛋白的表達;免疫組化法測定CD31在纖維蛋白-凝血酶膠基質血管內皮細胞中的定位。結果 免疫組化檢測內皮細胞標志物CD31為陽性,證明侵入纖維蛋白原-凝血酶膠基質中的成分為內皮細胞來源;U251-MMP-26組血管長、密度大,所占面積大,而U251-pcDNA3.1組和U251組血管短,密度小,所占面積小;U251-MMP-26組在第14天的I%和AI高于U251-pcDNA3.1組和U251組(P<0.05);U251-MMP-26組在14天中I%和AI的發展趨勢較U251-pcDNA3.1組和U251組明顯;MMP-26的mRNA和蛋白在U251-MMP-26中高表達,VEGF的mRNA和蛋白在U251-MMP-26中的表達水平明顯強于U251-pcDNA3.1組和U251組(P<0.01)。結論 MMP-26可能通過增強VEGF的表達促進人腦膠質瘤的血管新生,可作為抗腫瘤治療的靶點。
腦腫瘤;人腦膠質瘤;MMP-26;VEGF;血管新生
膠質瘤是中樞神經系統最常見的惡性腫瘤,盡管現在可采取手術、放療、化療等綜合治療,但療效仍不理想,尤其是高級別膠質瘤,預后較差[1]。而血管新生是惡性腫瘤演進過程中最關鍵的因素,能促進腫瘤的快速生長及轉移[2]。其中基質金屬蛋白酶(matrix metallo proteinase, MMP)家族通過介導細胞外基質(extracellular matrix, ECM)不同成分的降解參與血管新生[3]。MMP-26是MMPs家族的新成員,廣泛表達于上皮組織源性的惡性腫瘤,已有實驗[4]表明,MMP-26在體外能促進U251細胞的侵襲和遷移,體內能促進U251的局部浸潤和血管生成;MMP-26的過表達能促進乳腺癌細胞的生長、浸潤及誘導血管生成[5]。因此,MMP-26可能有效誘導了惡性腫瘤的血管生成,但其機制尚不明確。本實驗用MMP-26-pcDNA3.1質粒穩定轉染人膠質瘤細胞U251,建立裸鼠異種移植瘤模型,進而構建體外基于腫瘤組織塊的三維血管生成模型,通過相應的指標評價MMP-26對腫瘤血管生成的影響,旨在為臨床抗腫瘤血管生成治療提供一定的理論依據。
1 材料與方法
1.1 細胞株及試劑 人腦膠質瘤細胞系U251(吉林大學病理生物學教育部重點實驗室),脂質體2000(美國Invitrogen公司);BALB/c-nu裸小鼠(北京華阜康實驗動物公司);UltraSensitive SP超敏試劑盒(福州邁新公司);MMP-26、VEGF和GAPDH引物(上海生物公司;Trizol試劑盒(美國Gibco公司);RNA PCR Kit(Fermentas公司)。
1.2 U251細胞穩定轉染及擴大培養 U251培養于IMDM(10%FBS)培養基中,當達到80%~90%匯合度時,按照脂質體2000轉染試劑操作說明,將MMP-26-pcDNA3.1(MMP-26全長基因)和pcDNA3.1(pcDNA3.1空質粒)穩定轉染人膠質瘤U251細胞,并將細胞分為3組:U251組、U251-pcDNA3.1組和U251-MMP-26組。
1.3 裸鼠異種移植瘤模型 鑒定穩定轉染的細胞株并擴大培養,待細胞生長至80%~90%融合時,將4×106細胞接種于4~6周齡雌性裸鼠背部皮下,每組3~5只,SPF環境培養30天。
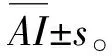
1.5 RT-PCR檢測腫瘤組織中MMP-26和VEGF mRNA的表達 按Trizol試劑盒說明書操作方法提取總RNA。用紫外分光光度計測吸光度(A)值,A260/A280=1.8~2.0為其純度要求。根據A260值計算RNA濃度。按逆轉錄試劑盒進行操作,得到cDNA后,分別用MMP-26、VEGF和GAPDH的引物進行PCR擴增。MMP-26引物序列:上游5′-ACCATGCAGCTCGTCATCTTAAGAG-3′,下游5′-AGGTATGTCAGATGAACATTTTTCTCC-3′,擴增產物為501 bp;VEGF引物序列:上游5′-CTCACCGCCTCGGCTTGTCACA-3′,下游5′-CCTGGTGGACATCTTCCAGGAGTA-3′,擴增產物為265 bp、407 bp、479 bp;GAPDH引物序列:上游5′-TGTTGCCATCAATGACCCCTT-3′,下游5′-CTCCACGACGTACTCAGCG-3′,擴增產物為202 bp。RT-PCR終產物進行1.5%瓊脂糖凝膠電泳,溴化乙啶(EB)顯色,在凝膠成像儀下觀察,照相,并對產物片段進行灰度掃描,結果為目的基因與內參基因的比值。
1.6 免疫組化法檢測腫瘤組織中MMP-26和VEGF蛋白的表達 標本經10%中性福爾馬林固定,常規脫水、石蠟包埋、切片。MMP-26和VEGF分別用枸櫞酸鹽緩沖液(pH 6.0)和Tris-EDTA緩沖液進行熱修復,免疫組化步驟按照UltraSensitive SP超敏試劑盒進行,PBS緩沖液(pH 9.0)代替一抗作為空白對照,蘇木精對比染色。結果判定:MMP-26和VEGF蛋白表達于細胞質,以細胞質出現黃色或棕黃色染色為陽性細胞。每張切片隨機觀察10個高倍視野,依陽性細胞占所觀察細胞的百分比及細胞著色強度綜合計分做半定量分析。(1)按陽性細胞百分率計分:無陽性細胞為0分;陽性細胞數≤10%為1分;11%~50%為2分;51%~75%為3分;>75%為4分。(2)按細胞染色強度計分:弱染色為1分;中度染色為2分;強染色為3分。將兩項得分結果相乘:0分為陰性(-),1~4分為弱陽性(+),5~8分為中等強度陽性(),9~12分為強陽性(),由兩名病理學專家進行雙盲閱片[7]。
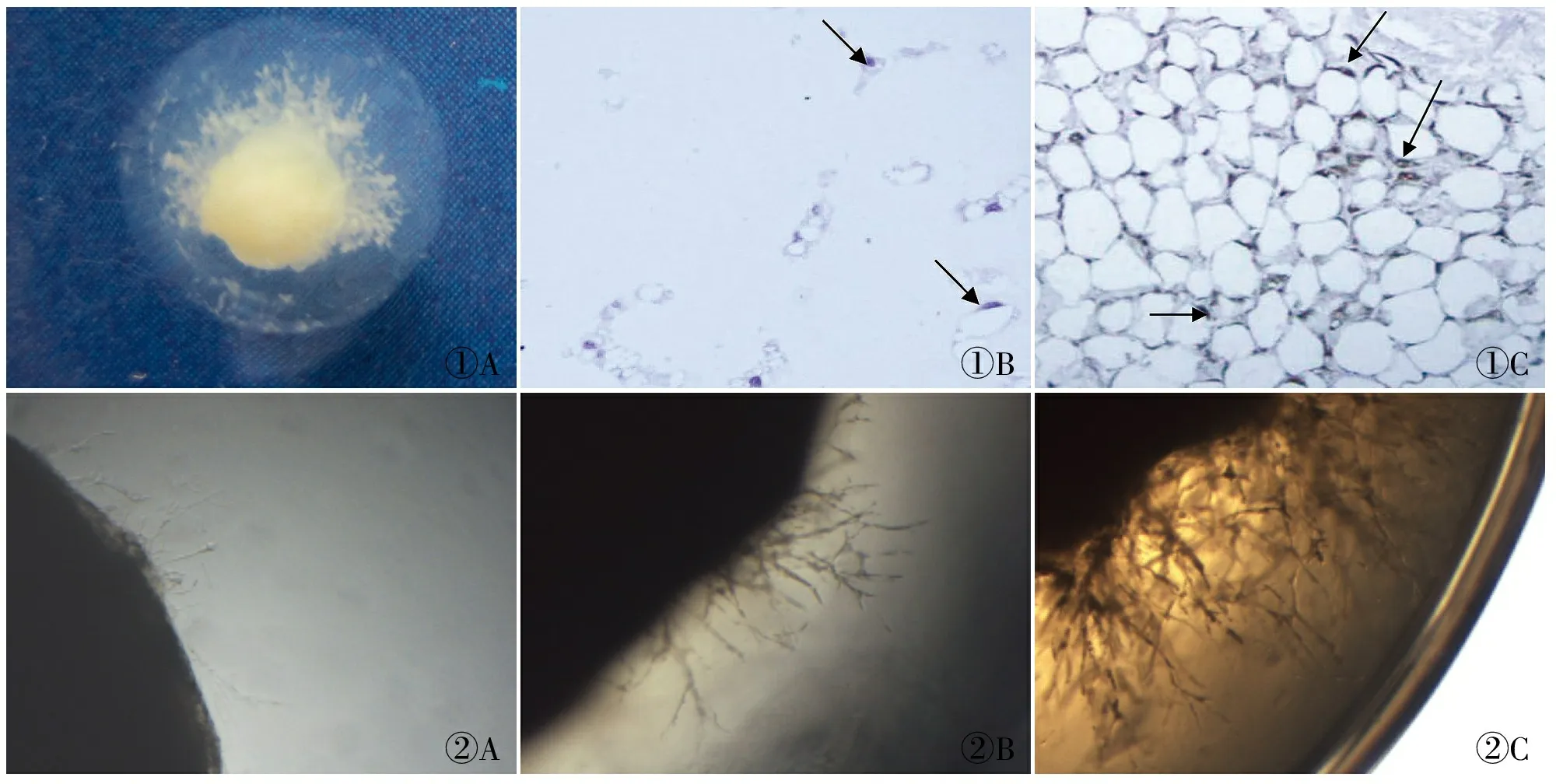
1.7 免疫組化法測定CD31在纖維蛋白-凝血酶膠基質血管內皮細胞中的定位 10%中性福爾馬林固定,將膠塊完整取出(圖1),石蠟包埋切片,用Tris-EDTA緩沖液(pH 9.0)進行熱修復,PBS緩沖液代替一抗作為空白對照,其余步驟同上,蘇木精對比染色。結果判斷:在胞膜/胞質內出現棕黃色顆粒為陽性標準。
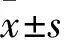
2 結果
2.1 膠中成分的鑒定 免疫組化檢測膠中的血管樣結構CD31的表達,蘇木精對比染色。結果顯示為陽性,說明其為內皮細胞來源,因此確定膠中的結構為血管(圖1)。
2.2 血管生成情況 倒置相差顯微鏡×4下觀察各組血管生成情況,結果顯示(圖2),U251-MMP-26組血管長,分支多,密度大,所占面積大,呈多層分布;而U251組和U251-pcDNA3.1組血管短,分支少,密度小,所占面積較小,分布稀疏。
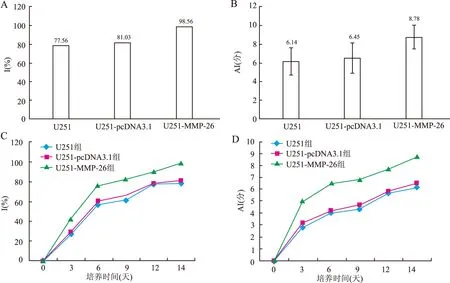
2.3 各組I%和AI 統計第14天各組的I%和AI,結果顯示(圖3A、B),U251-MMP-26組I%和AI均較空白組U251和空載組U251-pcDNA3.1明顯(P均<0.05);隨著時間的發展,14天中U251-MMP-26組的I%(圖3C)和AI(圖3D)的發展趨勢也較U251組和U251-pcDNA3.1組明顯。
2.4 RT-PCR檢測腫瘤組織中MMP-26、VEGF mRNA的表達 VEGF有多種不同的mRNA拼接產物,本實驗選用引物可擴增出VEGF121(265 bp)、VEGF165(407 bp)和VEGF189(479 bp)3條擴增帶(圖4)。MMP-26 mRNA在U251-MMP-26組高表達(1.26±0.02),而在空白組U251(0.26±0.03)和空載組U251-pcDNA3.1(0.27±0.03)中弱表達;而VEGF mRNA在U251-MMP-26組(1.21±0.01)的表達水平明顯強于空白組U251(0.64±0.00)和空載組U251-pcDNA3.1(0.66±0.00)(t=0.008,P<0.01),而U251組和U251-pcDNA3.1組之間的表達差異無統計學意義(P>0.05)。
①A①B①C②A②B②C
圖1 膠中的血管樣結構及成分鑒定:A.膠中的血管樣結構;B.HE對比染色(箭頭所指為內皮細胞);C.血管樣結構表達CD31(箭頭所指為內皮細胞),SP法 圖2 腫瘤組織塊血管長入膠中的情況:A.U251;B.U251-pcDNA3.1;C.U251-MMP-26
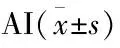
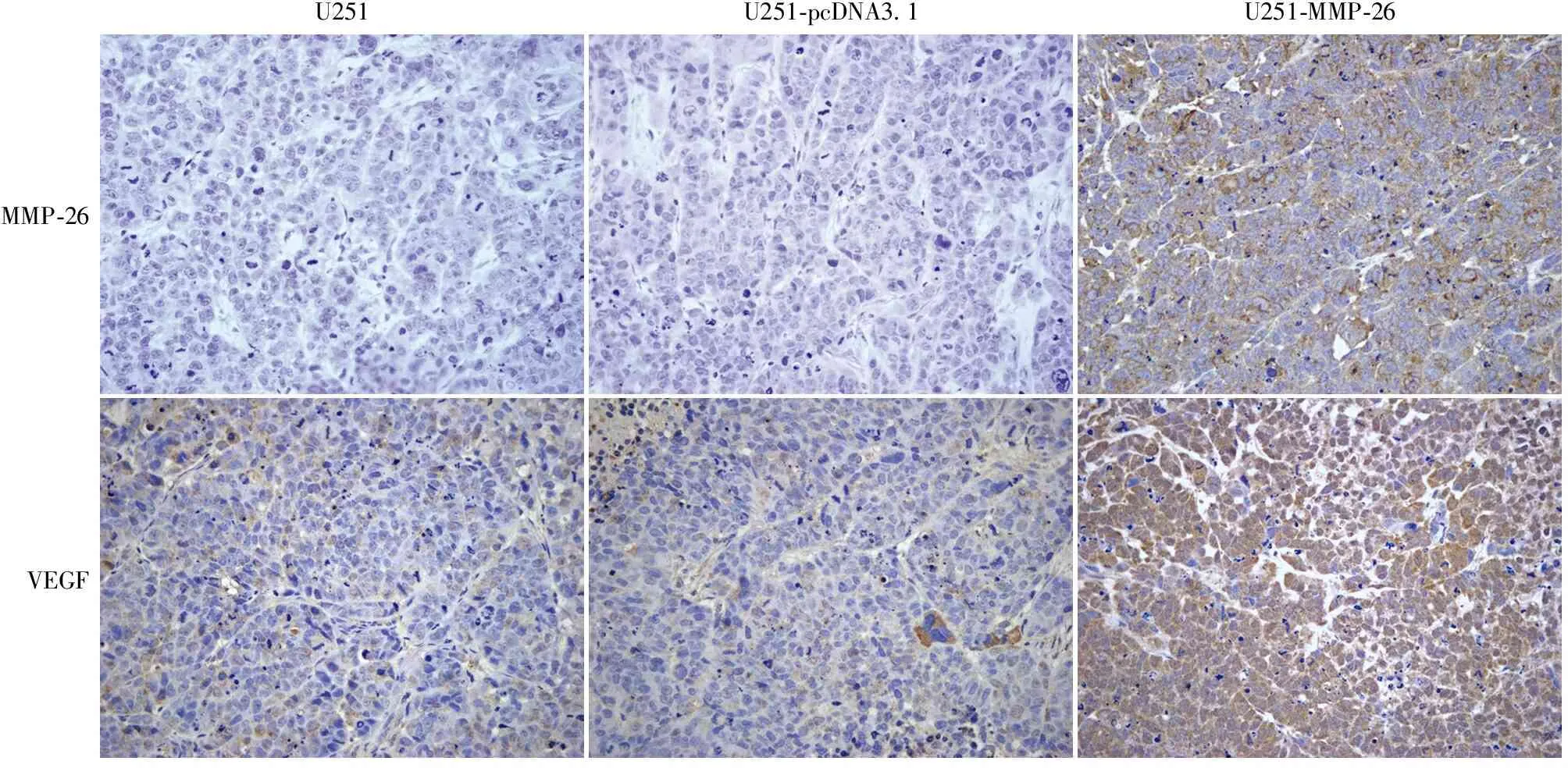
2.5 免疫組化法檢測腫瘤組織中MMP-26、VEGF蛋白的表達 MMP-26蛋白在U251-MMP-26組中呈強陽性,在空白組U251和空載組U251-pcDNA3.1中幾乎無表達(圖5);VEGF蛋白在U251-MMP-26組中的表達明顯強于空白組U251和空載組U251-pcDNA3.1(t=0.005,P<0.01,圖5),而U251組與U251-pcDNA3.1組之間差異無統計學意義(P>0.05)。
3 討論
腫瘤血管新生是惡性腫瘤的特征,也是其演進過程中最關鍵的因素,能促進腫瘤的快速生長及轉移[2]。惡性腫瘤細胞的轉移是一個復雜的、多階段的過程,包括腫瘤細胞從原發部位脫離、侵入淋巴管或血管,然后在遠處形成新的腫瘤[8-9]。阻礙惡性腫瘤細胞侵襲和轉移的主要屏障是ECM和基膜,參與降解ECM和基膜的蛋白裂解酶包括多種,其中MMPs家族發揮了重要作用。MMPs家族是一組鋅離子依賴的蛋白水解酶,有廣泛的底物特異性,并通過降解ECM和基膜參與血管新生、淋巴管生成及惡性腫瘤的侵襲和轉移[3,10]。

圖4 異種移植瘤組織中MMP-26、VEGF mRNA的表達
M.Marker DL2000標志物;1.U251;2.U251-pcDNA3.1;3.U251-MMP-26
截至目前,MMPs家族至少包括28個成員,其中,MT1-MMP通過纖維蛋白原的裂解活性促進腫瘤血管新生[11],而MMP-26以與MT1-MMP非常相似的方式降解纖維蛋白原。因此,MMP-26可能參與血管新生的過程。MMP-9是重要的明膠酶,具有裂解基膜成分的活性,并通過誘導癌細胞釋放VEGF促進腫瘤血管生成,而MMP-26通過激活MMP-9促進腫瘤生長[8,11-14]。MMP-26是MMPs家族的新成員,廣泛表達于上皮組織源性的惡性腫瘤,已有實驗[4]表明,MMP-26在體外能促進U251細胞的侵襲和遷移,體內能促進U251的局部浸潤和血管生成;MMP-26的過表達能促進乳腺癌細胞的生長、浸潤及誘導血管生成[5]。眾所周知,內皮細胞生長因子(vascular endothelial growth factor, VEGF)是最強的引起內皮細胞活化增殖的因子之一,可刺激內皮細胞分裂、遷移,降解原始血管的基膜及形成新的毛細血管[15]。由于前mRNA的切割位點不同,一種VEGF基因會表達出多種亞型,如VEGF121、VEGF165和VEGF189(數字代表VEGF蛋白的氨基酸數目),其中VEGF165在缺氧誘導的血管生成中發揮了重要作用[16],對于VEGF121和VEGF165亞型,其氨基酸鏈越短,其促內皮細胞有絲分裂活動越活躍,即VEGF121 較其他長鏈的亞型有更強的促血管生成作用[17]。
對血管生成的研究,體外主要應用內皮細胞的遷移實驗及小管形成實驗,由于兩者只能反映單層內皮細胞的增殖,不能反映靜止的內皮向增殖表型的轉化,因此不能更好地反映抗血管藥物應用后的作用。此外,兩者均無腫瘤細胞,并不能反應腫瘤細胞與內皮細胞之間的相互作用,缺乏體內的微環境,尤其是腫瘤微環境,因此不能代表體內情況。體內實驗主要采用腫瘤細胞誘導血管生成模型觀察裸鼠背部皮膚及裸鼠異種移植瘤模型計數各種腫瘤組織中的微血管密度,這兩種實驗方法只能體現腫瘤細胞與血管之間的二維關系,并不能體現腫瘤微環境中兩者之間的空間立體關系。因此,為進一步明確MMP-26在腫瘤血管新生中的作用,以及更直觀地觀察MMP-26對腫瘤血管生成的影響,本實驗應用穩定轉染MMP-26的人腦膠質瘤細胞系U251構建裸鼠異種移植瘤模型,建立體外基于人腫瘤組織塊(2 mm×1 mm)的三維血管生成模型,該模型保持了完整的腫瘤組織微環境,而纖維蛋白-凝血酶膠為血管及腫瘤組織生長提供了網架結構,由于膠中只含有幾種特定的血管生長因子,因此其低血清環境使得血管生長速度明顯高于腫瘤組織,明顯地減少了腫瘤生長的干擾,利于血管生成的測定。
U251U251?pcDNA3 1U251?MMP?26MMP?26VEGF
圖5 MMP-26蛋白、VEGF蛋白在各組異種移植瘤組織中的表達,SP法
倒置相差顯微鏡觀察結果顯示:U251-MMP-26組的血管生長情況較空白組U251和空載組U251-pcDNA3.1組血管長,分支多,密度大,所占面積大;而I%和AI的結果也顯示,U251-MMP-26組較空白組U251和空載組U251-pcDNA3.1明顯(P<0.05),說明MMP-26能有效誘導腫瘤微環境中的血管新生及促進腫瘤組織中的微血管侵入周圍間質組織(纖維蛋白-凝血酶膠),這樣,既為膠質瘤的生長提供了豐富的營養物質,同時也為膠質瘤的浸潤、侵襲和轉移提供了途徑。RT-PCR及免疫組化結果顯示:U251-MMP-26組中MMP-26和VEGF的mRNA和蛋白表達明顯強于未轉染組U251和空載組U251-pcDNA3.1 (P<0.01),說明MMP-26轉染可在mRNA水平和蛋白水平明顯增強VEGF的表達,因此,MMP-26誘導腫瘤組織中的血管新生可能是最終通過增強VEGF的表達水平實現的,然而具體的機制尚不明確,需進一步實驗證明。
目前,抗腫瘤血管生成療法在臨床上效果甚微,因此,需要一種更好的模型對血管生成進行全面、透徹的觀察和理解,進而為抗腫瘤藥物的研制和療效觀察提供更有效地方法。
[1] 范耀東, 邊 慧, 瞿家桂, 等. 咖啡因對體外培養U251人膠質瘤細胞的影響[J]. 臨床與實驗病理學雜志, 2016,32(5):544-547.
[2] Rouasari L C, West J L. Studying the influence of angiogenesis in vitro cancer model systems[J]. Adv Drug Deliv Rev, 2016,97:250-259.
[3] Abdelfattah N S, Amgad M, Zayed A A,etal. Molecular underpinnings of corneal angiogenesis: advances over the past decade[J]. Int J Ophthalmol, 2016,9(5):768-779.
[4] Deng Y P, Li W, Li Y L,etal. Expression of Matrix Metalloproteinase-26 promotes human glioma U251 cell invasion in vitro and in vivo[J]. Oncol Rep, 2010,23(1):69-78.
[5] Yang H F, Li Y L, Li W,etal. Roles of matrixmetalloproteinase-26 in the growth, invasion and angiogenesis of breast cancer[J]. Oncol Lett, 2012,4(4):832-836.
[6] Gulec S A, Woltering E A. A new in vitro assay for human tumor angiogenesis: three-dimensional human tumor angiogenesis assay[J]. Ann Surg, 2004,11(1):99-104.
[7] 趙瑞君, 謝春偉, 陳 戈, 等. PTP1B在ER陽性乳腺癌中的表達及臨床預后意義[J]. 臨床與實驗病理學雜志, 2016,32(5):492-495.
[8] Wang J J, Sanderson B J, Zhang W. Significant anti-invasive activities of mangostin from the mangosteen pericarp on two human skin cancer cell lines[J]. Anticancer Res, 2012,32(9):3805-3816.
[9] Kessenbrock K, Wang C Y, Werb Z. Matrix metalloproteinases in stem cell regulation and cancer[J]. Matrix Biol, 2015,44:184-190.
[10] Sbardella D, Fasciglione G F, Gioia M,etal. Human matrix metalloproteinases: an ubiquitarian class of enzymes involved in several pathological processes[J]. Mol Aspects Med, 2012,33(2):119-208.
[11] Pittayapruek P, Meephansan J, Prapapan O,etal. Role of matrix metalloproteinases in photoaging and photocarcinogenesis[J]. Int Mol Sci, 2016,17(6):868-887.
[12] Poswar F O, Fraga C A, Farias L C,etal. Immunohistochemical analysis of TIMP-3 and MMP-9 in actinic keratosis, squamous cell carcinoma of the skin, and basal cell carcinoma[J]. Pathol Res Pract, 2013,209(11):705-709.
[13] Oliveira Poswar de F, Carvalho Fraga de C A, Gomes E S B,etal. Protein expression of MMP-2 and MT1-MMP in actinic keratosis, squamous cell carcinoma of the skin, and basal cell carcinoma[J]. Int Surg Pathol, 2015,23:20-25.
[14] Xia Y H, Li M, Fu D D,etal. Effects of PTTG down-regulation on proliferation and metastasis of the SCL-1 cutaneous squamous cell carcinoma cell line[J]. Asian Pac Cancer Pre, 2013,14(11):6245-6248.
[15] Shibuya M. VEGF-VEGFR signals in health and disease[J]. Biomol Ther (Seoul), 2014,22(1):1-9.
[16] Zhang H T, Scott P A, Morbidelli L,etal. The 121 amino acid isoform of vascular endothelial growth factor is more strongly tumorigenic than other splice variantsinvivo[J]. Br Cancer, 2000,83(1):63-68.
[17] Imamura T. Physiological functions and underlying mechanisms of fibroblast growth factor (FGF) family members: recent findings and implications for their pharmacological application[J]. Bio Phar Bull, 2014,37(7):1081-1089.
Effect of matrix metalloproteinase-26 on human glioma angiogenesis
ZHANG Yu-hui1,2, LI Wei1, LI Xiang-xiang1, FANG Bo1, CHANG Xiao-na1, TANG Chen-chen1, ZHANG Li-hong1, LI Yi-lei1
(1TheKeyLaboratoryofPathobiology,MinistryofEducation,NormanBethuneCollegeofMedicine,JilinUniversity,Changchun130021,China;2DepartmentofPathology,FenyangCollegeofShanxiMedicalUniversity,Fenyang032200,China)
Purpose To investigate the effect of MMP-26 on human glioma angiogenesis and the possible mechanism. Methods The MMP-26 plasmid and empty plasmid pcDNA3.1 were stably transfected into U251 cells to establish a nude mice xenograft model, and then an in vitro human tumor tissue-based three-dimensional angiogenic model. Tissue disks were visually assessed over time to determine the percentage of wells that developed an angiogenic response(I%) and the density and length of neovessel growth were graded at intervals using a semiquantitative visual growth-rating scheme (angiogenic index, AI, 0-16 scale) in groups of MMP-26 transfected U251 cells (U251-MMP-26), pcDNA3.1 vector-transfected U251 cells (U251-pcDNA3.1) and non-transfected U251 cells(U251). RT-PCR and immunohistochemistry were used to detect the expression of mRNA and protein of MMP-26 and VEGF in groups of U251-MMP-26, U251-pcDNA3.1 and U251. Immunohistochemical localization of CD31 was determined in the endothelial tubes invading the fibrin-thrombin clot matrix. Results Immunohistochemical endothelial cell markers CD31 was positive in the vascular tubes invading the fibrin-thrombin clot matrix, confirming their endothelial origin. The angiogenesis results showed that difference of length of micro capillaries, density of branches, and the area occupied between U251-MMP-26 groups and control groups were significant. The percentage of tumor implants that developed invasion (I%) and the angiogenic index AI in U251-MMP-26 group on day 14 were higher than those of U251-pcDNA3.1 group and U251 group (P<0.05). The trends of I% and AI in 14 days were significant compared with those in control groups. The expression of mRNA and protein of MMP-26 and VEGF in U251-MMP-26 group was significantly higher in U251-MMP-26 group than those in U251-pcDNA3.1 group and U251 group(P<0.01). Conclusion The effect of MMP-26 on promoting glioma angiogenesis may be related to the increased expression of VEGF, which can be used as targets for anti-tumor therapy.
brain neoplasms; human brain glioma; MMP-26; VEGF; angiogenesis
國家自然科學基金(30870970)
1吉林大學病理生物學教育部重點實驗室,長春 1300212山西醫科大學汾陽學院病理教研室,汾陽 032200
張玉輝,女,碩士,助教。E-mail: 790322454@qq.com 李一雷,男,博士,教授,碩士生導師,通訊作者。Tel: (0431)856191021,E-mail: liyl@jlu.edu.cn
時間:2017-6-20 11:18 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.007.html
R 739.41
A
1001-7399(2017)06-0623-06
10.13315/j.cnki.cjcep.2017.06.007
接受日期:2017-03-02

