替米沙坦對(duì)高濃度葡萄糖引起的內(nèi)皮細(xì)胞間質(zhì)化的影響
孫 蓉,尚粉青
替米沙坦對(duì)高濃度葡萄糖引起的內(nèi)皮細(xì)胞間質(zhì)化的影響
孫 蓉1,尚粉青2*
目的 探討替米沙坦對(duì)高濃度葡萄糖引起的內(nèi)皮細(xì)胞間質(zhì)化的影響。方法 采用體外分離培養(yǎng)的人臍靜脈內(nèi)皮細(xì)胞(HUVEC)作為細(xì)胞模型,通過(guò)高濃度葡萄糖(30 mmol/L)誘導(dǎo)內(nèi)皮細(xì)胞間質(zhì)化,TGF-β抑制劑SB-431542或替米沙坦預(yù)處理內(nèi)皮細(xì)胞6 h,然后用高濃度葡萄糖(30 mmol/L)孵育臍靜脈內(nèi)皮細(xì)胞48 h。RT-PCR和Western blot觀察CD31、VE-cadherin、α-SMA和Vimentin表達(dá)變化。應(yīng)用糖尿病小鼠模型驗(yàn)證上述指標(biāo)的變化。結(jié)果 高濃度葡萄糖可以促進(jìn)內(nèi)皮細(xì)胞TGF-β的表達(dá),而替米沙坦可抑制高濃度葡萄糖引起的TGF-β表達(dá)增加;高濃度葡萄糖可以降低內(nèi)皮細(xì)胞CD31、VE-cadherin的表達(dá),增加α-SMA及Vimentin的表達(dá)。TGF-β抑制劑SB-431542及替米沙坦可以顯著逆轉(zhuǎn)高濃度葡萄糖對(duì)內(nèi)皮細(xì)胞間質(zhì)化的影響。結(jié)論 替米沙坦可以降低TGF-β的表達(dá),抑制高濃度葡萄糖誘導(dǎo)的內(nèi)皮細(xì)胞間質(zhì)化。
替米沙坦;高濃度葡萄糖;TGF-β;內(nèi)皮細(xì)胞間質(zhì)化
0 引言
心肌細(xì)胞纖維化是糖尿病心肌病發(fā)病過(guò)程中的重要機(jī)制,成纖維細(xì)胞激活、增殖是心肌纖維化過(guò)程中重要的病理過(guò)程。既往研究認(rèn)為,成纖維細(xì)胞只由自身活化而來(lái),近年來(lái)研究表明,成纖維細(xì)胞并非同質(zhì)性細(xì)胞,而是一組高度異源的細(xì)胞群體,除由局部靜止的成纖維細(xì)胞活化而來(lái)外,內(nèi)皮細(xì)胞受到刺激后向間質(zhì)成纖維細(xì)胞轉(zhuǎn)化,即內(nèi)皮細(xì)胞間質(zhì)化(Endothelial-mesenchymal transition,EndMT)也是成纖維細(xì)胞的重要來(lái)源之一,在心肌纖維化過(guò)程中起重要作用。血小板-內(nèi)皮細(xì)胞黏附分子(Platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)和血管內(nèi)皮鈣黏蛋白(Vascular endothelial cadherin,VE-cadherin)作為內(nèi)皮細(xì)胞的特異分子,在EndMT過(guò)程中表達(dá)減少,而肌動(dòng)蛋白(α-Smooth muscle actin,α-SMA)和波形蛋白(Vimentin)作為間質(zhì)細(xì)胞特異性蛋白,在EndMT過(guò)程中表達(dá)明顯增加。本文主要研究高濃度葡萄糖對(duì)EndMT的影響,并進(jìn)一步明確其機(jī)制及替米沙坦的治療作用。
1 材料與方法
1.1 材料
1.1.1 藥物、試劑及儀器 替米沙坦購(gòu)自勃林格殷格翰制藥有限公司。葡萄糖、SB-431542購(gòu)自Sigma公司。主要試劑:PCR引物,生工(上海)有限公司合成。β-actin抗體購(gòu)自Santa Cruz公司;CD31抗體、VE-cadherin抗體、α-SMA抗體及Vimentin抗體均購(gòu)自美國(guó)Abcam公司。蛋白酶抑制劑及磷酸酶抑制劑(德國(guó)Roche公司),ECL發(fā)光液(Vazyme公司,Millipore公司),Trizol試劑(Invitrogen公司),HiScriptTMqPCRSuperMix逆轉(zhuǎn)錄試劑盒、PCR DNA聚合酶(Vazyme公司),其余試劑為國(guó)產(chǎn)分析純。主要儀器:實(shí)時(shí)定量PCR儀及梯度PCR儀(美國(guó)Applied Biosystems公司),WB電泳儀和電泳槽、WB半干轉(zhuǎn)膜槽(BIO-RAD公司),自動(dòng)洗片機(jī)(柯達(dá)公司)。
1.1.2 臍靜脈內(nèi)皮細(xì)胞的分離與培養(yǎng) 人臍靜脈內(nèi)皮細(xì)胞標(biāo)本取自西安高新醫(yī)院婦產(chǎn)科孕婦足月正常娩出的臍帶組織。于無(wú)菌條件下獲得新生兒臍帶(長(zhǎng)約15~20 cm,無(wú)破損,無(wú)鉗夾痕跡),置于冰的臍帶保鮮液(M199培養(yǎng)基40%,100×AB/M溶液0.8%,1 mol/L HEPES溶液0.4%,肝素鈉注射液0.144%)中,6 h內(nèi)進(jìn)行HUVECs分離。0.1%膠原酶灌注消化法分離HUVECs細(xì)胞。0.125%胰蛋白酶消化傳代培養(yǎng),取生長(zhǎng)良好的第2~5代細(xì)胞用于實(shí)驗(yàn)。
1.1.3 動(dòng)物實(shí)驗(yàn)方法 選用8~10周的SPF級(jí)雄性db/db和db/m小鼠(體重20 g左右,購(gòu)于南京大學(xué)南京生物醫(yī)藥研究院)作為研究對(duì)象。20只8~10周的db/db小鼠(db/m小鼠8只作為對(duì)照組),適應(yīng)環(huán)境1周后測(cè)定空腹血糖。隨機(jī)分為高糖組及替米沙坦組;替米沙坦組給予替米沙坦10 mg/(kg·d)每天灌胃治療,db/db組和db/m組給予生理鹽水。療程8周,其中4周末、8周末測(cè)定空腹血糖。8周末血糖測(cè)定完畢后,CO2麻醉方法處死小鼠,取主動(dòng)脈(升主動(dòng)脈-主動(dòng)脈弓-腹主動(dòng)脈),PBS沖洗,液氮快速冰凍,-80 ℃保存?zhèn)溆谩K性囼?yàn)操作已得到西安市第一醫(yī)院倫理委員會(huì)批準(zhǔn)。
1.2 方法
1.2.1 Western blot分析 內(nèi)皮細(xì)胞經(jīng)PBS洗2遍,加入蛋白裂解液,冰上裂解20 min;液氮凍融3次,4 ℃、12 000 r/min離心15 min,取上清,ABC法測(cè)定蛋白濃度。加入loading buffer,95 ℃,8 min蛋白變性。10%聚丙烯酰胺凝膠電泳(上層膠30 mA,30 min;下層膠50 mA,90 min),轉(zhuǎn)膜(230 mA,2 h),5%脫脂牛奶(TTBS配制)封閉1 h,孵一抗4 ℃過(guò)夜,TTBS洗3遍,每遍5 min;孵二抗,室溫1 h;ECL發(fā)光,自動(dòng)洗片機(jī)洗片。標(biāo)定Marker,進(jìn)行掃描和分析。
1.2.2 Real time-PCR 六孔板每孔內(nèi)皮細(xì)胞加入Trizol 1 mL,提取RNA。小鼠主動(dòng)脈內(nèi)皮細(xì)胞RNA提取采用Trizol 1 mL沿主動(dòng)脈灌注,收集灌注液,提取RNA。采用紫外分光光度計(jì)檢測(cè)濃度。取2 μg總RNA進(jìn)行反轉(zhuǎn)錄(參照HiScriptTMqPCR SuperMix逆轉(zhuǎn)錄試劑盒說(shuō)明書(shū))。逆轉(zhuǎn)錄得到的cDNA進(jìn)行實(shí)時(shí)定量PCR反應(yīng),反應(yīng)體系參照TaqMan universal PCR Master Mix說(shuō)明書(shū)。
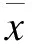
2 結(jié)果
2.1 高濃度葡萄糖對(duì)EndMT的影響 不同濃度葡萄糖(5、10、30 mmol/L)孵育臍靜脈內(nèi)皮細(xì)胞48 h,RT-PCR結(jié)果提示,高濃度葡萄糖可顯著增加內(nèi)皮細(xì)胞TGF-β的表達(dá),同時(shí)降低內(nèi)皮細(xì)胞CD31、VE-cadherin的表達(dá),增加α-SMA和Vimentin的表達(dá)。TGF-β抑制劑SB-431542(5 μmol/L)預(yù)處理內(nèi)皮細(xì)胞6 h,然后以甘露醇(25 mmol/L)作為對(duì)照組,用高濃度葡萄糖(30 mmol/L)孵育臍靜脈內(nèi)皮細(xì)胞48 h。RT-PCR及Western blot檢測(cè)結(jié)果均提示,高濃度葡萄糖可以降低內(nèi)皮細(xì)胞CD31、VE-cadherin的表達(dá),同時(shí)升高α-SMA及Vimentin表達(dá),而SB-431542預(yù)處理內(nèi)皮細(xì)胞可以顯著逆轉(zhuǎn)高濃度葡萄糖對(duì)內(nèi)皮細(xì)胞CD31、VE-cadherin、α-SMA及Vimentin表達(dá)的影響。見(jiàn)圖1、圖2。

圖1 高濃度葡萄糖對(duì)內(nèi)皮細(xì)胞TGF-β表達(dá)的影響注:*與5 mmol/L組比較,P<0.05

圖2 高濃度葡萄糖對(duì)EndMT的影響注:*與對(duì)照組比較,P<0.05;#與高糖組比較,P<0.05
2.2 替米沙坦對(duì)高濃度葡萄糖引起的EndMT的影響 替米沙坦(5 mmol/L)預(yù)處理內(nèi)皮細(xì)胞6 h,然后用高濃度葡萄糖(30 mmol/L)孵育臍靜脈內(nèi)皮細(xì)胞48 h,RT-PCR結(jié)果顯示,高濃度葡萄糖明顯增加內(nèi)皮細(xì)胞TGF-β的表達(dá),而替米沙坦可顯著降低高濃度葡萄糖引起的內(nèi)皮細(xì)胞TGF-β表達(dá)的增加;RT-PCR及Western blot檢測(cè)結(jié)果均提示,替米沙坦可以顯著逆轉(zhuǎn)高濃度葡萄糖對(duì)內(nèi)皮細(xì)胞CD31、VE-cadherin、α-SMA及vimentin表達(dá)的影響。見(jiàn)圖3。
2.3 db/db糖尿病模型小鼠主動(dòng)脈內(nèi)皮細(xì)胞各因子表達(dá)結(jié)果 與db/m小鼠相比,db/db小鼠主動(dòng)脈內(nèi)皮細(xì)胞TGF-β表達(dá)增加,CD31、VE-cadherin表達(dá)明顯減少,而α-SMA及Vimentin表達(dá)明顯增加。替米沙坦組TGF-β的表達(dá)較db/db小鼠降低,CD31、VE-cadherin表達(dá)明顯增加,而α-SMA及Vimentin表達(dá)顯著降低。見(jiàn)圖4。

圖3 替米沙坦對(duì)高濃度葡萄糖引起的EndMT的影響注:*與對(duì)照組比較P<0.05;#與高糖組比較,P<0.05

圖4 糖尿病模型小鼠主動(dòng)脈內(nèi)皮細(xì)胞各因子表達(dá)結(jié)果注:與db/m組比較,*P<0.05,**P<0.01;與db/db組比較,#P<0.05
3 討論
多因素誘導(dǎo)的EndMT是心肌細(xì)胞纖維化發(fā)展的重要機(jī)制之一[1-3]。高濃度葡萄糖能夠促進(jìn)人主動(dòng)脈內(nèi)皮細(xì)胞EndMT,損傷內(nèi)皮細(xì)胞功能和動(dòng)脈粥樣硬化[4]。研究表明,血管緊張素Ⅱ可介導(dǎo)高濃度葡萄糖誘導(dǎo)的EndMT[5]。內(nèi)皮素1和TGF-β可以誘導(dǎo)EndMT,而內(nèi)皮素-1受體拮抗劑Macitentan可有效抑制EndMT[6]。有報(bào)道,內(nèi)皮素1誘導(dǎo)的EndMT能夠促進(jìn)糖尿病小鼠心臟纖維化,基因敲除內(nèi)皮素1能夠減輕糖尿病小鼠心臟EndMT、纖維化及微血管減少。本研究表明,替米沙坦可以顯著抑制高濃度葡萄糖誘導(dǎo)的EndMT。Tang等[7-8]研究結(jié)果表明,血管緊張素Ⅱ受體拮抗劑厄貝沙坦亦有此作用。
TGF-β在內(nèi)皮細(xì)胞的EndMT中起重要作用。TGF-β可通過(guò)多種機(jī)制促進(jìn)EndMT[9]。TGF-β通過(guò)上調(diào)Snail、β聯(lián)蛋白、纖溶酶原激活劑抑制因子1和ATp300,下調(diào)p53,以及引起包含mir-125b和mir-21在內(nèi)的多種miRNA表達(dá)失調(diào)促進(jìn)EndMT。TGF-β也可通過(guò)Smad和非Smad路徑促進(jìn)Snail的表達(dá)[10]。研究表明,在臍靜脈內(nèi)皮細(xì)胞中,IL-1β和TGF-β2以NF-κB依賴的方式協(xié)同促進(jìn)EndMT[11]。由此可見(jiàn),TGF-β在EndMT過(guò)程中是多條信號(hào)傳導(dǎo)通路的中心環(huán)節(jié),有效抑制其表達(dá)有利于控制EndMT的發(fā)生和進(jìn)展。松弛素可減輕TGF-β所誘發(fā)的內(nèi)皮細(xì)胞EndMT,從而減輕心肌組織纖維化進(jìn)程[12]。人組織激肽釋放酶抑制蛋白可通過(guò)調(diào)節(jié)mir-21和內(nèi)皮一氧化氮合酶的表達(dá),抑制TGF-β所誘發(fā)的內(nèi)皮細(xì)胞EndMT[13]。本實(shí)驗(yàn)證實(shí)了高濃度葡萄糖對(duì)內(nèi)皮細(xì)胞的EndMT作用,并進(jìn)一步證實(shí)高濃度葡萄糖可以通過(guò)TGF-β來(lái)誘導(dǎo)EndMT。替米沙坦可以通過(guò)降低TGF-β的表達(dá),來(lái)抑制高濃度葡萄糖誘導(dǎo)的EndMT。
綜上所述,對(duì)于糖尿病的治療,無(wú)論是否合并高血壓,應(yīng)使用替米沙坦等藥物治療,這對(duì)于預(yù)防和治療糖尿病心肌病的發(fā)生和發(fā)展具有重要意義。
[1] Xu X,Friehs I,Zhong HT,et al.Endocardial fibroelastosis is caused by aberrant endothelial to mesenchymal transition[J].Circ Res,2015,116(5):857-866.
[2] Zeisberg EM,Tarnavski O,Zeisberg M,et al.Endothelial-to-mesenchymal transition contributes to cardiac fibrosis[J].Nat Med,2007,13(8):952-961.
[3] Ma KL,Liu J,Ni J,et al.Inflammatory stress exacerbates the progression of cardiac fibrosis in high-fat-fed apolipoprotein E knockdown mice via endothelial-mesenchymal transition[J].Int J Med Sci,2013,10(4):420-426.
[4] Tang R,Li Q,Lv L,et al.Angiotensin II mediates the high-glucose-induced endothelial-to-mesenchymal transition in human aortic endothelial cells[J].Cardiovasc Diabetol,2010,9:31.
[5] Tang R,Gao M,Wu M,et al.High glucose mediates endothelial-to-chondrocyte transition in human aortic endothelial cells[J].Cardiovasc Diabetol,2012,11:113.
[6] Cipriani P,Di BP,Ruscitti P,et al.The endothelial-mesenchymal transition in systemic sclerosis is induced by endothelin-1 and transforming growth factor-β and may be blocked by macitentan,a dual endothelin-1 receptor antagonist[J].J Rheumatol,2015,42(10):1808-1816.
[7] Tang RN,Lv LL,Zhang JD,et al.Effects of angiotensin II receptor blocker on myocardial endothelial-to-mesenchymal transition in diabetic rats[J].Int J Cardiol,2013,162(2):92-99.
[8] Ghosh AK,Nagpa LV,Covington JW,et al.Molecular basis of cardiac endothelial-to-mesenchymal transition (EndMT):differential expression of microRNAs during EndMT[J].Cell Signal,2012,24(5):1031-1036.
[9] Maleszewkaa M,Moonena JR,Huijkman N,et al.IL-1β and TGFβ2 synergistically induce endothelial to mesenchymal transition in an NFκB-dependent manner[J].Immunobiology,2013,218(4):443-454.
[10]Yi EY,Park SY,Jung SY,et al.Mitochondrial dysfunction induces EMT through the TGF-β/Smad/Snail signaling pathway in Hep3B hepatocellular carcinoma cells[J].Int J Oncol,2015,47(5):1845-1853.
[11]Maleszewska M,Moonen JR,Huijkman N,et al.IL-1β and TGFβ2 synergistically induce endothelial to mesenchymal transition in an NFκB-dependent manner[J].Immunobiology,2013,218(4):443-454.
[12]Zhou X,Chen X,Cai JJ,et al.Relaxin inhibits cardiac fibrosis and endothelial-mesenchymal transition via the Notch pathway[J].Drug Des Devel Ther,2015,9:4599-4611.
[13]Guo Y,Li P,Bledsoe G,et al.Kallistatin inhibits TGF-β-induced endothelial-mesenchymal transition by differential regulation of microRNA-21 and eNOS expression[J].Exp Cell Res,2015,337(1):103-110.
Effect of telmisartan on endothelial-mesenchymal transition induced by high-concentration glucose
SUN Rong1,SHANG Fen-qing2*
(1.Department of Emergency,Xi′an Gaoxin Hospital,Xi′an 710075,China;2.Cardiovascular Department,the First Hospital of Xi′an,Xi′an 710002,China)
Objective To investigate the effect of telmisartan on endothelial-mesenchymal transition induced by high-concentration glucose.Methods Endothelial cells were isolated from human umbilical vein endothelial cells(HUVECs).High-concentration glucose (30 mmol/L) was used to induce the endothelial-mesenchymal transition.The endothelial cells were pretreated by TGF-β inhibitor SB-431542 (5 μmol/L) or telmisartan (5 mmol/L) for 6 h,and were co-cultured with high-concentration glucose (30 mmol/L) for 48 h.The changes of CD31,VE-cadherin,α-SMA and vimentin were determined by RT-PCR and Western blot.Diabetic mice model was used to verify the changes of the above indicators.Results High-concentration glucose could increase the expression of TGF-β,which could be reversed by telmisartan.High-concentration glucose could decrease the expression of CD31 and VE-cadherin,and increase the expression of α-SMA and vimentin.TGF-β inhibitor SB-431542 and telmisartan could significantly reverse the effects of high-concentration glucose on endothelial-mesenchymal transition.Conclusion Telmisartan can reduce the expression of TGF-β,and inhibit the endothelial-mesenchymal transition induced by high-concentration glucose.
Telmisartan;High-concentration glucose;TGF-β;Endothelial-mesenchymal transition
2016-10-20
1.西安高新醫(yī)院急診科,西安 710075;2.西安市第一醫(yī)院心內(nèi)科,西安 710002
*通信作者
10.14053/j.cnki.ppcr.201707014

