番荔枝內酯類化合物基于耐阿霉素肝癌細胞SMMC—7721/ADR的構效關系研究
王緒楠+李祥+陳勇+李月

[摘要] 研究12種番荔枝內酯類化合物對耐阿霉素肝癌細胞SMMC-7721/ADR的作用,并初步探究其構效關系。實驗利用實時熒光定量PCR法檢測12種番荔枝內酯類化合物:annosquamin A(1),annosquamin B(2),annotemoyin-1(3),uvariamicin Ⅱ(4),annosquacin D(5),annosquacin B(6),isodesacetyluvaricin(7),uvarigrandin A(8),squamostatin D(9),squamostatin E(10),squamostatin A(11),12,15-cis-squamostatin A(12)對SMMC-7721/ADR細胞中相關基因NDUFV2的表達量。該研究發現所有受試化合物均使SMMC-7721/ADR中NDUFV2表達量有所下調,鄰雙四氫呋喃環型番荔枝內酯活性最強,而間雙四氫呋喃環型番荔枝內酯活性最弱。內酯環與鄰近的四氫呋喃環間碳數越少,作用越強;對于鄰雙四氫呋喃型番荔枝內酯化合物,鏈上含有的羥基個數越多,化合物作用可能越強;對于間雙四氫呋喃型番荔枝內酯化合物,鏈上含有的羥基個數越少,化合物作用可能越強;且受試化合物中均是含有3個羥基取代的化合物作用較強;相對構型為蘇式的番荔枝內酯的作用比赤式的強,四氫呋喃環為順式構型的番荔枝內酯的作用比反式的強;在其他基團完全相同的情況下,長鏈烷基端部與鄰近的四氫呋喃環之間的碳數越少,作用越強。
[關鍵詞] 番荔枝內酯;多藥耐藥;SMMC-7721/ADR;構效關系
[Abstract] The present research was launched to investigate the effects of 12 annonaceous acetogenins (ACGs) on human hepatic carcinoma cell line SMMC-7721/ADR, and to find out their structure-activity relationship. SMMC-7721/ADR cells were treated with 12 ACGs including annosquamin A(1),annosquamin B(2),annotemoyin-1(3),uvariamicin Ⅱ(4),annosquacin D(5),annosquacin B(6),isodesacetyluvaricin(7),uvarigrandin A(8),squamostatin D(9),squamostatin E(10),squamostatin A(11),and 12,15-cis-squamostatin A(12) for 24 h, and the different expression of the target gene NDUFV2 were detected by quantitative real-time PCR. All the tested compounds made the expression of the target gene NDUFV2 decreased on human hepatic carcinoma cell line SMMC-7721/ADR, of which the bistetrahydrofuran ACGs showed the best activity,which the non-adjacent bistetrahydrofuran ACGs displayed the worst activity.The ACGs with the reducing number of carbons between γ-unsaturated lactone and the close tetrahydrofuran (THF) ring are more potent. For bistetrahydrofuran ACGs with the same nucleus skeleton,they would be more active as more hydroxyls on aliphatic chain, which for the non-adjacent bistetrahydrofuran ACGs with less hydroxyls on aliphatic chain that would be more active. ACGs with 3 hydroxyls on aliphatic chain would be more active. ACGs with threo configuration are more active than erythro configurotion, and the compounds with cis THF ring seem to be superior to those of trans THF ring. Furthermore, the ACGs with the reducing number of carbons between terminal methyl and the close tetrahydrofuran (THF) ring are more potent.
[Key words] annonaceous acetogenins;multidrug resistance;SMMC-7721/ADR;structure-activity relationship
番荔枝Annona squamosal L.為番荔枝科Annonaceae番荔枝屬Annona植物,廣泛分布于熱帶及亞熱帶地區,我國的廣東、廣西、云南及海南等南方多數城市均有栽培[1],據《中華本草》[2]記載:番荔枝科番荔枝屬植物番荔枝的干燥成熟種子,性味苦、寒,歸心、肺、肝、腎、脾經,其功效為消積殺蟲、清熱解毒、解郁、止血。番荔枝內酯是從番荔枝科植物中提取分離得到的一類長鏈內酯類化合物,其基本化學結構為35~37個碳原子構成的化合物骨架,分子中含0~3個四氫呋喃環(tetrahydrofuran,THF),末端有1個甲基取代或經重排的γ-內酯環和2條連接這些部分的長烷基直鏈,在碳鏈上還常常帶有一些立體化學多變的含氧官能團(羥基、酮基、乙酰氧基、環氧結構等)或者雙鍵[3-6]。目前,已有文獻報道,番荔枝內酯具有顯著的抗腫瘤作用,尤其是對抑制多藥耐藥腫瘤細胞的生長[7]表現出強烈的活性。對線粒體的強效抑制作用[8],從而誘導腫瘤細胞凋亡[9],殺死腫瘤細胞為其作用機制。本實驗前期采用體外線粒體復合酶Ⅰ活性測試、計算機模擬分子對接兩種方法,以AGGs對線粒體復合酶Ⅰ的NDUFV2亞基模擬對接,發現AGGs能夠與線粒體復合酶Ⅰ的NDUFV2亞基結合位點進行很好結合,為進一步驗證AGGs對該亞基的作用,結合番荔枝內酯立體結構的復雜性,其構效關系研究[10]已經成為現代研究的一大熱點,本實驗選用實驗室前期分離得到的 12個番荔枝內酯類化合物,選用實時熒光定量PCR法,主要考察結構中γ-內酯環兩環間與鄰近的四氫呋喃環的碳數、羥基個數、四氫呋喃環及相鄰羥基的構型、長鏈烷基端部與鄰近的四氫呋喃環之間的碳數等因素對SMMC-7721/ADR上目的基因NDUFV2的作用之間的關系,以期進一步探索番荔枝內酯對抗腫瘤作用的機制,并為臨床治療找到一種具有高活性抗多藥耐藥性腫瘤的化合物結構模型。
1 材料
12個番荔枝內酯化合物annosquamin A(1),annosquamin B(2),annotemoyin-1(3),uvariamicin Ⅱ(4),annosquacin D(5),annosquacin B(6),isodesacetyluvaricin(7),uvarigrandin A(8),squamostatin D(9),squamostatin E(10),squamostatin A(11),12,15-cis-squamostatin A(12)(表1,圖1)均為本實驗前期分離得到,經HPLC-DAD檢測,HPLC純度均>98%。順鉑(齊魯制藥有限公司);紫杉醇(北京華素制藥有限公司);阿霉素(浙江海正藥企有限公司);Trizol試劑(南京卡羅登生物科技有限公司);逆轉錄試劑盒、SYBR Green染料(TOYOBO,日本);SMMC-7721/ADR細胞、SMMC-7721細胞、RPMI 1640 培養基(南京凱基生物科技發展有限公司);DEPC水、胎牛血清(杭州四季青生物科技有限公司);胰蛋白酶(Biosharp公司,美國);噻唑藍(MTT)、PBS磷酸鹽緩沖溶液、EDTA(北京索來寶科技有限公司);乙醇、二甲基亞砜(DMSO)(分析純,無錫海碩生物有限公司);丙酮、氯仿(江蘇漢邦有限公司)。
超凈臺(蘇州安泰空氣技術有限公司,SW-CJ-2F);CO2細胞培養箱(Thermo Scientific HE-RA cell 150i,美國);酶標儀(Spectra MAX190,Molecular Devices,美國);超微量核酸蛋白測定儀(NanoDrop,美國);定量PCR儀qTOWER 2.0(耶拿,德國)。
2 方法
2.1 SMMC-7721/ADR細胞和SMMC-7721細胞的培養
SMMC-7721/ADR細胞株培養于在含20 mg·L-1阿霉素、10%胎牛血清及1%青霉素、鏈霉素混合液的RPMI 1640培養基中1周,再培養于不含阿霉素的培養液中2周后進行實驗。SMMC-7721細胞培養于在10%胎牛血清及1%青霉素、鏈霉素混合液的RPMI 1640培養基中。細胞置于CO2培養箱中,在37 ℃和5% CO2條件下培養。
2.2 MTT法驗證細胞的多藥耐藥性
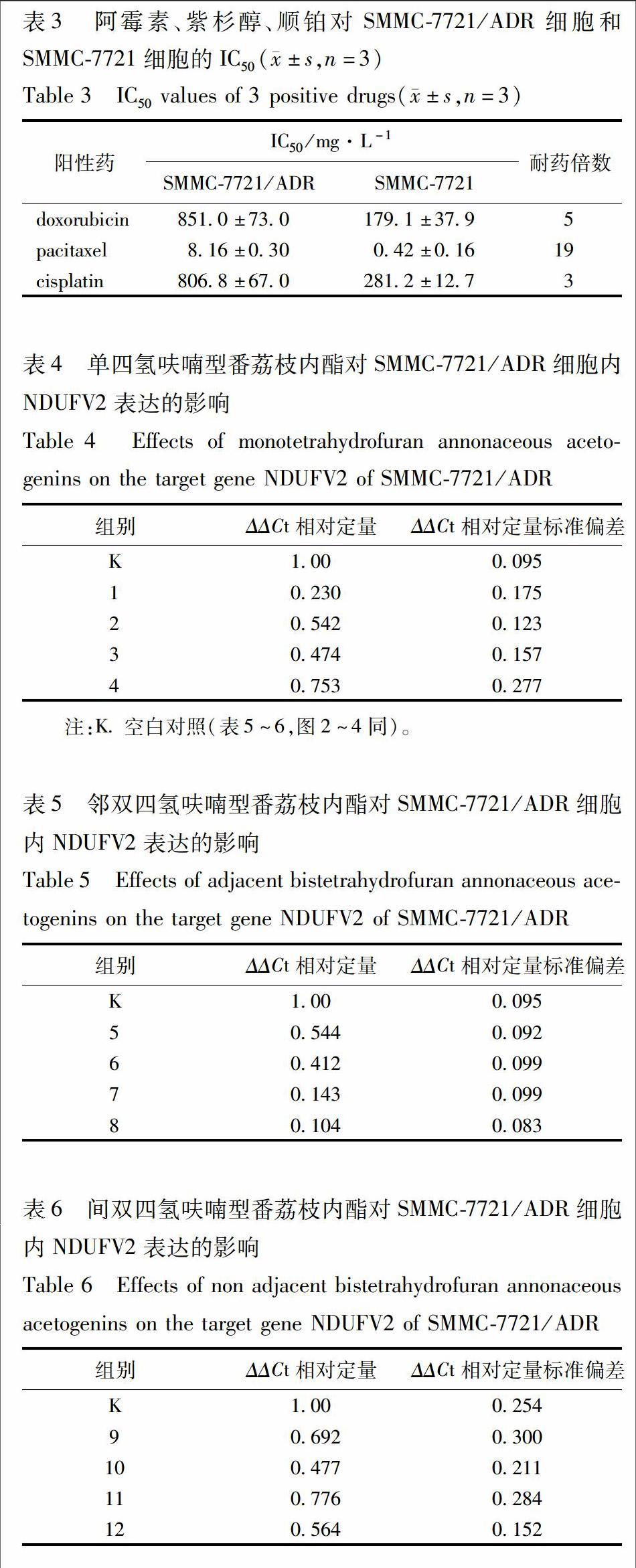
取對數生長期細胞SMMC-7721/ADR和SMMC-7721,確定活細胞數大于90%。用RPMI 1640培養液調整細胞濃度為5×104 個/mL接種于96孔板,200 μL/孔,每孔細胞數約為1×105個。將細胞分為對照組(細胞用培養基培養)、給藥組(細胞分別用不同濃度梯度的紫杉醇、阿霉素、順鉑培養),SMMC-7721/ADR細胞給藥組的濃度梯度分別為阿霉素(700,350,175,87.5,43.75,21.875,10.937 5,5.468 75,2.734 375 mg·L-1),紫杉醇(171,85.5,42.75,21.375,10.687 5,5.343 75,2.671 875,1.335 938,0.667 969 mg·L-1),順鉑(725,362.5,181.25,90.625,45.312 5,22.656 25,11.328 13,5.664 063,2.832 203 1 mg·L-1)。SMMC-7721細胞給藥組的濃度梯度分別為阿霉素(700,350,175,87.5,43.75,21.875,10.937 5,5.468 75,2.734 375 mg·L-1),紫杉醇(85.5,42.75,21.375,10.687 5,5.343 75,2.671 875,1.335 938,0.667 969,0.333 984 mg·L-1),順鉑(725,362.5,181.25,90.625,45.312 5,22.656 25,11.328 13,5.664 063,2.832 203 1 mg·L-1)。將細胞培養24 h后,吸出上清液,對照組加入200 μL/孔培養基,給藥組加入200 μL/孔含各濃度梯度的紫杉醇、阿霉素、順鉑的培養基,然后將96孔板置于37 ℃,5% CO2培養箱中培養24 h。隨后每孔加入5 g·L-1 MTT試劑20 μL,繼續培養4 h。輕輕吸出96孔板中培養液,加入DMSO,150 μL/孔,震蕩搖勻10 min,使結晶物充分溶解,并在490 nm波長處用酶標儀測定各孔吸光度(A)。采用直線回歸法計算藥物對SMMC-7721/ADR細胞和SMMC-7721細胞的半數抑制濃度(IC50)。實驗重復3次。
細胞抑制率=(1-A實驗組/A對照組)×100%
2.3 實時熒光定量PCR法
取對數生長期細胞SMMC-7721/ADR確定活細胞數大于90%。用RPMI 1640培養液將細胞接種于直徑10 cm為培養皿中,將細胞分為對照組(細胞用培養基處理)和給藥組(細胞用10 μmol·L-1的不同番荔枝內酯的培養基處理),培養24 h,將上清液吸出,對照組加入10 mL培養基,給藥組加入10 mL含不同番荔枝內酯的培養基,然后將培養皿置于37 ℃,5% CO2飽和濕度培養箱中培養24 h,棄去上清液,加入10 mL PBS,輕輕振蕩,清洗細胞后棄去液體,加入1 mL Trizol試劑裂解細胞,按照Trizol提取細胞總RNA 方法說明書提取總RNA。使用Nonodrop超微量核酸檢測儀測定RNA濃度和純度。根據逆轉錄反應試劑盒說明書合成cDNA,將合成的cDNA取2 μL按照SYBR Green摻入法配成20 μL反應體系,以HMBS為內參,NDUFV2為目的基因,反應程序為:95 ℃預變性3 min,95 ℃變性5 s,55 ℃退火10 s,72 ℃延伸15 s,進行50個PCR循環。熔解曲線:60 ℃以每秒升高5 ℃至95 ℃,95 ℃6 s。qPCR最終實驗數據采用2-ΔΔCT法進行分析,ΔΔCT=(CtmiRNA-CtHMBS)給藥組-(CtmiRNA-CtHMBS)對照組(表2)。
3.2.1 內酯環與鄰近的四氫呋喃環間的碳數對化合物活性的影響 四氫呋喃環與內酯環間的碳數對化合物作用有較大影響。化合物1與2,化合物5與6的相對分子質量、THF的類型、相對構型、OH數均相同,它們僅在四氫呋喃環與γ-內酯環之間的碳原子數不同。單四氫呋喃型番荔枝內酯化合物中,化合物1(2環間碳數為 7個)的下調大于化合物2(2環間碳數為 9個)。此外,鄰雙四氫呋喃型番荔枝內酯化合物中,化合物6(2環間碳數為9個)的下調大于化合物5(2環間碳數為11個),由此推測,該類化合物結構中,四氫呋喃環與內酯環間碳數越少,化合物的作用可能越強。
3.2.2 取代羥基個數對化合物活性的影響 取代羥基個數對化合物作用有較大影響。鄰雙四氫呋喃型番荔枝內酯化合物7與8的四氫呋喃環與內酯環之間的碳原子數相同、相對構型相同,它們僅在羥基的個數上有所不同。化合物8(有3個羥基)的下調大于化合物7(有2個羥基)。間雙四氫呋喃型番荔枝內酯化合物9與11的四氫呋喃環與內酯環之間的碳原子數相同、相對構型相同,僅在羥基的個數上有所不同,化合物9(有3個羥基)下調大于化合物11(有4個羥基)。由此推測,對于鄰雙四氫呋喃型番荔枝內酯化合物,鏈上含有的羥基個數越多,化合物作用可能越強;對于間雙四氫呋喃型番荔枝內酯化合物,鏈上含有的羥基個數越少,化合物作用可能越強;且受試化合物中均是含有3個羥基取代的化合物作用較強。
3.2.3 四氫呋喃環及鄰位羥基構型對化合物活性的影響 四氫呋喃環的構型對化合物的作用也有較大的影響。化合物9和10,化合物11和12僅在四氫呋喃環的構型上略有不同,間雙型四氫呋喃環番荔枝內酯類化合物中,化合物10(構型為trans/threo-threo/trans/threo)的下調比化合物9(構型為trans/threo-threo/trans/erythro)的多。由此推測,具有蘇式構型的番荔枝內酯類化合物的作用比具有赤式構型的番荔枝內酯類化合物作用強。化合物12(構型為cis/threo-threo/trans/erythro)的下調比化合物11(構型為trans/threo-threo/trans/erythro)要多。由此推測,四氫呋喃環為順式構型的番荔枝內酯類化合物作用比反式的強。
3.2.4 長鏈烷基端部與鄰近的四氫呋喃環之間的碳數對化合物活性的影響 四氫呋喃環與長鏈烷基端部之間的碳數對化合物作用有一定的影響。在單四氫呋喃環型番荔枝內酯類化合物中,化合物3和4的四氫呋喃環與內酯環間的碳數,取代羥基位置、個數,四氫呋喃環及其相鄰的取代羥基相對構型都相同,不同之處在于四氫呋喃環與長鏈烷基端部之間的碳數不同,化合物3(碳數為12個)的下調比化合物4(碳數為14個)強,由此推測,在其他基團完全相同的情況下,四氫呋喃環與長鏈烷基端部之間的碳數越少,化合物作用越強(表4~6,圖2~4)。
4 討論
通過上述番荔枝內酯類化合物對SMMC-7721/ADR細胞中NDUFV2的影響表明:①所有受試化合物均使SMMC-7721/ADR中NDUFV2表達量有所下調,鄰雙四氫呋喃環型番荔枝內酯活性最強,而間雙四氫呋喃環型番荔枝內酯活性最弱;②內酯環和鄰近的四氫呋喃環間碳數越少,活性越強;③對于鄰雙四氫呋喃型番荔枝內酯化合物,鏈上含有的羥基個數越多,化合物作用可能越強;對于間雙四氫呋喃型番荔枝內酯化合物,鏈上含有的羥基個數越少,化合物作用可能越強,且受試化合物中均是含有3個羥基取代的化合物作用較強;④相對構型為蘇式的番荔枝內酯的活性比赤式的強,四氫呋喃環為順式構型的番荔枝內酯的活性比反式的強;⑤在其他基團完全相同的情況下,長鏈烷基端部與鄰近的四氫呋喃環之間的碳數越少,活性越強。結合以上研究,可以為合成高活性抗腫瘤多藥耐藥的番荔枝內酯類化合物提供理論依據。
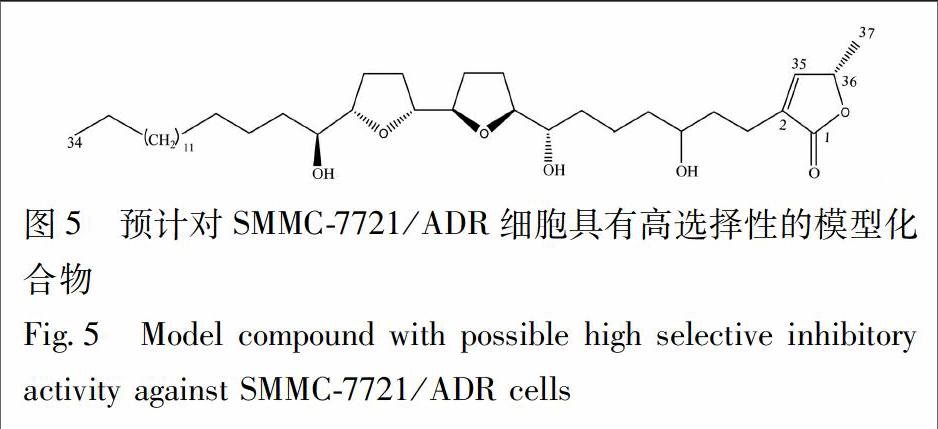
化合物8分子式為C37H66O7,含有3個羥基取代,構型為th/t/th/t/th,四氫呋喃環和內酯環之間碳數位13個的鄰雙四氫呋喃環型番荔枝內酯,其對SMMC-7721/ADR細胞中NDUFV2表達下調最為顯著,結合實驗構效分析結構,本文設想了1個化合物結構:總碳原子數為37,羥基數為3個,四氫呋喃環與內酯環間碳數為7個,THF環與鄰位羥基的構型為th/c/th/c/th,該化合物可能會對SMMC-7721/ADR細胞中NDUFV2表達下調產生更為顯著的影響,化合物結構(圖5)。
由本實驗結果推測,番荔枝內酯對耐藥細胞抑制活性的影響因素主要包括四氫呋喃環與內酯環間的碳數、取代羥基個數、四氫呋喃環構型、四氫呋喃環與長鏈烷基端部之間的碳數等方面。然而,考慮到立體化學的復雜、多變,這些因素并非單獨作用,而是相互影響,綜合作用。各因素的影響力度也不一樣,這可能與各因素導致番荔枝內酯化合物與受體的結合程度不同有關[11]。同時,這也是該類化合物首次被報導參與線粒體復合酶Ⅰ蛋白的連接,這為后期用于研究逆轉多藥耐藥腫瘤細胞機制研究提供了一定的依據。
[參考文獻]
[1] 中國科學院中國植物志編輯委員會. 中國植物志. 30卷[M]. 北京: 科學出版社,1979.
[2] 國家中醫藥管理局. 中華本草[M]. 上海:上海科學技術出版社,1998.
[3] Chen Y,Yu D Q. Classification and NMR characteristics of the γ-lactone and THF rings of antitumor bioactive annonaceous acetogenins [J].Acta Pharm Sin,1998, 33(7):553.
[4] 潘錫平,于德泉. 大花紫玉盤中的新抗腫瘤活性番荔枝內酯及其絕對構型研究[J]. 藥學學報, 1997, 32(4): 286.
[5] 孫蘭,朱久香,余競光,等. 圓滑番荔枝種子化學成分研究[J]. 藥學學報, 2003, 38(1):32.
[6] Wong H F, Brown G D. β-Methoxy-γ-methylene-α,β-unsaturated-γ-butyrolactones from Artabotrys hexapetalus[J]. Phytochemistry, 2002, 59(1):99.
[7] Bermejo A, Figadere B, Zafra-Polo M C, et al. Acetogenins from Annonaceae: recent progress in isolation, synthesis and mechanisms of action[J]. Nat Prod Rep, 2005, 22(2):269.
[8] Hllerhage M, Matusch A, Champy P, et al.Natural lipophilic inhibitors of mitochondrial complex I are candidate toxins for sporadic neurodegenerative tau pathologies[J].Exp Neurol, 2009, 220(1): 133.
[9] Chiu H F, Chih T T, Hsian Y M, et al. Bullatacin, a potent antitumor annonaceous acetogenin, induces apoptosis through a reduction of intracellular cAMP and cGMP levels in human hepatoma 2.2.15 cells[J]. Bioche Pharmacol, 2003, 65(5): 319.
[10] Yang H, Zhang N, Li X, et al. Structure-activity relationships of diverse annonaceous acetogenins against human tumor cells[J]. Bioorg Med Chem Lett, 2009,19(8): 2199.
[11] 袁斐,白鋼鋼,苗筠杰,等. 番荔枝內酯類化合物對耐阿霉素乳腺癌細胞MCF-7/ADR體外活性的影響[J].中草藥, 2014,45(19):2815.
[責任編輯 丁廣治]

